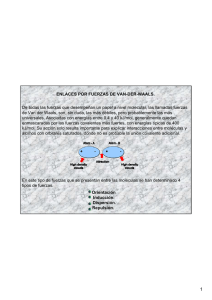
DOCENTE: Vanesa Sofía Carrillo Quintero ÁREA: QUÍMICA GRADO: SÉPTIMO UNIDAD TEMÁTICA: FUERZAS INTERMOLECULARES GUÍA Nº: 5 FECHA: 1 DE OCTUBRE “UN ESPACIO PEDAGÓGICO DE DESARROLLO DE INTELIGENCIAS” NOMBRE: ______________________________________________________________________________ FUERZAS INTERMOLECULARES Las fuerzas intermoleculares ejercen influencia en las fases condensadas de la materia (líquidos y sólidos). Son las principales responsables de las propiedades macroscópicas de la materia (punto de fusión y ebullición). Los puntos de ebullición de las sustancias reflejan la magnitud de las fuerzas intermoleculares que actúan entre las moléculas. La fuerza electrostática es la atracción que se presenta entre polos de carga opuesta. Las moléculas covalentes pueden ejercer entre sí fuerzas atractivas de tipo electrostático, a estas fuerzas se les conoce como fuerzas intermoleculares, y son las responsables de las propiedades de la materia como el punto de fusión y el punto de ebullición. Fuerzas ión - ión : Se presentan por la atracción electrostática entre iones propiamente dichos. Estas atracciones son de alta intensidad (más fuertes) originando que los compuestos iónicos poseen altos puntos de fusión. Como ejemplos tenemos al NaCl, KI, Na2SO4. Página 1 de 4 FTO-DEC-002_V2/18/01/2017 Fuerzas ión - dipolo : Es cuando un ión y una molécula polar (dipolo) se atraen uno a otra. El ejemplo más importante tiene lugar cuando un compuesto iónico se disuelve en agua (sal en agua). Fuerzas ión – dipolo inducido Tienen lugar entre un ión y unamolécula apolar.La proximidad del ión provoca una distorsión en la nube electrónica de la molécula apolar que la convierte (de modo transitorio) en una molécula polarizada. Fuerzas de Van der Waals (Johannes Direk Van der Waals) Son fuerzas de atracción débiles que se establecen entre moléculas eléctricamente neutras (tanto polares como no polares). Fuerzas dipolo - dipolo Es el resultado de la interacción entre moléculas polares.Cuando están cerca unas de otras, como en líquidos y sólidos, sus cargas parciales actúan como pequeños campos eléctricos que las orientan y dan lugar a las fuerzas dipolo-dipolo: el polo positivo de una molécula atrae el polo negativo de la otra. Página 2 de 4 FTO-DEC-002_V2/18/01/2017 Enlace por puente de hidrógeno Un tipo especial de fuerzas dipolo - dipolo se da entre moléculas que tienen un átomo de Hidrógeno unido a un átomo pequeño, altamente electronegativo con pares de electrones libres. Los átomos más importantes que llevan esta descripción son Nitrógeno, Oxígeno o el Flúor. Estructura tridimensional del hielo. Cada átomo de oxígeno está enlazado a cuatro átomos de hidrógeno. El espacio vacío en la estructura explica la baja densidad del hielo. Los puentes de hidrógeno tienen un fuerte efecto en la estructura y propiedades de muchos compuestos. La fuerza de un puente de hidrógeno es determinada por la interacción coulómbica entre el par libre de electrones del átomo electronegativo y el núcleo de hidrógeno. Fuerzas dipolo – dipolo inducido: Es producto de la interacción de una molécula polar y una no polar. El campo eléctrico induce una distorsión en la nube electrónica. Para una molécula no polar,esta distorsión produce un momento dipolar inducido temporal; para una molécula polar,aumenta el momento dipolar ya presente.Por ejemplo la disolución de yodo (no polar) en agua (polar). Fuerzas de dispersión o fuerzas de London (Fritz Wolfgang London)Las fuerzas de dispersión son fuerzas atractivas débiles que se establecen fundamentalmente entre sustancias no polares. Se deben a las irregularidades que se producen en la nube electrónica de los átomos de las moléculas por efecto de la proximidad mutua. La formación de un dipolo instantáneo (por factores externos como disminución de la temperatura), en una molécula origina la formación de un dipolo inducido en una molécula vecina de manera que se origina una débil fuerza de atracción entre las dos. Por este proceso se explica la condensación del H2 y N2 a su estado líquido, que de otra manera sería imposible. Taller 1. ¿ Qué diferencia existe entre las fuerzas intramoleculares y las intermoleculares? Página 3 de 4 FTO-DEC-002_V2/18/01/2017 2. ¿ El hielo y el agua líquida tienen la misma densidad? 3. Explique la formación de los puentes de hidrógeno en el compuesto NH3 4. Teniendo en cuenta la teoría expuesta en la guía explica cómo son las fuerzas intermoleculares (de atracción) en cada uno de los estados: SÓLIDO LÍQUIDO GAS FUERZAS INTERMOLECULARES 5. Organiza los conceptos donde corresponde y escribe una breve definición: Ión-ión, Ión-dipolo, dipolo-dipolo inducido, dispersión (London), puente de Hidrógeno Página 4 de 4 FTO-DEC-002_V2/18/01/2017