Clasificación de las sustancias según su conductividad.
Anuncio

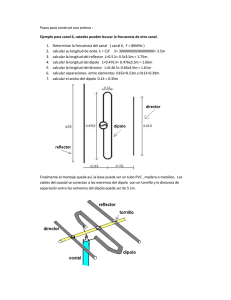
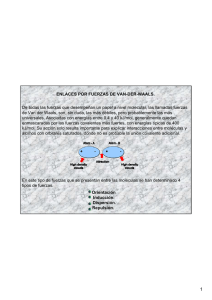
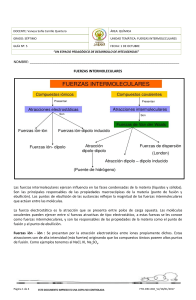
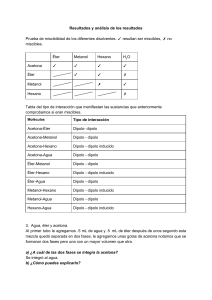
UNIDAD 3 Temas: - Clasificación de las sustancias según estado de agregación (puntos de fusión y ebullición). Formación de redes tridimensionales o de moléculas discretas. -Clasificación de las sustancias según su conductividad. -Modelos de enlace metálico, iónico y covalente. - Representaciones de Lewis de compuestos moleculares e iónicos. -Momento dipolar: Enlace covalente polar entre dos átomos. Interacciones débiles: Dipolo instantáneo-dipolo inducido, dipolo-dipolo inducido, dipolo-dipolo, puente de hidrógeno, ion-dipolo. -Energía de enlace. Cambios energéticos en la formación y ruptura de enlaces. Interacciones eléctricas • De atracción +, • De repulsión +, + ó -,Átomos de una misma molécula Entre Moléculas vecinas 2 ENLACE QUÍMICO • Siempre que dos átomos o iones están unidos fuertemente entre sí, decimos que hay un enlace químico entre ellos. Estas son interacciones intramoleculares. • Cuando se trata de interacciones entre moléculas vecinas, hablamos de enlaces intermoleculares. 3 Fuerzas Intramoleculares Fuerzas de atracción intramoleculares (átomo-átomo) Enlace iónico puro Enlace covalente Enlace metálico polar coordinado 4 Modelo del mar de electrones 5 Fuerzas Intermoleculares Fuerzas de atracción intermoleculares (molécula-molécula) dipolo - dipolo Puentes de H dipolo – dipolo inducido Fzas de dispersión de London (dipolo instantáneo – dipolo inducido) ión - dipolo 6 Interacción dipolo-dipolo Moléculas polares 7 Fuerzas intermoleculares Puentes de Hidrógeno Una atracción dipolo-dipolo particularmente fuerte ocurre entre moléculas en las cuales un Hidrógeno está enlazado en forma covalente con un elemento muy pequeño y muy electronegativo (F, O, N). Se forman entonces moléculas muy polares en las que un pequeño átomo de Hidrógeno lleva una carga positiva que fácilmente se puede aproximar al extremo negativo de un dipolo cercano. 8 8 Interacción por puentes de hidrógeno METANOL (CH3OH) 9 Puentes de hidrógeno en el agua 10 Puentes de hidrógeno en el hielo 11 Puentes de hidrógeno en proteínas 12 13 Fuerzas de dispersión de London Sólo son significativas cuando las moléculas están muy cercanas entre sí. 14 Interacción ion-dipolo 15 Interacción dipolo-dipolo inducido 16 Cómo determinar fuerzas intermoleculares EN TODOS LOS CASOS ESTÁN PRESENTES LAS FUERZAS DE DISPERSIÓN DE LONDON. LA INTENSIDAD DE CADA TIPO DE FUERZA , AUMENTA DE IZQUIERDA A DERECHA EN EL DIAGRAMA ANTERIOR. 17 Imágenes y gráficas tomadas de Brown, Química, la ciencia central, 9ª ed. De tarea para el próximo martes • Localizar ejemplos concretos (qué sustancias) para cada uno de los tipos de fuerzas (intramoleculares e intermoleculares) vistos en clase. • Terminar de leer capítulos 8 (págs. 297-330)y 11 (págs. 437-446) del Brown, 11ª edición. 18