FUERZAS INTERMOLECULARES En el interior de una molécula
Anuncio

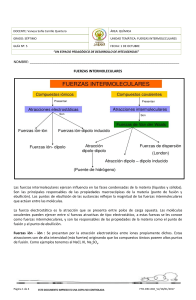
FUERZAS INTERMOLECULARES En el interior de una molécula las uniones entre los átomos que la constituyen son de tipo covalente y, por lo tanto, difícil de separar unos de otros. Sin embargo, entre dos o más moléculas también pueden producirse interacciones. Estas interacciones de carácter electrostático se conocen, de forma genérica, como "fuerzas intermoleculares" y son las responsables de que cualquier sustancia, incluidos los gases nobles, se puedan licuar. Estas fuerzas las podemos clasificar en: 1. Fuerzas de van der Waals 1.1 Entre moléculas iguales 1.1.1 Fuerzas de orientación (dipolo-dipolo) 1.1.2 Fuerzas de dispersión o de London (dipolo instantáneo-dipolo inducido) 1.2. Entre moléculas distintas 1.2.1 Fuerzas dipolo-dipolo inducido 1.2.2 Fuerzas ion-dipolo 2. Enlaces por puente de hidrógeno 1. FUERZAS DE VAN DER WAALS 1.1.1 Fuerzas de orientación (dipolo-dipolo) Este tipo de interacción aparece solamente entre moléculas polares y son proporcionales a los valores de los momentos dipolares de las moléculas. Ejemplos: SO2, HCl, ... 1.1.2. Fuerzas de dispersión o de London (dipolo instantáneo - dipolo inducido) Esta fuerza explica como los gases apolares (He, Ne, Ar, Kr, Xe, Rn, O2, N2, H2, ...) se pueden licuar. Las moléculas poseen cierta energía que produce un desplazamiento (vibración) de los electrones de sus posiciones, por lo que se crean dipolos instantáneos, muy pequeños y temporales y en determinadas circunstancias, bajas temperaturas o con aumento de la presión, esos dipolos temporales pueden orientarse y se atraen. Son fuerzas muy débiles, aunque aumentan con la masa molecular, ya que aumenta el número de electrones de la molécula, esto hace que, en la moléculas grandes, sea más fácil la formación de dipolos instantáneos. Se dice que estas moléculas son polarizables. Esto justifica que los alcanos se presenten en estado gaseoso, líquido o sólido según el tamaño de la cadena carbonada: hasta 4 carbonos son gases, a partir del pentano hasta el hexadecano son líquidos y los compuestos superiores se presentan en estado sólido. También estas fuerzas aumentan, a igualdad de masa, cuanto más larga sea la molécula, esto justifica que el pentano tenga mayor punto de fusión y de ebullición que el dimetilpropano. En todos los compuestos covalentes habrá presentes fuerzas de dispersión y si además la molécula es polar también habrá fuerzas de orientación que, en ese caso, tendrán mayor importancia. 1.2.1. Fuerzas dipolo-dipolo inducido Una molécula polar induce un dipolo en otra molécula no polar; originándose, de esta forma, la atracción electrostática. Esta interacción explica como gases apolares (O2, Cl2, ...) son algo solubles en disolventes polares como el agua. 1.2.2.Fuerzas ion-dipolo En este caso el ion se va rodeando de las moléculas polares. Estas fuerzas son importantes en los procesos de disolución de compuestos iónicos, como la disolución de NaCl en agua. 2. ENLACES POR PUENTE DE HIDRÓGENO Para que se dé el enlace de hidrógeno es necesario que la molécula tenga hidrógeno y que éste se encuentre unido a un elemento con una electronegatividad muy alta y que posea, como mínimo un par de electrones sin compartir: F, O y N. Este tipo de interacción es más fuerte que las fuerzas intermoleculares de dispersión y de orientación y con él se justifica el elevado punto de fusión y ebullición que tiene el agua. El enlace de hidrógeno más fuerte se presentará cuando el hidrógeno está unido al flúor, HF, y sin embargo, el agua tiene el punto de fusión más alto que el HF. Esto es debido a que una molécula de agua puede formar cuatro enlaces de hidrógeno con cuatro moléculas de agua vecinas y el HF sólo puede formar dos enlaces de hidrógeno con dos moléculas de HF vecinas. Este tipo de interacción se da entre moléculas iguales y distintas y son las responsables de que los alcoholes, los fenoles, las aminas y los ácidos carboxílicos (todos de cadena corta) se puedan disolver en agua.