Fuerzas intermoleculares
Anuncio

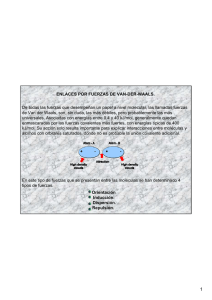
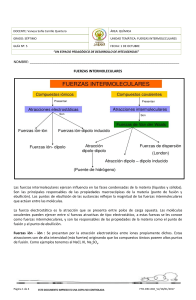
Laura García Espinosa 2ºB Fuerzas intramoleculares Dentro de una molécula, los átomos están unidos mediante fuerzas intramoleculares (enlaces iónicos, metálicos o covalentes, principalmente). Estas son las fuerzas que se deben vencer para que se produzca un cambio químico. Son las que determinan las propiedades químicas de las sustancias. Existen otras fuerzas intermoleculares que actúan sobre distintas moléculas y que hacen que éstas se atraigan o se repelan. Estas fuerzas son las que determinan las propiedades físicas de las sustancias como, por ejemplo, el estado de agregación, el punto de fusión y de ebullición, la solubilidad, la tensión superficial, la densidad, etc. Tipos de fuerzas intermoleculares. Puentes de Hidrógeno Fuerzas de tipo electrostático EL átomo de H se une a átomos muy electronegativos y de pequeño tamaño (F, O, N ). Puntos de fusión y ebullición mas elevados que las sustancias de su misma serie. Fuerzas de Van der Waals Fuerzas de tipo electrostático débiles y de baja energía. Unen moléculas tanto polares como apolares. Mantienen unidas a las moléculas, con poca fuerza. Fuerzas dipolo-dipolo de Keeson. F.dipolo-dipolo inducido de Debye Fuerzas de van der Waals Fuerzas de London o de dispersión Fuerzas intermoleculares Enlace o puente de hidrógeno Fuerzas de Van der Waals Son fuerzas de atracción débiles que se establecen entre moléculas eléctricamente neutras (tanto polares como no polares), pero son muy numerosas y desempeñan un papel fundamental en multitud de procesos biológicos. Fuerzas dipolo dipolo o de Keeson Fuerzas de orientación. Forman dipolos permanentes. La parte positiva del dipolo atrae a la parte negativa del dipolo más próximo. Dos disposiciones: Cabeza- cola. Antiparalela (más estable si las moléculas son más voluminosas). La fuerza de atracción es más intensa cuanto mayor es la polarización de dichas moléculas o cuanto mayor sea la diferencia de electronegatividad entre los átomos enlazados. Agitación térmica: al aumentar la Tª disminuyen las fuerzas de Keeson al cambiar o variar su disposición en el espacio. Fuerzas dipolo dipolo inducido o de Debye Tienen lugar entre una molécula polar y una molécula apolar. En este caso, la carga de una molécula polar provoca una distorsión en la nube electrónica de la molécula apolar y la convierte, de modo transitorio, en un dipolo instantáneo o inducido que establece una fuerza de atracción entre las moléculas. Fuerzas de dispersión o de London Las fuerzas de dispersión son fuerzas atractivas débiles. Entre sustancias no polares, aunque también están presentes en las sustancias polares. Se deben a las irregularidades que se producen en la nube electrónica de los átomos de las moléculas por efecto de la proximidad mutua. La formación de un dipolo instantáneo en una molécula origina la formación de un dipolo inducido en una molécula vecina de manera que se origina una débil fuerza de atracción entre las dos Enlace de hidrógeno. Se produce cuando un átomo de hidrógeno está unido covalentemente a un elemento que sea: muy electronegativo y con dobletes electrónicos sin compartir de muy pequeño tamaño y capaz, por tanto, de aproximarse al núcleo del hidrógeno los elementos muy electronegativos indicados (F, O y N) y un hidrógeno de una molécula vecina El enlace que forman con el hidrógeno es muy polar y el átomo de hidrógeno es un centro de cargas positivas que será atraído hacia los pares de electrones sin compartir de los átomos electronegativos de otras moléculas .Se trata de un enlace débil. Sin embargo, como son muy abundantes, su contribución a la cohesión entre biomoléculas es grande.