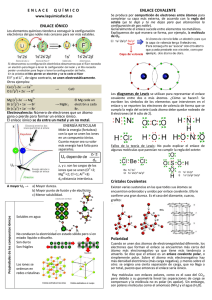
Introducción a la química. Profesora: Veliz Jazmin. Uniones intermoleculares. En química vemos dos tipos de uniones químicas. Las interatómicas y las intermoleculares. Uniones Interatómicas: Son las que se establecen entre los átomos. Hay de tres tipos. En dos de ellas, las llamadas Iónicas y Covalentes, los átomos tratan de llegar a completar el último nivel con ocho electrones cumpliendo con la clásica teoría del octeto de Lewis. La otra es la Unión metálica que se establece entre átomos iguales del mismo metal. Uniones intermoleculares: Son más débiles que las interatómicas. Podemos clasificar a las uniones intermoleculares en tres tipos. Unión Puente de Hidrógeno y Fuerzas de Van der Waals. Dentro de estas últimas tenemos Las fuerzas de dispersión o de London, y las interacciones dipolo-dipolo o dipolo-dipolo inducido y ion-dopolo. Interacciones dipolo-dipolo: Una molécula es un dipolo cuando existe una distribución asimétrica de los electrones debido a que la molécula está formada por átomos de distinta electronegatividad. Como consecuencia de ello, los electrones se encuentran preferentemente en las proximidades del átomo más electronegativo. Se crean así dos regiones (o polos) en la molécula, una con carga parcial negativa y otra con carga parcial positiva. Ion dipolo-dipolo inducido: Tienen lugar entre una molécula polar y una molécula apolar. En este caso, la carga de una molécula polar provoca una distorsión en la nube electrónica de la Introducción a la química. Profesora: Veliz Jazmin. molécula apolar y la convierte, de modo transitorio, en un dipolo. En este momento se establece una fuerza de atracción entre las moléculas. Gracias a esta interacción, gases apolares como el O2, el N2 o el CO2 se pueden disolver en agua. fuerzas de dispersión o fuerzas de London. En muchos textos, se identifican con las fuerzas de van der Waals, lo que puede generar cierta confusión. Las fuerzas de dispersión son fuerzas atractivas débiles que se establecen fundamentalmente entre sustancias no polares, aunque también están presentes en las sustancias polares. Se deben a las irregularidades que se producen en la nube electrónica de los átomos de las moléculas por efecto de la proximidad mutua. La formación de un dipolo instantáneo en una molécula origina la formación de un dipolo inducido en una molécula vecina de manera que se origina una débil fuerza de atracción entre las dos. Puente de Hidrógeno: Es la más fuerte de las intermoleculares y es la responsable del alto punto de ebullición que exhiben moléculas como el agua. Se da mucho en aquellas moléculas que tienen átomos de hidrógeno. El ejemplo más común es la molécula de agua. (H2O). Representemos primero la estructura electrónica de esta molécula. Introducción a la química. Profesora: Veliz Jazmin. La polaridad química o sólo polar es una propiedad de las moléculas que representa la separación de las cargas eléctricas en la misma molécula. Esta propiedad está íntimamente relacionada con otras propiedades como la solubilidad, el punto de fusión, el punto de ebullición, las fuerzas intermoleculares, etc Moléculas polares son las tienen enlaces polares cuyos dipolos no se anulan. Para que una molécula sea polar es necesario que tenga enlaces polares, pero no todas las moléculas con enlaces polares son polares. En una molécula polar hay separación entre las cargas positivas y negativas. La polaridad de un enlace químico se da cuando existe una distribución asimétrica de la nube electrónica del enlace en torno a los dos átomos que forman dicho enlace. Esto sucede cuando ambos átomos tienen distinta electronegatividad. Por ejemplo, si consideramos la molécula de H2, formada por dos átomos idénticos, no hay distinta electronegatividad entre ellos y, por tanto, el enlace no es polar, sino apolar. La nube electrónica se distribuye de forma simétrica en torno a los dos átomos. En cambio, en la molécula, por ejemplo, de HBr, al ser el bromo más electronegativo que el hidrógeno, atrae hacia sí los electrones del enlace químico y la nube electrónica quedará distribuida de forma asimétrica. Decimos que el enlace H-Br es polar y que, aunque la molécula globalmente sea neutra, por esta distribución asimétrica queda una densidad de carga negativa sobre el Br, lo cual representamos como delta(-), y una densidad de carga positiva sobre el hidrógeno, representada como delta(+). Delta(-) y delta(+) son iguales y de signo contrario.