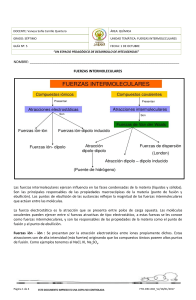
27/3/2021 fuerzas intermoleculares fuerzas intermoleculares: text, images, music, video | Glogster EDU - Interactive multimedia posters ¿como se define? ???? Se definen como las fuerzas atractivas que existen entre moléculas y que provocan que permanezcan próximas entre si cuando las sustancia esta en estado liquido o gaseoso. El termino “intermolecular”, aunque se refiere exclusivamente a sustancias moleculares (sustancias unidas por enlaces covalentes), también se refiere a cualquier tipo de partículas (moléculas, iones y átomos). Si las fuerzas intermoleculares no existieran, todas las sustancias serian gases y no habría estado líquido ni solido. En Fuerzas de London FUERZAS DE DISPERSION O FUERZAS DE LONDON En las moléculas no polares puede producirse de forma transitoria un desplazamiento relativo de electrones, de modo que origina un polo positivo y otro negativo (dipolo transitorio); esto determina una atracción entre dichas moléculas (el polo positivo de una molécula atrae al negativo de la otra y viceversa). Estas fuerzas de atracción son muy débiles y se denominan fuerzas de London, en honor al físico alemán-estadounidense Fritz London (19000-1954). Dipolo-dipolo inducido En los dipolos inducidos, actúa una molécula polar sobre una molécula no polar. Cuando esta ultima se introduce en el campo de fuerza de la molécula polar, se produce una acumulación de cargas negativas en un extremo y de cargas positivas en el opuesto, generándose así un Dipolo-dipolo Cuando dos moléculas polares se acercan una a la otra, tienden a linearse de tal forma que el extremo positivo de un dipolo esta dirigido al extremo negativo del otro. Cuando esto ocurre, hay una atracción electrostática entre los dos dipolos. Por varias razones, esta es una atracción mucho más débil que la existente entre iones con cargas opuestas. Primero, solo hay cargas parciales sobre los extremos de los dipolos; segundo, los átomos y las moléculas están en constante movimiento y los choques impiden a los dipolos estar perfectamente alineados; tercero, hay una fuerza de repulsión entre los extremos de los dipolos que transportan cargas similares. Made by Glogster.com fuerzas intermoleculares https://edu.glogster.com/glog/fuerzas-intermoleculares/2bh8avlpl08 1/1