I.E.S. Gabriela Mistral Química de 2º de Bachillerato Leyre González
Anuncio

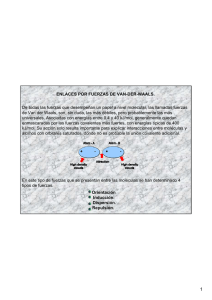
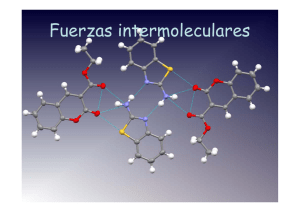
I.E.S. Gabriela Mistral Química de 2º de Bachillerato Leyre González López Los puntos de fusión y ebullición de los compuestos es una propiedad física característica de cada uno de ellos, y depende del tipo de fuerza que mantiene unidas las partículas (átomos, iones o moléculas) que lo forman. Estos tipos de fuerzas se pueden dividir en dos tipos: • De carácter atómico: covalentes, iónicas o metálicas. • De carácter molecular: puente de hidrógeno, fuerzas de Van der Waals (dipolo permanentedipolo permanente, dipolo permanente-dipolo inducido, dipolo instantáneo-dipolo inducido). Cuanto mayores sean estas fuerzas, mayores serán los puntos de fusión y de ebullición. Estas fuerzas se ordenan, de más fuerte a más débil: 1. Covalente. 2. Iónica. 3. Metálica. 4. Puente de hidrógeno 5. Dipolo permanente-dipolo permanente. 6. Dipolo permanente-dipolo inducido. 7. Dipolo instantáneo-dipolo inducido. También hay que tener en cuenta que las fuerzas intermoleculares (números 5 a 7) aumentan con el tamaño de las moléculas. Cuestión 1 de septiembre de 2003. Sabiendo que las temperaturas de 3550, 650, -107 y -196 ºC corresponden a las temperaturas de fusión de los compuestos nitrógeno, aluminio, diamante y tricloruro de boro: a) Asigne a cada compuesto el valor que corresponde a su temperatura de fusión y justifique esta asignación. b) Justifique los tipos de enlace y/o las fuerzas intermoleculares que están presentes en cada uno de los compuestos cuando se encuentran en estado sólido. a) El menor punto de fusión, -196 ºC, corresponde al nitrógeno, puesto que es una sustancia molecular, las cuales tienen puntos de fusión bajos. El siguiente punto de fusión más bajo, -107 ºC, corresponde al tricloruro de boro, que es una sustancia molecular y por tanto también tiene bajo punto de fusión, pero éste es mayor que el del nitrógeno puesto que las fuerzas que mantienen unidas las moléculas en el BCl3 son algo más fuertes que en el N2 -explicado en el apartado b)-. El punto de fusión de 650 ºC corresponde al aluminio, que es un metal. El enlace metálico es un enlace fuerte y por tanto las sustancias metálicas tienen puntos de fusión altos. El punto de fusión más alto, de 3350 ºC corresponde al diamante, que es un cristal covalente. Los cristales covalentes son las sustancias con los puntos de fusión más altos, debido a que es el enlace covalente, muy fuerte, el que mantiene unidos los átomos. b) En la molécula de N2 hay un enlace covalente triple entre dos átomos de N, que es lo que forma esta molécula. Pero lo que mantiene unidas las moléculas en estado sólido no es un enlace covalente sino las fuerzas intermoleculares entre las moléculas de N2. Al ser la molécula de N2 apolar, estas fuerzas son del tipo dipolo instantáneo-dipolo inducido. En un momento dado, debido a que los electrones no están en posiciones fijas alrededor del átomo, se puede generar un dipolo instantáneo debido a que los electrones se sitúen en una zona de la molécula, que adquirirá carga parcial negativa, dejando otra parte de la molécula con carga parcial positiva. Este dipolo instantáneo puede inducir un dipolo a otra molécula vecina, lo que sería un dipolo inducido. El tricloruro de boro también es un compuesto covalente que forma moléculas. Cada átomo de boro forma tres enlaces sencillos con átomos de cloro formando las moléculas de BCl3. Y dichas moléculas también están unidas por fuerzas intermoleculares del tipo dipolo instantáneo-dipolo inducido, puesto que el BCl3 también es una molécula apolar. Pero al ser la molécula de tricloruro de boro más grande que la molécula de nitrógeno, su punto de fusión es algo mayor, ya que sus fuerzas intermoleculares son más fuertes (éstas aumentan con el tamaño de las moléculas). En el aluminio lo que mantiene unidos a los átomos es el enlace metálico: el Al ha perdido tres electrones para adquirir la configuración de gas noble, quedándose como Al3+. Los cationes Al3+ forman una red de átomos entre los cuales se mueven los electrones perdidos, formando una nube electrónica. En el diamante lo que mantiene unidos los átomos de carbono es el enlace covalente. Cada átomo de carbono forma 4 enlaces sencillos con 4 átomos vecinos, formando una red tridimensional de átomos de carbono unidos por enlaces covalentes.