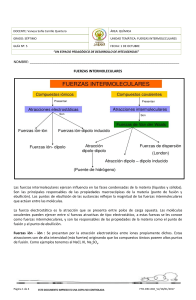
MINISTERIO DE EDUCACIÓN DIRECCIÓN REGIONAL DE EDUCACIÓN DE VERAGUAS INSTITUTO URRACÁ I-TRIMESTRE MÓDULO N° 3 Asignatura: QUIMICA NIVEL: XI GRADO Profesora: Miriam Camarena A, B, C, D, F FUERZAS INTERMOLECULARES I- OBJETIVO GENERAL: Reconocer las fuerzas intermoleculares presentes en los diferentes materiales encontrados en la naturaleza. II- FUERZAS INTERMOLECULARES Las fuerzas intermoleculares se definen como el conjunto de fuerzas atractivas y repulsivas que se producen entre las moléculas como consecuencia de la polaridad que poseen las moléculas. Las fuerzas intermoleculares, fuerzas de atracción entre moléculas a veces también reciben el nombre de enlaces intermoleculares, aunque son considerablemente más débiles que los enlaces iónicos, covalentes y metálicos. Las principales fuerzas intermoleculares son: Las fuerzas de Van der Waals, que podemos clasificar a su vez en: o Ión – dipolo o Dipolo - Dipolo o Fuerzas de dispersión de London. El enlace de hidrógeno (antiguamente conocido como puente de hidrógeno) FUERZA DE VAN DER WAALS También conocidas como fuerzas de dispersión de London o fuerzas dipolo-transitivas, corresponden a las interacciones entre moléculas con enlaces covalentes apolares debido a fenómenos de polarización temporal. Estas fuerzas se explican de la siguiente forma: como las moléculas no tiene carga eléctrica neta en ciertos momentos se puede producir una distribución en la que hay mayor densidad de electrones en una región que en otra, por lo que aparece un dipolo momentáneo. Cuando dos de estas moléculas polarizadas y orientadas convenientemente se acercan lo suficiente entre ambas, pude ocurrir que las fuerzas eléctricas atractivas sean lo bastante intensas como para crear uniones intermoleculares. Estas fuerzas son muy débiles y se incrementan con el tamaño de las moléculas. FUERZAS DE LONDON O DE DISPERSIÓN Las fuerzas de London se presentan en todas las sustancias moleculares. Son el resultado de la atracción entre los extremos positivo y negativo de dipolos inducidos en moléculas adyacentes. Incluso los átomos de los gases nobles, las moléculas de gases diatómicos como el oxígeno, el nitrógeno y el cloro (que deben ser no polares) y las moléculas de hidrocarburos no polares como el CH4, C2H6 tienen tales dipolos instantáneos. En la mayoría de los casos se trata de fuerzas muy débiles, aunque van aumentando con el tamaño molecular porque los átomos grandes al tener más electrones se pueden deformar con mayor facilidad. ATRACCIONES DIPOLO-DIPOLO Una atracción dipolo-dipolo es una interacción entre dos moléculas polares o dos grupos polares de la misma molécula si ésta es grande. En la sección anterior explicamos cómo se forman moléculas que contienen dipolos permanentes cuando se enlazan simétricamente con átomos con electronegatividad diferente. Las moléculas que son dipolos se atraen entre sí cuando la región positiva de una está cerca de la región negativa de la otra. Las atracciones dipolo-dipolo, también conocidas como Keeson, por Willem Hendrik Keesom, quien produjo su primera descripción matemática en 1921, son las fuerzas que ocurren entre dos moléculas con dipolos permanentes. Estas funcionan de forma similar a las interacciones iónicas, pero son más débiles debido a que poseen solamente cargas parciales. Un ejemplo de esto puede ser visto en el ácido clorhídrico: HCl, HF, HBr, HI FUERZAS ION-DIPOLO Estas son interacciones que ocurren entre especies con carga. Las cargas similares se repelen, mientras que las opuestas se atraen. Es la fuerza que existe entre un ion y una molécula polar neutra que posee un momento dipolar permanente. Las moléculas polares son dipolos (tienen un extremo positivo y un extremo negativo. Los iones positivos son atraídos al extremo negativo de un dipolo, en tanto que los iones negativos son atraídos al extremo positivo), estas tienen enlaces entre sí Las fuerzas ion-dipolo son importantes en las soluciones de las sustancias iónica. ENLACE DE HIDRÓGENO El enlace de hidrógeno ocurre cuando un átomo de hidrógeno es enlazado a un átomo fuertemente electronegativo como el Flúor, F, el Oxígeno, O, o el nitrógeno, N . El átomo de hidrógeno posee una carga positiva parcial y puede interactuar con otros átomos electronegativos en otra molécula (nuevamente, con N, O o F). Por otra parte, cuanto mayor sea la diferencia de electronegatividad entre el H y el átomo interactuante, más fuerte será el enlace. Un ejemplo claro del enlace de hidrógeno es el agua. Los enlaces de hidrógeno se encuentran en toda la naturaleza. Proveen al agua de sus propiedades particulares, las cuales permiten el desarrollo de la vida en la Tierra. Los enlaces de hidrógeno proveen también la fuerza intermolecular que mantiene unidas ambas hebras en una molécula de ADN. Es un tipo especial de interacción dipolo-dipolo entre el átomo de hidrógeno que está formando un enlace polar, tal como N—H, O—H, ó F—H, y un átomo electronegativo como F, O, N. Esta interacción se representa de la siguiente forma: A—H•••B A—H•••A A y B representan F, O ó N; A—H es una molécula o parte de una molécula y B es parte de otra. La línea de puntos representa el enlace de hidrógeno. Los puentes de hidrógeno son especialmente fuertes entre las moléculas de agua y son la causa de muchas de las singulares propiedades de esta sustancia. Te presentamos el siguiente cuadro a modo de resumen las fuerzas inter- e intramoleculares: Ejemplos de prácticas de problemas de aplicación: 1. ¿Qué tipos de fuerzas intermoleculares existen entre los siguientes pares? a. HBr y H2S b. Cl2 y CBr4 c. I2 y NO3 – d. NH3 y C6H6 Razonamiento y solución: Para identificar las fuerzas intermoleculares, conviene clasificar las especies participantes como 1) moléculas no polares, 2) moléculas polares y en 3) iones. Recuerde que las fuerzas de dispersión existen entre todas las especies. a. Tanto como el HBr y el H2S son moléculas polares, de modo que entre ellas se establecen fuerzas dipolo – dipolo, además de las fuerzas de dispersión. b. Tanto el Cl2 como el CBr4 son moléculas no polares, de modo que entre ellas solo existen fuerzas de dispersión. c. El I2 es no polar, de modo que las fuerzas de atracción entre esta molécula y el ion NO 3 – son del tipo ion – dipolo inducido y fuerzas de dispersión. d. El NH3 es polar y el C6H6 es no polar. Entre estas especies se establecen fuerzas del tipo ion – dipolo inducido y fuerzas de dispersión. 2. ¿Cuál de las siguientes especies, CH3OCH3, CH4, F-, HCOOH, Na+, ¿puede formar enlaces de hidrógeno con el agua? Razonamiento y solución: Para formar enlaces de hidrógeno, un átomo de H debe estar ligado a un átomo de uno de los elementos electronegativos (F, O, N) Estos átomos no se encuentran en el CH4 o en el Na+, por tanto, solo las especies CH3OCH3, F- y HCOOH, pueden formar enlaces de hidrógeno con el agua. 3. Identifique los tipos de fuerzas intermoleculares que esta presentes en cada una de las sustancias y escoja de cada par la que tiene el punto de ebullición más alto. a) HF y HCl b) CHCl3 y CHBr3 c) Br2 y ICl Razonamiento y solución: a. Tanto el HF y HCl son moléculas polares, de modo que entre ellas se establecen fuerzas dipolo – dipolo, además de las fuerzas de dispersión, pero el HF forma puentes de hidrógeno por eso tiene el punto de ebullición más alto. b. Ambos compuestos son polares así que tienen tienen fuerzas dipolo- dipolo y fuerzas de dispersión. El CHBr3 tiene mayor punto de ebullición por tener mayor masa molar. c. El Br2 es no polar tiene fuerza de dispersión y el ICl es polar tiene fuerza dipolo-dipolo y London por eso tiene el punto de ebullición más alto III. METODOLOGÍA. De acuerdo con el material teórico proporcionado. los ejemplos dados y los vídeos sugeridos, resuelva los problemas que se le proponen en la actividad correspondiente a esta sesión. Vídeos sugeridos: https://www.youtube.com/watch?v=DS0v0RWUwCI&feature=emb_rel_end ACTIVIDAD N° 1 FUERZAS INTERMOLECULARES I. Resuelva las siguientes situaciones presentadas para fuerzas intermoleculares. 1. Determine las fuerzas intermoleculares presentes en cada caso: a) N2 b) NH3 c) CO d) CCl4 2. Determine las fuerzas intermoleculares presentes en cada caso: a) HCl b) H2O c) Br2 d) He 3. Señale el (los) tipo(s) de fuerzas intermoleculares que existen entre las moléculas (o unidades básicas) en cada una de las siguientes especies: LiF, CH4 y SO2. 4. ¿Cuáles de las siguientes especies, H2S, C6H6, CH3OH, pueden formar enlaces de hidrógeno entre sí? II- Identifique para cada caso si al mezclar las substancias forman una solución homogénea. En caso de que forme solución homogénea, indique el tipo de fuerzas intermoleculares que domina: a) CCl4 y H2O b) KCl y H2 O c) Br2 y CCl4 d) CH3CH2OH y H2O e) CH3CH2CH2CH3 y III- CH3CH2CH2CH2CH3 Identifique los tipos de fuerzas intermoleculares que esta presentes en cada una de las sustancias y escoja de cada par la que tiene el punto de ebullición más alto. a) C6H14 o C8H18 b) C3H8 o CH3OCH3 c) CH3OH o CH3SH d) NH2NH2 o CH3CH3