Document
Anuncio

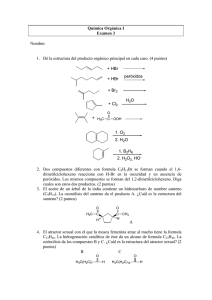
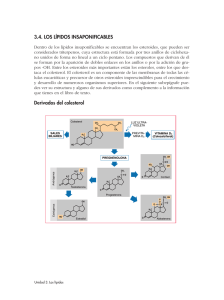
Universidad de Alcalá Doctorado en Química Médica 2010-2011 ESTRATEGIAS EN SINTESIS DE FARMACOS SÍNTESIS DE LOSARTÁN Y ANÁLOGOS 13/06/2011 Ramón Alajarín Ramón Alajarín Ferrández 1 Síntesis de Losartán y análogos 1. Introducción 2. Biología-Farmacología 3. Patentes de Dupont-MercK 4. Lagunas en las patentes 5. Síntesis de Valsartán 6. Fármacos duales de Losartán 7. Conclusiones Cl N H3C OH N N N N NH Carini, Duncia, Wang (US 5138069, DuPont-Merck, 1986) 13/06/2011 Ramón Alajarín 2 1. Introducción Síntesis de Losartán y análogos Compañía: The DuPont Merck Pharmaceutical Company Clase: Antagonista de Angiotensina II Cl N H3C Area Terapeútica: Hipertensión, Ansiedad, Infarto, OH Fallo cardiaco. N N N N N - K+ Descubrimiento: 1986 Formulaciones: Sal Potásica (tabletas) Con Hidroclorotiazida (Tabletas) Marcas Registradas: Cozar, Avasta, Hyzaa, Losacor D - El primer antihipertensivo aprobado perteneciente a la clase de antagonistas del receptor Angiotensina II (tipo AT1). - La patente describe 354 moléculas nuevas para el tratamiento de la hipertensión. - Lanzado al mercado en 1994 (Suecia). - Actualmente existen derivados en el mercado con perfil farmacológico mejorado o en las etapas finales de desarrollo. 13/06/2011 Ramón Alajarín 3 2. Biología-Farmacología Síntesis de Losartán y análogos Modo de Acción DBP – 83 mmHg Infarto Hipertensión Enfermedad coronaria SBP – 140 mmHg Edad, raza, sexo, otras enfermedades, estatus socio-económico Terapia Diuréticos de tiazida Inhibidores ACE Bloqueantes β-adrenérgicos Bloqueantes de calcio Antagonistas AII H3C OH O H N CH3 CH3 CH3 N MeO2C 13/06/2011 N N N N NH COOH Me Propanolol OH NO2 CO2Me SH O Cl N Captopril N H Me Nifedipino Ramón Alajarín Losartán 4 2. Biología-Farmacología Síntesis de Losartán y análogos El Sistema Renina-Angiotensina Angiotensinógeno (α2-globulina) Asp-Arg-Val-Tyr-Ile-His-Pro-Phe-His-Leu-Leu-Val-Tyr-Ser... Renina Angiotensina I (ΑΤ−Ι) Asp-Arg-Val-Tyr-Ile-His-Pro-Phe-His-Leu Enzima Convertidora de Angiotensina (ACE) (proteasa no específica) Angiotensina II (ΑΤ−ΙΙ) Asp-Arg-Val-Tyr-Ile-His-Pro-Phe Vasoconstricción Angiotensinasas Glándula adrenal Aldosterona Angiotensina III Arg-Val-Tyr-Ile-His-Pro-Phe Presión sanguínea Angiotensinasas Fragmentos Inactivos 13/06/2011 Retención Na+/ Líquidos Ramón Alajarín Presión sanguínea 5 2. Biología-Farmacología Síntesis de Losartán y análogos El Sistema Renina-Angiotensina Vasodilatación Angiotensinógeno (α2-globulina) Asp-Arg-Val-Tyr-Ile-His-Pro-Phe-His-Leu-Leu-Val-Tyr-Ser... Renina [AT-II] Presión sanguínea 13/06/2011 [Bradiquinina] Tos seca (ACE) Angiotensina I (ΑΤ−Ι) Asp-Arg-Val-Tyr-Ile-His-Pro-Phe-His-Leu X [NO] Presión sanguínea Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg Enzima Convertidora de Angiotensina (ACE) (proteasa no específica) Inhibición Angiotensina II (ΑΤ−ΙΙ) Asp-Arg-Val-Tyr-Ile-His-Pro-Phe Ramón Alajarín Captopril 6 2. Biología-Farmacología Síntesis de Losartán y análogos El Sistema Renina-Angiotensina Angiotensinógeno (α2-globulina) Asp-Arg-Val-Tyr-Ile-His-Pro-Phe-His-Leu-Leu-Val-Tyr-Ser... Renina Angiotensia I (ΑΤ−Ι) Asp-Arg-Val-Tyr-Ile-His-Pro-Phe-His-Leu Enzima Convertidora de Angiotensina (ACE) (proteasa no específica) Angiotensia II (ΑΤ−ΙΙ) Antagonista AT1 Asp-Arg-Val-Tyr-Ile-His-Pro-Phe X Angiotensinasas Vasoconstricción Presión sanguínea Antagonista AT1 X Aldosterona Angiotensia III Arg-Val-Tyr-Ile-His-Pro-Phe Retención Na+/ Líquidos Angiotensinasas Fragmentos Inactivos 13/06/2011 Glándula adrenal Ramón Alajarín Presión sanguínea 7 2. Biología-Farmacología Síntesis de Losartán y análogos Receptores de AT-II AT1 AT2 AT-II AT-II Radicales libres de oxígeno Respuesta Secreción de inotrópica aldosterona Contracción vascular AT1 Aumenta NO Aumenta citoquinas AT2 LOSARTAN 13/06/2011 Inhibición del crecimiento y proliferación Aumenta apoptosis AT-II Ramón Alajarín 8 2. Biología-Farmacología Síntesis de Losartán y análogos Relaciones estructura-actividad Cl N H3C Cl N H3C N OH N N N N NH COOH SAR (Merck) X J. Med. Chem. 1990-1991 Fuzukawa (Takeda, Osaka Japan, 1979) IC50 (nM) IC50 (µM) - Losartán (Merck) Grupo ac. carboxílico (o tetrazol) en el anillo aromático. - Sustitución en C2 de imidazol crítica para incrementar la potencia. - Bifenilo como anillo aromático. 13/06/2011 Ramón Alajarín 9 2. Biología-Farmacología Síntesis de Losartán y análogos Metabolismo Cl N H3C OH N CYP2C9 H3C Cl N N COOH N N N NH N N N NH Losartán (Merck) EXP 3164 Bioasequibilidad oral: 25% Metabolito más activo Vida media: 2 h 50% eliminación por vesícula biliar No tos ni angioedema Vértigo 13/06/2011 Ramón Alajarín 10 2. Biología-Farmacología Síntesis de Losartán y análogos Sartanes H3C H3C H3C N Cl N O HO OH H3C CH3 OH HO H N N N N Losartan (1988, Du Pont) Valsartan (1991, Ciba Geigy) N CH3 HO N O N H3C N H3C N N N S CH3 H N N N N CH3 O O CH3 N O H N N N N OH S-8308 (1982, Du Pont) N CH3 O H N N N N OH S-8006 O N OH O O2N O CH 3 Cl N N Cl N O H3C N N OH CH3 O OH HO Olmesartan (Sankyo) 13/06/2011 Candesartan (1993, Takeda) Eprosartan (1993, SmithKline Beecham) Ramón Alajarín Telmisartan (1992, Thomae) 11 3. Patentes de Dupont-Merck Síntesis de Losartán y análogos Análisis Retrosintético Cl N N Y C A H3C R N N N N X Cl N OH N H + N N N NH CN X CN R N N N N OH H3C N N Cl N OH H3C OH H3C Cl N z B Cl N H3C + OH N H Cl N Y CN OH H3C N H X + o CN H3C z CN A: Lineal; Generación del anillo de tetrazol en el último paso. B: Lineal; Generación del anillo de tetrazol en los pasos iniciales. C: Convergente; Generación del enlace bifenilo en los últimos pasos. 13/06/2011 Ramón Alajarín Etapas primeras o últimas Acoplamiento del bifenilo, Activación bencílica-acoplamiento Síntesis del tetrazol 12 3. Patentes de Dupont-Merck Síntesis de Losartán y análogos Síntesis Lineal A CH3 I CO2CH3 + Br CH3 CH3 a, b I c 5 4 H3C O CH3 7 6 CH3 8 N OMe 11 10 O NH.HCl g N H3C N H + OH OH 12 CN f e OR CN CO2H Br H3C d 13 14 h N H3C N H OH Cl OH 15 a. Cu, 180-240 ºC, 1h (11%); b. NaOH (100%); c. SOCl2, reflujo, NH4OH luego SOCl2, reflujo 3h (84%); d. NBS, (PhCOO)2, CCl4, reflujo, 3h (60%); e. Mg, THF, 20 ºC, luego 10 (91%); f. 4,5 N HCl, reflujo, 12h (88%); g. NH3 ac.; h. NCS, dioxano, 50 ºC, 8h (70-75%); 13/06/2011 Ramón Alajarín 13 3. Patentes de Dupont-Merck Síntesis de Losartán y análogos Síntesis Lineal A N H3C Cl N OH A1: 7-8-9-1 (3,3%) CPh3 N N N N A2: 7-8-9-18-1 (6,8%) Br CH3 18 n CN CN + H3C N H 15 Cl H3C OH A N A2 Cl l, m A1 Cl N N i 8 A2 N H3C N 7 r, m OH N CN N N NK+ OH 9 1 i. MeOH, MeONa 15, 0,5 h, luego DMF 8, t.a., 16 h (20%); l. NaN3, NH4Cl, DMF, 100 ºC a 120 ºC, 13 d (1533%); m. Isopropanol, KOH, agua (86%); n. TMSN3, xileno, 115 ºC, 41 h, luego 10N NaOH, DCM, THF, t.a., 5 min, PPh3Cl, 3 h (75%); r. 3,4N HCl, 10-20 ºC, 2 h (76%). 13/06/2011 Ramón Alajarín 14 3. Patentes de Dupont-Merck Síntesis de Losartán y análogos Análisis Retrosintético Cl N Y C A X H3C R N N N N X Cl OH N H N N N N NH CN N R N N N N OH H3C N N Cl N OH H3C OH H3C Cl N + CN z B Cl N H3C + OH N H Cl N Y CN OH H3C N H X + o CN H3C z CN A: Lineal; Generación del anillo de tetrazol en el último paso. B: Lineal; Generación del anillo de tetrazol en los pasos iniciales. C: Convergente; Generación del enlace bifenilo en los últimos pasos. 13/06/2011 Ramón Alajarín Etapas primeras o últimas Acoplamiento del bifenilo, Activación bencílica-acoplamiento Síntesis del tetrazol 15 3. Patentes de Dupont-Merck Síntesis de Losartán y análogos Síntesis Lineal B Br CH3 CH3 CPh3 N N N N o CN B CPh3 N N N N p B 16 7 N H3C N OH CPh3 N N N N 18 r, m B 17 N H3C Cl q Cl N B: 7-16-17-18-1 (11,4%) OH B N N N N - K+ 1 N H3C N H Cl O 15a m. Isopropanol, KOH, agua (86%); o. NaN3, n-Bu3SnCl, tolueno, 110 ºC, 70 h luego 10N NaOH, PPh3Cl, 3 h (68%); p. NBS, AIBN, CCl4, reflujo, 3h; q. 15a, 10N NaOH, NaBH4 (47% a partir de 16); r. 3,4N HCl, 10-20 ºC, 2 h (76%). 13/06/2011 Ramón Alajarín 16 3. Patentes de Dupont-Merck Síntesis de Losartán y análogos Pasos clave: Acoplamiento del bifenilo CH3 CH3 H3C I CO2CH3 e, f a, b + O MgBr N OMe CO2H I CH3 + CH3 5 4 10 6 a. Cu, 180-240 ºC, 1h (11%); b. NaOH (100%) 11 e. 4-Bromotolueno, Mg, THF, 20 ºC, luego 10 (91%); Acoplamiento de Ullmann f. 4,5 N HCl, reflujo, 12h (88%) Tª > 200 ºC Oxazolina de Meyer Rto: 11% Rto: 80% CH3 CH3 c c. SOCl2, reflujo, luego NH4OH, luego SOCl2, reflujo 3h (84%); CN CO2H 6 13/06/2011 7 Ramón Alajarín 17 3. Patentes de Dupont-Merck Síntesis de Losartán y análogos Pasos clave: Bromación bencílica CPh3 N N N N d CN Br CH3 Br CH3 CN 16 7 CPh3 N N N N p 17 8 p. NBS, AIBN, CCl4, reflujo, 3h; d. NBS, (PhCOO)2, CCl4, reflujo, 3h (60%) Punto débil de la síntesis: CCl4 TÓXICO 13/06/2011 Ramón Alajarín 18 3. Patentes de Dupont-Merck Síntesis de Losartán y análogos Pasos clave: Síntesis del imidazol O NH.HCl H3C g N H3C N H N H + OR OH OH OH NH3 OH OH NH NH2 OH OH OH OH OH Fukuzawa g. NH3 ac.; h. NCS, dioxano, 50 ºC, 8h (70-75%) O Cl 15 14 13 12 N H3C h Rto: 70-75% NH2 O OH 13 NH2 NH H3C OR + H3C O NH2 NH O N H OH OH H3C O N OH 12 NH3 N H 3C N OH N H3C N H OH 14 13/06/2011 Ramón Alajarín 19 3. Patentes de Dupont-Merck Síntesis de Losartán y análogos Pasos clave: Acoplamiento bencilo-imidazol Br N H3C Cl N OH CN + i N H3C Cl N H Regioselectividad no indicada. Rto: 20% CN OH i. MeOH, MeONa 15, 0,5 h, luego DMF 8, t.a., 16 h (20%) 15 8 9 Br N H3C CPh3 N N N N + 17 (no aislado) 13/06/2011 N H3C N H Cl N Cl O q OH CPh3 N N N N Regioselectividad no indicada. Rto: 47% a partir de 16 q. 15b, 10N NaOH, NaBH4 (47% a partir de 16) 15b 18 Ramón Alajarín 20 3. Patentes de Dupont-Merck Síntesis de Losartán y análogos Pasos clave: Acoplamiento bencilo-imidazol Br N H3 C + CN 19 N H N H3C N Cl + N OH Cl OH 15 CN 20 13/06/2011 Cl OH N H3C Ramón Alajarín 2:1 CN 21 21 3. Patentes de Dupont-Merck Síntesis de Losartán y análogos Pasos clave: Síntesis del tetrazol Ar CN NH4Cl/NaN3 Ar DMF/115 ºC CH3 H N N N N CN 7 CH3 CH3 CH3 o Finnegan. Método poco segruo (HN3) Rto: 15-33% 2 semanas Descomp. exotérmica del producto Na+ Sn(n-Bu)3 N N N N N 22 23 CPh3 N N N Duncia y col. N N - N N (DuPont/Merck) 16 o. NaN3 (1,0 equiv), n-Bu3SnCl (1,08 equiv), tolueno, 110 ºC, 70 h luego 10N NaOH, PPh3Cl (1,04 equiv), 3 h, t.a. (68%) Azida separada por extracción acuosa y oxidada con NaNO2/HCl 13/06/2011 Ramón Alajarín 22 3. Patentes de Dupont-Merck Síntesis de Losartán y análogos Pasos clave: Síntesis del tetrazol Mecanismo por pasos N N Bu3SnN3 R N N N N + R SnBu3 SnBu3 N N N R Mecanismo Concertado N R 13/06/2011 N Bu3SnN3 R N N - SnBu3 SnBu3 N N+ N R Ramón Alajarín N N 23 3. Patentes de Dupont-Merck Síntesis de Losartán y análogos Pasos clave: Síntesis del tetrazol CH3 a 6 NH N NH 24 N NH2 Cl b O CO2H CH3 CH3 CH3 26 CN 25 CN c d CH3 CH3 O + PPh3 N 30 CN N3 CN H N N N N Global 46% CH3 CH3 29 e N N N N Global 17,4% 28 N3 CN N CN 27 a. SOCl2, CHCl3, reflujo, 4 h, luego THF, NaOH, NH2CH2 CH2CN (86%); b. PCl5, luego dioxano, NH2NH2, t.a., 16 h (46%); c. CH3CN, N2O4, t.a., 24 h (44%); d. PPh3, DEAD, TMSN3, t.a., Fluoruo de metal alcalino, 24 h luego CAN, 0 ºC, luego 1N NaOH, t.a., 24 h, HCl (53%); e. 1 N NaOH. TMSN3, comercial, estable, p. eb. 105 ºC, alto coste 13/06/2011 Ramón Alajarín 24 3. Patentes de Dupont-Merck Síntesis de Losartán y análogos Pasos clave: Síntesis del tetrazol O O EtO EtO N N O Ph3P O EtO EtO N N + PPh3 Ar CN N H O EtO EtO + PPh3 N NH O + CN N Ar O PPh3 N Ar CN O O F- N Ar N H N N N HO Ar N + Me3Si N N N N N+ N N N CN H 13/06/2011 - Ramón Alajarín Ar N + Ph3PO CN + Me3SiF 25 3. Patentes de Dupont-Merck Síntesis de Losartán y análogos Pasos clave: Otras síntesis del tetrazol CH3 CN Witenberg y Donner (Abbott, 1993) 7 Me3SiO N 3 Sn n-Bu n-Bu 32 Me3SiN3 5,4 equiv. CH3 Me3SiO n-Bu Sn N N n-Bu N N TOLUENO/ 110 ºC 72 h O Sn n-Bu n-Bu 33 CH3 CH3 31 (catalítico) N N N N TON = 10 SiMe3 34 H N N N N HCl (86%) 29 TMSN3, comercial, estable, p. eb. 105 ºC, alto coste 13/06/2011 Ramón Alajarín 26 3. Patentes de Dupont-Merck Síntesis de Losartán y análogos Pasos clave: Otras síntesis del tetrazol CH3 CH3 NaN3 (4,6 equiv)/ DMF CN H N N N N ZnCl2 (3 equiv)/ 36 h 7 (94%) Galante (American Home Products Corporation, 1995) 29 CH3 CH3 CPh3 N o. NaN3 (1,0 equiv), n-Bu3SnCl N N (1,08 equiv), tolueno, 110 ºC, N 70 h luego 10N NaOH, PPh3Cl (1,04 equiv), 3 h, t.a. (68%) o CN 7 16 La síntesis de Merck es la más competitiva en base a rendimientos, coste de reactivos e impacto ambiental. 13/06/2011 Ramón Alajarín 27 3. Patentes de Dupont-Merck Síntesis de Losartán y análogos Pasos clave: Protección de la Patente. Intermedios CH2X2 (H, Br, I, OTs, OH, OMs o imidazoles) N N X1 (H, Ph3C, pNO2Bn, CH2CH2CN) N N Patente US, 1987 35 N CH2X2 (Br, I, OTs, OH, OMs o imidazoles) N X1 (H, Ph3C, pNO2Bn, CH2CH2CN) N N N Patente US, 1988 37 13/06/2011 N SnR3 N N Patente US, 1988 36 CH2X2 (derivados de imidazol) N CH2X2 (H, Br, I, OTs, OH, OMs o imidazoles) N X1 (H, Ph3C, pNO2Bn, CH2CH2CN, SnR3) N N Patente EP, 1988 38 Ramón Alajarín 28 3. Patentes de Dupont-Merck Síntesis de Losartán y análogos Aproximación de Suzuki CH3 CPh3 N N N N Ph-CN NaN3 a Li CPh3 N N N N b ClZn CPh3 N N N N CPh3 N N N N c Ph3CCl 39 41 40 Materiales de partida baratos 16 Shuman, King, Anderson (Merck) Flippin (Syntex) a. N-BuLi/hexano, THF, -20 ºC a –10 ºC, 1 h; b. ZnCl2 0 ºC, luego (PPh3)2NiCl2 (MeMgCl como agente reductor); c. 4-Yodotolueno 20 ºC, 10 h (94%) 13/06/2011 Ramón Alajarín 29 3. Patentes de Dupont-Merck Síntesis de Losartán y análogos Aproximación de Suzuki Pd(0) o Ni(0) R-X + R’-Met R-R’ (R-R) Met= Li, Mg, Al, Zn, Zr, B, Sn, Cu(I), Si Met= B (Suzuki) Desde el punto de vista industrial, entre las distintas reacciones de acoplamiento C-C catalizadas por Pd o Ni, la reacción de Suzuki es la reacción más adecuada debido a su menor impacto ambiental, coste, condiciones de reacción suaves, versatilidad y compatibilidad con grupos funcionales. 13/06/2011 Ramón Alajarín 30 3. Patentes de Dupont-Merck Síntesis de Losartán y análogos Aproximación de Suzuki Síntesis de organoboranos A partir de organolitios o reactivos de Grignard R-B(OR)2 R-Met + B(OR)3 Met= Li, Mg Hidroboración de alquenos y alquinos R R H X + + HBY2 HBY2 H BY2 R H H BY2 R X E-vinilboranos o alquilboranos t-BuLi R BY2 H H Z-vinilboranos O Y2 = 2 O Disiamilo 13/06/2011 Ramón Alajarín Catecol 31 3. Patentes de Dupont-Merck Síntesis de Losartán y análogos Aproximación de Suzuki La Reacción de Suzuki Mecanismo Eliminación reductiva L2Pd(0) R1-R2 R1X Adición oxidativa Etapa lenta 1 80-85 ºC/tolueno 2 R R Pd L L 1 R X Pd L L I > OTf > Br >> Cl Transmetalación Neutralización B(OH)4-Na+ + NaHCO3 Activación B(OH)3 + KX R2B(OH)3-K+ Na2CO3 + H2O R2B(OH)2 + Na2CO3 + H2O NaHCO3 Síntesis de bifenilos: supresión del subproducto de homoacoplamiento 13/06/2011 Ramón Alajarín 32 3. Patentes de Dupont-Merck Síntesis de Losartán y análogos Aproximación de Suzuki: Síntesis Lineal CH3 N CPh3 N N N N H N N a N CPh3 HO OH N B N N N b N H3C N N H3C Cl N OH CPh3 N N N N e foi N 18 d 16 Lo y Rossano (DuPont Merck) OH Puntos débiles: Formación de n-BuH Síntesis lineal N K+ CPh3 N N N N 17 Cl N N CPh3 N N N N c 43 39 42 Br Global: 39% d, e: 47% hasta 66% 1 a. Acetona, Et3N, Ph3CCl, 35 ºC, 2 h (97%); b. n-BuLi/ hexano, THF, -20 ºC, 1h, luego B(OiPr)3, -25 ºC, luego H2O, destilación, tratamiento con AcOH (100%); c. 4-Bromotolueno, Na2CO3, tolueno, (PPh3)4Pd, 80 ºC, 10 h (71%) d. NBS, Vazo 52, DCM, reflujo, 7 h (93,5%); e. 2-Butil-4-cloroimidazol-5carboxaldehído, K2CO3, DMA, luego NaBH4, H2O, 3 h (72 %); f. HCl, THF, 23 ºC, 12 h, luego KOH, IPA (49%); i. THF, H2SO4, 20-25 ºC, 16 h, luego AcOiPr, luego neutralización, eliminación del disolvente, columna de intercambio, luego K2HPO4 (85%). Vazo 52 CN CN (PPh3)4Pd PdCl2 o Pd(OAc)2/ PPh3 N N 13/06/2011 Ramón Alajarín 33 3. Patentes de Dupont-Merck Síntesis de Losartán y análogos Aproximación de Suzuki: Síntesis convergente N H N N a N b CPh3 HO OH N N B N N h + N N H 44 Cl O Cl N OH + CPh3 N N N N foi N 18 N N N K+ 1 Global: 74% Lo y Rossano (DuPont Merck) Br Br 45 OH N H3C g Cl N OH 43 Br N H3C Cl N 42 H3C N H3C 46 Punto débil: Formación de n-BuH a. Acetona, Et3N, Ph3CCl, 35 ºC, 2 h (97%); b. n-BuLi/ hexano, THF, -20 ºC, 1h, luego B(OiPr)3, -25 ºC, luego H2O, destilación, tratamiento con AcOH (100%); f. HCl, THF, 23 ºC, 12 h, luego KOH, IPA (49%); g. K2CO3, DMA, 20-25 ºC, 3 h, luego NaBH4, MeOH, 20-25 ºC, 2 h (90 %); h. PdCl2, PPh3,tolueno, 80-85 ºC, 2 h (90%); i. THF, H2SO4, 20-25 ºC, 16 h, luego AcOiPr, luego neutralización, eliminación del disolvente, columna de intercambio, luego K2HPO4 (85%). 13/06/2011 Ramón Alajarín 34 3. Patentes de Dupont-Merck Síntesis de Losartán y análogos Aproximación de Suzuki: Síntesis convergente Utilización del aldehído 44 en lugar del alcohol 15: N H3C Cl N N H3C N H N Cl OH Cl OH 17:83 + Br Br DMA/K2CO3 15 OH N H3C Br 46 47 + -10 ºC, 2 h N H3C N H Cl O Br N H3C Cl N N Cl O 45 O N H3C 97:3 + 44 Br 48 Br 49 El aldehído 48 es un sólido de bajo P.F. Su reducción al alcohol cristalino 46 permite separarlo de su regioisómero (< 0,5%) 13/06/2011 Ramón Alajarín 35 3. Patentes de Dupont-Merck Síntesis de Losartán y análogos Aproximación de Suzuki: Síntesis convergente El uso de borato de triisopropilo previene, gracias a su efecto estérico, la formación del ácido diarilborínico como subproducto cuando se utiliza borato de trimetilo N N N N CPh3 CPh3 OH N N B N N La hidrólisis para obtener el ácido diarilborónico se ha llevado a cabo con NH4Cl/iPrOH/pH=8-11. CPh3 iPrO OiPr N N B N N NH4Cl/ iPrOH CPh3 HO OH N N B N N pH 8-11 El grupo tritilo es necesario ya que el tetrazol libre actua como veneno para el catalizador de Pd. El grupo tritilo se elige por las condiciones suaves de protección/desprotección, forma un único isómero sobre el nitrógeno N2 y es inerte a las condiciones básicas de la reacción de Suzuki. 13/06/2011 Ramón Alajarín 36 3. Patentes de Dupont-Merck Síntesis de Losartán y análogos Formas polimórficas Cl N H3C Cl N OH H3C N N N N NH OH N 255 ºC N N N NH Forma II Estable Por calentamiento de I Forma I Estable Por recristalización Reivindicación de las dos formas (Campbell, DuPont-Merck) Extensión de 5 años de la protección de la forma I comercial hasta 2014 13/06/2011 Ramón Alajarín 37 4. Lagunas en las patentes Síntesis de Losartán y análogos Wyeth-Ayerst (Americam Home Products Corporation) Reivindicado DuPont-Merck Reivindicación del grupo terc-butilo como grupo protector del tetrazol H N N N N CN Br a CMe3 N N N N b 51 52 Ellingboe, Nikaido, Bagli (Wyeth-Ayerst) H3C 57 54 Negishi e N d 56a CH3 55 + Suzuki CMe3 N N N N CO2Et Cl N Global 15,5% ZnBr N NH2.HCl B(OH)2 CMe3 N N N N N Br 53 No generación de n-BuH O c CMe3 N N N N CMe3 N N N N MgBr Br Br 50 CMe3 N N N N H3C O N CH3 58 f N N Global 38% 56 H3C N CH3 Libre de patente Tasosartán a. Na N3, NH4Cl, DMF, 100 ºC, 18 h (73%); b. CF3COOH, t-BuOH, H2SO4, t.a., 18 h (67%); c. Mg, THF, BrCH2CH2Br cat., B(OiPr)3, t.a., 23 h (48%); d. 56a, Pd(PPh3)4, Et3N, DMF, 100 ºC, 22 h (66%); e. Mg, THF, BrCH2CH2Br cat., 55 ºC, 0,5 h, luego ZnCl2/tolueno, 45-50 ºC, 1 h, luego Pd(OAc)2, PPh3, 56a (78%); f. NaHCO3, n-BuOH, reflujo, 48 h (69%). 13/06/2011 Ramón Alajarín 38 4. Lagunas en las patentes Síntesis de Losartán y análogos Syntex (Roche) Reivindicación del grupo dimetilfenilo como grupo protector del tetrazol H N N N N Me Ph Me N N N N a 42 Me Ph Me N N N N b 59 CO2Me c Me Ph Me N N N N Flippin (Syntex) Br 61 60 a. CF3COOH, α-metilestireno, 25 ºC, 3 h (82%); b. n-BuLi/hexano, THF, -10 ºC a 0 ºC, 1 h, luego ZnCl2, 10 ºC a 0 ºC, luego 4-bromobenzoato de metilo, luego Ni(II)(PPh3)2 (agente reductor MeMgCl), 36 h, (79%). Alternativa a la reacción de Negishi CN aob Cl + ClZn 62 CH3 CH3 63 CN NC H3 C Cl + c ClZn 7 64 13/06/2011 a. Acetilacetonato de niquel (7% mol), (i-PrO)3P (15% mol) (agente reductor Vitride), THF, 40 ºC, 6 h (89%); b. PdCl2(DPPF).CH2Cl2 (5% mol), THF, reflujo, 72 h (82%); c. NiCl2(PPh3)2 (7% mol), PPh3 (15% mol) (agente reductor Vitride), THF, reflujo, 55 ºC, 5 h (75%). Miller, J. P.; Farrell, R. P. Tetrahedron Lett. 1998, 39, 6441. 65 Ramón Alajarín 39 4. Lagunas en las patentes Síntesis de Losartán y análogos Synthelabo Me3C CMe3 N N N N OH B N N N N CMe3 aob d 68 N N N N CMe3 N N I CMe3 N N N N CMe3 N N N N CHO Br N N c Chekroum (Synthelabo) e B 66 a. nBuLi/hexano, THF, B(OMe)3, 0 ºC a t.a., 16 h (45%); b. Mg, THF, 50 ºC, 0,5 h, luego t.a., B(OMe)3, 16 h, (65%); c. nBuLi/hexano, B(OMe)3, THF, reflujo, 4 h (23%); d. 4-clorobenzaldehido, Na2CO3, Pd(PPh3)4, DMF, reflujo, 6 h (65%); e. 4-bromobenzaldehido, K2CO3, Pd(PPh3)4, DMF, 85 ºC, 1 h ((80%). N N N N Me3C 70 N N N CMe3 N 61 ZnCl MgBr CPh3 N N N N 69 Chekroum (Synthelabo) 11 CH3 CPh3 N N N N CH3 63 CH3 I Negishi Murahashi 16 16 71 H3C Suzuki B(OH)2 72 16 13/06/2011 Ramón Alajarín 40 4. Lagunas en las patentes Síntesis de Losartán y análogos Ortho Pharmaceutical Corporation-R.W. Johnson Pharmaceutical Research Institute H N N N N CN F 73 H N N N N a F 29 74 Russell, Murray (Ortho Pharmaceutical) MgBr 11 (3 equiv) Alto coste 13/06/2011 CH3 b a. NaN3, n-BuOH, AcOH, reflujo, 48 h (71%); b. 11, DME, reflujo, 16 h (78%). CH3 Ramón Alajarín 41 4. Lagunas en las patentes Síntesis de Losartán y análogos Zeneca B(OH)2 Br CN CPh3 N N N N b, c a + Br CH3 CH3 CN CPh3 N N N N H3C d CH3 50 72 7 16 N H3C OH f N H N N N Hardknott, Russell, Pittam (Zeneca) Cl N OH e N N H 15 Cl N 17 N H3C Cl OH CPh3 N N N N 18 Bajo Rdto; Escala laboratorio, CCl4, dioxano a. PdCl2, Na2CO3, MeOH, tolueno, reflujo, 2 h (80%); b. n-Bu3SnN3, tolueno, reflujo, 48 h (90%); c. Ph3CCl, DCM, Et3N, t.a., 2,5 h; d. NBS, AIBN, CCl4, 3 h (92%); e. MeONa, DMF, t.a., 72 h (27%); f. HCl, dioxano, t.a., 1 h (58%). 1 13/06/2011 Ramón Alajarín 42 4. Lagunas en las patentes Síntesis de Losartán y análogos Sanofi/Bristol-Myers Squibb O O Br O N N NH N N N b a H N N + CN H3C CN H3C 75 N N H3C 8 Irbesartán n-Bu3SnN3 tóxico; 8 caro 76 77 a. NaH, DMF, 75, t.a., 0,5 h, luego 8, t.a., 1 h (87%); b. n-Bu3SnN3, xileno, reflujo, 88 h, luego recristalización de EtOH (68%). 13/06/2011 Ramón Alajarín 43 5. Síntesis de Valsartán Síntesis de Losartán y análogos Síntesis de Valsartán via acoplamiento Suzuki-Muyaura patentadas por Novartis 13/06/2011 Ramón Alajarín 44 5. Síntesis de Valsartán Síntesis de Losartán y análogos Na2CO3, Pd(PPh3)4, tolueno, H2O, 80 ºC, 10h, 80% (Li, SYNLETT 2006) O Na2CO3, Pd(PPh3)4, H2O, 110 ºC, 6h 85% (Metha, J. Chem. Res. 2010) O CPh3 N CO2CH3 N N N N + N CO2CH3 N + Br B O O O B O O O N O N CO2CH3 CO2CH3 O CO2H Ph3C N N N N N N N NH + NC B O + Br Br a) Buli, 25 ºC, THF; b) anhid ZnCl2, -20 ºC; c) Qphos, Pd(OAc)2, 75 ºC 2h, 80% (Metha, Beilstein J. Org. Chem. 2010) 13/06/2011 Fenantrolina, NMP, quinolina, 170 ºC, 24h, 78% (Goossen, J. Org. Chem. 2007) Ramón Alajarín 45 6. Fármacos duales de losartán Síntesis de Losartán y análogos V. Calderone J. Med. Chem. 2006, 49, 2628-2639 New NO-Releasing Pharmacodynamic Hybrids of Losartan and Its Active Metabolite: Design, Synthesis, and Biopharmacological Properties AgNO3 Cl CO2H MeCN, rt O2N O N H3C N CO2H H3C + DCC, DMAP Cl THF, rt O NO 2 Cl O N O N N N NH OH N N N N NH 13/06/2011 Ramón Alajarín 46 6. Fármacos duales de losartán Síntesis de Losartán y análogos V. Calderone J. Med. Chem. 2006, 49, 2628-2639 New NO-Releasing Pharmacodynamic Hybrids of Losartan and Its Active Metabolite: Design, Synthesis, and Biopharmacological Properties 13/06/2011 Ramón Alajarín 47 6. Fármacos duales de losartán Síntesis de Losartán y análogos V. Calderone J. Med. Chem. 2006, 49, 2628-2639 New NO-Releasing Pharmacodynamic Hybrids of Losartan and Its Active Metabolite: Design, Synthesis, and Biopharmacological Properties 13/06/2011 Ramón Alajarín 48 6. Fármacos duales de losartán Síntesis de Losartán y análogos J. Álvarez-Builla y M. L. Díez-Marqués J. Med. Chem. 2009, 52, 7220-7227 Losartan-Antioxidant Hybrids: Novel Molecules for the Prevention of Hypertension-Induced Cardiovascular Damage H2O2 H2O H-Metmyoglobin-Fe3+ .Ferryl myoglobin[Fe4+ =O] ABTS.(blue/green) 13/06/2011 Ramón Alajarín H-AO ABTS2(colorless) AO .+ 49 6. Fármacos duales de losartán Síntesis de Losartán y análogos J. Álvarez-Builla y M. L. Díez-Marqués J. Med. Chem. 2009, 52, 7220-7227 Losartan-Antioxidant Hybrids: Novel Molecules for the Prevention of Hypertension-Induced Cardiovascular Damage BnO OH BnO CO2H OH R + Cl N H3C DEAD, PPh3 Et2O, rt H2, 30% Pd/C CHCl3, MeOH, rt OH N H3C O N O N N N NH N N N N N CPh3 6b (R = H); 6a (R = Cl) 13/06/2011 Ramón Alajarín 50 6. Fármacos duales de losartán Síntesis de Losartán y análogos J. Álvarez-Builla y M. L. Díez-Marqués J. Med. Chem. 2009, 52, 7220-7227 Losartan-Antioxidant Hybrids: Novel Molecules for the Prevention of Hypertension-Induced Cardiovascular Damage 13/06/2011 Ramón Alajarín 51 6. Fármacos duales de losartán Síntesis de Losartán y análogos J. Álvarez-Builla y M. L. Díez-Marqués J. Med. Chem. 2009, 52, 7220-7227 Losartan-Antioxidant Hybrids: Novel Molecules for the Prevention of Hypertension-Induced Cardiovascular Damage 13/06/2011 Ramón Alajarín 52 6. Fármacos duales de losartán Síntesis de Losartán y análogos J. Álvarez-Builla y M. L. Díez-Marqués (unpublished results) New Losartan-hydrocaffeic acid hybrids as antihypertensive-antioxidant dual drugs: ester, amide and amine linkers HO OH Cl N Bu O H N O N N N N HO N N N N Cl N H OH Bu O N O HO OH N Bu N 13/06/2011 N N H N Bu O H N O H N N N N Bu N N N N N OH Cl Cl OH Cl OH H N OH N N N N N H Ramón Alajarín H 53 6. Fármacos duales de losartán Cl Cl N Bu J. Álvarez-Builla y M. L. Díez-Marqués (unpublished results) N OH N Bu Síntesis de Losartán y análogos OH N H N N N N O New Losartan-hydrocaffeic acid hybrids as antihypertensiveantioxidant dual drugs: ester, amide and amine linkers H N N N N mmol ABTS/L 25 1 N Bu 0.27 0.3 O 0.24 N O O OH 0.31 N Bu O N 0.36 Cl OH Cl Capacidad antioxidante 0.4 HO OH H N N N N N N N N 0.17 0.2 H 0.13 0.10 0.1 5 2b 0.03 0.03 OH H HO N N N N OH Bu Cl N Bu 6 N O N O 12 OH Cl N N Bu H N Bu H N O N N N N 4 2b 5 6 15 22 29 25 100 Inhibición de la contracción celular 95 95 94 93 93 92 90 90 88 OH N N 100 H N N N N OH Cl 1 % Control H N O HO OH Cl N 85 85 N N N N 82 H H 22 13/06/2011 80 29 Control Ang II Ramón Alajarín 1 4 2b 5 6 15 22 29 54 7. Conclusiones Síntesis de Losartán y análogos 1. La síntesis de Losartán representó un desafío para los investigadores de DuPont/Merck. 2. Ellos pusieron a punto nuevos métodos a escala industrial y bajo condiciones suaves para: a) la síntesis de tetrazoles estéricamente impedidos; b) ortometalación del anillo aromático; c) Reacción tipo Suzuki. 3. El mejor proceso para la producción de Losartán es la síntesis convergente de la aproximación de Suzuki. 4. La única desventaja de este proceso es la fomación de gas butano en la ortometalación con n-BuLi en la síntesis del ácido borónico. 13/06/2011 Ramón Alajarín 55 7. Conclusiones Síntesis de Losartán y análogos 5. DuPont/Merck construyó una importante protección de patente. 6. Wyeth-Ayerst (American Home Products Corporation) superaró la protección de la patente cambiando el grupo protector del tetrazol y utilizando la reacción de Negishi en la construcción del enlace bifenilo. 7. Se desarrollaron nuevos análogos con perfiles farmacológicos mejorados, como Valsartán, en los que se aplicaron las reacciones de Suzuki y Negishi 8. Se han desarrollado fármacos híbridos con efectos duales antihipertensivovasorrelajante y antihipertensivo-antioxidante que prometen ser una nueva estrategia en el tratamiento de las enfermedades cardiovasculares. 13/06/2011 Ramón Alajarín 56