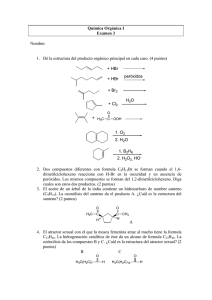
F C Cl HO CH2CH3 H3C CH3 CH2OH HO O H H3C a.1. a.2.
Anuncio

EXAMEN DE QUÍMICA.INGENIERÍA ELÉCTRICA.26/01/2012 GRUPO Nombre: A IMPORTANTE: No se contestará a ninguna pregunta sobre el examen individualmente. PARTE TEÓRICA 1) Escribe la configuración electrónica del átomo de número atómico 22. ¿de qué elemento se trata? Escribe los cuatro números cuánticos de los electrones de la última capa. 2) a) ¿Qué tipo de isomería presentan entre sí los siguientes compuestos? a.1. a.1. CH3 H3C OH CH3 H3C OH y CH3 a.2 a.2. H3C ¿ H3C CH3 respecto a H3C CH3 ? b) Indica qué tipo de isomería presenta este compuesto y determina la configuración correspondiente. Si es posible, dibuja el enantiómero y un diastereoisómero. H HO C O Cl H3C CH2CH3 H3C CH3 HO F CH2OH 3) Para la reacción redox indicada, de los enunciados siguientes indica razonadamente los que son falsos y los que son verdaderos: 1 Cr2(SO4)3 + 10 KOH + 1 KClO3 →2 K2CrO4 + 5 H2O + 1 KCl + 3 K2SO4 a) Los iones K+ actúan como oxidantes. b) Los iones Cr3+ actúan como reductores. c) El sulfato actúa como reductor. d) El cloruro es el reductor conjugado del clorato. 4) Formula o nombra correctamente los siguientes compuestos: a H3C H3C b CH3 O H3C CH3 c Propanoato de etilo d H Propanamida 5) Responde, de manera razonada, a las siguientes cuestiones: a) ¿Es posible que una reacción exotérmica no sea espontánea? b) ¿Es cierto que si el potencial de una pila es negativo, el proceso redox tendrá lugar de modo espontáneo? c) En el cátodo de una pila galvánica, ¿tiene lugar un proceso de oxidación o de reducción? d) ¿es el ion Na+ el ácido conjugado del NaOH? 6) Dada la molécula de fosfina, PH3, contesta razonadamente: a) Indica la geometría de la molécula según la TRPECV. b) ¿Será una molécula polar o apolar? c) ¿Qué tipo de hibridación presentará el átomo central de la molécula? 7) ¿Cuáles de las moléculas siguientes pueden formar puentes de hidrógeno con otras moléculas de la misma especie: CH3F, PH3, CH3CH2OH, CH3NH2? ¿Qué tipo de fuerzas intermoleculares existirán entre H2O y CH3Cl? ¿y entre HF y PH3? ¿y entre He y N2? 8) Contesta razonadamente: ¿Quién tiene mayor potencial de ionización, el cesio o el cloro? ¿y afinidad electrónica? ¿Qué tipo de enlace tenderán a formar entre ambos átomos? 9) Se tiene una pila de Daniell formada por los pares Zn2+/Zn (E0Zn2+/Zn=-0,76V) y Cu2+/Cu (E0Cu2+/Cu=+0,34V). 1) Indica las reacciones que tienen lugar en ánodo y cátodo. 2) Si el potencial es de 1,041v, indica razonadamente cuál de estas afirmaciones es correcta: i) La concentración de Cu2+ es 100 veces la del Zn2+; ii) la concentración del Zn2+ es 100 veces la del Cu2+ iii) La concentración de Cu2+ es 1000 veces la del Zn2+ iv) las concentraciones de Cu2+ y Zn2+ son iguales. 10) Expresar en % atómico la composición de una aleación cuya composición en peso es 50% Cu /50% Ag. Datos: pesos atómicos: Cu (63,54), Ag (107,87). EXAMEN DE QUÍMICA. INGENIERÍA ELÉCTRICA. 26/01/2012 Nombre: IMPORTANTE: No se contestará a ninguna pregunta sobre el examen individualmente. No alterar el orden de las preguntas. PROBLEMAS 1) Ajusta en forma iónica la reacción que tiene lugar en la transformación en medio ácido, del sulfato crómico en cromato potásico por la acción del clorato potásico que se convierte en cloruro. ¿Cuál es la molaridad de una disolución de sulfato crómico si 50 mL de la misma necesitan para su oxidación 300 mL de otra disolución que contiene 61,25 g/L de clorato potásico. Datos: pesos atómicos K (39), Cl (35,5), O (16) 2) Se tiene una disolución reguladora con las siguientes concentraciones: acetato sódico 0,06 M y ácido acético 0,08 M a 25ºC. Dato Ka=1,80·10-5) Calcula: a) la variación de pH que se produce cuando se disuelven 0,5 g de hidróxido sódico en 250mL de la disolución anterior. b) ¿Qué variación de pH se produce cuando disolvemos 0,5 g de NaOH en 250mL de agua? Dato: pesos atómicos Na (23), O (16), H (1) 3) El líquido utilizado en las baterías de los coches es una disolución de ácido sulfúrico, de densidad 1,18 g/mL y 25,21 % de riqueza. Sabiendo que para rellenar una batería se necesitan 4 L, calcular la cantidad de ácido sulfúrico concentrado (d = 1,84 g/mL) y 95,0 % de riqueza necesaria para la preparación de los 4 L. Dato: masas atómicas S (32), O (16), H (1) 4) Los calores normales de combustión del hidrógeno, carbono, metano y etano son, respectivamente, -68.32, -94.05, -212.80 y –372.82 kcal/mol. Calcular los calores de formación del metano y etano y el calor de la reacción C2H6 (g) + H2 (g) → 2 CH4 (g). Pregunta extra formulación inorgánica (obligatoria para todos): Sulfito potásico Ácido sulfúrico Bicarbonato potásico (o carbonato ácido de potasio) Amoníaco Dicromato potásico KMnO4 FeO BaO2 NO2 H 2S