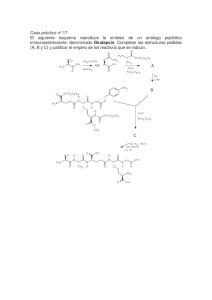
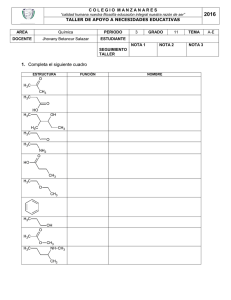
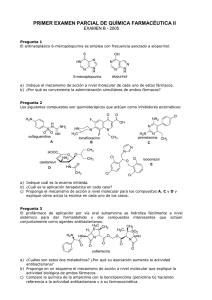
Síntesis Orgánica NO . . . . Het . Het . . SI Het . NO El Método de las Desconexiones (Método del Sintón) W Rivera Muñoz 2009 Wilbert Rivera Muñoz [email protected] PRÓLOGO El análisis retrosintético ideado y propuesto en la década de los 60 por J. E. Corey, se ha constituido en un verdadero nuevo paradigma de la síntesis orgánica, que progresivamente viene siendo asumido por los diversos autores de los libros más actualizados de química orgánica del nivel superior de enseñanza. Sin embargo, en estas publicaciones, muchos de los esquemas o planes de síntesis que se producen en varias etapas, son todavía encarados de una manera tradicional, lo que coloca en un verdadero conflicto a todo estudiante, que aborda el aprendizaje de los mismos, con la esperanza de encontrar correspondencia plena entre el nuevo paradigma y el tratamiento de la reactividad de los compuestos orgánicos. Son muy pocas las publicaciones en español, que estudian y asumen la metodología de la retrosíntesis en la resolución de problemas de síntesis orgánica. Los aportes de S. Warren con su “Diseño de Síntesis Orgánica” (Introducción programada al método del sintón) y la de Borrell “Diseño de Síntesis Orgánica”, así como las publicaciones internas de la Universitat de Jaen “El método de las desconexiones”, y el curso en línea de Síntesis Orgánica de la Universidad de Antioquia, cuyo responsable es G. A. Escobar, son el esfuerzo mas destacable que se han producido. La experiencia o experticia acumulada en la enseñanza de la síntesis orgánica, por muchos años, en la docencia universitaria de la Universidad Autónoma Tomas Frías de la ciudad de Potosí, permite al autor, poner a consideración de los estudiantes de las diferentes Carreras donde se aborda la síntesis orgánica, la presente obra enmarcada en la metodología del análisis retrosintético y el uso del método de las desconexiones o método del sintón en la resolución de problemas de moléculas orgánicas de nivel de profundidad diverso. 1 Wilbert Rivera Muñoz [email protected] Ya se han publicado con anterioridad, “Introducción a la Síntesis Orgánica”, “El método del Árbol de Síntesis” y “El método de las Hojas de Síntesis”, enfocados en el paradigma retrosintético, los que han sido positivamente acogidos por los estudiantes de la Carrera de Química y los cibernautas del mundo hispano, que les permiten ahondar en la disciplina de la química orgánica. El método de las desconexiones (o método del sintón), abarca la mayoría de los grupos funcionales y se hace una profundización del uso de los enoles y enolatos en las condensaciones de los compuestos carbonílicos. Por otro lado, también se ha incluido, la sección dedicada a la síntesis de compuestos heterocíclicos simples y fusionados, como un preámbulo a la síntesis de fármacos. Muchas de las reacciones abordadas y algunas definiciones han sido tomadas de la bibliografía que se hace mención y se ha consultado, sin embargo los problemas y diseños de síntesis propuestos, son de responsabilidad exclusiva del autor y desde luego los mismos no son únicos, como bien puede comprenderse. Espero y aspiro, a que la presente obra, responda a la inquietud y expectativa de los lectores que desean aprender o profundizar sus conocimientos de síntesis orgánica dentro la metodología del análisis retrosintético. Precisamente pensado en ellos es que se ha escrito la misma. Wilbert Rivera Muñoz Potosí, 2009. 2 Wilbert Rivera Muñoz [email protected] CONTENIDO Pág. 1. Metodología de la Síntesis Orgánica ………………………………………. 4 1.1. La metodología del análisis retrosintético ………………………………… 1.1.1. Análisis retrosintético 1.1.2. Método de las desconexiones o método del sintón 5 2. Estrategia general del método de las desconexiones . ……………….…….. 9 2.1. Principios generales para la formación de enlaces C-C ……………………. 2.2. Reglas para una buena estrategia …………………………………………… 2.3. Sintones electrófilos y nucleófilos ………………………………………….. 2.3.1. Sintones electrófilos 2.3.2. Sintones nucleófilos 9 12 12 3. Formación y desconexión de enlaces C-X (heteroátomos) ............................... 20 3.1. Formación y desconexión de un grupo C-X ……………………………….. 3.2. Desconexión de dos grupos C-X ………………………….……………… 20 23 4. Desconexión C-C, vía la desconexión de un grupo funcional ………………. 25 4.1. Desconexión de alcoholes simples …………………………………………. 4.2. desconexión de olefinas simples …………………………………………… 4.3. Desconexión de aril cetonas ……………………………………………….. 4.4. Desconexiones de Cα-carbonílicos ………………………………………… 4.4.1. Formación de enolatos 4.4.2. Equivalentes sintéticos de varios enolatos 4.4.3. Alquilación de enolatos 25 26 27 27 5. Desconexiones lógicas C-C, vía la desconexión de dos grupos funcionales …. 34 5.1. Modelo de desconexión 1,3-dioxigenado …………………………………… 34 5.1.1. Compuestos β-dicarbonílicos 5.1.2. Compuestos β-dicarbonílicos a través de condensaciones intramoleculares 5.1.3. β-hidroxicompuestos 5.1.4. compuestos α,β-insaturado carbonílicos 5.1.5. Control en las condensaciones de los compuestos con grupos carbonilo 5.2. Modelo de desconexión 1,5-dioxigenado ……………………………………. 40 6. Desconexiones ilógicas C-C, vía la desconexión de dos grupos funcionales … 44 3 Wilbert Rivera Muñoz [email protected] 6.1. Compuestos con relación 1,2-dioxigenado ………………………………… 6.1.1. Compuestos α-hidroxicarbonílicos 6.2. Modelo 1,4-dioxigenado ………………………………………………….. 6.2.1. Compuestos 1,4-dicarbonílicos 6.2.1.1. Compuestos 1,4-dicetónicos 6.2.1.2. Compuestos 1,4-cetoésteres 6.2.1.3. Compuestos γ-hidroxicarbonílicos 6.2.2. Otras estrategias que utilizan sintones ilógicos 6.2.2.1. Adición de triple enlace 6.2.2.2. Adición del grupo COOR como grupo activante 6.2.3. Compuestos 1,2 y 1,4 difuncionalizados por reconexiones 44 46 7. Compuestos 1,6-difuncionalizados ………………………………………….. 58 7.1. Compuestos 1,6-dioxigenados ……………………………………………. 7.2. Oxidación de Baeyer-Villiger ……………………………………………. 7.3. Transposición de Beckmann ……………………………………………… 58 62 67 8. Formación de sistemas heterocíclicos ……………………………………… 70 8.1. Ciclación intramolecular …………………………………………………. 8.1.1. Modelos para la ciclación intramolecular 8.1.1.1. Modelo saturado 8.1.1.2. Modelo α-insaturado 8.1.1.3. Modelo α-carbonilo 8.1.2. El grupo ciano en la síntesis de heterociclos 8.1.3. Heterociclos con varios heteroátomos 8.1.3.1. heteroátomos a distancia (1,2) 8.1.3.2. Heteroátomos a distancia (1,3) 8.1.3.3. Heteroátomos a distancia (1,4) 8.2. Ciclación intermolecular ………………………………………………….. 8.2.1. Ciclaciones 1,3-dipolares 8.2.2. Reacción de Diels-Alder 8.2.3. Cicloadiciones 8.3. Heterociclos Condensados ………………………………………………… 8.3.1. Síntesis de Quinoleinas 8.3.1.1. Síntesis de Combes 8.3.1.2. Síntesis de Conrad-Limpach-Knorr 8.3.1.3. Síntesis de Skraup 8.3.1.4. Síntesis de Döbner-Miller 8.3.1.5. Síntesis de Friedländer 8.3.2. Síntesis de Isoquinoleinas 70 84 91 4 Wilbert Rivera Muñoz [email protected] 8.3.2.1. Síntesis de Pomeranz-Fritsch 8.3.2.2. Síntesis de Bischler-Napieralski 8.3.2.3. Síntesis de Pictet-Gams 8.3.2.4. Síntesis de Pictet-Spengler 8.3.3. Síntesis de Benzodiazinas 8.3.3.1. Síntesis de cinnolinas 8.3.3.2. Síntesis de quinazolinas 8.3.3.3. Síntesis de fatalizinas 8.3.3.4. Síntesis de quinoxalinas 8.3.4. Síntesis de Indoles 8.3.4.1. Síntesis de Fischer 8.3.4.2. Síntesis de Bischler 8.3.4.3. Síntesis Reissert 8.3.4.4. Síntesis de Leimgruber-Batcho 8.3.5. Síntesis de Benzofuranos 8.3.6. Síntesis de Benzotiofenos Referencias Bibliográficas ………………………………………………….. 121 5 Wilbert Rivera Muñoz [email protected] CAPITULO 1 METODOLOGÍAS DE LA SÍNTESIS ORGÁNICA Una estructura conocida, pero aún no sintetizada es para el químico lo que para otros hombres puede representar una montaña todavía no escalada, un mar no surcado, un campo nunca cultivado o un planeta aún no alcanzado”. R. B. Hoodward. P. N. de Química 1965 Las metodologías para encarar una síntesis exitosa han ido cambiando con el transcurrir del tiempo y el desarrollo de la misma química orgánica como ciencia, de ahí que se pueden mencionar las siguientes: Metodología de la “asociación directa” Metodología de la “aproximación intermedia” Metodología del “análisis lógico” La metodología de la asociación directa, fue la que llevó en el siglo XIX y principios del XX a la obtención de muchas moléculas de interés, como el .terpineol (Perkin 1904), alcanfor (Komppa 1903 y Perkin 1904, tropinona (Robinsón 1917). En esta metodología, se reconoce directamente en la estructura de la molécula objetivo (MOb), una serie de subestructuras o unidades, que puedan ser colocados apropiadamente en la estructura de la molécula objetivo o precursora, empleando reacciones conocidas. En esta metodología, generalmente se tiende a que los grupos se inserten en un solo paso, lo que exige del químico conocimientos bastos sobre reacciones orgánicas y ante todo mucha experiencia en síntesis, para poder asociar una reacción específica al objetivo de ubicar la subestructura en el lugar deseado. Entre 1920 y 1945 se lograron síntesis de moléculas más complejas que se basaron en el conocimiento de reacciones para formar moléculas políciclicas y en un planteamiento detallado que permitiera aplicar esos métodos. Después de la 2da Guerra Mundial y hasta 1960 se pasó a otro nivel de sofisticación gracias a la formulación de los mecanismos de las reacciones orgánicas, la introducción del análisis conformacional, el desarrollo de métodos espectroscópicos, el uso de métodos cromatográficos de análisis y separación y el descubrimiento y aplicación de nuevos reactivos selectivos. Muchas de estas síntesis que tenían 20 o más pasos fueron posible gracias a la evaluación previa de cada paso basada en el conocimiento de mecanismos de reacción, intermedios reactivos, efectos estéricos y electrónicos en la reactividad, efectos conformacionales y 6 Wilbert Rivera Muñoz [email protected] estereoelectrónicos. A pesar de ello en esa época cada problema sintético se encaraba como un caso especial y con un análisis individualizado. Se hacía bastante uso de la intuición y no se aplicaban técnicas generales de solución de problemas, se insistía mucho en que la síntesis química se asemejaba más a un arte. Uno de los grandes representantes de esta corriente es el químico y premio Nóbel (1965) R.B. Hoodward, (“por su aporte a la síntesis orgánica”). Dentro sus aportes es bueno destacar la síntesis de moléculas complejas como la quinina, el colesterol, etc. En cambio la metodología del Análisis Lógico, tiene como uno de sus propulsores y defensores a otro químico orgánico contemporáneo. J. E. Corey, también premio Nóbel por su aporte a la síntesis. La metodología creada por este químico, supone la elección y aplicación de una determinada estrategia como el empleo táctico de los diferentes recursos que la moderna química orgánica nos ofrece y constituye “una metodología limitada únicamente por las fronteras de la química y el poder creador de la inteligencia humana”1 El punto central de esta metodología es un análisis racional y penetrante de la estructura molecular de la Molécula Objetivo (MOb) y de las moléculas precursoras generadas en sentido antitético. La mejor aplicación se ha encontrado en una serie de Software creados, para generar las diferentes rutas de síntesis. El método se conoce como el “método de las desconexiones” o el “método del sintón” y se basa en un nuevo paradigma de la química orgánica y particularmente de la síntesis orgánica, conocida como la RETROSÍNTESIS. Por otro lado, la metodología de análisis lógico, ha permitido la creación de varios software para “automatizar” las síntesis de una infinidad de compuestos orgánicos. El recuadro que a continuación se muestra, es una prueba clara de la dinamicidad en este campo: Nombre del programa CAMEO Distribuidor Plataforma de uso LHASA UK, Vax/VMS, University of Leeds UNIX, Mac CAOS (Computer- CAOS/CAMM Assisted Organic Center, The Synthesis) Netherlands UNIX Funciones del programa Predicción de productos de reacciones orgánicas dadas materia prima y condiciones de reacción. Corroboración de rutas sintéticas y retrosintéticas Planeación de síntesis, obtención de reacciones y bases de datos espectrales 1 SERRATORA F. HEURISKÓ. Introducción a la Síntesis Orgánica. Pág. 37 7 Wilbert Rivera Muñoz CAOS/CAMM CHIRON (CHIRal Center, The synthON) Netherlands UNIX LHASA (Logic and Heuristics University of Leeds, Applied to Synthetic School of Chemistry Analysis) Ohio Supercomputer React3.21 Mac Center SYNGEN (SYNtesis GENeration) Brandeis University PC/Linux SYNLIB (SYNthesis CAOS LIBrary) 3.2 SYNTREE University of Liverpool [email protected] Programa interactivo para el análisis de la estereoquímica en las moléculas y para la selección de precursores en síntesis orgánica Programa para la planeación eficiente de rutas sintéticas, con análisis retrosintético Programa para modelar y ajustar mecanismos de reacciones químicas Es el único programa con generación automática de los más cercano posible a rutas de síntesis orgánica. SGI, MAC, X Programa para síntesis orgánica. Windows DOS Programa para explorar síntesis orgánica. CHAOS. “Computerization and Heuristic Applied to Organic Síntesis”, es un programa de enfoque empírico enteramente desarrollado en la Universidad de Barcelona, bajo la dirección del Prof. Félix Serratosa. No obstante, la mayoría de los químicos orgánicos, planean las síntesis que encaran, con un mínimo de análisis lógico, haciendo uso simultáneamente de las metodologías de la “asociación directa” y de “análisis lógico”, lo que origina consiguientemente la metodología de la “aproximación intermedia”. Los métodos que mejor se conocen y han aplicado, dentro la metodología de la aproximación intermedia, son: El método del “árbol de síntesis” y El método de las “Hojas de síntesis” 1. 1. LA METODOLOGÍA DEL ANÁLISIS RETROSINTÉTICO Se dice muy acertadamente que el corazón de la síntesis orgánica es el diseño de rutas sintéticas para la preparación de una molécula. La síntesis más sencilla, es aquella en la que la molécula objetivo puede obtenerse a partir de materiales de partida simples y asequibles, en una sola reacción (etapa).Sin embargo, en la mayoría de los casos las síntesis no son tan sencillas. Con la finalidad de convertir un material de partida elegido para transformarlo en la molécula objetivo, generalmente se deben asumir numerosas medidas, como agregar, cambiar o eliminar grupos funcionales y construir tal vez, el esqueleto carbonado correspondiente, con la estereoquímica prevista en la estructura de la molécula objetivo. 8 Wilbert Rivera Muñoz [email protected] 1.1.1. Análisis Retrosintético La metodología para un enfoque sistemático para el diseño de una ruta de síntesis de una molécula, fue ideada por Elías James Corey (por el que obtuvo el Premio Nobel de Química en 1990), la misma requiere someter a la molécula objetivo, a un ejercicio intelectual de abstracción, llamado análisis retrosintético. Esto implica una evaluación de cada grupo funcional en la molécula objetivo y la estructura del esqueleto carbonado de la molécula. La determinación de las moléculas precursoras, así como la reacción y condiciones de la misma que permitan formar la molécula objetivo (MOb) en una etapa, se constituye en el paso esencial del análisis retrosintético, que tiene que ser repetido ahora con cada una de las moléculas precursoras generadas, hasta llegar a los materiales de partida simples y fácilmente accesibles. El análisis retrosintético de la molécula objetivo por lo general se traduce en más de una posible ruta de síntesis. Por lo tanto, es necesario evaluar en forma crítica cada una de ellas con el fin de elegir el camino más viable químicamente y más económico. La seguridad de cada posible ruta de síntesis (la toxicidad y reactividad de los peligros asociados con las reacciones involucradas) también es considera a la hora de evaluar las rutas sintéticas alternativas para una molécula. ANÁLISIS RETROSINTÉTICO MOb Desconexión (Transformación) SINTONES S1 S2 EQUIVALENTES SINTÉTICOS (Moléculas precursoras) SÍNTESIS Reacción Fig. 1. Esquema general del análisis retrosintético 2 1.1.2. Método de las Desconexiones o Método del Sintón El nuevo paradigma de la síntesis orgánica, es decir, el análisis retrosintético aplicado a la síntesis de una molécula y a cada una de las moléculas precursoras originadas, como se indica en el esquema de la Fig. 1, hasta llegar a los materiales de partida, ha dado lugar a una poderosa herramienta sintética, denominada, Método de las Desconexiones o Método del Sintón. El método de las desconexiones, comprende dos fases, que se dan en direcciones contrarias y simultáneamente, a las que se conoce como: Fase de análisis, y fase de síntesis 2 BORRELL J.I. Diseño de Síntesis Orgánica. Cap. 1. pág. 1 9 Wilbert Rivera Muñoz [email protected] Glosario de Términos utilizados en el método de las desconexiones Como todo método, tiene su estructura, simbología y lenguaje apropiados, que inicialmente deben de ser comprendidos por el estudiante o el químico orgánico, que se dispone a utilizar esta nueva herramienta sintética: MOb. Molécula Objetivo. Se denomina así, a toda molécula que se desea sintetizar o preparar a partir de materiales simples y asequibles, que en un problema pueden estar previamente definidos o estar librados a las opciones que el químico busque a partir de su diseño de síntesis. Análisis Retrosintético. Es el proceso de abstracción analítica, que el químico efectúa en sentido antitético (en dirección contraria a la síntesis), sobre las características estructurales de la MOb, que permite vislumbrar los enlaces formados en la última etapa de la síntesis, lo que proporciona las moléculas precursoras y la reacción que origina la molécula sometida al análisis retrosintético. Esta operación culmina cuando se arriba a moléculas o materiales de partida considerados simples y asequibles Transformación. ( ) La flecha especial utilizada, debe de entenderse como una representación simbólica de la expresión “se prepara a partir de” y también representa algún tipo de transformación en la estructura que el químico propone, basado en reacciones y mecanismos de reacción conocidos, con la finalidad de arribar a las estructuras de los sintones, sintones quirales (quirones) o simplemente equivalentes sintéticos; cuya reacción forma o produce la molécula sometida a análisis retrosintético. Los tipos de transformación al que se hace referencia, en realidad son operaciones sintéticas como las: Desconexiones, Conexiones, Reordenamientos, Interconversión de Grupos Funcionales (IGF), Adición de Grupos Funcionales (AGF), Supresión de Grupos Funcionales (SGF) Desconexión. Es una operación sintética que representa la ruptura imaginaria del o los enlaces químicos, que se habrían formado en la molécula objetivo, a partir de los sintones o más precisamente de sus equivalentes sintéticos (moléculas precursoras). Se puede entender la misma como la inversa de una reacción química, se representa por una flecha (muy distinta a la de una reacción química o de condiciones de equilibrio) y una línea ondulada cruzada sobre el enlace que se desconecta. Incluso es posible colocar sobre la flecha la desconexión que se da: C-C, C-S. C-X, C-O, C-N. etc. 10 Wilbert Rivera Muñoz MOb S [email protected] S1 + S Consiguientemente, se deberá esperar que existan las siguientes desconexiones: S2 Desconexiones Heterolíticas Desconexiones Homolíticas o de radicales Desconexiones Electrocíclicas SINTONES Desconexión Reacción Conexión. Es la operación sintética de reconectar dos puntos de la Molécula Objetivo, en lo que llegaría a ser la molécula precursora. La reacción estaría vinculada a la ruptura del enlace “reconectado” Un ejemplo típico de la reconexión se tiene en las Moléculas que se obtuvieron por la apertura de un enlace químico, como es el caso de la ozonólisis de los alquenos, que proporcionan productos que para su síntesis debe empezarse por la Mol écula Precursora MOb G1 G2 S conexión G1 G2 S S S Reacción operación de desconexión Reordenamiento La operación de transformación, que permite reubicar una subestructura de la MOb que se somete a análisis retrosintético, para establecer las estructuras de los sintones, equivalentes sintéticos (moléculas precursoras), se denomina reordenamiento. La reacción que ocurre entre las moléculas precursoras, será una reacción de transposición. La transposición pinacolínica, el reordenamiento de G1 Molécula Precursora MOb G2 S reordenamiento G1 G2 S S Reacción S Fríes, la transposición de Beckmann, la transposición de Curtius y la transposición de Claisen. Son ejemplos típicos de transposición, cuyos productos requerirán un reordenamiento de sus componentes estructurales en la operación de transformación, para llegar a su molécula precursora. Interconversión de Grupos Funcionales (IGF) Es el proceso por el cual el grupo(s) funcional(es) de la molécula sometida a un análisis retrosintético, es convertido en otro grupo funcional, ubicado en la estructura del sintón o equivalente 11 Wilbert Rivera Muñoz [email protected] Molécula Precursora MOb G1 G2 S IGF G1 G3 S S S Reacción sintético (molécula precursora) que a través de una reacción normal de sustitución, eliminación, adición, transposición, oxidación o reducción, se transformará en el grupo funcional de la molécula que se desea obtener. La reversa de un IGF, es la reacción química. Se representa por la flecha , con las siglas IGF sobre ella. Adición de Grupo Funcional (AGF) Es la adición de un nuevo grupo funcional en la estructura de la molécula precursora (equivalente sintético), que se transformará en la MOb a través de una reacción orgánica. El propósito de introducir este nuevo grupo funcional, normalmente es el de facilitar que en la estructura de la molécula precursora (sintón, molécula intermedia, equivalente sintético) una posterior operación sintética, que podría ser por ejemplo: Una simple desconexión, ya que el grupo funcional adicionado podría estabilizar la estructura del sintón resultante de la desconexión, activar o desactivar la molécula para alguna otra Molécula Precursora MOb G1 G2 S AGF G1 S S Reacción SINTON G2 S G 3 DESCON G1 G2 S Reacción S G 3 reacción química de la molécula. Remoción de Grupo Funcional (RGF) Esta operación sintética de transformación, permite proponer que en la molécula precursora a partir MOb G1 G2 S RGF G1 Molécula Precursora S S Reacción S de la cual se la preparará la MOb, se suprima un grupo funcional, el mismo que en la etapa de síntesis tendrá que introducirse en la estructura de la MOb, a través de algún tipo de reacción, como ser por ejemplo, adición, transposición, etc. Sintón. En general se llama así, a la especie química que resulta casi siempre de una desconexión de algún enlace de la MOb. Este fragmento puede poseer una carga negativa o positiva o ser un diradical, que podrían estar totalmente justificados por la estructura que soportan las cargas o contienen los electrones no apareados. Estos son los denominados sintones lógicos, o que la estructura resultante de la desconexión, presente un especie 12 Wilbert Rivera Muñoz [email protected] química que no justifique plenamente el tipo de carga, a los que se denomina sintones “ilógicos” o sintones “anómalos”. Si el sintón resultante es quiral, se denomina Quirón. Equivalente sintético (molécula precursora). En todo caso un sintón es una especie química que no puede ser utilizado directamente en una reacción química, unas veces debido a su inestabilidad y otras a que es una especie que no existe, para ello será necesario efectuar previamente un proceso de abstracción sobre la estructura del sintón, para llegar a justificar su existencia a través de un equivalente sintético. De modo que este último, el equivalente sintético, o molécula precursora, es la molécula real que contiene y actúa como los sintones generados por la desconexión efectuada en la MOb. 13 Wilbert Rivera Muñoz [email protected] CAPITULO 2 ESTRATEGIA GENERAL DEL MÉTODO DE LAS DESCONEXIONES “El químico sintético es más que un lógico y un estratega; es un explorador fuertemente inclinado a especular, imaginar e incluso crear”. E.J. Corey. Premio Nobel de Química 1990 Como ya se tiene manifestado, el método de las desconexiones es una consecuencia directa del análisis retrosintético, razón por la cual, se podrá convenir que el esquema que a continuación se detalla, en la Fig. 2, resumen en toda su dimensión a la estrategia utilizada en el método de las desconexiones o del sintón, cuando es aplicado a la planificación de un diseño de síntesis para una determinada molécula a ser sintetizada (MOb). MOb ANÁLISIS ESTRUCTURAL NO DESCONEXIONES SIMPLIFICACIÓN MOb ¿COMERCIAL? (SINTONES = EQ. SINTÉTICOS) DESARROLLO DE SÍNTESIS EN LAB. ELECCION DE UN CAMINO DE SÍNTESIS FIN SI CORRECCIONES Fig. 2 Etapas del método de las desconexiones 3 2.1. Principios generales para la formación de enlaces C-C Para elaborar un buen diseño de síntesis, para una molécula objetivo, se debe tomar en cuenta los siguientes principios generales: 1. La síntesis debe contener el menor número posible de etapas o pasos. Puesto que se cumple la siguiente sentencia: A mayor número de etapas, menor rendimiento global 2. La funcionalidad requerida para una desconexión, debe ser introducida en el esqueleto carbonado a medida que éste se construye, ya que es poco probable funcionalizar toda la molécula al final de la síntesis. 3 BORRELL J.I. Op. Cit. Pág. 10 14 Wilbert Rivera Muñoz [email protected] 3. En la mayoría de las reacciones, donde se forman enlaces carbono-carbono, se pueden presentar las siguientes alternativas4: a. Los dos átomo de carbono que se unen, ya tienen alguna funcionalidad H3C H3C CH3 O + OH CH3 MgBr H3C H3C c1 c2 c1 c2 Fig. 3. Formación de enlaces entre dos carbonos funcionalizados b. Uno de los átomos de carbono tiene inicialmente funcionalidad, mientras que el otro es adyacente a un grupo funcional. c1 c1 COOEt + H3C COOEt al al H3C COOEt Cl COOEt c2 c2 Fig. 4 Formación de enlace entre un carbono funcionalizado y otro a un grupo funcional 4. Las reacciones de formación de enlaces carbono-carbono, más importantes en síntesis, implican la interacción de un carbono nucleófilo (cargado negativamente, dador de electrones) y un carbono electrófilo (cargado positivamente, aceptor de electrones). Las reacciones radicalarias son poco importantes en síntesis; por ello en sentido retrosintético las desconexiones más importante son del tipo heterolítico. H3C CH3 CH3 H3C H3C CH3 C-C H3C CH3 H3C CH3 H3C sintón electrófilo aceptor (a) CH3 sintón nucleófilo dador (d) Fig. 5. Desconexión heterolítica de enlaces carbono-carbono Ejemplos: CH 3 sintón nucleófilo (d) CH 3MgBr SINTONES CH 3 sintón electrófilo (a) CH 3-I EQUIVALENTES SINTÉTICOS 4 BORRELL J.I. Op.Cit. cap 6 15 Wilbert Rivera Muñoz [email protected] Los sintones electrofílicos (a) y nucleofílicos (d) se clasificación atendiendo la posición relativa del átomo de carbono reactivo, respecto del grupo funcional considerado principal grupo funcional Centro reactivo X = heteroátomo Tipo de sintón Carbono ipso (C1) d1 o a1 Xo C5 C3 C1 C4 C2 . ipso Carbono (C2) d2 o a2 . Carbono (C3) d3 o a3 Carbono (C4) d4 o a4 equivalente sintético sintón Denominación d0 CH 3S CH 3SH d1 C 1 NaCN d2 N 0 CH 3CHO/B- CH 2-CHO 1 0 2 alquil d a0 CH 3 LiCH3 P(CH 3)2 ClP(CH3)2 0 OH a1 . 1 O . . + (H ) . O Br O 3 a ó . . OMe OMe alquil a CH 3 O OMe + (CH 3)2S Br- Fig. 6. Ejemplos de sintones a y d junto con su equivalente sintético En consecuencia, se puede concluir que: 16 Wilbert Rivera Muñoz Sintones sin funcionalidad, como CH3 o clasifican como alquil (a) y alquil (d). + [email protected] CH3-, se denominan alquilantes y se Sintones en los que el centro reactivo es el propio heteroátomo del grupo funcional se denominan d0 y a0. Sintones en los que el propio carbono del grupo funcional principal es el centro reactivo, se denominan (d) o (a) ipso. La combinación de los equivalentes sintéticos de un sintón (d) y uno (a) produce, en las condiciones adecuadas, un enlace carbono-carbono. Los sintones d0 y a0 dan lugar, por el contrario, a enlaces carbono-carbono o heteroátomo - heteroátomo. HO O H3C monofuncionales sin funcionalidad COOH 1, 2 - difuncional O H3C 1 3 O0 OH CH3 H3C 1 O 4 1 H 3 1, 4 - difuncional 1, 3 - difuncional 2 5 COOEt 4 3 1, 5 - difuncional O 4 1 COOEt 5 4 O 2 2 3 2 3 1, 4 - difuncional 1, 5 - difuncional 1, 6 - difuncional 5 2 6 COOEt 1 Fig. 7. Distancias difuncionales en la MOb. Cuando reaccionan sintones alquil (a) + sintones alquil (d), los productos obtenidos no presentan funcionalidad. En cambio en cualquier otra combinación posible se tendrán productos con alguna funcionalidad. 2.2. Reglas para una buena Estrategia 1. En las moléculas polifuncionales, los sintones deben contener más de un grupo funcional 17 Wilbert Rivera Muñoz [email protected] 2. Los compuestos monocíclicos pueden provenir de la combinación intramolecular de un sistema de cadena abierta que contenga un carbono dador (d) y uno aceptor (a) en ambos extremos. EtOOC (d) (d) COOEt C- C O (a) (a) O OEt 3. Las reacciones entre un centro dador (d) y un centro aceptor (a) en sistemas cíclicos originan compuestos espirocíclicos, anillos fusionados o anillos puente. O O (d) . . (a) X 2.3 Sintones más usuales en la síntesis 2.3.1. Sintones electrófilos. Los sintones más comunes, que recurrentemente se utilizan en la síntesis de un gran número de compuestos orgánicos son los siguientes: Sintones alquil a, derivados de agentes alquilantes Sintones a1 derivados de compuestos carbonílicos Sintones a1 derivados de enlaces múltiples C-N Sintones a2 derivados de alfa-carbonilos y epóxidos Sintones a3 derivados de alquenos electrófilos Carbenos 2.3.1.1. Sintones alquil a, derivados de agentes alquilantes Corresponden al sintón R+ a) R-X (X = Cl, Br, I, OTs, OMs, SO3F). La principal aplicación de estos reactivos es la reacción de sustitución nucleofílica (SN1 o SN2). b) RCl/AlCl3. Aplicación en la reacción de Friedel – Crafts. c) R3O+BF4-, R3S+X- (R = Me, Et). Las sales de trialquiloxonio y de trialquilsulfonio son también alquilantes enérgicos. 18 Wilbert Rivera Muñoz [email protected] 2.3.1.2. Sintones a1 derivados de compuestos carbonílicos Sintón a1 Equivalentes sintéticos a) O ejem.: HO O Nu OH H3C R1 CH3 R R R1 R R1 R Nu R1 Nu OSiMe3 MeS O b) Nu O X = Cl, OCOR, SR', OR' X R O R AlCl4 (RCOCl/AlCl3) R 2.3.1.3. Sintones a1 derivados de enlaces múltiples C- N: Sintón a1 Equivalentes sintéticos (Si R' = H) a) NR' NR' X R NR 2' NHR' R X R Nu X Nu Nu (Si R' dif H) R1 R NR 2' X R NR 2' R X por ejemplo: Reacción de Mannich Nu Nu b) R O + H /H2O CH R R NH N (a) O Nu R Nu R Nu Nu 19 Wilbert Rivera Muñoz [email protected] 2.3.1.4. Sintones a2 derivados de halocarbonilos y epóxidos Sintón a2 Equivalentes sintéticos Nu O X R3 X = Br, OTs, OMs R1 (a) R2 MeO OMe X a) X = Br, OTs, OMs R2 NO 2 R2 R3 R1 R3 O R1 R3 R1 (a) R2 R2 NO 2 (seguido de la reacción de Nef) (a) R3 R1 Knoevenagel R2 NO2 1) B- NO 2 O R3 + O NO2 + 2) H /H2O H . R1 R1 -78ºC + . . R1 ( HNO3) R1 reacción de Nef OH H b) O R1 (a) R2 R3 O R (a) (a) R2 X = Br, Cl, OTs, OMs R1 R3 Nu 20 Wilbert Rivera Muñoz [email protected] 3 2.3.1.5. Sintones a derivados de alquenos electrófilos: Sintón a3 Equivalentes sintéticos H3C a) 3 H3C H3C H3C H3C X 1 2 CH3 H3C H3C CH3 CH3 H3C CH3 CH3 Nu CH3 CH3 Nu X= Br, OTs, OMs R2 O R2 1) BR1 b) Nu R2 R1 R3 3 2) H 3O + R1 R4 1 R3 H H3C O H3C (a) R4 (R 3 = H, R, OMe ) R4 O H3C R3 H O 2 O Nu CH3 (a) H3C CH3 R2 (a) H H3C CH3 N R2 C O H3C OR CH3 N C R1 H R4 R1 R4 Equivalentes sintéticos: Substratos de la reacción de MIchael 2.3.1.6. Carbenos H 3C H 3C No son clasificables según lo expuesto anteriormente. Son especies neutras, pero deficientes en electrones. Muy reactivas como electrófilos Reaccionan con alquenos para rendir ciclopropanos, con carbonilos cetónicos para generar epóxidos o con moléculas aromáticas ricas en electrones. 21 Wilbert Rivera Muñoz [email protected] 2.3.2. Sintones nucleófilos Sintones alquil d, derivados de organometálicos 1 Sintones d derivados de aniones alquinilo, anión nitroalquilo y carbaniones estabilizados por P o S. 2 Sintones d derivados de carbaniones estabilizados por uno o por dos grupos aceptores mesómeros. 3 Sintones d derivados de aniones estabilizados a larga distancia. 2.3.2.1. Sintones alquil d, derivados de organometálicos Corresponden al sintón R- los siguientes equivalentes sintéticos: a) Magnesianos de Grignard: RMgX Mg R-X (a) b) Organolíticos: RLi R (a) c)Organocúpricos; R2CuLi (Reactivo de Gilman) I 4 R Li + éter 2Li R-MgX (d) R (d) + Cu2I2 Li + LiI + 2 LiI 2 R2CuLi (d) Otras reacciones de interés, en las que participa el reactivo de Grignard son las siguientes: RCOCl + RCOR' R2'CuLi d) Organozinc: RZnCl (ampliamente utilizado en la reacción de Reformatsky) R-I RMgX + + R2'CuLi ZnCl 2 R-R' R-ZnCl + MgXCl O Síntesis de Reformatsky O H3C O OMe Br Zn H3C OMe RCHO H3C OMe éter ZnBr OH R 22 Wilbert Rivera Muñoz [email protected] 1 2.3.1.2. Sintones d derivados de aniones alquinilo, anión nitroalquilo y carbaniones estabilizados por P o S Aniones NaNH2 Alquinilo: R R C Na + NH 3 C como equivalentes de sintones d1 R EtMgBr CH R M(AcO)2 MgBr R + + C M 2 EtH AcOH M = Hg, Cu Utilidad sintética: R C + R R'Br R' H3C HC C + R'Br H R' Hg H3C ++ R' H2SO4 R O O sintón d1 "ilógico" Aniones nitroalquilo NO 2 NO 2 R = H, Me, alquilo R R OH- R sintéticos N N R R - O - de O NO 2 O+ O como equivalentes sintones d1 R O + NO 2 R O reacción R de Nef R R Anión cianuro, NC- . Su equivalente sintético es el cianuro de hidrógeno (HCN) o sus sales (NaCN). Puesto que el nitrilo es hidrolizable a ácido carboxílico, es considerado como el equivalente sintético del sintón d1 “ilógico” HOOC-. 23 Wilbert Rivera Muñoz [email protected] Aniones estabilizados por S y P como equivalentes sintéticos de sintones d1 S O H3C H R S S S BuLi + HS H H3C S S (d 1 ) O O O NaH S S R R HS CH3 H3C CH2 O S CH 2 H3C H3C CH2 (d 1 ) Anión DIMSIL R = alquilo Ph3P CH3 (alquiliden) R = función no carbonada Ph3P Ph3P OMe (alquiliden d 1 ) R Sintones alquiliden R = función carbonada Ph3P Ph3P COOMe (alquiliden d 2 ) (CH 2)n-2 (alquiliden dn ) COOEt Obtención: RCH 2Br + Ph3P B- Ph3P Br R Ph3P Ph3P R (d) R 24 Wilbert Rivera Muñoz [email protected] 2 2.3.1.3. Sintones d derivados de carbaniones estabilizados por uno o por dos grupos aceptores mesoméricos R1 H O R1 O R1 O R2 R R2 R El orden de activación de los diferentes grupos es como sigue: -CR=NR2+ > -COR > -CN> COOR > -CR=NR > -Ph > CH=CR2 BR2 R Para la formación del carbanión, se precisa la presencia de una base cuyo ácido conjugado tenga un pKa mayor que la del ácido a ionizar. H BH X X Además, para que la desprotonación se produzca de forma completa se necesita un equivalente de base + Y Y B H B Y Y + BH X X a) Sintones derivados de carbanión estabilizado por un grupo –M (pKa = 10 – 27): Equivalentes sintéticos de un carbanión en alfa de un grupo aldehído: R R CH2 KH THF CHO R R1-NH 2 R CN R + O -78ºC CH3 CH3 N H2 N R2 CH3 CH3 R R O 1) HCl / EtOH R1 N R R HO NR 1 BuLi/THF CH3 CH3 CH CH3 O HO 2) CH CH3 HO CH 2 LDA NR1 CH CH3 R CHO CHO (se produce autocondensación) CH CH2 CH R1 LDA/THF O CH R1 -78ºC N N R2 R2 25 Wilbert Rivera Muñoz [email protected] Equivalentes sintéticos de un carbanión en alfa de un grupo cetona: O R CH CH3 O O R CH 2 B R1 R CH 2 R1 R'NH 2 NR' R NR' CH 2 R1 B R O CH R1 O H3C H H H O H3C H3C 1) B + 2) Me3SiCl + LDA/1, 2-dimetoxietano/oºC ClSiMe3 + Et3N/DMF/calefacción ClSiMe3 OTMS OTMS H3C H3C ( 78%) enolato cinético ( 99%) enolato termodinámico Las cetonas se pueden enolizar regioselectivamente hacia el carbono menos sustituido por tratamiento con etildiisopropilamina y captura del enolato con dibutilboriltrifluorometanosulfonato (Bu2BSO3CF3). Otros equivalentes sintéticos de un carbanión en alfa de un grupo cetona, son las enaminas. Igualmente se puede controlar la enolización hacia el carbono menos sustituido, variando el volumen de la amina secundaria cíclica, utilizada para la formación de la enamina. NRR' O NRR' HNRR' R2 R1 H R2 R2 + R1 R1 enamina O HNRR' = N H piperidina N H morfolina 26 Wilbert Rivera Muñoz [email protected] Equivalentes sintéticos de un carbanión en alfa de un grupo éster o nitrilo R2 CH COOR' (R' = Me, Et ) R2 CH R2 CH2 R2 CN COOR' CH2 CN LDA THF LDA THF R2 CH COOR' R2 CH CN b) Sintones procedentes de carbaniones estabilizados por dos grupos –M Los pKa se hallan comprendidos entre el pKa = 9 de la acetilacetona y los pKa = 13 -14 de los sistemas malónicos. La ionización se realiza casi cuantitativamente por tratamiento con NaOR/ROH (pKa = 18). El tratamiento con bases como la piperidina (pKa = 11), provoca la desprotonación en un grado elevado. Sintón y equivalente sintético R COOH COOEt COOEt R Formación del carbanión COOEt H2 C H2C COOH NaOMe COOEt COOEt CN CN R CN CN COOEt CN COOEt COOEt CN CN COOEt CN CH3 H2 C CN COCH 3 pKa = 12 - 13 MeOH COOEt COOEt CN CN OH-M CN pKa = 13 MeOH COOEt NaOMe R H2C COOEt COOEt R + CN CN COCH 3 pKa = 11 NaOMe COCH 3 pKa = 11 MeOH O COOEt COOEt COCH 3 COCH 3 COCH3 COCH 3 COCH 3 COCH3 COOEt K2CO 3 COCH3 pKa = 9 H2 O COCH3 27 Wilbert Rivera Muñoz [email protected] Un grupo mesomérico éster puede utilizarse adecuadamente para activar un carbanión en un equivalente sintético, ya que el mismo es susceptible de descarboxilarse5 y de este modo producir sintones, cuya estabilidad muchas veces no resulta muy clara de la sola desconexión. O COOR' (Ar)R + OR' B- (Ar)R-X COR O R R'= Me, Et 1) NaOH/H2O R = Me, OR' 2) H 3O + O (Ar)R (Ar)R (Ar)R O R = Me H calor (-CO2) Me O R O R = OH calor (-CO2) corresponde al sintón: corresponde al sintón: O O H3C O HO H2C CH 2 OH COOR' Igualmente H2C CN proviene de CN 3 2.3.1.4. Sintones d derivados de aniones estabilizados a larga distancia H H2 C H2C 2 BuLi SH . S Li S 5 “August Wilhelm von Hofmann (1818), que había trabajado bajo la dirección de Lieibg fue importado a Londres desde Alemania. Como ayudante se le asignó, algunos años más tarde, a un joven estudiante, William Henry Perkin (1838-1907). Un día, en presencia de Perkin, Hofmann especulaba en voz alta sobre la posibilidad de sintetizar quinina, el valioso antimalárico. Hofmann había realizado investigaciones sobre los productos obtenidos del alquitrán de hulla, y se preguntaba si sería posible sintetizar quinina a partir de un producto del alquitrán de hulla como la anilina” 28 Wilbert Rivera Muñoz [email protected] COOH COOH + COOH COOH C tBUO-K COOH COOH HC COOH COOR LDA C COOR 29 Wilbert Rivera Muñoz [email protected] CAPÍTULO 3 FORMACIÓN Y DESCONEXIÓN DE ENLACES C-X (HETEROÁTOMO) “Muchas de las cosas que he hecho, y que creo que son motivo de satisfacción han supuesto, no cadenas lógicas, sino razonamientos en los que existía (precisamente) un vacío en la cadena, y yo he sabido dar este salto al vacío …”. D.H.R. Barton (Premio Nóbel de Química 1969. 3.1. Formación y desconexiones de un grupo C-X 3.1.1. Carbono electrófilo y oxígeno nucleófilo Esta desconexión es muy común en los éteres y los alcoholes. R C C O + R OR'(Ar) R2SO4 ó R-X OR'(Ar) + O R' = H, alquilo, arilo R'O o OAr, incluso R'OH Proponer un diseño de síntesis, para la MOb. 10 a partir de materiales simples y asequibles. Para escribir el diseño de síntesis es suficiente seguir el sentido de las flechas de reacción. O CH3 O C-O + MOb 10 CH 3 sintones methoxybenzene ONa + síntesis de Williamson CH 3Br IGF equivalentes sintéticos PBr3 IGF CH 3OH NaOH OH IGF SO3H RGF KOH fusión H2SO4/SO3 30 Wilbert Rivera Muñoz [email protected] El proceso de análisis retrosintético de la MOb 10, que es un éter no simétrico, da otra posibilidad de desconexión, la misma generaría el equivalente sintético, bromo benceno, pero el halógeno de esta estructura no podría ser desplazado por SN por un grupo metóxido sin que existan otros grupos fuertemente desactivadores en el anillo bencénico. Por tal razón se desestima esta posible desconexión. Alternativamente, el fenol puede ser tratado con sulfato de dimetilo (Me 2SO4)/NaOH, para obtener la MOb.10 En los alcoholes, la desconexión C-X, es decir C-O, orienta a la preparación de los mismos a partir de moléculas precursoras alifáticas, las cuales se hidratan por catálisis ácida, o por oximercuración – desmercuración, para originar productos del tipo OH C-O CH3 CH3 + OH 1-cyclopentylethanol hidratación CH2 / H+ H2O Markovnikov y la hidroboración si los alcoholes son alcoholes anti Markovnikov. Los ésteres y anhídridos, derivados del ácido carboxílico, también pueden presentar la desconexión C- O. En este caso se podría decir que la desconexión es acilo – oxígeno. O O C- O + OR' OR' (Ar)R (Ar)R reacción O X (Ar)R OR' (X = Cl , OH en medi o ácido) O O O X C-O OH O O O OH O (X = Cl, OH en medio ácido) reacción 31 Wilbert Rivera Muñoz [email protected] 3.1.2. Carbono electrófilo y azufre nucleófilo o carbono nucleófilo y azufre electrófilo C S + C Los sulfuros (tioéteres) se pueden obtener, también por un esquema del tipo carbono electrófilo y azufre nucleófilo. En cambio las sulfotas requieren para su formación un carbono nucleófilo y un azufre electrófilo. Los sulfóxido son resultado de la oxidación de los C S . C . sulfuros S S ejem.: . C C SR' + . Williamson S SR' C O O . C O S . sulfóxidos O . C O . sulfonas ejem.: . S C S O . R' O C SO2R' SEAr sulfuros o reducción de las sulfotas, como puede verse en el esquema ¿Cuál es el plan de síntesis más consistente, para la MOb 11? Los tioéteres, tienen una reactividad similar a los éteres, por lo que su síntesis, también puede encararse por la reacción de Williamson, como se muestra en el diseño de síntesis adjunto Br . Br CH 2 . S C-S + S Br Br Br (MOb 11) Br síntesi s de Wi ll iamson + Br HS mayoritari o Br2 NBS Fe CH3 Br HS mayoritari o Br2/Fe CH3 32 Wilbert Rivera Muñoz [email protected] 3.1.3. Formación y desconexión de enlaces carbono - halógeno La variedad de reacciones de formación de enlaces carbono – halógeno, permite vislumbrar tres tipos de desconexiones posibles para este tipo de enlaces: Carbono electrófilo y halógeno nucleófilo. + C X Ej em : adi ci ón de HX a al quenos. IGF de ROH a RX CH3 C-X R (a) X R Br X CH3 HBr (d) Carbono nucleófilo y halógeno electrófilo. + C X ejem.: Adición de X 2 a alqueno. SEAr y otros C-X R (d) X (a) Br R CH3 X CH3 Br2 / AcOH CH3 CH3 Br Carbono y halógeno radicalarios. X (r) + X ejem.: Bromaciones alílicas con NBS o 2Xy peróxido C-X R (r) C R X Br NBS H2C CH3 H2C CH3 3.1.4. Formación y desconexión de enlaces carbono - nitrógeno El nitrógeno forma con el átomo de carbono enlaces sencillos (aminas), dobles (iminas) y triples (nitrilos). Además el nitrógeno puede llegar a ser tetravalente en ciertas condiciones (sal de amonio cuaternario) debido a la alquilación de aminas terciarias. Por otro lado, existen dos tipos de métodos de formación de enlaces carbono-nitrógeno que afectan a los enlaces sencillos y dobles: Carbono electrófilo y nitrógeno nucleófilo. Aminas: R NR' 2 C RX + + N HNR' 2 33 Wilbert Rivera Muñoz [email protected] N NH CH2 Amidas: R R + Br CH2 Cl + NR' 2 HNR' 2 O R O OEt + HNR' 2 O Proponer un diseño de síntesis a partir de materiales simples y asequibles, para la MOb 12 O O Cl C-N NH H2N (MOb 12) cyclopentanamine SOCl2 N-cyclopentylcyclohexanecarboxamide IGF Cl O NH3 OH 1) OH-/H 2O 2) H 3O + CN Cl 2 peróxi do cyclopentane cyclohexanecarbonitrile Imino derivados: La desconexión del enlace doble C=N, es aplicable a iminas, oximas, hidrazonas, etc., que se obtienen entre un aldehído o cetona con el correspondiente compuesto amínico. R" RN R" RNH 2 + O R' R' Para mejorar las estrategias de síntesis de compuestos que contienen enlaces C-N, será necesario recordar además, las interconversiones utilizadas en la síntesis de la MOb 13 34 Wilbert Rivera Muñoz [email protected] CH3 NH R CH3 NH R O CH3 LiAlH4 (MOb 13) R C-N IGF Cl amida + O CH3 H2N CH3 CH3 H2/ Ni Raney IGF CH3 N R C-N NH2 R + CH3 O imina CH3 CH3 Otras formas de formar enlaces C-N, de aminas primarias, son las siguientes: NH NH 3 O NH2 Reduc Reduc: NaBH4, NaB(CN)H 3, H2/cat NOH NH 2OH R CN ó R N3 R LiAlH4 R ó H2/Pt CONH2 ó CH 2NH 2 R 3.1.5. Carbono nucleófilo y nitrógeno electrófilo: C CON3 Hoffmann Curtius Schmidt Lósen RNH 2 N Esta situación se presenta en los compuestos aromáticos, donde el anillo bencénico está unido a grupos: -NO2, NO, N2X.. Estos enlaces C-N, se forman por sustitución electrofílica aromática SEAr. 3.2. Desconexión de dos grupos C-X 3.2.1. Compuestos 1,1 – difuncionalizados OEt Ph 1, 1-diX Ph CH + 2 MeO Ph CHO + 2MeOH acetal sintones EtO H + equivalentes sintéticos 35 Wilbert Rivera Muñoz [email protected] OH OH OH CN IGF NH2 + CN + KCN equivalentes sintéticos sintones 1-(aminomethyl)cyclopentanol LiAlH4 H O + CN COOH H3C H3C + CH H3C NH2 + CN NH2 NH2 2-aminobutanoic acid HCl conc. Strecker NH3 CHO H3C KCN 3.2.2. Compuestos 1,2 – Difuncionalizados O O O O O IGF N Br O + N H N PBr3 O 1, 2 -diX HO C-O H 1-(2-bromoethyl)-2,3-dihydro-4,1-benzoxazepin-5(1H)-one O + OH (MOb 14) OH NH C-N COOH O + oxirane NH2 2-aminobenzoic acid O COOH OH COOH 1, 2 - diX + Cl Cl 1) NaOH Cl 2) CH 3COOH Cl Br Br2 / P4 C - Cl Cl 2/Fe OH H3C COOH 36 Wilbert Rivera Muñoz [email protected] 3.2.3. Compuestos 1,3-Difuncionalizados: Cl Cl IGF OH H3C COOH 1, 3 - diX COOH H3C H3C HCl LiAlH4 O O O RGF BrMg H Br Mg/éter H O O O 1, 2 diX H2C Br H H HBr OH OH H + 37 Wilbert Rivera Muñoz [email protected] CAPÍTULO 4. DESCONEXIÓN C-C-, VÍA LA DESCONEXIÓN DE UN GRUPO FUNCIONAL “La Síntesis Orgánica es fuente de emoción provocación y aventura y puede ser también un noble arte”. R. B. Hoodward. 4.1. Desconexión de alcoholes simples En la desconexión de alcoholes sencillos, las reacciones siguientes, son las más recurrentes: 4.1.1. Reacciones de Grignard y otros organometálicos Et H3C H5 C6 H3C C -C OH EtMgBr O H5C6 2) H 3O + ó Los otros C-C también son desconectables EtLi + CHO 4.1.2. Reacciones de reducción sobre grupos carbonilo IGF NaBH4 OH COOEt IGF LiAlH4 OH 4.1.3. Reacciones de los epóxidos, en medio ácido o básico OH C -O CH 2 + O MgBr 2-cyclohexyl-1-phenylethanol + 2) H 3O + Los alcoholes, son las moléculas precursoras más versátiles, en la síntesis orgánica, debido a la amplia gama de posibilidades de transformación en otros grupos funcionales. Por tal razón, se analizará la síntesis de la MOb 12 con cierto detalle. Los alcoholes terciarios MOb 15, que presentan dos sustituyentes idénticos, casi siempre son preparados a partir de la reacción de una molécula de éster y dos moléculas de un reactivo organometálico de: Grignard. Esto implica, que los enlaces formados entre el éster 38 Wilbert Rivera Muñoz [email protected] y el reactivo de Grignard, son el (b) y (c), por lo que se desconecta por los enlaces indicados y los sintones que se forman sugieren que los equivalentes sintéticos son el éster correspondiente y el bromuro de etil magnesio . MOb 15 OH . a . CH3 b c Cl sintones OH C-C ( b y c) H2C CH3 H2C CH3 Cl H3C 1) éter 2) H 2O COOEt + 2 CH3CH 2MgBr equivalentes sintéticos Cl IGF + EtOH/H COOH CN IGF AGF Cl 1) NaOH 2) H CH3 AGF IGF NaCN Cl AGF Cl Cl . Cl CH3 Cl 2 /AlCl3 Si se desconectara por (a), la molécula precursora es una cetona alifática, y el Grignard tiene el resto aromático. + Cl 2 /hv . OH O CH 2 CH3 a C-C ( 1) + H3C CH3 Cl Cl H3C CH 2MgBr 1) éter 2) H 2O Cl Alternativamente, al desconectarse por (b) o (c), la cetona precursora es mixta y el Grignard contiene el resto alquílico, como se puede observar. OH OH . . b H2C CH3 C-C ( b ó c) + c Cl Cl H3C CH3 H3C O 1) éter 2) H 2O + Cl CH 3CH 2MgBr H3C 39 Wilbert Rivera Muñoz [email protected] 4.2. Desconexión de olefinas simples Ph 4.2.1. Reacciones de eliminación 4..2.2. La reacción de Mannich OH 1) éter AGF La ruta que utiliza el epóxido como molécula precursora, tiene el inconveniente de producir un alqueno isomérico a la MOb, por lo que no es recomendable. O 2) H 3O + PhMgBr + Ph AGF Ph + PhMgBr O OH 1) éter 2) H 3O O O O CH2 + AGF NEt2 NEt3 EtBr OH-/ calor reacción de Eliminación de Hofmann Mannich O HCHO + HNEt2 / H 4.2.3. La reacción de Wittig La reacción es altamente estereoselectiva, es decir es también regioespecífica PPh3 Ph + H O Wittig a Ph b CHO Wittig + Ph Ph3P 1) Ph3P 2) BuLi Diels - Alder CH2 + CH2 Ph CHO Br CH2 40 Wilbert Rivera Muñoz [email protected] La estereoselectividad (E/Z) de la reacción de Wittig, se puede observar en las siguientes transformaciones: H Ph3P R O Ph3P O Ph3P O R R' R' R' R R R' H R R' R = COOEt R = alquil Formación del iluro Si R y R' son H o alquilo R 1) Iluros estabilizados (Ph3P=CHR, R=COR’, COOMe, Ar. C=C) dan mayoritariamente alquenos trans. 2) Iluros no estabilizados (Ph3P=CHR, R= alquilo) dan predominantemente alquenos cis. 3) Los alquilidenfosfonatos ((RO)2PO=CHR) dan elevadas selectividades del alqueno trans Ph3P ButLi o PhLi R R' Ph3P H R R' Si R y R' es un grupo -M + NaOH o Na RO- Ph3P R' 4.2.4. Olefinas cis, a partir de precursores cíclicos El alqueno atacado en la ozonólisis, es el que se halla más rico en electrones. Recuérdese que el oxígeno posee pares de electrones sin compartir OEt OEt 1 EtOOC 5 2 3 6 CHO Birch reducción "reconexión" 4 CH3 ozonólisis CH3 CH3 Na/NH3 (l) t-BuOH 4.2. Desconexión de aril cetonas Esta desconexión, se halla relacionada con la reacción de Friedel – Crafts, tanto en la acilación intermolecular, así como en la ciclación intramolecular. Los reactivos acilantes, pueden ser, los haluros de acilo, ácidos carboxílicos y anhídridos cíclicos. 41 Wilbert Rivera Muñoz [email protected] O OMe Cl OMe + O NO 2 F-C H3C NO 2 CH3 OMe H3C O CH3 Cl F-C + NO 2 H3C CH3 Desconexión incorrecta, el grupo NO 2 es fuertemente desactivante del benceno consiguientemente la reacción de acilación de Friedel-Crafts no ocurre 4.4. Desconexiones de C- carbonílicos El carbono de los compuestos que contienen el grupo carbonilo (aldehídos, cetonas, ésteres, dicetonas, diésteres, nitratos, nitrilos, etc.), es el centro de muchas reacciones de formación de enlace C-C. Debido a la acidez de los H, éstos sufren un -desprotonación en presencia de una base adecuada, con la consiguiente formación de un carbanión. La carga negativa resultante sobre el C al C=O, es estabilizado por resonancia, por el mismo grupo carbonilo. H O O H O R H R B: H H R H H La selección de la base, para la formación de enolatos, se sujeta a que el pKa del ácido conjugado de la base debe ser mayor por lo menos en tres unidades al pKa del compuesto carbonílico que posee H acídicos. O H3C O H3C pKa = 20 MeO- pKa = 15 Formación del enolato desfavorable tBuO- pKa = 19 CH3 O pKa = 10 Formación del enolato muy favorable OEt 4.4.1. Formación de enolatos: O O H3C H3C B: + BH LDA, T HF -78º producto cinético OH H + H3C MeONa producto termodinámico 42 Wilbert Rivera Muñoz [email protected] El enolato cinético Li Se da porque el sustrato, cuenta con H alfa, fácilmente accesibles para la desprotonación por medio de una base típica como es el LDA (pKa aprox 30) N . . . LDA . El LDA (diisopropilamiduro de litio) es una base fuerte, no nucleofílica, con impedimento estérico Enolatos de ésteres: Los ésteres son susceptibles de una reacción de sustitución por la base, el LDA puede ser problemático, razón por la cual con los ésteres se utiliza la base no nucleofílica (isopropilciclohexil amiduro de litio) . . O O . LDA, THF, -78º OR' E R R N O N + . O Li Li . OR' OR' THF, -78º . R R Enolato termodinámico: Una desprotonación reversible puede conducir a enolato más estables, lo cual ocurre cuando se obtiene el C=C más substituido de la forma enólica. O K Las condiciones O K O CH2 típicas para formar + tBUO-K / tBuOH CH3 CH 3 enolatos H3C H3C H3C termodinámicos son: CH3 RO-M+ en ROH CH3 CH3 como solvente prótico (pKa del ROH = 15 a18) Los enolatos cinético y termodinámico, pueden ser atrapados, aislados, separados y purificados, para obtener enolatos regioquímicamente puros. Esto puede realizarse por la formación de acetatos de enol y el sililenoléter Acetato de enol: CH3 Ph O 1) NaH, DME Ph 2) Ac2O E CH3 + O + CH2 Ph O CH3 aislar, separar y purificar O CH3 O Li O CH 3Li, T HF CH 3Li, T HF Ph CH3 CH2 Ph O Li 43 Wilbert Rivera Muñoz [email protected] Sililenoléter: CH3 Ph 1) LDA CH3 Ph 2) Me2SiCl O + CH2 Ph OTMS OTMS aislar, separar y purificar CH 3Li, T HF ó Bu4NF o TiCl4 CH3 Ph CH2 Ph O M O M Enolatos a partir de enonas: El enolato se genera por reducción a partir de la disolución. de un metal en amoniaco líquido H H H 1) MeLi 1) Li, NH3 2) TMS-Cl O 2) E + O TMSO H OSiMe3 E OSiMe3 O H3C H3C H TMS - OTF TMS-Cl Et3N H3C Et3N OSiMe3 O H3C H3C Li, NH3, tBuOH TMS-Cl Enolatos a partir de adición conjugada (1,4) en compuestos , – insaturado cetónicos: O + O Li O E (CH 3)2CuLi CH3 3-methylcyclohex-2-en-1-one E + CH3 CH3 CH3 CH3 se prepara para su uso inmediato 44 Wilbert Rivera Muñoz [email protected] Enolatos a partir de reducción de -halocarbonilos O O- M H3C Br + H3C Zn o Mg CH2 CH3 CH3 1-bromo-3-methylbutan-2-one Enolatos a partir de , insaturado cetonas O sitio cinético sitio termodinámico CH3 H3C 4.4.2. Equivalentes sintéticos de varios enolatos NR O O + CH3 enolato H2C H2C CH3 O N nitroalcano enolato azaenolato NR O C H3C N H2C nitrilo enolato O B: H + N CH3 CH3 B: H B: Cetona, aldehído, éster, amida OH O R H B: Imina N Nitrilo Nitroalcano OSiMe3 OAc OMe C H N H2C CH3 enol H2C CH3 Enol éter H2C CH3 Enol éster H2C CH3 Silil enol éter H2C CH3 enamina La formación de los equivalentes sintéticos del enol señalados, transcurre a través de reacciones simples y de rendimiento alto: Formación de los silil enol éteres: Los derivados del silil enol, también pueden prepararse fácilmente a partir de ésteres y amidas. Los silil enol éteres tienen que emplearse preferentemente en el caso de aldehídos, puesto que éstos enolizan con bases fuertes induciéndose a la condensación aldólica. 45 Wilbert Rivera Muñoz [email protected] OSiMe3 OSiMe3 O CH3 1) LDA CH3 Me3SiCl Et3N 2) Me3SiCl CH3 -78º Formación de enaminas: La regioselectividad, puede controlarse por la combinación adecuada de los efectos electrónicos y estéricos + O N CH3 N N H CH3 CH3 2-methylcyclohexanone Formación de enol éteres por reducción de Birch: La regioselectividad de la reducción es controlada por efectos electrónicos OMe Li/NH3 OMe H O O + H + tBuOH methoxybenzene 1-methoxycyclohexa-1,4-diene cyclohex-2-en-1-one 4.4.3. Alquilación de enolatos: La alquilación de enolatos, corresponde mayormente a una reacción con haluros de alquilo y epóxidos: Donde los haluros de alquilo y bencilo primarios O O son buenos para la alquilación, los haluros de 1) LDA, T HF, -78º C alquilo secundario sólo en algunos casos y los CH3 2) CH 3I haluros de alquilo terciarios, básicamente no reaccionan con los enolatos, porque la reacción nucleofílica bimolecular. transcurre por un mecanismo de sustitución Por otro lado, la alquilación es incrementada por la polaridad de los solventes que se utilizan como medio de reacción. O O (Me2N) 3P=O HMPA S R NMe2 DMF R=H R = CH 3 DMA H3C CH3 DMSO 46 Wilbert Rivera Muñoz [email protected] O O H3CN H3CN NMe2 NCH 3 Me2N TMEDA Alquilación de silil enoléteres, catalizada por ácidos de Lewis. Alqulación SN1 O OT MS CH3 tBu-Cl, TiCl4 CH3 la alquilación puede ocurrir con un haluro de alquilo 3º C(CH 3)3 CH 2Cl 2 -40º C ( 79%) OT MS O SPh R O SPh R Ni Raney R Cl ( 95%) TiCl4, CH2Cl 2, -40º C ( 78%) ACIEE 1978, 17, 48 y TL 1979, 1427 OT MS O CH3 nBu4NF, THF, MeI Alquilación de enolatos de compuestos , insaturado carbonílicos: O-M + O R' R O cinético R' R E R' R H H E H H O-M + O R' R E H E; El ectrófi lo R' R H E termodinámico Transposición de Enonas de Store-Danheiser: -alquilación de cetonas insaturadas en , O OPh LDA O OPh HO CH 3Li OPh CH3 H3O CH3 + PhOCH2Cl OMe 3-methoxycyclohex-2-en-1-one OMe OMe O 47 Wilbert Rivera Muñoz [email protected] Alquilación de enaminas. O O N O N H3C morfol ina morfol ina H + H + producto termodinámico producto cinéti co R no puede alqui larse H3C H3C O I morfol ina: O N H O + N H2O H3C H3C R R Se controla la monolaquilación y la formación del producto cinético, aprovechando el efecto estérico, para lo cual se tiene que utilizar una amina secundaria, voluminosa como la morfolina Por otro lado, las enaminas quirales, producen en la alquilación, cetonas alfa sustituidas también quirales H3C N CH3 O E E (2S,5S)-1-cyclohex-1-en-1-yl-2,5-dimethylpyrrolidine Alquil iminas: Las iminas, isoelectrónicas con las cetonas, pueden transformarse en enaminas, que posteriormente pueden ser alquiladas o reaccionar con un reactivo electrófilo. Me O Ph OMe Li N CH3 - O N 1) E LDA, T HF, -20º C N-[(1S)-1-benzyl-2-methoxyethyl]-N-cyclohexylideneamine 2) H 3O + E E = -CH3, -Et, -Pr, PhCH2, alilo 48 Wilbert Rivera Muñoz [email protected] . Las hidrazonas, isoelectrónicas de las cetonas, pueden formar enaminas que seguidamente son alquiladas e hidrolizadas para liberar la cetona . N N O + N . Me2N-NH 2 H . N N . N . LDA, THF (-H 2O) E . N N O E H3O . E + Los aniones de las hidrazonas son mucho más reactivos que los correspondientes enolatos de aldehídos o cetonas. Existe un inconveniente, puesto que puede existir dificultad en la hidrólisis final. Las hidrazonas quirales son utilizadas para la alquilación asimétrica (las hidrazonas RAMP/SAMP, son utilizadas en la síntesis asimétrica) 1) OMe MeO N N NH2 RAMP NH2 SAMP LDA O 2) OTBS N N N N I OMe O3 H . ( 95%) . . OMe SBTO . SBTO N N N OMe 1) LDA O N OMe CH3 CH3 3) MeI, 2N HCl 2) Ts-CH 3, THF -95 -20ºC 100% 49 Wilbert Rivera Muñoz [email protected] CAPÍTULO 5. DESCONEXIONES LÓGICAS C-C, VÍA LA DESCONEXIÓN DE DOS GRUPOS FUNCIONALES “Los problemas son oportunidades para demostrar lo que se sabe”. C. F. Hebbel. 5.1. Modelo de desconexión 1,3-dioxigenado Las desconexiones para este modelo se efectúan según el siguiente análisis básico de desconexiones de tres tipos de compuestos, que responden a la relación 1,3 – dioxigenado: equivalentes sintéticos sintones O O O 1, 3-diO . . . O O . + O + . . X . enolato . X = buen grupo saliente como el -OR condensación de Claisen equivalentes sintéticos sintones . . O O . OH OH 1, 3-diO IGF . . . . + . condensación aldólica OH 1, 3-diO . O O O O etc. etc. . enolato. + H . aldehído La olefina, también podría prepararse utilizando la reacción de Wittig. La condensación aldólica, se puede llevar por la acción de una base fuerte disuelta en alcohol, hasta la deshidratación de los aldoles formados, para producir compuestos , insaturado carbonílicos. Por tal razón también se puede proponer la desconexión directa por el punto de instauración olefínico. 5.1.1. Compuestos β-dicarbonílicos Los compuestos 1,3-dicarbonílicos se obtienen con buenos rendimientos a través de reacciones de condensación del tipo Claisen, que implican la reacción entre ésteres y compuestos con hidrógenos activos, como ésteres, cetonas, aldehídos, nitrilos, nitroderivados y algunos hidrocarburos en presencia de reactivos alcalinos. 50 Wilbert Rivera Muñoz [email protected] Las β-dicetonas y los β-cetoaldehidos se obtienen por una condensación de Claisen cruzada, utilizando una cetona y un éster. En la condensación de Claisen cruzada de cetonas y ésteres se obtienen buenos rendimientos debido a que las cetonas son notablemente más ácidas que los ésteres, por lo tanto, en el medio básico la cetona se desprotona en mayor grado que el éster MOb 17 MOb 18 Proponer un diseño de MOb 16 O síntesis a partir de materiales simples, para las siguientes moléculas: Aparentemente las dos alternativas de desconexión (a) y (b), conducen a la condensación de Claisen para la formación de los enlaces O O Ph O Ph COOEt Ph . tBu O O O O MOb 16 O OEt Ph EtONa O a Ph . a . . O 1, 3-diO b + O O r - F-C b EtO . + Ph + . Cl . AlCl3 EtONa desconectados y los equivalentes sintéticos generados, permitirían formar la MOb 16. Sin embargo, la alternativa (b), resulta ser la más adecuada, en razón a que, en el medio básico de la reacción, el carbanión formado PhCOCH2- estaría mejor estabilizado, por efectos de resonancia e inductivos. La desconexión (a), en la MOb 17, resulta ser la más apropiada en el caso particular, puesto que conduce a equivalentes sintéticos simples y asequibles O O + EtO MOb 17 tBu O b b O a tBu O O O O O a OEt 1, 3-diO O +. OEt OEt tBu EtONa/EtOH O EtONa/EtOH tBu O 51 Wilbert Rivera Muñoz [email protected] La mejor alternativa de desconexión en la MOb 18, es la (b), debido a que conduce a equivalentes sintéticos simétricos. La alternativa (a) no deja de tener su importancia, en el uso del formiato de etilo. Ph a b EtOOC 1) OH- y luego H O + 2) EtOH/H EtOH Ph 1, 3-diO Ph O MOb 18 Ph + EtONa b NC Ph + EtOOC Ph IGF EtO a Ph OEt + COOEt 2 PhCH2MgBr IGF + Ph EtONa/EtOH HCOOEt Ph O CrO 3/H2SO4 HO 1) THF 2) H 2O 5.1.2. Compuestos β-dicarbonílicos a través de condensaciones intramoleculares MOb 19 MOb 20 O Proponer un plan de síntesis, que tenga consistencia técnica, para las siguientes moléculas O COOMe N H3C La desconexión 1,3 – diCO, conduce a un diéster en relación 1,6. Los mismos son fáciles de reconectar a un hexaciclo alqueno, modelo que se estudiará un poco más atrás. Por tal razón se proporciona un diseño de síntesis alternativo, en base a reacciones conocidas Diseño al que sólo se puede cuestionar el gran número de etapas, que en general disminuye el rendimiento de la síntesis. Es posible pensar en otra desconexión 1, 3 – diCO para la MOb 19, como se O O OMe COOMe COOH COOMe 1, 3 - diCO + IGF 2 MeOH/H NaH MOb 19 1) OH- Cond. Claisen intramolecular 2) H 3O OH OH OH RGF 2) H 2O *Na-C H2 Ni COOH IGF Br OH PBr3 IGF Br + CN CN IGF 2 NaCN C-Na* 2 HCHO Muestra. 52 Wilbert Rivera Muñoz [email protected] O O La misma, requiere, que se garantice que la ciclopentanona precursora, se transforme con altos rendimientos cuantitativamente en su enolato o enol, para atacar al otro equivalente sintético COOMe 1, 3 -diCO COOEt O OEt = carbonato de dietilo COOEt condensación de Dieckman . base que llegaría a ser el carbonato de dietilo. Otras veces es necesario ejercitar un control en la estructura de la MOb, con la finalidad de generar condiciones estructurales apropiadas para ejercitar una desconexión, dentro algún modelo conocido. Así, la MOb 20 requiere de este tipo de estrategia, el control en este caso, puede consistir en adicionar un grupo éster en la posición al grupo que cetónico, COOEt COOEt O O N H3C N H3C MOb 20 1) HO-, H 2O 2) H 3O COOEt 1, 3-diCO AGF COOEt C-N N H3C EtONa H2C COOEt NH2 H3C H2C + 3) calor (-CO2 ) posteriormente sea fácil su remoción, sin que afecte mucho el rendimiento general de la síntesis 5.1. 3. -Hidroxicompuestos La mejor desconexión en estas moléculas, es el enlace formado por los C y C, respecto al grupo carbonilo. Este tipo de compuestos son típicos productos de las reacciones de condensación aldólica y similares, razón por la cual un buen diseño de síntesis para la MOb 21, puede ser el siguiente: La reacción entre el formal- ciclohexanona y la acetona en medio básico, es una reacción de condensación del tipo aldólico. El grupo aldehído es el más reactivo y no existe riesgo de autocondensación del aldehído por efectos estéricos. La base que debe ser utilizada para formar los - hidroxicarbonilos, tiene que ser una base débil, para evitar la deshidratación de la función alcohol y producir de este modo un compuesto , insaturado carbonílico, que será el objeto de nuestro estudio en el próximo párrafo 53 Wilbert Rivera Muñoz [email protected] OH O O O H CH3 H3C + PCC EtONa MOb 21 CH3 OH condensaci ón al dóli ca cruzada 2) H 3O + MgBr Br + HCHO Mg/éter Br2 , cal or .5.1.4. Compuestos , insaturado carbonílicos ( , insat.CO ) Los compuestos α,β-insaturados carbonílicos son fáciles de preparar por la deshidratación de un compuestos β-hidroxicarbonílico, por lo que su desconexión pasa por funcionalizar la molécula insaturada a un alcohol. H CHO O 2N O CHO , insat. CO H3C MeOK, MeOH + O 2N H2O MOb 22 CHCl 2 CaCO , calor 3 O 2N CH3 CH3 Cl 2/calor O 2N HNO 3 /H2SO4 Toda vez que un compuesto carbonílico , insaturado, MOb 22, puede funcionalizarse al correspondiente alcohol, para obtener un modelo 1,3- dioxigenado, es posible desconectar la molécula directamente por el doble enlace, formulando un grupo C=O en el carbono y un grupo -CH3 en el carbono . La desconexión de la MOb 23, se inicia con el éster cíclico (lactona), por ser el punto más crítico, lo que permite luego desconectarlo como un compuesto carbonílico , insaturado. 54 Wilbert Rivera Muñoz [email protected] COOMe H3C O COOMe OH IGF O + 1, 3 -diO + MOb 23 CH3 H H3C + H3C CH3 CH2 H H H3C O O OH O a, b insat. CO H3C CH3 CH 2(COOMe)2 CH3 EtONa NH 3 La desconexión convencional por el doble enlace de la MOb 24, conduce a compuestos con una relación 1,5 – dicarbonílica, aspecto que se estudiará un poco más adelante. En tal virtud un diseño no convencional y aceptable utiliza la estrategia de la dimedona, como molécula de partida o intermedia, para preparar la MOb 24 OMe OMe O IGF IGF MOb 24 H3C H3C CH3 H3C OH H3C H3C O H3C CH3 1 ) MeMgBr 2) H 3O IGF + O MeOH HCl H3C O H3C dimedona 5.1.5. Control en las condensaciones de los compuestos con grupos carbonilo autocondensación . . . . CH2 enolato cinético RO- H O . . O OH O O CH3 + control cinético O O OH . . . . . . . . enol termodinámico . . OH . control termodinámico . 55 Wilbert Rivera Muñoz [email protected] condensación intramolecular O O CH3 O CH3 O OH CH3 CH3 CH3 O O CH3 CH3 CH3 OH condensación cruzada O Idealmente, una de las moléculas que reaccionan debería de enolizarse rápidamente, mientras que la otra preferiblemente no debería tener H, para. garantizar que no se formen O O R2 R1 t-Bu COOEt Cl , H , EtO COOEt R1, R2 = H, OEt, Cl, Ar, t-Alk, CO2Et otros subproductos O O . , insat. CO . . . + se efectúa regiocontrol COOH termodinámico en medio ácido OHC H3PO4 COOH Condensación de Mannich O O C-O O OH 1, 1-diX O CH3 MeO H3C MOb 25 OH MeO + Me2CO, H KMnO4, H2O O O O CH2 CH3 + N Me3 MeO MeO MeO 1) Me2NH, HCHO, HCl MeCOCl AlCl3 2) NaHCO 3 3) MeI OMe 1) Ag2O, OH2) H 3O + O +H C 3 CH3 56 Wilbert Rivera Muñoz [email protected] Esta reacción permite obtener en el momento necesario en la ruta de síntesis, las cetonas vinílicas, que por otros medios, presenta muchas dificultades su preparación. Este aspecto se ilustra con la síntesis de la MOb 25: Activación de los grupos Sistema no activado: Sistema activado: MeCHO H3C H3C + COOEt CHO producto de autocondensación MeCOOEt O H3C OH COOEt H + COOEt COOEt H3C H3C H3C COOEt COOEt COOEt COOEt Enaminas Ya se tiene dicho, que una forma de contar con un enolato activado, es la formación de una enamina, entre el compuesto carbonílico y una amina secundaria. O O H3C H3C Ar + H3C H3C X Análisis: En la síntesis de la MOb 26, se observa el uso adecuado de enaminas para garantizar la formación del compuesto 1,3 diCO. Ar CHO CHO MOb 26 Síntesis: La enamina formada, permite su respectiva acilación, para llegar a la Mob 26 O O N H H3C H3C H H3C CH3 ArCOCl Ar H3C + CHO H2O H3C H H3C CH3 H3C CHO + N N MOb 26 Reducción de Birch Esta reducción se constituye en una buena alternativa, para preparar ciclohexenonas, como puede observarse en la síntesis de la MOb 27: OMe OMe O MOb 27 CH3 CH3 H3O CH3 + Na, NH3, EtOH Sin embargo, debe recordarse que ciertos compuestos ,-insaturado carbonílicos, pueden ser preparados por la reacción de Wittig y también a través de la reacción de Reformatsky. 57 Wilbert Rivera Muñoz [email protected] Proponer un plan de síntesis, a partir de materiales simples para la MOb 28. Análisis: Se desconecta inicialmente la lactona, seguida de la desconexión 1,3-diO. El compuesto α,β-insaturado carbonílico (α,β- insat. CO), se obtiene por la eliminación de Hoffmann y la cetoamina, por la reacción de Mannich activar H3C H3C OH ZnBr CH 2 OH COOH 1, 3-diO IGF COOH O O OH COOMe proteger + H3C H3C H3C O MOb 28 1, 3-diO CH2 OH O O Hoffmann Me2N proteger Mannich H3C O H3C Síntesis: La síntesis de la Mob 28, es muy apropiado para mostrar el control que se debe ejercer sobre determinados centros de reacción para Et2NH H3C O H3C HCHO H H3C H3C H3C O O AcOH 1) MeI O COOMe 2) EtONa + CH2 ZnBr AcO NEt 2 H3C H3C OH OH 1) KOH MOb 28 2) H + COOMe AcO O O 4-hydroxy-4-methyltetrahydro-2H-pyran-2-one lograr las transformaciones deseadas y necesarias 5.2. Modelo de desconexión 1, 5 dioxigenado (1,5-diO) El modelo de desconexión 1,5-diO, puede ser aplicado, luego de la funcionalización necesaria, a compuestos como: 1,5-dihidroxilos, 1,5-hidroxialdehidos, 1,5-hidroxicetonas, 1,5-hidroxiésteres, 1,5-cetoaldehidos, 1,5-dicetonas, 1,5-cetoésteres, 1,5-dialdehidos, etc. Las posibilidades se incrementan, si además se toma en cuenta a los nitroderivados y nitrilos, que pueden formar en medio básico, carbaniones muy reactivos capaces de adicionarse a compuestos ,-insaturado carbonílicos, para obtener productos del tipo 1,5diO. 58 Wilbert Rivera Muñoz [email protected] O El análisis fundamental de la desconexión de los compuestos 1,5diO es el siguiente: O R1 O R1 b a 3 1 1, 5 -diCO 5 R2 R2 equiv. sintético O O O H2C CH 2 + H2C R2 sintones CH 2 R1 O a O b CH 2 R1 1, 5 -diCO + sintones R2 H2C O O CH 2 R1 R2 equiv. sintético H2C La elección de la desconexión (a) o (b), en torno al C3, dependerá de la naturaleza de los grupos R1 y R2, que puedan conferir una mayor o menor estabilidad al sintón o equivalente sintético necesarios para la formación de la Molécula Objetivo. Asimismo, la activación del enolato deberá ser adecuadamente controlada. Las reacciones que mayormente están vinculadas a la formación de compuestos 1,5- diCO, son la reacción de adición conjugada de Michael y la reacción de anelación de Robinson. Sintetizar las MOb 29, 30 y 31, a partir de materiales simples y asequibles: MOb 29 MOb 30 MOb 31 O O O O COOEt Ar Ph COOH CH3 Ph Ph O O O Análisis: El COOEt carbanión 1, 5-diCO IGF 1 + COOEt necesario para 3 COOEt COOH adicionarse al 5 compuesto ,MOb 29 O insaturado O 1 carbonílico 1, 5-diCO CH3 H3C CH3 5 puede ser 3 CHO + HCHO CH3CHO H2C CHO obtenido a partir del básico. Lo que posteriormente obligará a una descarboxilación, para malonato de dietilo en medio llegar a la MOb 29 59 Wilbert Rivera Muñoz [email protected] O Síntesis: El enlace formado por los cetoaldehidos a distancia 1–5, generalmente ocurre por el ataque del nucleófilo que origina la cetona metílica, en medio básico H3C HCHO + CH 3CHO EtONa H2C O O CH3 CH3 EtONa CHO LDA EtOH EtOH CHO EtOOC EtONa EtOOC O O O 1) OH- calor 2) H 3O COOH COOH COOEt + COOEt MOb 29 COOH sobre el grupo formilo, por la mayor reactividad de este último. Análisis. Se inicia con la desconexión por el doble enlace de la Mob 30 y continua con la relaciones dicarbonílicas que se forman O Ph O COOEt H3C O , insat. CO Ph Ph Ph COOEt 1, 5-diCO 1 H3C O O + 3 5 Ph COOEt MOb 30 Ph 1, 3-diCO a,b- insat. CO Ph O OHC + H3C H3C Ph + COOEt COOEt CH3 Síntesis. Se procede con una combinación de Condensaciones de Claisen, Claisen Schmidt , la reacción de Michael y la anelación de Robinson, para llegar a la Mob 30 Ph Ph O O + OHC EtONa COOEt COOEt EtONa Ph H3C H3C O O Ph EtOH CH3 + COOEt H3C EtONa Ph O COOEt H3C O EtOH Ph Ph Ph ethyl 2-oxo-4,6-diphenylcyclohex-3-ene-1-carboxylate MOb 30 COOEt 60 Wilbert Rivera Muñoz [email protected] Análisis. La desconexión como 1,5-diCO de la Mob 31, origina dos precursores, que requieren una activación de la cetona para formar el nucleófilo necesario para la reacción de Michael; para ello se recurre a la formación de una enamina. O O O O 1, 5-diCO Ph 1 5 3 Ar + Ph H2C Ar CH3 CH3 MOb 31 O CN Ph + EtMgBr HCHO + H3C Ar Las cetonas vinílicas son muy reactivas y tienden a dimerizarse por la reacción de DielsAlder, razón por la cual, si éstas son necesarias como sustrato en la reacción de adición de Michael, es necesario prepararlas “in situ” y una reacción muy útil para ello es la reacción de Mannich, como puede verse en la síntesis de la MOb 32. Análisis. La desconexión 1,5-diCO, de la MOb 32, genera un precursor como la cetona vinílica, que deberá formarse por la reacción de Mannich, seguida de la eliminación de Hoffmann para combinarse con el cetoéster formado por la condensación de Claisen O O 3 1 CH2 COOMe 1, 5-diCO 5 + COCH 3 1, 3-diO MOb 32 COOMe H3C IGF + HCHO + + MeOOC CH3 HNEt 2 O O 3 COCH 3 vía Manni ch O O 5 COOMe CH3 1 CHO 1, 5-diCO H3C CH3 H2C CHO HCHO + CH 3CHO Síntesis. La cetona vinílica, necesaria para la reacción (de Michael) con el cetoéster, se prepara, combinando adecuadamente la reacción de Mannich, la eliminación de Hoffmann y la reacción de Michael. La MOb 32, podría sufrir una ciclación intramolecular, si existiría aún en el seno de la reacción un catalizador básico (anelación de Robinson) 61 Wilbert Rivera Muñoz [email protected] O O H3C CH 3CHO 1) EtONa/EtOH H C 2 2) HCHO O CH3 CH3 EtONa CHO EtONa EtOH CHO H2/Pd,C CH3 CH3 NEt 3 O HCHO NEt 2 Et2I HNEt 2 EtONa O CH2 O COOMe EtONa COCH 3 MeOOC COOMe COOMe CH3 H3C MOb 32 EtONa COCH 3 En algunas oportunidades, la reacción de adición de Michael, permite formar compuestos cíclicos, particularmente si la reacción es intramolecular. Esta reacción recibe en realidad la designación de “anelación de Robinson” ó “Anillación de Robinson, como puede observarse en la síntesis de la MOb 33. Análisis. La Mob 33, presenta una estructura típica de los productos de “anelación de Robinsón”, por lo que se inicia desconectando por el punto de insaturación, lo que origina precursores con modelos dioxigenados típicos. O O CH3 O CH3 3 1, 3-diO 1 O 5 O H3C 1, 5-diCO + O HCHO + + CH 3COOEt H3C H2C CH3 O + OEt CH3 1, 3-diO 3 HCHO CH3 + 1 1, 5-diCO O H3C 1, 3-diCO O EtMgBr H2C O MOb 33 CH 3COCl CH3 5 OEt O H3C O O Síntesis. Es necesario ejercer control, para generar el nucleófilo con el C 2º, lo que se consigue por la formación de la enamina, con un grupo amínico, suficientemente voluminoso. El producto se forma como se indicó por la anelación p anillación de Robinson. 62 Wilbert Rivera Muñoz [email protected] O O CH 3COCl + EtMgBr + HCHO CH3 CH3 H3C OEt H2C EtOH O O OEt EtONa CH 3COOEt O CH3 O H2C O O CH3 CH3 N 1) EtONa H3C EtOH O H3C O MOb 33 CH3 O EtONa O 2) H3O O + La anelación de Robinsón, también permite obtener compuestos cíclicos 1, 3-dicetonas. En tal virtud, proponer un diseño de síntesis para la MOb 34. Análisis. La desconexión 1,3-diCO de la Mob 34, origina una molécula precursora, con una relación 1,5-diCO, que presenta la posibilidad de efectuar la desconexión por dos enlaces diferentes (a) y (b), las mismas son viables. H3C H3C CH3 b 5 OEt H3C O O MOb 34 a b CH3 1, 3-diO + CH3 O + OEt O H3C H3C O activar CH3 CH3 H3C CH3 O O O 1, 3-diO + O O H3C 1, 5-diCO H3C H3C 1, 5-diCO a 1 CH3 CH3 3 1, 3-diCO O H3C CH3 activar CH3 + O OEt OEt Síntesis. Se propone la síntesis, de la Mob 34, tomando en cuenta la desconexión (a), por ser el mecanismo mucho más consistente: H3C COOEt CH3 +O O OEt CH3 H 1) EtONa EtOH + 3) EtOH, H H3C CH3 + COOEt + 2) H 3O , calor CH3 H3C O CH3 CH3 EtONa EtONa O H3C OEt H3C O O O MOb 34 63 Wilbert Rivera Muñoz [email protected] CAPÍTULO 6 DESCONEXIONES ILÓGICAS C-C, VÍA LA DESCONEXIÓN DE DOS GRUPOS FUNCIONALES “La inteligencia consiste no sólo en el conocimiento, sino también en la destreza de aplicar los conocimientos en la práctica”. Aristóteles. Todas las desconexiones estudiadas hasta el momento, han conducido a la formación de sintones lógicos, consistentes en cationes o aniones, cuyas cargas han estado estabilizadas por grupos funcionales o estructuras totalmente claras. Lamentablemente ello no siempre es así. Existe un conjunto bastante significativo de moléculas orgánicas que presentan desconexiones muy específicas, por lo que es difícil encontrar un modelo de desconexión general, razón por la cual se las estudia individualmente. 6.1. Compuestos con relación 1,2 dioxigenado 6.1.1. Compuestos -hidroxicarbonílicos Los compuestos α-hidroxicarbonílicos se desconectan en el enlace C-C que une a las dos funciones. sintones Esta operación conduce a un sintón natural o logico ilogico O lógico (el sintón catiónico) y a un sintón no O R 1, 2-diO R natural o ilógico (el sintón aniónico). Los CH3 + CH3 equivalentes sintéticos pueden ser aldehídos e OH OH ión acetiluro respectivamente. El grupo H acetileno terminal con sales mercúricas en H3C HC C medio acido forma una metilcetona. Esta O reacción es también útil si el grupo acetileno es interno y además simétrico. O Li O H nBuLi, THF HC CH HC C HO CH3 CH3 CH3 H2O Li HC HC Hg(AcO)2 HO CH3 H2O O CH3 a-hidroximetilcetona 64 Wilbert Rivera Muñoz [email protected] Un caso especial de α-hidroxicetonas son las benzoínas o diarilhidroxicetonas, en donde los dos grupos R son aromáticos o heterociclos. Las benzoínas son resultado de la autocondensación del benzaldehído catalizada por iones cianuro. O OH CHO NaCN, CH3CH 2OH 2 H2 O Benzoina (CH 2)11 CH 3 Las benzoínas pueden no ser + N simétricas, por ejemplo uno de los Br O aldehídos, puede ser un aldehído S CHO piridínico. El ión cianuro no cataliza a H3C los aldehídos alifáticos, los cuales HO presencia de sales de tiazolio. sufren el mismo acoplamiento en CH3 CH3 Las α-hidroxicetonas alifáticas, pueden formarse a partir de la condensación de esteres carboxílicos con sodio metálico en un solvente inerte y bajo reflujo. Estas hidroxicetonas se denominan aciloínas y las reacciones de condensación pueden formarse de manera intramolecular e intermolecular. OMe 1) Na, NH3, eter H3C + 2) H , H2O O H3C O H3C OH + 2 MeOH La reducción bimolecular de cetonas a pinacoles, es una de las pocas reacciones radicalarias de utilidad sintética, debido a la aptitud de estos pinacoles de participar de reacciones de transposición, denominada transposición pinacolínica para producir teralquilcetonas. HO H3C O H3C OH Mg(Hg) benceno H3C H3C CH3 CH3 H + H3C CH3 H3C H3C O ter-alquilcetonas Los compuestos reunidos bajo la denominación de ácidos oxocarboxílicos que comprenden los aldehidoácidos y los cetoácidos, tienen una gran importancia en la serie alifática y tanto por su relación bioquímica con los oxácidos, como por las reacciones de síntesis que pueden producirse a partir de ellos o de sus derivados, constituyen un importante grupo de compuestos orgánicos, sobre los cuales se están trabajando intensamente en los últimos tiempos. 65 Wilbert Rivera Muñoz [email protected] Los ácidos α-hidroxicarboxilicos, cuando son desconectados, también generan un sintón ilógico, como el ión cianuro. El grupo ciano o nitrilo, por hidrólisis básica, seguida de neutralización, genera el grupo carboxílico de los ácidos. 1,2-Dioles . Los 1,2-dioles, tienen en las olefinas los mejores precursores para su preparación, sólo dependerá de la estereoquímica del diol en cuestión, para recurrir a una de las reacciones especificas resumidas en el cuadro adjunto. En realidad los epóxidos también permiten obtener otros compuestos 1,2 dioxigenados, cuando es abierto por un nucleófilo como los alcóxidos por ejemplo. Los aldehídos y cetonas, también sirven como moléculas precursoras para preparar los epóxidos, cuando son tratados con iluros de azufre. OH H3O HO O + . . . OR mCPBA OsO 4, FeCl3 . KMnO4, H2O t-BuOH . . . . HO . HO ROH . OH . OH HO . CH3 CH 3I + CH 3SCH3 H3C BuLi + S I H2C THF S(CH 3)2 CH3 H3C O + S (CH 3)2S + O CH3 O Electrófilos “ilógicos” Las moléculas 1,2-dioxigenadas, también pueden construirse empleando electrófilos ilógicos; los reactivos mas importantes de este tipo son los compuestos carbonílicos alfahalogenados obtenidos por halogenación de la forma enólica de un compuesto carbonílico. La halogenación de cetonas, permite obtener compuestos 1,2 difuncionalizados, debido a que el halógeno es un buen grupo saliente y puede sustituirse fácilmente con otros nucleófilos. El mecanismo de reacción implica la formación de un enol termodinámico. O H3C CH3 O Br2 HAc O CH3 H3C Nu Br CH3 H3C + Br Nu 66 Wilbert Rivera Muñoz [email protected] Sin embargo, la halogenación de aldehídos y ácidos no resulta tan simple, debido a los bajos rendimientos, por lo que se han ideado alternativas de halogenación muy interesantes. Otro método para obtener α-hidroxiácidos, consiste en la hidrólisis de α-haloácidos (reacción de Hell-Volhar-Zelinsky) COOH Br2 H3C COOH H3C P4 COO OH H C 3 Br H3 O HO + COOH H3C OH 6. 2. Modelo 1,4-dioxigenado En este modelo, la desconexión también conduce a un sintón lógico y a otro sintón ilógico (no natural), que puede ser un nucleófilo o un electrófilo, cuyo equivalente sintético, tiene que ser todavía reelaborado adecuadamente, para poder ser utilizado en la reacción química. 6.2.1. Compuestos 1,4-dicarbonílicos 6.2.1.1. Compuestos 1,4- dicetónicos La desconexión de estos sustratos puede conducir a: a. Un sintón aniónico lógico y un sintón catiónico ilógico O R1 O R2 CH2 1, 4 -diCO R1 H2C O R2 O El equivalente sintético del anión es el ión enolato o el mismo enol del compuesto carbonílico. En cambio el equivalente sintético para el carbocatión es el alfa halocarbonilo b. Un sintón catiónico lógico y un sintón aniónico ilógico El equivalente sintético del sintón catiónico lógico es el compuesto carbonílico α, β– insaturado. O O 1, 4-diCO R1 R1 CH 2 R2 R2 O O NO 2 R1 CH2 O R2 , base Un equivalente sintético para el sintón aniónico puede ser un anión o nitroalcano 67 Wilbert Rivera Muñoz [email protected] 6.2.1.2. Compuestos 1,4-cetoésteres Los γ- cetoésteres, los 1,4diésteres y los 1,4diácidos se pueden desconectar a un sintón catiónico natural, cuyo equivalente sintético es un compuesto carbonílico α, β insaturado, y al sintón aniónico no natural (-) O R1 1, 4-diCO OR2 OR2 R1 CH 2 O R2 O R1 CH2 C N O COOR, cuyo equivalente sintético es el ion cianuro. Proponer un diseño de síntesis, a partir de materiales simples y asequibles para las siguientes moléculas: MOb 35 MOb 36 O CH3 MOb 37 O MOb 38 O COOEt Ph O O O O CH3 COOH Análisis. La Mob 35 puede desconectarse según el modelo 1,4-diCO. La ciclopentanona precursora, deberá de controlarse para que su Cα, sea más nucleófilo, para una reacción con alto rendimiento con el α.bromoacetona O Br O 3 1 4 C-X 1, 4-diCO CH3 + Ph H3C CH3 O O O MOb 35 AGF O O O 1 1, 3-diO CH3 3 CHO 1, 4-diCO CH3 + CH 3CHO Br 4 Síntesis. Se controla y garantiza la nucleofilicidad de la ciclopentanona, utilizando LDA, para llegar a la Mob 35 68 Wilbert Rivera Muñoz [email protected] O O H3C HAc 1) EtONa, EtOH Br NHMe2 CH3 1) CH3 O CH 3CHO OLi O Br2 CH3 NMe2 2) H 3O + 1) H 2/Pd,C Br 2) LDA/THF EtONa MOb 35 2) H 2O H2C Análisis. El modelo 1,4-diCO, que presenta la Mob 35, permite también encarar su desconexión, tomando en cuenta la reacción de Michael, sobre una cetona vinílica, que se puede preparar por la reacción de Mannich, seguida de la eliminación de Hoffmann. O O O 1 4 3 Ph IGF CH2 Ph 1, 4-diCO HNO 2 Ph + + O 2N O MOb 35 NO 2 O O PhCH2Cl Mannich O O Hofmann H3C CH3 CH3 Br O CH3 + CHO CH3CHO Síntesis. La última etapa, para llegar a la Mob 35, requiere de la utilización de la reacción de Nef. O H3C Br2 CH3 O O HAc Mannich EtONa Br O O CH3 NMe2 H2/Pd-C EtOH H3C CH3 1) MeONa/MeOH O PhCH2Cl Ph HNO 2 MOb 35 2) H 2SO 4 /MeOH - 35ºC O 2N El uso de nitroalcanos o nitroarenos, genera como producto cetonas, por la reacción de Nef, razón por la cual esta metodología solo es aplicable a compuesto 1,4-cetoésteres, 1,4cetocetonas y 1,4-cetoaldehidos. 69 Wilbert Rivera Muñoz [email protected] Análisis El ácido carboxílico de la MOb 36, debe transformarse en un grupo éster estable, luego desconectar por el epóxido, se debe entender que el doble enlace del anillo es más reactivo a la epoxidación, que el otro grupo. La desconexión α,β-insat CO, permite formar una estructura más fácil de desconectar por los modelo dioxigenados presentes en la molécula intermedia HCHO O H3C H3C O H3C O CH2 O H3C IGF O CH2 H3C 1, 3-diO C-O CH2 H3C H3C COOH MOb 36 + O H3C COOEt COOEt COOEt 1, 3-diO O O O H3C CH3 O O OEt + H3C H3C H3C Br H3C 1, 4-diCO + 1 O 4 1, 3-diCO H3C COOEt H3C COOEt COOEt Síntesis. El único cuidado que se debe tener en esta síntesis e la epoxidación del doble enlace anular, más reactivo que el doble enlace vinílico, luego las reacciones para llegar a la síntesis de la Mob 36, son conocidas en sus altos rendimientos. O H3C O H3C OEt + EtONa H3C COOEt H3C H3C O NaH EtONa O O H3C O O COOEt EtOH Br H3C H3C COOEt CH3 H3C 1) NaH 2) HCHO O H3C H3C MOb 36 CH2 O COOEt + 3) H refl. O MCPBA CH2 CH 2Cl 2 H3C COOH H3C COOH 70 Wilbert Rivera Muñoz [email protected] Análisis: La desconexión de la Mob 37, por O O (a) requiere que el enolato de la ciclohexanona provenga de una enamina, de lo contrario se corre el riesgo de que se produzca la reacción de epoxidación de Darzens. La desconexión por (b), también podría generar un electrófilo ilógico, el ión CN- . Y la cetona vinílica requerida, puede prepararse por la reacción de Mannich, seguida de una reacción de eliminación de Hofmann. Ambas desconexiones son muy Br OEt OEt + b a a O O MOb 37 O b CH 3COOEt O CH2 + C N útiles para probarlas en el laboratorio Síntesis: Se sigue la desconexión (a). La hidrólisis al final debe ser controlada, para no afectar al grupo éster de Mob 37 Br O NEt 2 NEt 2 Br OEt O OEt NHEt 2 H H3O O + OEt + O O MOb 37 Análisis: La mejor opción es la funcionalización del anillo pequeño de la Mob 38,, para iniciar con la desconexión, que origina un precursor 1,4-diCO y cuyo tratamiento ya se ha estudiado varias veces O O a,b IGFs O CH3 1 4 1, 4 -diCO O + Br O 3 MOb 38 CH3 Síntesis. Se recurre nuevamente a la enamina de la ciclohexanona, para desplazar el halógeno de la cetona. El compuesto 1,4- diCO formado, se cicla en medio básico. O O 1) N H H H3C O Br CH3 O + + 2) H 2O/H EtONa EtOH MOb 38 H2 Pd-C Zn(Hg) O O HCl 71 Wilbert Rivera Muñoz [email protected] 6.2.1.3. Compuestos -hidroxicarbonílicos Un compuesto γ-hidroxicarbonílico corresponde al modelo 1,4-diO, razón por la cual, la desconexión del mismo, proporciona un sintón aniónico lógico y un sintón catiónico ilógico, cuyo equivalente sintético puede ser un epóxido HO HO R CH 2 R R1 O + R1 H2 C O O R CH2 R1 O enol o enolato epóxido MOb 39 O Como podría sintetizarse la siguiente molécula? Ph OH Análisis. La desconexión del modelo γ-hidroxi carbonílico, Mob 39, origina la ciclohexanona como molécula precursora y un epóxido aromático. Se tiene que buscar el enol o enolato de la cetona, que active su OSiMe3 O Ph 1, 4-diO Ph + O OH MOb 39 Cα, para aperturar el epóxido por el lado menos impedido. O Síntesis. El silienol éter, es un potente nucleófilo, capaz de atacar a un epóxido por el lado menos protegido, en medio ácido y catalizado por sal de Ti (IV). OSiMe3 NEt 3 O Me3SiCl Ph 1) TiCl4 2) H 3O Ph MCPBA Ph CH2 + OH MOb 39 O 6.2.2. Otras estrategias que utilizan sintones “ilógicos” 6.2.2.1. Adición de triple enlace La adición de un triple enlace, como grupo funcional, entre dos funciones oxigenadas en posición 1,4, permite trabajar con una desconexión basada en la química de los acetiluros. 72 Wilbert Rivera Muñoz [email protected] Proponer un plan de síntesis para la MOb 40: Análisis. Una primera IGF en la Mob 40, permite comprender la adición necesaria de instauraciones hacia un grupo acetiluro central, que tuvo que combinarse necesariamente con dos precursores carbonílicos. CH3 O OH OH 1) IGF H3C CH3 2) AGF O O C-C H3C HC CH H H CH3 H3C O CH3 CH3 CH3 MOb 40 IGF O OH IGF H3C H3C CN Br IGF IGF H3C H3C CH3 CH3 CH3 CH3 HO OH OH Síntesis. El 1) nBuLi, THF 1) nBuLi, THF CH H C H C CH 3 diacetiluro o O O 2) 2) H3C CH3 acetiluro por CH3 etapas, se CH H 3 H H2 Pd/C H3C CH3 combina con CH3 CH3 OH moléculas de aldehídos H3C CH3 diferentes, se 1) NaBH4 O hidrogenan la HO 2) PBr3 molécula H3C CrO 3/H2SO4 3) NaCN intermedia CH3 4) DIBAL-H MOb 40 formada y seguidamente se oxida los grupos alcohol del mismo, al compuesto dicetónico, Mob 40. Las γ-lactonas, pueden también prepararse de manera análoga, como se muestra a continuación: HO O OH COOH R O O R OH O R HC H CH + CO 2 R 6.2.2.2. Adición del grupo COOR como grupo activante La adición del grupo COOR, además de activar el sintón aniónico, facilita la desconexión de una molécula 1,4 diX. Sintetizar la MOb 41, a partir de materiales simples: H3C Br O MOb 41 73 Wilbert Rivera Muñoz [email protected] Análisis. La Mob 41, es transformada en un γ-hidroxicarbonílico y se adiciona un grupo éster en el Cα de la molécula precursora, para luego desconectar como 1,4-diO. Los siguientes pasos ya son conocidos. EtOOC H3C H3C Br IGF H3C OH AGF OH O O O MOb 41 1, 4-diO EtOOC 1, 3-diCO H C 3 + CH3COOEt CH 3COOEt + O O EtOOC CH 3COOEt CH 3COOEt EtOOC 1) H3C O , EtONa 2) H3O EtONa H3C OH + O 1) H 3O O + 2) calor H3C Br PBr3 MOb 41 H3C O OH O Síntesis. El acetoacetato de etilo es un nucleófilo que abre al epóxido en medio básico. El grupo éster se hidroliza y descarboxila para llegar a la Mob 41 Proponer un plan de síntesis para las siguientes moléculas: MOb 42 MOb 43 O MOb 44 CH2 H H3C O EtOOC OMe O H3C CH3 H3C O MOb 45 MOb 46 Ph CH3 CH3 O O MOb 47 HO H OH H3C O O COOMe OH 74 Wilbert Rivera Muñoz [email protected] Análisis. La desconexión 1,3-diO de la Mob 42, conduce a un precursor 1,4-diCO, que puede desconectarse convencionalmente o previo un IGF de la misma, transformarlo en una estructura precursora, que por la oxidación de Wacker, forme el compuesto dicarbonilico. O O Br CH3 1, 3-diO H3C H3C CH2 IGF H3C CHO CHO H3C H3C CH3 CH2 H3C CHO H3C 1, 4-diCO MOb 42 O + Br CH3 H3C CHO CH 3CH 2CHO H3C + CH 3Br Oxidación de Wacker: PdCl2, CuCl2, O2 , DMF, H2O Síntesis. El bromuro de alilo alquila el aldehído, el producto se oxida y luego se cicla en medio básico, para formar la MOb 426 O H3C H3C CH2 1) EtONa CHO H3C 2) Br CH2 H3C CHO oxidacion de Wacker CH3 H3C EtONa EtOH MOb 42 CHO H3C Análisis. La lactona, Mob 43, se abre, para originar un γ-hidroxiácido, que por IGFs, llega a un 1,4-cetoéster, que se desconecta conforme al modelo. La ciclohexenona se forma por la anelación de Robinsón y la 1,5-diCO se prepara a partir de la reacción de Michael 6 Georg Wittig (1897-1987) Químico alemán, nació en Berlín y murió en Heidelberg. Estudió en las universidades de Tubinga y Marburgo y se doctoró en esta última en 1926. Enseñó en la Universidad Técnica de Brunswick desde 1932, en la de Friburgo a partir de 1937, en el Instituto de Física de Tubinga desde 1944, y en Heidelberg, donde ocupó la cátedra de química orgánica, desde 1956 hasta su jubilación. En 1979 fue galardonado con el premio Nobel de Química, compartido con el estadounidense Herbert Ch. Brown, por la realización de los llamados «reactivos de Wittig», empleados en un método de olefinación por él inventado que permite nuevas posibilidades para sintetizar las sustancias biológicamente activas. 75 Wilbert Rivera Muñoz [email protected] H3C H3C O O H3C OH C-O O 1 COOH IGFs COOEt 4 2 3 CH3 CH3 CH3 MOb 43 1, 4-diCO O H3C CH3 O + CH3 H2C CH3 H3C O 1, 5-diCO a 3 b O HCHO H3C + O H3C 1, 3-diO 5 O COOEt + a H3C H3C 1 b Br CH3 CH3 1, 5-diCO O O CH3 O CH3 + + CH3 CH3 CH2 CH 3Br CH3 Síntesis. La enamina con carbono secundario, se obtiene utilizando una amina secundaria voluminosa. El compuesto 1,5-diCO, se cicla por anelación de Robinson y luego en medio básico se hace reaccionar con el α bromo éster. El compuesto dicetónico resultante se reduce con LiAlH4 y luego en medio ácido se forma la lactona Mob 43 H3C O H3C O 1) EtOH/EtOH 2) HCHO CH3 CH2 H3C O H3C 1) EtONa O O 2) H 3O N H H3C O EtONa O CH3 O EtOH CH3 + CH3 N CH3 H3C CH3 COOEt 1) EtONa Br H3C H3C O H H3C OH + COOH O LiAlH4 COOEt THF O CH3 CH3 CH3 MOb 43 Análisis. El primer IGF de la Mob 44, lo transforma en el precursor 1,3-diCO, la desconexión de esta última molécula, genera un precursor con dos relaciones 1,4-diCO, se continúa con la desconexión indicada, que requerirá el uso de un bromuro de alilo. 76 Wilbert Rivera Muñoz [email protected] CH2 CH2 CH2 CH2 OMe IGF EtOOC 3 O 1, 3-diO O O 1, 4-diCO 2 EtOOC 1 3 EtOOC 2 4 OEt EtOOC 1 CH3 1 Br + 4 OEt CH3 O O MOb 44 CH3 O CH3 isomerización CH2 EtOOC + O 1, 4-diCO OHC + EtOOC CH3 EtOOC CH3 Br O CH3 Síntesis. Es una secuencia de condensaciones del tipo aldólico o la de Claisen. Para llegar a sintetizar la Mob 44. 1) EtONa CH3 CH2 EtOOC AlCl3 2) H3C calor COOEt 2) CH 3CHO CH2 1) NaH COOEt CH3 Br COOEt Br O CH2 O 1) EtONa CH2 COOEt CH2 OH O EtONa EtOOC EtOOC COOEt EtOOC CH3 Me2SO4 O O O MOb 44 Análisis: La desconexión de la función lactona de la MOb 45, inicia la serie de desconexiones La funcionalización del grupo oxidrilo al carbonilo, permite luego se proceda con la reacción de Michael y la anelación de Robinsón. CH3 CH3 CH3 CH3 CH3 4 COOEt CH3 3 C-O COOEt IGF 2 O 1 O OH O MOb 45 CH3 CH3 CH3 H2C SGF CH3 CH3 1, 5-diCO 3 + O 5 O CH3 CH3 CH3 CH 3Br Br CH3 1, 3-diO + O O CH3 O 1 AGF COOEt + 1, 3-diO 1 O 1, 4-diCO CH3 O 3 CH3 CH3 O 1, 5-diCO CH3 O 5 O CH2 + H3C O 77 Wilbert Rivera Muñoz [email protected] Síntesis: Todas las reacciones utilizadas, está vinculadas a las condensación de Michael, anelación de Robinson y la reacción de formación de ésteres de Fischer, permite obtener la lactona, es decir la MOb 45. CH3 O 2) H3C O CH3 1) EtONa CH3 CH3 CH3 H2/Pd,C EtONa EtOH CH3 O 1) LDA 2) CH 3Br O O O CH3 CH3 CH3 CH2 CH3 CH3 CH3 1) LDA, T HF EtONa 2) H2C EtOH O O O CH3 O 1) LDA 2) Br CH3 O COOEt COOEt CH3 CH3 CH3 CH3 CH3 CH3 COOEt LiAlH4 THF H3O + O calor O OH O MOb 45 Análisis. Se sigue la desconexión 1,4-diCO, porque permite dividir en dos partes la MOb 46. Se continúa con la desconexión 1,3- diCO, seguido de la desconexión α,β-insaturado CO, para finalizar con la desconexión retroNef. Ph Ph 1, 4-diCO H3C 2 1 O Ph H H H 1, 3-diCO H3C H3C COOEt O 3 O O O Br 4 COOMe 1, 3-diO MOb 46 COOMe Ph Ph retroNef O + O 2N H COOEt + CH3 O O Síntesis. El nucleófilo del nitroareno, se adiciona según Michael a la ciclopentanona α,βinsaturada. El grupo nitro se transforma en C=O, por la reacción de Nef. El compuesto 78 Wilbert Rivera Muñoz [email protected] dicarbonilico se hace reaccionar con el enolato del propanoato de etilo, se sigue con la reacción de Dieckmann, y las reacciones necesarias para llegar a la MOb. 46. COOEt Ph Ph Ph , EtONa CH3 Nef 1) EtONa 2) H O O 2N O 2N Ph O H O Ph O H EtONa H3C H3C COOEt Dieckmann 1) EtONa Ph H 2) MeOOC O O Br O H3C O O COOMe MOb 46 Análisis. La MOb 47, es un polialcohol, que por un IGF, se transforma en grupo oxigenados adecuados, para mostrar que existen 2 relaciones 1,4-diCO y una 1,5-diCO, que no es posible aplicarlo porla imposibilidad de ubicar un doble enlace conjugado con un C=O. Se desconecta por ambos 1,4-diCO y se continúa con los IGfs necesarios hasta llegar a materiales de partida simples, como el benceno y el anhídrido malónico HO OH 1 COOEt 2 4 IGF 2 1, 4-diCO 3 OH COOEt COOEt 5 4 Br + O O MOb 47 OH IGF IGF IGF OH IGF O O C-C HOOC C-C + O O O Síntesis. La síntesis de la MOb 47, no requiere de ninguna estrategia extraordinaria, como puede verse, las reacciones involucradas en la misma son, aquellas conocidas y para las cuales los mecanismos y rendimientos en el laboratorio son manejables positivamente. Así se puede partir del benceno y el anhídrido malónico 79 Wilbert Rivera Muñoz [email protected] O O + O HOOC ác. polifosfórico 1) Zn(Hg) HCl 2) HF seco O NaBH4 OH O OH POCl3 H2SO4 diluido HO CrO 3/H2SO4 OH COOEt COOEt 1) LDA/THF LiAlH4 O COOEt 2) O 2 THF OH Br MOb 47 6.2.3. Compuestos 1,2 y 1,4 difuncionalizados por reconexiones Otro método que produce compuestos 1,2 y 1,4-difuncionalizados consiste en la ruptura oxidativa de enlaces dobles por el ozono para generar dos carbonilos, que variarán de acuerdo a las condiciones de reacción. Así, la ozonólisis, seguida del dimetilsulfuro (Me2S) genera aldehídos, del peróxido de hidrogeno ácidos y del borohidruro de sodio alcoholes. La estrategia, consiste en la reconexión de los carbonos oxigenados (alcoholes, aldehídos, cetonas o ácidos), en las relaciones de distancia, 1,2 y 1,4 diO, para formar el correspondiente alqueno del cual se supone derivaron por la reacción de ozonólisis. MOb 48: MOb 49: O H Proponer un diseño de síntesis para las Ph O H C siguientes moléculas : OH 3 O O H3C Análisis. La MOb 48 es un éter olefínico no simétrico y con el grupo aldehído en un extremo, razón por la cual, se puede asumir que el mismo es resultado de la apertura de un doble enlace por ozonólisis seguido de la reacción con Me2S. Ph O H H O O MOb 48 Ph recon O Ph O Ph AGF O H C-O Ph OH Br Ph HO Ph Br C-C CH2 O O HC CH H2C 80 Wilbert Rivera Muñoz [email protected] El doble enlace del precursor se funcionaliza a un alquino interno etéreo simétrico. Los éteres son resultado de la aplicación de la síntesis de Williamson y el diol de la reacción del diacetiluro sobre aldehídos, como material de partida. Síntesis. El diacetiluro se consigue con un exceso de sodamida, que actúa son formaldehído, para dar el alcohol, que se eterifica por Williamson. El alquino se reduce a alqueno, que es abierto por Ozonólisis, seguido de reacción con Me2S para formar el aldehído. HC CH NaNH2 + Na -C C-Na + OH 2 HCHO 1) NaOH O exceso O 2) 2 Ph HO Ph Ph Br H2, Pd (CaSO4 ) Ba(AcO)2 H H 1) O 3 Ph O 2 2) Me2S O O Ph O Ph H MOb 48 Análisis. El grupo ácido carboxílico de la MOb 49, puede orientar hacia una reconexión olefínica. La molécula precursora se funcionaliza a un grupo acetileno interno, lo que hace vislumbrar la reacción de un diacetiluro sobre dos moles de un α, β-insaturado CO, que se consigue por la condensación aldólica del formaldehído con la acetona en medio básico. H3C O O O H3C OH reconexion acido O H3C H3C IGF H3C H3C MOb 49 O IGF CH3 OH H3C CH3 HO O C-C O CH2 + O C-O CH3 O H3C CH3 O H3C H3C CH3 O 1, 3-diO HC CH + H2C CH3 HCHO + H3C CH3 Síntesis. El acetiluro se puede preparar con nBuLi de manera secuencial, cuando se requiera de dicho grupo para adicionarse según Michael al compuesto α,β-insaturado CO. 81 Wilbert Rivera Muñoz [email protected] El intermedio se reduce a alcohol con NaHB4, y el acetileno se reduce hasta el alqueno, que será tratado por ozonólisis oxidativa, para formar la MOb. 49 O O HC CH nBuLi HC C-Li + H2C CH3 HC CH3 O nBuLi THF THF + Li -C CH3 O OH O HO H2C CH3 O NaBH4 H3C CH3 H3C H2, CaCO3 Pd(AcO)2 CH3 CH3 O OH CH3 O CH3 CH3 1) NaH CH3 1) O 3 2) CH 3Br CH3 2) H 2O 2 CH3 2 HOOC MOb 49 O OH H3C PROBLEMAS Proponer un plan de síntesis, partiendo de materiales simples y económicos, para cada una de las siguientes moléculas: 1 2 3 O 4 O O CO 2Me CO 2Me COOH H3C CH3 H3C CO 2Me Ph H3C H3C OH CH3 5 5 7 8 CH3 O O O HO COOH CH2 H3C H3C H3C Br O H3C CH3 82 Wilbert Rivera Muñoz 9 MeO [email protected] 19 O 11 CH3 12 O H3C O CH3 CH3 H3C OH O CH3 CH3 O COOMe COOEt O O 13 14 15 MeO 16 83 Wilbert Rivera Muñoz [email protected] CAPÍTULO 7 COMPUESTOS 1,6-DIFUNCIONALIZADOS “La verdadera grandeza de la ciencia acaba valorándose por su utilidad”. G. Marañón Los compuestos 1,6 difuncionalizados, preferentemente utilizan la estrategia de la reconexión para su respectiva síntesis; esta estrategia, puede muy bien combinarse con la reacción de Diels-Alder, que en general forma como productos, aductos olefínicos de seis eslabones o la reducción de Birch de anillos bencénicos, que igualmente genera productos olefínicos de seis eslabones 7.1. Compuestos 1,6 dioxigenados O R R 1, 6-diCO 1 6 3 5 R1 R1 O La ozonólisis nuevamente es la reacción mas adecuada para romper el doble enlace y formar compuestos carbonílicos diversos, en función de las condiciones de la reacción. Proponer un diseño de síntesis para las siguientes moléculas orgánicas: MOb 50 MOb 51 MOb 52 OMe H H MeOOC O H3C O H3C MeOOC H3C CH3 MeOOC H O H OMe MOb 53 MOb 54 COOH MOb 55 CH3 CH3 COOH COOH H O O O CHO COOH H3C O CH3 H3C CH2 H3C O Análisis: Se desconecta por la función lactona de la MOb 50, la molécula precursora formada, a su vez, se plantea su formación a partir del diácido carboxílico en posición 1-6. Los cuales se reconectan para dar origen al alqueno que los produjo por reacción de 84 Wilbert Rivera Muñoz [email protected] ozonólisis oxidativa. El alqueno formado es un típico aducto de de Diels –Alder, entre el ciclopentadieno y el crotonaldehido H H 3 H C - O MeOOC 1 HOOC OH 2 4 OH 5 O MeOOC COOMe H H COOH 6 IGF H O MOb 50 1 IGF 6 retro D-A 2 1 HOOC reconexion H HOOC 6 H H 3 5 4 H H H CH2 HO CHO HO + CHO Síntesis: La reacción de Diels-Alder entre el ciplopentadieno y el aldehído α,β-insaturado, proporciona el aducto alqueno, para su correspondiente apertura por ozonólisis oxidativa, previa una reacción de protección del grupo aldehído, que posteriormente se desprotege, para ser reducido a la función alcohol. Este alcohol, reacción con el grupo éster en medio ácido, para formar la lactona deseada, MOb 50 OH CH2 + hv H H CHO 1) O 3 OH 2) H 2O 2 + H HOOC HOOC O O CHO O O 1) Na 2CO 3 MeOOC NaBH4 MeOOC MeOH TsOH MeOOC H2O MeOOC O CHO O HO H H H3O MeOOC 2) MeI MeOOC MeOOC OH + O MOb 50 MeOOC COOMe H H O Análisis: Se proyecta la molécula precursora de la MOb 51, hacia un diácido, el cual pudo haberse obtenido por ozonólisis oxidativa a partir de una molécula olefínica de seis eslabones. El éter por sucesivas IGFs, se funcionaliza a un compuesto carboxílico, 85 Wilbert Rivera Muñoz [email protected] resultado de la hidrólisis ácida de una función anhídrido. Este último, es un aducto típico de la ciclación de Diels-Alder OMe OMe OMe H H IGF MeOOC OH H HOOC H reconexión IGF HOOC MeOOC H H H H OMe OMe OMe OH MOb 51 IGF O O H H CH2 r- D - A + COOH IGF O O CH2 COOH H H O O Síntesis. Por la reacción de Diels-Alder, se forma el aducto anhídrido cíclico, que luego de ser hidrolizado es reducido al respectivo alcohol, que por Williamson se transforman en éteres. El ciclohexeno se abre por ozonólisis oxidativa y los grupo ácidos reaccionan en medio ´-acido con el alcohol metílico para transformarse en la MOb 51 O CH2 + OH O H H O hv H3O O H COOH + LiAlH4 THF CH2 COOH H O H OH 1) NaH 2) MeI OMe OMe H MeOOC H O OMe H MeOH MeOOC H H + H HOOC 1) O 3 HOOC 2) H 2O2 H OMe H OMe OMe MOb 51 Análisis: Inicialmente se desconecta la MOb 52, siguiendo el modelo α,β-insat. CO, originándose así, una molécula precursora con relación 1,6-diCO, que puede ser reconectado a un hexacicloalqueno disustituído, que se funcionaliza a otra molécula α,βinsat CO para su desconexión y la generación de un equivalente sintético con relación 1,5diCO. Esta molécula precursora, se continúa desconectando y aplicando IGFs relativamente sencillos hasta llegar a los materiales de partida simples y asequibles, como la cetona y el alcohol etílico. 86 Wilbert Rivera Muñoz [email protected] CH3 CH3 H3C O CH3 H3C 1, 3-diCO H3C CH3 O CH3 reconexi ón 6 3 H3C H3C 6 CH3 CH3 CHO 1 MOb 52 AGF CH3 CH3 CH3 CH3 H3C CH3 H3C 1, 5-diCO O 1 CH3 CH3 CH3 H3C 1, 3-diCO H3C 5 CHO 3 + CH3 1 3 O O CHO 1, 3-diCO H3C CH3 H3C CHO CH3 + H3C H3C IGF CH3 CHO H3C H3C IGF CN IGF CH3 H3C CH3 Br H3C OH AGF O CH3 CH 3MgBr H3C Síntesis: La acetona, permite formar el intermediario t-Butilformaldehido, que en medio básico y etanol, se condensa con el etanal. Al producto, α, β-insat CO formado, se adiciona el enolato de la butanona, el mismo medio básico permite la ciclación intramolecular. O CH 3MgBr/THF H3C H3C 2) H 3O CH3 OH 1) PBr3 + 2) KCN H3C H3C H3C CH3 CH3 CN DIBAL-H H3C CHO H3C THF CH3 1) CH 3CHO/EtONa CH3 CH3 CH3 CH 3COCH 2CH 3 EtONa H3C EtOH 2) EtOH CHO CH3 H3C CHO EtONa H3C H3C CH3 CH3 CH3 O O Zn(Hg)/HCl CH3 H3C CH3 H3C CH3 H3C 1) O 3 CH3 2) Me2S CH3 H3C CHO O EtONa H3C EtOH O CH3 H3C MOb 52 Luego el C=O se transforma en –CH2, por reducción. El cicloalqueno producido se abre por ozonólisis en Me2S. Y nuevamente se cicla en medio básico para obtener la MOb 52. 87 Wilbert Rivera Muñoz [email protected] Análisis: Se empieza por la desconexión de las lactonas de la MOb 53, El precursor generado presenta varias relaciones di Oxigenadas, se toma la reconexión del 1,6dicarboxílico y los grupos de esta molécula se estabilizan, como cetona y éster respectivamente. Ahora se procede a una desconexión retro Diels-Alder. En el dienófilo se desconecta por el doble enlace. La butanona se prepara a partir de un acetileno terminal y éste último a partir de un haluro de etilo y acetiluro sódico 6 COOH 5 COOH CH3 6 1 CH3 1 HOOC C-O O O O lactonas O 5 4 3 4 3 reconx COOH HO CH3 COOH H3C OH CH3 OH HO CH3 MOb 53 IGFs EtOOC CH2 CHO + HC IGF H3C + CH2 1, 3-diO H3C O r-D-A COOEt COOEt H3C H3C O H3C H3C H3C C-C O Br + HC C-Na + CH3 Síntesis. Luego de la apertura del ciclohexeno, por ozonólisis oxidativa, La hidrólisis ácida del grupo éster que queda y la correspondiente formación del hidrato cetónico, es suficiente para la formación de las lactonas y el correspondiente cierre del ciclo, para producir la MOb 53. H3C Br HC C-Na HgSO4 H3C + H2SO4 O H3C 2) EtOOC H3C CH3 COOEt 1) H 3PO4 CHO HC O H3C CH2 calor CH3 CH3 H O O O O CH3 CH2 COOH COOH 1) O 3 + HOOC H3C COOEt O 2) H 2O 2 COOEt H3C O H3C MOb 53 Análisis: La desconexión por el doble enlace de la MOb 54, permite generar un precursor con relación 1,6-diCO, que puede ser reconectado para formar un ciclohexeno, aducto típico en las reacciones de Diels-Alder, por lo cual se ejercita un retro-D-A, para llegar a los materiales de partida simples. 88 Wilbert Rivera Muñoz [email protected] CH3 CH3 1 1, 3-diO 3 CHO reconexión O 4 CHO 6 5 CH3 1 4 H2C 6 retro-D-A CH3 H3C CH2 CH2 H3C CH2 MOb 54 H2C H2C CH3 + H2C CH3 Síntesis: La reacción de Diels-Alder entre dos moléculas de 2-metil butadieno, forma un aducto que con HMCPBA forma un epóxido con el centro más reactivo. Por hidrólisis ácida del epóxido se forma un diol que es oxidado por ácido periódico, hacia un compuesto 1,6-diCO. Se protege el grupo CHO con una enamina, al mismo tiempo de activar su C alfa, para una condensación en medio ácido, se calienta el sistema y se obtiene la MOb 54 CH2 H2C H2C O calor + CH3 CH3 CH3 PhCO3H H2C H2C H2C CH3 CH3 CH3 H3O CH3 O N H N CH2 OH CHO H3C HAc OH HIO 4 O HAc H3C H3C CH3 + CH2 H2C CH3 CH3 CH3 N HAc CHO MOb 54 calor H3C CH2 H3C CH2 Análisis: La síntesis de la MOb 53, permite proponer las desconexiones que se detallan, para la MOb 55. 89 Wilbert Rivera Muñoz [email protected] COOH H3C COOH reconexión CH2 COOH COOH H3C CH2 H3C H3C O H3C COOH + H3C O O H3C MOb 55 + H3C OHC COOH O Síntesis. Las reacciones que se indican ya fueron estudiadas, en la síntesis de la MOb 53. H3C CH2 H3C COOH 1) H3PO4 H3C O 2) OHC COOH H C 3 O COOH CH2 SnCl4 H3C 1) O 3 O 2) H 2O 2 COOH COOH COOH MOb 55 H3C 7.2. O Oxidación de Baeyer–Villiger Asimismo, otra reacción asociada a la estrategia de reconexión, es la oxidación de cetonas por peroxiácidos, mas conocida como reacción de Baeyer-Villiger. En cetonas cíclicas, la oxidación con perácidos, genera lactonas. Los grupos unidos a las cetonas asimétricas, poseen una aptitud migratoria, que permite, en términos literales, “ insertar un átomo de oxigeno” entre el grupo carbonilo y el grupo migrante, produciéndose así, un éster o una lactona. Se debe tomar en cuenta, que las enonas (cetonas α, β insaturadas) no son buenos sustratos para la oxidación de BaeyerVilliger, en razón a que el alqueno es mucho mas reactivo que la cetona. Sin embargo hay estructuras especiales donde el alqueno puede ser protegido por un sustituyente cercano por el efecto estérico y orientarse de este modo el ataque del peracido hacia el grupo carbonilo. O O MCPBA CH2Cl 2 …… O O CH3 O CH3 MCPBA CH 2Cl 2 O 90 Wilbert Rivera Muñoz [email protected] La aptitud migratoria de los diferentes grupos, en la reacción de Baeyer-Villiger, es como sigue: H > Ph > alquilo 3º > cicloalquilo > alquilo 2º > alquilo 1º > Me Proponer un plan de síntesis para las siguientes moléculas: …. MOb 57 MOb 56 HO …. MOb 58 CH3 COOH CH3 BnO OH NH2 HO O L-Dopa O OH MOb 59 MOb 60 O O MOb 61 O O O O Ph Análisis. El grupo alfa amino ácido, de la MOb 56, es posible prepararlo por la reacción de Strecker y también uno de los grupos OH del benceno o ambos pueden ser resultado de la hidrólisis de un éster, formado por la oxidación de Baeyer –Villiger, sobre una función cetona El resto de IGFs es de fácil ejecución en base a reacciones básicas H3C HO COOH O O COOH IGF NH2 HO HO (2R)-2-amino-3-(3,4-dihydroxyphenyl)propanoic acid CH3 MOb 56 NH2 IGF CH3 COOH O CHO Strecker O NH2 IGF CH3 HO HO Br CH 2OH O HO r-F-C CH 2OH IGFs + O HO HO 4-(2-hydroxyethyl)phenol 4-bromophenol Síntesis. Para la formación del Grignard requerido, se protege el OH orto del benceno. La síntesis de Strecker, de alfa amino ácidos, seguido de la oxidación de Baeyer-Villiger y la posterior hidrólisis ácida del grupo éster conduce a la formación satisfactoria de la MOb 56. 91 Wilbert Rivera Muñoz [email protected] CH3 Br 1) Me2SO4 3) O CH 3COCl AlCl3 HO HO 4) HBr/H 2O PCC CH3 COOH MCPBA O HO CH3 O H3C CH 2OH O CH 2OH 2) Mg/éter CHO O Strecker HO NH2 HO CH 2Cl 2 O COOH H3O + HO COOH MOb 56 NH2 NH2 HO HO Análisis. La MOb 57 es un alcohol terciario, por lo que puede preparárselo a partir de un éster y un exceso de Grignard, la molécula precursora formada, es un compuesto 1,6-diCO, por lo que se recurre a reconectarlo en un lactona, que puede formarse a partir de una cetona. Esta cetona bicíclica, se funcionaliza con un punto de insaturación para conseguir una estructura de un aducto de Diels-Alder. El grupo carbonilo se puede formar a partir de un compuesto que contiene un grupo nitro, por la reacción de Nef OMe CH3 1 CH3 O 2 OH IGF 3 6 OH 3 4 5 2 4 5 6 OH 1 COOMe reconexión de lactona O O Baeyer-Villiger OH MOb 57 CH2 retro-D-A IGF + NO 2 NO 2 AGF O O Síntesis. Se parte de la reacción de Diels-Alder de un ciclohexadieno y un nitroetileno. El aducto formado se satura, para proceder a la oxidación de Baeyer-Villiger, la apertura de la lactona y la esterificación del grupo ácido, forman un intermediario que puede ser luego tratado con un exceso de Bromuro de fenilmetilo, para obtener la MOb 57 92 Wilbert Rivera Muñoz [email protected] CH2 + 1) calor 2) T iCl3/H2O H2/Pd-C MCPBA CH 2Cl 2 NO 2 O O O 1) H 3O O CH3 + 2) MeOH COOMe CH3 OH COOMe 1) 2 CH3MgBr MOb 57 2) H 3O + OH OH OH Análisis. En la MOb 58, el doble enlace, conjugado con un grupo C=O, puede ser atacado por un perácido para formar un epóxido. Sin embargo cuando existe una protección del doble enlace con un grupo voluminoso cercano, puede evitarse esta reacción y sólo la oxidación de Baeyer- Villiger, afectará al C=O cetónico Bn = Bencil CH2 BnO RGF BnO BnO retro-D-A IGF + O NO 2 O O MOb 58 BnO NO 2 C-O + IGFs CHO BnOK Br Síntesis. El doble enlace, en el aducto de Diels-Alder, puede ser protegido por la utilización del grupo bencilo (Bn). El grupo nitro del dienófilo, se oxida a grupo C=O, por la reacción de Nef, para luego ser oxidado por B-V y así arribar a la MOb 58. CH2 BnO NO 2 BnOK 1) NaBH4 calor 2) PBr3 CHO Br NO 2 BnO Nef cyclopenta-2,4-diene-1-carbaldehyde MCPBA BnO MOb 58 BnO CH 2Cl 2 O O O Análisis. Se procede a desconectar la MOb 59 como 1,3-diCO, lo que origina un precursor 1,6-diCO. No es posible reconectarlo, por lo que se adiciona un grupo –COOEt, para activar el Cα, y así desplazar un haluro de un γ.haloéster. Nuevamente se genera un 93 Wilbert Rivera Muñoz [email protected] intermedio o precursor 1,3- diCO, que al ser desconectado, genera una nueva estructura 1,6-diCO, que ahora es posible reconectarla para llegar al ciclohexeno como material de partida. O O 1, 3-diCO O 4 3 1 2 COOEt 6 5 COOEt AGF COOEt C-C O spiro[4.4]nonane-1,6-dione MOb 59 Br O COOEt reconexión EtOOC 1 COOEt 6 3 + 1, 3-diCO COOEt 4 ethyl 2-oxocyclopentanecarboxylate cyclohexene Síntesis. La apertura oxidativa de un ciclohexeno, permite obtener la molécula precursora que luego de reaccionar con el γ-bromoéster, origina una molécula que fácilmente se transforma, luego de una reacción de Dieckmann, en la MOb 59 O 1) O 3/H2O 2 2) EtOH/H COOEt COOEt COOEt EtONa O + COOEt 1) EtONa COOEt O + 1) HBr 1) H 3O 2) calor Br 2) EtOH COOEt O 3) EtOH/H O PPA = ác. polifosfórico + O COOEt PPA MOb 59 ethyl 4-(2-oxocyclopentyl)butanoate O spiro[4.4]nonane-1,6-dione Análisis. Se supone, que la formación de la MOb 60, se da por la reacción de BaeyerVilliger. El precursor formado se desconecta por el ciclopropano, lo que genera un equivalente sintético α,β-insat.CO, que desconectado forma la molécula precursora. con relación 1,4-diCO. La desconexión de esta última, vislumbra los materiales de partida. O O O O O RGF C-C 1, 3-diO -CH2- + OHC MOb 60 O CHO 1, 4-diCO + 1-bromoacetone Br 94 Wilbert Rivera Muñoz [email protected] Síntesis. El enlato del acetaldehído se combina con el α-bromocetona, para formar una molécula 1,4-diCO, que en medio básico y EtOH, se condensa para formar una ciclopentanona con insaturación α,β. Con la reacción de Simonns-Schmidt, se forma el ciclopropano y una posterior, oxidación de Baeyer- Villiger produce la MOb 60. O O H3C O O Br2/HAc H3C CH3 O-Na H3C EtONa EtOH H3C Br CH 2I 2 + OHC EtONa Zn/CuCl H2C O CHO H O O MCPBA, NaHCO3 CH 2Cl 2 MOb 60 Análisis. Se asume que la MOb 61, fue formada por una reacción de oxidación de BaeyerVilliger de una ciclopentanona. Funcionalizada esta molécula, permite desconectarla como un α, β- insat CO, que puede obtenerse a partir de un nitrilo adecuado, lo que orienta a materiales de partida simples y asequibles. O O O O O 1, 3-diO AGF RGF Ph Ph Ph CHO Ph IGF MOb 61 O CH3 + IGF O O RGF 1, 3-diO HCHO H2C Ph Ph CN HO CH3 C-C PhMgBr Ph + CH3 CH3 O Ph H2C Síntesis. Se toma el propeno y benceno como materiales de partida, la estrategia pasa por H3C MCPBA CH2 H3C O CH 2Cl 2 2) H 3O O HO + CH3 CrO 3 2) HCHO Ph Ph 1) Br2/FeBr3 CH3 H2SO4 1) EtONa PhMgBr EtOH 2) Mg/THF O HCN Ph H2C 1) DIBAL EtONa O O O O EtOH CHO Ph 2) H 2O CN Ph Ph O 2/Pd-C MCPBA Ph CH 2Cl 2 O MOb 61 Ph 6-phenyltetrahydro-2H-pyran-2-one 95 Wilbert Rivera Muñoz [email protected] reducir el nitrilo a CHO con DIBAL en hexano, para formar el intermedio que por anillación (o anelación) de Robinson y posterior saturación, proporcione la ciclopentanona adecuada para oxidarla por el procedimiento de Baeyer-Villiger, para formar la MOb 61. 7.3. Transposición de Beckmann La transposición de oximas en medio acido, denominada transposición de Beckman, produce una amida o latama si la cetona de partida es lineal o cíclica respectivamente. Para mejorar el rendimiento de este tipo de reacciones se han estudiado varios catalizadores y medios ácidos. Así por ejemplo, nuevos medios ácidos utilizados como catalizadores, con el propósito indicado, lo constituyen, el TCT/DMF, DAST/CH2CL2 , CF3SO3H, PCl5, HgCl2/MeCN y el ZnO. ………… DAST: TCT: Cl N Cl F S N N F Cl NEt 2 F Trifluoruro de dietilaminosulfuro Triclorotriazina La aptitud migratoria de los grupos es la misma que en la reacción de Baeyer – Villiger. MOb 62 MOb 63 NH Proponer un diseño de síntesis para cada una de las siguientes moléculas: MOb 64 O CH3 H N O NH O EtO CH3 Ph Análisis. La MOb 62 es una amida que podría prepararse por el reordenamiento de Beckmann de una oxima. Las desconexiones posteriores de la cetona aromática conducen a materiales de partida simples. N O OH H3C H3C NH CH3 C-N retro-Beckmann + O NH 2OH MeO MOb 62 OMe OMe retro-Friedel-Crafts O RGF Cl + IGF CH3 OH OMe 96 Wilbert Rivera Muñoz [email protected] Síntesis. La reacción de la cetona aromática intermedia con NH2OH y su posterior tratamiento con una solución acuosa de ácido sulfúrico y ZnO, permite formar la amida aromática MOb 62. O O H3C CH3 Me2SO4 1) H 2SO4 conc Cl AlCl3 2) KOH fusión OMe OH OMe N OH NH 2OH.HCl H3C H3C NH H2SO4 ZnO O OMe MOb 62 OMe Análisis. La estrategia de síntesis de la MOb 63, se inicia tratándola como una lactama formada por la transposición de Beckmann de una oxima. El resto de desconexiones sencillas conducen a un ciclohexeno como material de partida para la síntesis. O CH3 CH3 HO O N NH C-N r-Beckmann + oxima NH 2OH CH3 IGF 7-(4-methylphenyl)azepan-2-one MOb 63 CH3 O OH CH3 C-C + C-O Br Síntesis. La síntesis de MOb 63, según la estrategia asumida, no presente ninguna reacción de cuidado especial. OH O CH3 OH MCPBA POCl3 CH 2Cl 2 CH3 CH3 2) H 2O Mg Collins THF BrMg CH3 Br O CH3 HO N O NH 2OH NH H2SO4 HCl HgCl 2 2-(4-methylphenyl)cyclohexanone CH3 7-(4-methylphenyl)azepan-2-one MOb 63 97 Wilbert Rivera Muñoz [email protected] La última reacción, muestra el uso adecuado de la reacción de reordenamiento de Beckmann, para la formación de lactamas Análisis. La estrategia del reordenamiento de Beckmann, para la etapa de desconexión de la MOb 64, simplifica ampliamente la síntesis de la lactama. OH H N O O N O AGF IGF r-Beckmann a,b-insat.CO O MOb 64 Ph 5-phenylazepan-2-one Ph Ph Ph O 1 1, 5-diCO CHO O + C-C + Ph CH3 5 3 CH3 CHO CH2 Ph a,b-insat.CO O + H3C HCHO CH3 Síntesis. El benceno es un material de partida adecuado para la síntesis de la MOb 64. Las reacciones implicadas en el diseño propuesto, son suficientemente claras sobre el alcance de las mismas. CH 2OH CHO 1) Br 2/FeBr3 PCC 2) Mg/THF 3) 4) H 3O O CH 2Cl 2 O Ph EtONa CH3 + O CHO O H3C CH3 2) O Ph HCHO CH2 OH O N H N MOb 64 Ph EtONa/EtOH CH3 1) EtONa/EtOH H2/Pd,C O CF 3SO3H NH 2OH ZnO HCl Ph Ph Ph 98 Wilbert Rivera Muñoz [email protected] CAPÍTULO 8 FORMACION DE SISTEMAS HETEROCÍCLICOS “Un constructor o un artista pueden maravillar al mundo con sus obras civiles o artísticas elaboradas a partir de materiales simples. Asimismo el químico, puede producir la misma sensación, cuando a partir de moléculas simples, presenta nuevas moléculas de propiedades y usos diversos, como los polímeros y los fármacos”. W. Rivera En las secciones precedentes, se ha estudiado con suficiente detalle, la aplicación de varias reacciones intramoleculares e intermoleculares para la formación de sistemas carbocíclicos, como por ejemplo, las reacciones de condensación del tipo aldólico, la acilación, la alquilación, la adición, la reacción de ciclación Diles- Alder, las reacciones electrocíclicas, sigmatrópicas, etc. etc. La construcción de sistemas heterocíclicos también utiliza estas mismas reacciones, con la particularidad de que en el sistema heterocíclico debe estar presente o contener al menos un átomo diferente al carbono. Los más comunes son el nitrógeno, oxigeno, azufre y fósforo. El sistema cíclico de la molécula que se desea sintetizar, puede provenir de la modificación de un sistema cíclico presente en alguno de los reactivos implicados en la síntesis o ser el resultado de la ciclación de antecedentes no cíclicos y que ha sido construido en el desarrollo de la síntesis por ciclación intramolecular o por métodos basados en ciclaciones intermoleculares (cicloadiciones). 8.1. Ciclación intramolecular Las reglas generales de desconexión de heterociclos provenientes de una ciclación intramolecular, fueron adecuadamente sistematizadas por J. I. Borrell7, las mismas que se asumen en la presente sección (Het = N, O, S) 1. En la síntesis de un compuesto monociclito, el cierre del anillo supone generalmente la formación de un enlace carbono- heteroátomo. 7 BORRELL J.I. “Introducción al Análisis Retrosintético”. Cap. 8.Laboratori de Sintesi. Grup d’Enginyería Molecular (GEM). Institut Químic de Sarriá, Universitat Ramon Llull. España. (Diapositivas de apoyo para Clases) 99 Wilbert Rivera Muñoz [email protected] Modelo: Ejemplo: .NO . . . Het Ph . Ph . O Ph Ph . O O .SI 2. Si el sistema contiene dos heteroátomos adyacentes, no es usual que el cierre del anillo suponga la formación de un enlace entre los mismos. Son excepciones las ciclaciones sobre grupos nitro, nitroso o diazonio. Modelos: . . . Het Het . NO . . . SI . Het Het CH3 Ejemplo: CH3 . . O . N H NH O O + NH 2NH 2 OEt 3. Si la molécula objetivo es bicíclica, con el anillo heterocíclico fundido a un anillo bencénico, es habitual que el compuesto de partida sea siempre un derivado bencénico adecuadamente disustituído en orto Modelo: . G . . . . Het Het . Ejemplo: CH3 CH3 NH2 O N N +O NH2 8.1.1. Modelos para la ciclación intramolecular Para comprender la formación de heterociclos a través de una ciclación intramolecular, es necesario tomar en cuenta que tanto los sustratos como los productos intermedios y finales que se forman, suelen presentar diversas formas tautoméricas, de los cuales es necesario 100 Wilbert Rivera Muñoz [email protected] seleccionar el tautómero mas útil para efectuar la desconexión o para identificar los sintones correspondientes Se pueden mencionar tres modelos para la ciclación intramolecular y las correspondientes desconexiones: Modelo saturado: Modelo α-insaturado Modelo α-carbonilo . . . . . . Het Het Het O 8.1.1.1 Modelo saturado La desconexión directa C-Het, se presenta solo en algunos casos particulares, es más común, transformarlo previamente en un modelo α-insaturado o α-carbonilo, como se puede ver en el siguiente esquema: . . Het O AGF . . (Si Het = N) C - Het . . Het Het X (SN2, intramolecular) modelo alfa-carbonilo X = Br, OTs, O . Het (adicion de Michael) Proponer un diseño de síntesis, a partir de materiales simples y asequibles, para las siguientes moléculas: MOb 65 …… MOb 66 …… MOb 67 O COOEt COOEt Ph N CH3 N N Ph Ph Análisis. La MOb 65, puede funcionalizarse previamente, hacia un modelo α-carbonílico o a un modelo insaturado, para encontrar moléculas precursoras, que puedan desconectarse con mayor facilidad. La vía que se propone con la AGF, según (b), es la más adecuada, por requerir menos etapas, para la síntesis. 101 Wilbert Rivera Muñoz [email protected] O PhCHO CH3 Ph COOEt Br C-N Ph AGF a Ph O N COOEt Ph C-N COOEt Ph NH NH2 CH3 CH3 CH3 N b CH3 AGF MOb 65 COOEt Ph N CH 2 1, 4-diCO C-N Ph O H2C + Ph COOEt O NH2 CH3 CH3 Br CH3 + Ph COOEt O , base Síntesis. Se inicia con la acilación de Friedel – Crafts del benceno por un lado y por el otro con la bromación del, acetato de etilo, según H. V. Z. Las siguientes etapas, requieren de un trabajo en medio básico y al final se procede a la hidrogenación de los centros insaturados para llegar a la MOb 65 O CH 3COCl CH3 AlCl3 CH 3NH 2 EtONa CH 3COOEt Br2 COOEt Ph Br Ph P4, rojo N O H2 COOEt Ph CH3 Pd N CH3 MOb 65 Análisis. El enlace del N al carbono β, en relación al grupo éster, (MOb 65) es orientador para pensar que el mismo se formó por una adición intramolecular conjugada de Michael, de una amina sobre un éster α, β insaturado. La desconexión C- N, da origen a otras desconexiones comunes, hasta llegar a materiales de partida simples. COOEt COOEt COOEt C-N C-N + N NH Ph H2N Br Ph RGF MOb 66 COOEt Ph PhCN CHO + CH3 CH3 1, 3-diO COOEt CH3 102 Wilbert Rivera Muñoz [email protected] Síntesis. El o- metil benzaldehído, puede prepararse, de ser necesario, por la reacción de Gattermann–Koch, sobre el ácido para-metil sulfónico. El resto de reacciones, para la síntesis de la Mob 66, permiten pensar en un rendimiento aceptable en la síntesis. PhCN COOEt CHO LiAlH4 NBS COOEt CH3 COOEt CH3 H2N EtONa EtOH Ph 2-methylbenzaldehyde COOEt Br CH3 COOEt NH N Ph Ph ethyl (2-benzyl-2,3-dihydro-1H-isoindol-1-yl)acetate MOb 66 Análisis. Al igual que en el ejemplo anterior, el enlace C-O en la posición β al grupo éster, en la Mob 67, sugiere desconectar por dicho enlace, que tendría que haberse formado por una reacción intramolecular de Michael de un alcohol sobre el α,β insaturado CO. COOEt OH O OH COOEt C-O COOEt C-N + N N RGF Br NH COOEt Ph Ph Ph ethyl (4-benzylmorpholin-2-yl)acetate C-N CH3 1, 3-diO NH2 MOb 67 O Ph CH 3CHO + Ph3P=CHCOOEt Síntesis. La síntesis de la Mob 67, requiere que se encare la misma por dos vía, por lo que resulta ser convergente y la última etapa, la formación del éter cíclico, requiere de una base, que transforme el alcohol en su alcóxido, que es más nucleófilo. OH NH2 Ph + O 2) H 3 O + COOEt NH O OH COOEt NaH Ph N N Ph CH 3 CHO Ph3 P=CHCOOEt COOEt COOEt NBS Ph MOb 67 Br 103 Wilbert Rivera Muñoz 8.1.1.2. [email protected] Modelo α-insaturado . . Si Het = N . . . . N Het R Het R O R tautómero Proponer un diseño de síntesis a partir de materiales simples y asequibles, para las siguientes moléculas: MOb: 68 MOb: 69 MOb: 70 MOb: 71 O Ph EtOOC N CH3 Ph COOH COOEt Ph O N CH3 H3C N CH3 N Et Análisis. El proceso de desconexión de la MOB 68, puede encararse por dos alternativas. La (a), requiere la preparación de un compuesto intermedio 1,4-dicarbonilico y la (b) un compuesto intermedio γ- hidroxicetónico. + CH3COCH3 BrCH 2COOEt 1, 4-diCO CH3 C-N O CH3 N AGF a O NH CH3 amida O CH3 C-N EtOOC + CH3 CH3 N H3C C-N CH3 O NH2 b C-N NH O MOb 68 CH3 IGF amina Br O CH3 CH3 OH O CH3 NH2 H3C CH3 O + CH3 O Síntesis. Las vías de desconexión, de la Mob 68, generan dos rutas de síntesis, igualmente válidas. Se propone un diseño en base a la alternativa de desconexión (b), el cual requiere en una de sus etapas la protección temporal del grupo cetónico. CH 3COCH 3 + CH3 CH3 OH OH NaH BrCH 2COOEt THF EtOOC H O + EtOOC O O NH2 1) H3C 2) H 3O + N CH3 1) TsNHNH 2, H 2) Na(CN)BH 3 CH3 MOb 68 CH3 EtONa O N CH3 CH3 O + NH O CH3 104 Wilbert Rivera Muñoz [email protected] Análisis. La desconexión del anillo furánico, conduce a un sintón o equivalente sintético 1,4-diCO, que se desconecta para producir un sintón electrofílico ilógico. C-O Ph Ph O Ph Ph Ph Ph O O O OH 1, 4-diCO MOb 69 Br CH3 + Ph Ph O O Síntesis. El uso del LDA, es suficiente para garantizar el enolato de la acetofenona, como nucleófilo, para sustituir al halógeno de la cetona halogenada, por lo que no es necesario ejercer control sobre esta molécula. La formación del furano, requiere de catálisis ácida O CH 3COCl Br Br2 CH3 AlCl3 Ph HAc Ph O Ph O O O H3C Ph, LDA/THF Ph H MOb 69 Ph + Ph Ph O O OH 2,5-diphenylfuran . Análisis. La Mob 70 es un derivado piridínico, característico de la síntesis de piridinas de Hansch, es decir, se deberá formar el ciclo piridínico a partir de una aldehído y dos moles de compuesto 1,3-diCO y oxidar la dihidroquinona intermedia formada Ph Ph Ph EtOOC COOEt EtOOC COOEt IGF C-N COOEt EtOOC + H3C N CH3 H3C N H MOb 70 CH3 NH 3 CH3 H3C O O 1, 5-diCO Ph 2 CH3COOEt EtOOC 1, 3-diCO + Ph EtOOC COOEt + 1, 3-diCO CH3 CHO H3C H3C O 2 CH3COOEt O O 105 Wilbert Rivera Muñoz [email protected] Síntesis: El cetoéster necesario, para reaccionar con el benzaldehído, se prepara previamente, por la condensación de Claisen del acetato de etilo. Y como oxidante en el último paso, para formar la Mob 70, se puede utilizar el DDQ. Ph Ph Ph CHO EtOOC COOEt EtONa COOEt EtOOC CH3 H3C O CH3 H3C O NH 3 EtOOC O COOEt H3C N H CH3 O DDQ Ph EtOOC COOEt MOb 70 H3C N CH3 diethyl 2,6-dimethyl-4-phenylpyridine-3,5-dicarboxylate Análisis. La MOB 71 presenta un anillo piridínico como sustituyente sobre un quinolina. De tal manera que se inicia el retroanálisis por la estructura piridínica de la quinolina. La desconexión simultánea, sobre la cetona y la amina, muestran a la anilina y el compuesto carbonílico que se condensaron. Como es poco probable la introducción del anillo bencénico en una piridina, se toma la estrategia de construir el anillo piridínico a partir de derivados acetiluros apropiados O O COOEt COOH C-N N N N H N Et C-N MOb 71 EtOOC COOMe COOEt + IGF NH2 NO 2 AGF EtO N N COOMe AGF COOMe COOMe NO 2 HC OHC NO 2 NH 3 HN COOMe HC COOMe Síntesis. Los ésteres nitrílicos, conjuntamente el m-nitrobenzaldehido, permiten la ciclación intermolecular, para formar un derivado hidropiridínico que se oxida a piridina con HNO3 conc. Luego el grupo nitro, permite construir el anillo piridínico de la quinoleina, por reacciones de condensación con un compuesto diCO adecuado. La etilación del grupo amino, permite formar la MOb 71. 106 Wilbert Rivera Muñoz [email protected] COOMe HC NH 3 COOMe OHC + NO 2 NO 2 HNO 3 HN HC COOMe COOMe COOEt 1) OH+ 2) H 3O , calor COOMe EtOOC NH2 N N EtO NO 2 3) Sn, HCl COOMe O O COOH COOEt 1) NaH, 2) EtI 3) OH-, 4) H3O + N H N MOb 71 N N Et Modelo α-carbonilo 8.1.1.3. Si Het = N . . . . . . N OH Het Het O O OR tautomero . . Het OH tautomero enolico Proponer un plan de síntesis, a partir de materiales simples, para las siguientes moléculas: MOb: 72 MOb: 73 MOb: 74 H N S O H H3C O O CH3 NH O Análisis. La MOb 72, una tetrahidropiranona, se desconecta por el enlace S-CO. Las siguientes IGFs, permiten formar un precursor 1,5-diCO, que desconectado, proporciona los materiales de partida. 3 IGF IGFs C-S O + CHO COOEt COOEt S 1, 5-diCO SH Br CHO 1 COOEt COOEt 5 tetrahydro-2H-thiopyran-2-one MOb 72 107 Wilbert Rivera Muñoz [email protected] Síntesis. La condensación de Michael entre el éster α, β –insaturado y el acetaldehído en medio básico, forma el 1,5-aldehidoéster, que luego de ser reducido el grupo CHO a alcohol con tioúrea es posible tener la molécula precursora que actuará sobre el grupo éster, para formar la MOb 72. CH3 H2C 1) NaBH4 CHO COOEt EtONa CHO COOEt 1) (H 2N) 2C=S COOEt 2) H 2O, NaOH 2) PBr3 COOEt SH Br NaH MOb 72 S O Análisis. La desconexión del enlace amido de la lactama, genera la primera molécula precursora que es un γ. aminoéster, que se forma entre una amina primaria y el γbromoéster y consiguientemente el γ-hidroxiéster, que se reacciona entre el enolato del acetato de etilo y un epóxido como materiales de partida simples y asequibles. C-N IGF C-N COOEt O N NH H2N CH3 CH3 COOEt HO COOEt Br CH3 1-methylpyrrolidin-2-one MOb 73 O + CH 3COOEt Síntesis: El epóxido y acetato de etilo son los reactivos que reaccionan para formar el γhidroéster. El OH se sustituye por bromo con PBr3 y ésta reacciona con metilamina para formar la molécula precursora que se cierra en un anillo lactámico, para formar la MOb73. CH 3COOEt PBr3 1) EtONa HO 2) COOEt CH 3NH 2 Br COOEt COOEt NH O CH3 N O CH3 1-methylpyrrolidin-2-one MOb 73 108 Wilbert Rivera Muñoz [email protected] Análisis. La MOB 74, es el fármaco quimioterápico, Gram (-) ROSOXACIN, que por un IGF, forma una lactama con un ciclo de cinco eslabones, que al ser desconectado, forma una molécula precursora amino éster derivada de un nitroéster. El nitroéster es un aducto que se puede formar a partir de un dienófilo nitro y un dieno. El dieno requiere para su formación de una reacción de Wittig H H H H O H H O AGF NH O NH O C-N O MOb 74 H H IGF O H2N O O 2N H H H2C O H2C H + EtOOC EtOOC O C-C H H O H H PPh3 CHO + O 2N O EtOOC EtOOC CHO O CH3 + O 2N O Síntesis. Inicialmente se aprovecha la condensación de un aldehído aromático con nitrometano. Para reducir el grupo nitro, se protegen los grupos OH. La preparación del aminoéster intermediario, procede por reacciones simples, así como la formación de la lactama de cinco eslabones. La lactama es sometida a reducción selectiva con LiAlH4, para producir la MOb 74. HO CH3 HO CHO O O 2N HCHO EtONa NO 2 H HO HO H2C COOEt PPh3 H C 2 1) HBr, H 2O 2 + NO 2 O CHO H2C H 2) PPh3 3) BuLi hv EtOOC EtOOC H H H O 2N H2N H H O H LiAlH4 O H EtOOC H H MOb 74 O NH O O EtOOC O O H O H2, Sn O H H NH 109 Wilbert Rivera Muñoz [email protected] 8.1.2. El grupo ciano en la síntesis de heterociclos E La polaridad del enlace C-N del grupo ciano hace que este reactivo pueda reacciona con nucleófilos y electrófilos, originando heterociclos con uno o varios heteroátomos en el anillo R C R N C NH Nu Así, es muy común observar la participación del grupo nitrilo en ciclaciones intramoleculares, cuando en la misma molécula se cuenta con un extremo electrofílico o nucleofílico. Proponer un plan de síntesis, a partir de materiales simples, para las siguientes moléculas: MOb: 75 MOb: 76 H N O N NH2 N HN N Br NH2 Análisis. La MOb 75, presenta en un de los heterociclos, la estructura de la guanidina y en el otro heterociclo se tiene una estructura saturada, que puede transformarse a una lactama. Se inicia con este último y luego se desconecta por la estructura de la guanidina, obteniéndose un precursor hidroxinitrilo lactámico, que puede producir una estructura dilactámica, el cual se desconecta por el enlace N-CO, para formar una molécula 1,5-diCO, que desconectado conduce a los materiales simples para la síntesis H N N NH2 O H N N NH2 H N O H N NH AGF N N NH2 NH NH2 NH MOb 75 NH3 O C-N + H N O O C-N H N H2N OH NH + NH2 COOMe COOMe N N N 1, 5-diCO COOMe COOMe + O 1, 3-diCO MeO CH2 OMe + H3C N N 110 Wilbert Rivera Muñoz [email protected] Síntesis: La Condensación del tipo aldólico de los materiales de partida conduce a un compuesto 1,5 diCO, que con NH3, forma el primer ciclo dilactámico capaz de combinarse con la guanidina para formar el segundo heterociclo. El grupo CN, es muy importante en la segunda ciclación. La reducción de los grupos C=O, conduce a la MOb 75. COOMe COOMe COOMe COOMe CH3 CH2 1) EtONa H N O O O H N OH HN N NH3 EtONa 2) Me2CO 3 N N N NH2 H N O N NH2 N NH2 N H N O H N NH H2N N LiAlH4 H N N NH NH2 NH MOb 75 NH2 Análisis. Se toma el enlace C-N de aminas, para la primera desconexión, de la MOb 76, posteriormente la desconexión simultánea de un H y un Br. Perfila a un compuesto con dos grupos CN, que se desconectan en un dihaluro y dos moles de HCN. Br HN N N Br MOb 76 HN N Br N Br CH CH N N H Síntesis. El malonato de dimetilo sirve para la preparación del dihaluro, que se combina con HCN. A este sistema se adiciona HBr y luego en medio ácido se produce la ciclación, para formar la MOb75 COOEt 1) LiAlH 4 2) PBr3 COOEt HBr 2 HCN Br Br N N N HN Br H H + MOb 76 HN N Br 111 Wilbert Rivera Muñoz [email protected] 8.1.3. Heterociclos con varios heteroátomos El proceso de desconexión para moléculas con varios heteroátomos, puede realizarse para cada enlace carbono-heteroátomos, de acuerdo a los modelos anteriormente estudiados o simultáneamente, para lo cual se utilizan reactivos poliheteroatómicos asequibles. 8.1.3.1. Heteroátomos a distancia (1, 2). Los reactivos más representativos y usuales son, las hidrazinas e hidrazinas sustituidas, así como la hidroxilaminas. H2N H2N NH2 Hidrazina OH Hidroxilamina ….. MOb. 78 MOb: 77 Proponer un diseño de síntesis para las siguientes moléculas: O ….. Mob 79: N H CH3 Ph CH3 N N Ph pirazoles N N O isoxazoles H3C CH3 piridacinas Análisis: La MOb 77, derivado del pirazol, se desconecta directamente por los enlaces CN, para generar precursores simples como la hidrazina y un compuesto 1,3-diCO. O CH3 N H O N CH3 MeO CH3 + MeO MOb 77 CH3 O + H2N O MeO O NH2 Síntesis. El acetato de metilo, es un buen precursor para formar el compuesto 1,3-diCO, el cual se combina con la hidrazina para generar la MOb 77. OMe O 2) CH3 O 1) EtONa CH3 O CH3 H2N MeO NH2 O CH3 MeO H2N O N MeO O O CH3 N N H 5-methyl-2,4-dihydro-3H-pyrazol-3-one MOb 77 CH3 MeO N H N Análisis. La MOb 78, derivado del isoxazol, se desconecta por los enlace C-N y C-O, para encontrar las moléculas precursoras, que se han combinado para formar el Heterociclo. 112 Wilbert Rivera Muñoz [email protected] Ph CH3 1, 3-diCO Ph Ph Ph O MeO O O + N Ph Ph + O O NH2 3,5-diphenylisoxazole HO MOb 78 Síntesis. La bezofenona y el benzoato de etilo permiten formar el 1,3-diCO requerido, para reaccionar en medio ligeramente ácido con la hidroxilamina y luego de agregar el NaH, se da la ciclación, que requiere de mayor ácido para deshidratar y producir finalmente la MOb 78 Ph Ph CH3 1) EtONa O NaH OH N Ph Ph O O COOEt Ph OH O + H Ph Ph H Ph Ph H + HO H2O N Ph O NH O 2) Ph Ph Ph H2N N N N O Ph O MOb 78 + Ph Ph O O Análisis: La MOb 79, es un derivado de la diacina, que por desconexión C-N simultánea, permite asegurar que la cicloadición se ha producido entre la hidrazina y un compuesto 1,4-diCO. H2N CH3 NH2 CH3 + CH3 CH3 N RGF N H3C 4 O 1, 4-diCO 1 O + N CH3 H3C O H3C N CH3 H3C H3C MOb 79 O H3C O CH3 H3C CH3 Br CH3 Síntesis: La butanona permite crear el compuesto 1,4-diCO, que luego se combina con la hidrazina, para formar una hidrodiacina, que oxidada con DDQ, genera la MOb 79 CH3 CH3 CH3 O O H2N CH3 CH3 N N EtONa H3C H2C O H3C O H3C CH3 DDQ N O O Br2 NH2 N Br HAc H3C CH3 H3C CH3 H3C CH3 H3C CH3 3-ethyl-6-isopropylpyridazine MOb 79 113 Wilbert Rivera Muñoz [email protected] 8.1.3.2. Heteroátomos a distancia (1,3) Los reactivos más significativos que contienen los heteroátomos a una distancia 1,3 o se hallan intercalados uno respecto del otro son: La úrea y sus derivados, las guanidina y derivados, la tioúrea y derivados, las amidinas y derivados, y por último, la cianamida sódica. S NH O H2N H2N H2N Na HN tioúrea guanidina úrea C R NH2 NH2 NH2 NH NH2 amidinas N Cianamida sódica Proponer una síntesis para las siguientes moléculas: Mob 80 MOb: 81 MOb: 82 O H N O N NH2 N HN H2N N O N H CH3 S Ph NH2 Análisis. En la MOb 80, puede visualizarse la estructura de la úrea, lo que invita a proponer dos desconexiones C-N, simultáneas O HN C-N úrea NH2 + O NH2 N CH3 úrea H 6-methyldihydropyrimidine-2,4(1H,3H)-dione O O O EtO EtO CH3 + CH3 OHC CH3 MOb 80 O Síntesis. Se parte con NH2 O una condensación de HN O O NH2 Claisen-Schmidt, entre 1) EtONa/EtOH EtO un éster y un aldehído, O N CH3 EtO CH3 2) OHC H CH3 para luego combinar el CH3 MOb 80 producto con la úrea, por para arribar a la MOb 80 la reacción de Michael, Análisis. Inicialmente se efectúa una RGF en la MOb 81, para generar un precursor portador del grupo guanidina, razón por la cual se efectúa una desconexión simultánea C-N, para continuar la desconexión por la enamina formada. La relación 1,5-diCO, es la mejor 114 Wilbert Rivera Muñoz [email protected] para continuar desconectando y produciendo estructuras con relaciones dioxigenadas en 1,3. Se arriba así a moléculas simples, como materiales de partida. guanidina HN H N O N NH2 H N O N NH2 C-N RGF N Ph O NH2 NH2 H N guanidina N NH2 Ph O Ph NH2 NH2 MOb 81 O OEt O CHO 1 Cl CHO IGF 3 O NH2 CHO C-N O 4 O 5 Ph O OEt Ph Cl 1, 5-diCO O OEt Ph CHO 1, 3-diCO H H3C O + O + OEt O OEt 1, 3-diO O NH2 OEt OEt Ph CHO + CH3 Ph Síntesis. Las condensaciones de Claisen y Claisen –Schmidt, permiten obtener un intermediario clave, que se transforma fácilmente en un diéster, que luego de la hidrólisis, se combina con el SOCl2, para formar una molécula dihalogenada que con amoníaco se transforma en una diamida. La reacción intramolecular del producto anterior, produce el sustrato adecuado que reacciona con la guanidina. O O OEt OEt 1) EtONa/EtOH 2) CHO CH3 O O OEt CHO Ph Ph O 1) EtONa OEt OEt H N CHO O Ph OEt H N O N Cl NH 3 OEt O O Ph O 2) H Cl + O 2) SOCl 2 EtONa CHO H3C 1) H 3O O NH2 CHO NH2 O N HN Ph Ph O NH2 NH2 NH2 Ph NH2 NH2 DDQ O H N N NH2 N Ph MOb 81 NH2 115 Wilbert Rivera Muñoz [email protected] El producto así formado, luego es sometido a un “proceso de aromatización”, con DDQ, para formar la MOb 81 Análisis. Un tautómero de la MOb 82, permite ver, la estructura de la tioúrea. Se desconecta por C-N y C-S, para formar los intermediarios, tioúrea y una alfa-bromocetona, la misma que conduce a un compuestos, 1,6-diCO que se reconecta, para llegar a la ciclohexanona, como material de partida N + HN HN S SH S MOb 82 O NH2 N H2N Br OHC H3C reconex 1, 3-diO O O O CH3 CH3 CH3 O Síntesis. La ciclohexanona es el material de partida simple que luego de varias reacciones, es abierto por ozonólisis en medio de sulfuro de dimetilo, para producir un compuesto 1,6diCO, que en medio básico se condensa, para dar la cetona indicada, para su bromación y posterior reacción con la tioúrea y así formar la MOb 82 O OHC 1) CH 3MgBr/THF H C 3 + 2) H 3O 1) O 3 3) POCl 3 2) Me2S O EtONa/EtOH CH3 O NH2 O HN Br2 SH O H2/Pd,C HAc Br N HN CH3 CH3 N MOb 82 H2N S S 4-cyclopentyl-1,3-thiazol-2-amine 8.1.3.3. Heteroátomos a distancia (1, 4): NH2 NH2 etilendiamina NH2 NH2 o-fenilendiamina XH NH2 X = O, S Proponer un diseño de síntesis, para las siguientes moléculas: 116 Wilbert Rivera Muñoz [email protected] ….. MOb: 84 MOb: 83 N Ph Ph N ….. MOb: 85 N Ph SH EtO N N N Ph Ph N OH OEt Ph Análisis. Se procede a la desconexión directa de los enlaces imínicos de la MOb 83. Lo cual produce dos estructuras de moléculas precursoras, cuyas síntesis son simples N NH2 Ph C=N N Ph O O NH2 Ph MOb 83 Ph HO IGF + O Ph Ph r-conden benzoínica IGF OH 2 PhCHO OH Síntesis. La condensación benzoínica del benzaldehído, permite llegar al compuesto dicarbonílico necesario, para combinarse con el o-fenilendiamina, preparada por amonólisis del pirocatecol, para formar la MOb 83 OH NH2 amonólisis OH N Ph N Ph NH2 CHO KCN/H2O Ph HO 2 Ph O PCC MOb 83 CH 2Cl 2 O O Ph Ph Análisis. Nuevamente en la MOb 84 puede distinguirse la estructura de una tioúrea, por lo cual se desconecta por los enlaces C-N. Ph N N H2N SH N S + C-N Ph tioúrea N Br Ph N OH NH2 IGF OMe Ph OMe OH MOb 84 Ph Ph Ph COOMe Ph O + CH3 O O NH3 COOMe a,b-insat.CO OMe Ph O O O Ph N O C-N OMe OMe Ph 1, 3-diCO O O Ph O COOMe OMe + OMe Ph O 117 Wilbert Rivera Muñoz [email protected] La funcionalización del equivalente sintético bromado, permite arribar a estructuras con relaciones dioxigenadas, fáciles de manejar en sus desconexiones. Síntesis. Así el malonato de dimetilo puede ser un material de partida para la preparación de la MOb 84. COOMe COOMe O 1) EtONa Ph O COOMe PhCOCH3 OMe OMe EtONa/EtOH COOMe 2) PhCOOMe Ph NH3 O Ph Ph H2N N Br Ph S N O Ph OH N O PBr3 OMe OMe OMe NH2 Ph Ph N N O Ph Ph O O SH MOb 84 N Ph OH Análisis. La MOb 85, un derivado pirazínico, se funcionaliza para llegar a un precursor que contiene dos grupos imínicos. La desconexión por los mismos, permite observar que es un alfa amino éster, la molécula que se autocondensa EtO EtO N N TGF Ph N OEt N H OEt O CHO HCN + NH3 O C-N Ph Ph MOb 85 H N O RGF N Ph Ph Ph O OH OEt IGF r-Strecker Ph H2N + + Ph NH2 NH2 EtO O Ph Ph Síntesis. Se recurre a la síntesis de Strecker, para formar el aminoéster requerido, el cual se condensa en medio básico. El Et3ONF4, permite llegar al compuestos diimínico que es luego oxidado o aromatizado por el DDQ, para llegar a formar la MOb 85. Ph Ph CHO Ph O O OH OEt EtOH HCN H NH3 NH2 EtOH EtO EtO N + MOb 85 HO N Et3O BF4- DDQ Ph Ph Ph N O Ph Ph N N H O Ph Ph H N EtONa + + NH2 EtO O H2N Benceno OEt calor N Ph N OEt OH Ph 118 Wilbert Rivera Muñoz [email protected] 8.2. Ciclación intermolecular 8.2.1. Ciclaciones 1,3-dipolares Estas reacciones normalmente forman anillos heterocíclicos de cinco eslabones, para lo cual es necesario la reacción entre un compueston1,3 dipolar y un alqueno. La reacción es una cicloadición [3-2]. Los compuestos 1,3-dipolares que más uso de han hecho para formar heterociclos pentagonales son: Las azidas, los diazoalcanos, el óxido nitroso, las iminas de nitrilo, los óxidos de nitrilo, las iminas de azometileno, los compuestos azoxi, los iluros de azometano, las nitronas, los óxidos de carbonilo y el ozono. Son bastante comunes, las ciclaciones y desconexiones que se indican a continuación, lo que muestra la amplia gamma de reactivos 1,3-dipolares y sus estructuras de resonancia o tautómeros utilizados en el propósito de formar heterociclos pentagonales. R + R N N R CH2 R1 R3 + R O N R1 R1 R1 N N H2C H2C R + R N N O R R3 + R N N H2C R2 N NR 2 H2C R1 R1 R1 R1 H R3 R R N O C H2C R3 R3 + N N N O + N N R3 N N H2C R1 R1 R1 R1 Y El mecanismo de la reacción 1,3-dipolar generalmente aceptado, responde a una reacción concertada X Y Z X R R R R Z R R R R Proponer un plan de síntesis, para las siguientes moléculas: MOb: 86 ………. MOb: 87 …….. MOb: 88 N O H3C N N N N HN CH3 H3C Ph (Ejem. de isoxazoles) N N H3C CH3 (Ejem. de triazoles) Ph (Ejem. de tetrazoles) 119 Wilbert Rivera Muñoz [email protected] Análisis. La MOb 86, es un derivado del isoxazol. Su desconexión puede orientarse a la utilización de un óxido de nitrilo y un derivado de acetilénico + N N O H3C CH3 H3C O- CH 3Br CH3 + RGF CH Ph r-Mukaiyama Ph MOb 86 H3C Br Br Ph Ph NO 2 CH2 PhCHO + Ph Ph3P=CH2 Síntesis. El óxido de nitrilo se puede preparar a partir de nitrometano por la reacción de Mukaiyama. El derivado acetilénico, a partir del benzaldehído, haciendo crecer la cadena con insaturación, previamente, con la reacción de Wittig. El dieno polar y el dienófilo formado, se combinan según Diels-Alder, para formar la MOb 86 + N H3C NO2 2) Et 3N Ph N H3C CH3 H3C Ph PPh3 2) Br 2/H + O calor CH3 1) H2C CHO O 1) PhNCO MOb 86 Ph 3) NaNH2 4) CH3Br Análisis. La MOb 87, un derivado del triazol, puede desconectarse conforme a la reacción de Diels-Alder, lo que permite proponer moléculas de partida sencillas H3C N N C-N N H3C CH3 H3C N N CH 3Br N H3C HC CH3 + NaN3 + CH 2 CH3Br MOb 87 Síntesis. El azida de sodio y el acetileno son buenos materiales de partida para preparar la MOb 87. CH3Br + H3C NaN3 N N H3C N N N N calor 1) nBuLi HC CH 2) CH 3Br HC C CH3 1) nBuLi 2) CH 3Br H3C C C CH3 H3C CH3 MOb 87 120 Wilbert Rivera Muñoz Análisis: El derivado de tetrazol,MOb 88, se desconecta para generar precursores azidas y nitrilos que se combinan en una cicloadición heteromolecular para formar un aducto heterocíclico. [email protected] + N N N HN N + N Ph NaN3 N C-N C N Ph MOb 88 Síntesis: El benzonitrilo requerido, un dienófilo potente, se forma a partir del benceno por las reacciones básicas que se indican. La reacción de cicloadición, para formar el aducto MOb 88, se efectúa con el azida sódico, como dienófilo polar, catalizado con un poco de calor N NaN3 HN N calor N Ph N 1) HNO 3 H2SO4 2) Sn/HCl NH2 MOb 88 1) NaNO 2/HCl 2) CuCN/Cu 8.2.2. Reacción de Diels-Alder heteronuclear Cuando en la reacción de Diels-Alder, se sustituye un átomo de carbono por un heteroátomo en el dieno o el dienófilo de la reacción, se forma una aducto heterocíclico de seis miembros, al menos con un heteroátomo en el anillo. Se aplican todas las consideraciones teóricas y de reactividad, estudiadas para la reacción de Diels-Alder de formación de aductos carbocíclicos. Heterodienos: Son buenos heterodienos, los aldehídos y cetonas conjugadas, 1-azadienos y 2azadienos. Los aldehídos y cetonas conjugadas producen anillos piránicos, la reacción es facilitada por ácidos de Lewis o un aumento de la presión, así como la R CH2 R + G O R1 G O R1 presencia de un grupo electrón atrayente sobre el alqueno. 121 Wilbert Rivera Muñoz [email protected] Heterodienófilos más comunes en la reacción de Diels-Alder8: . . . O . N . . Aldehídos, cetonas N . . . . N N Comp azocarbonilicos N Tioaldehidos, tiocetonas, tioésteres, tiofosgeno nitrilos iminas . S . N S O O sulfinilaminas nitrosocompuestos Heterodienófilos: Los aldehídos, cetonas y aldehídos si son deficitarios en electrones, reaccionan en condiciones suaves, caso contrario requieren condiciones de presión y temperatura elevadas o catalizadores tipo ácidos de Lewis. Estos heterodienófilos permiten la formación de sistemas piránicos, útiles en la preparación de precursores acíclicos de varios fármacos, como es el caso de loa antibióticos macrocíclicos. … Ph Ph R R 1 1 CH2 G G O O + + H R2 O R3 R3 R2 Ph O OR OR R R Ph Debido a la inestabilidad de las iminas, éstas se preparan in situ a pesar de ser menos utilizadas como heterodienófilos que las cetonas y aldehídos. Los grupos aceptores en las iminas las hacen más estables y permiten la formación de hidropiridinas. G R G N H2C R H2C R N + R1 R R1 . R1 . N . 8 N R1 . H2C R1 H2C R1 + Otto Paul Hermann Diels (1876 – 1954. Químico alemán. Estudió química en la Universidad de Berlín entre 1895 y 1899, consiguiendo el doctorado este año. Profesor y jefe del departamento de química en la Universidad de Berlín. En 1916, tomó el puesto de profesor de Química en la Universidad de Kiel, cargo que no dejó hasta su jubilación en 1945. En 1906 descubrió el anhídrido malónico. Investigó en reacciones de deshidrogenación con selenio. dicetonas. Pero su trabajo más importante es la reacción de Diels - Alder. En 1950 recibió el Premio Nobel junto a Kurt Alder8 122 Wilbert Rivera Muñoz [email protected] Heterodienófilos más comunes en la reacción de Diels-Alder: . . . . . N N . . O N . . N-vinil y N-ariliminas, oxazoles, 1,2,4-triazinas N N . . . azoalquenos . . N . . 1,2,4,5-tetrazinas . . . . CH3 . Iminas y dimetilhidrazonas α,β-insaturadas Comp. carbonílicos α,β insaturado, meturo de quinonas . . . N N O . O . . nitrosoalquenos N-aciliminas Proponer un diseño de síntesis para las siguientes moléculas: ….. MOb: 90 Mob 89 H3C …. MOb: 91 COOMe Ph N O Ph H3C O CHO Ph MOb: 92 MOb: 93 MOb 94 H2N CH3 O N CH3 N COOEt N Ph Análisis. La MOb 89 presenta la estructura de un típico aducto, formado por la reacción de Diels – Alder, razón por la cual se propone una desconexión retro-Diels- Alder, con lo que se producen un dieno Ph H3C H3C Ph + Ph O r - D-A Ph CH 3COCl O + CH2 MOb 89 PhCHO + Ph3P=CHCH=CH 2 Ph y un heterodienófilo como precursores adecuados para encarar la síntesis. 123 Wilbert Rivera Muñoz [email protected] CH2 Síntesis. La reacción de Wittig sobre el benzaldehído, permite formar el dieno. El heterodienófilo se forma por una reacción de acilación de Friedel-Crafts, sobre el benceno. Dieno y H3C PhCHO Ph3P=CHCH=CH 2 Ph calor H3C CH 3COCl Ph O Ph Ph MOb 89 AlCl3 O dienófilo se combinan con un calentamiento suave para formar la MOb 89 COOMe Análisis. La MOb 90 tiene la estructura de un hetero aducto de Diels-Alder, por lo que se procede a una desconexión retro Diels-Alder. Las moléculas precursoras ya son fáciles de sintetizar directamente N CH2 H + COOMe NHCOOME N r-D-A + Ph Ph NHCOOME CH2 Ph H MOb 90 NH2 O Ph NH2 r-Reilly + O O 2 Me2CO 3 Síntesis. Se combinan las reacciones de Wittig y oxidación de Reilly, cuidando de activar el heterodienófilo para efectuar la reacción de Diels-Alder y llegar a la MOb 90 CH2 O 2 Ph3P=CH2 SeO2 dioxano, calor NH2 Ph H 2 Me2CO 3 Ph NH2 COOMe CH2 O O NHCOOME BF3 N COOMe + Ph N MOb 90 NHCOOME C6H6 Ph H Análisis. El derivado del pirano, muestra una estructura muy apropiada, como para desconectarla por una retro Diels-Alder. El dieno generado, puede desconectarse por el enlace olefínico, lo que produce, equivalentes sintéticos, mucho más simples y que se los puede preparar, sin dificultad. CH2 CH2 + r-Diels-Alder O CHO HCHO + CH 3CHO CHO O acrylaldehyde 6-cyclopentyl-3,4-dihydro-2H-pyran-2-carbaldehyde CH3 MOb 91 HCHO Li + CH3 + O Cl O acetyl chloride 1-cyclopentylethanone 124 Wilbert Rivera Muñoz [email protected] Síntesis. El heterodieno, se forma por condensación entre la cetona y el formaldehído. El dienófilo se forma por condensación aldólica del acetaldehído, que luego forman la MOb 91. CH2 CH3 Br 1) nBuLi O 1) EtONa O 2) HCHO 2) CH 3COCl calor CH 3CHO O C6H6 CH2 CHO MOb 91 1) EtONa 2) HCHO CHO H2N CH2 H2N Análisis. La MOb H2N CH r-D-A RGF + 92, derivado N N N COOEt COOEt piridínico, se COOEt funcionaliza MOb 92 COOH COOH hacia un aducto, C-N imínico donde se H2N CH2 HN CH3 CHBr2 desconecta según CHO IGF + COOH r-D-A. COOH NH2 NH2 ác. glioxílico La desconexión amidina del heterodieno, moléculas sencillas de partida. El dienófilo es un derivado acetilénico. produce Síntesis. El heterodieno, se prepara por condensación entre la amidina y el ácido glioxílico, para combinar luego con el dienófilo. HN H2N CH3 CH2 CH H2N NH2 NH2 amidina CHBr2 COOH H2N CH2 COOEt N H2O COOH N COOEt hv CHO COOH COOH ác. glioxílico 1) DDQ H2N MOb 92 2) calor (-CO2) N COOEt El aducto formado se aromatiza con DDQ, para formar la MOb 92 125 Wilbert Rivera Muñoz [email protected] Análisis. La MOb 93, se desconecta por r-D-A. CH2 r - D-A + N NH2 C-N N imina + HCHO Ph El dieno es el ciclopentadieno y el heterodienófilo una imina, que por desconexión llega al benzonitrilo, Ph MOb 93 CN como material de partida. Síntesis. La imina formada actúa como dienófilo y se combina con el ciclopentadieno para formar la MOb 93 NH2 CN CH2 1) LiAlH4 N 1) HCl N 2) HCHO/H 2O 2) H 2O calor Ph Ph MOb 93 Análisis. En el tautómero de la MOb 94, se procede a desconectar según r-D-A. El dieno formado se tautomeriza para proceder a la desconexión, como un α,β-insat.CO y luego se continua desconectando como 1,5-diCO. CH3 CH3 O HO CH3 CH2 HO CH3 r-D-A + N Ph N N Ph Ph MOb 94 CH3 CH3 O O O 1, 5-diCO CH2 + CH3 OHC CH3 1, 3-diO CH3 OHC CH3 CH3 CH3 CH3 CH3 Síntesis. La imina de la anilina se combina con el dieno que es un tautómero del α, β-insat. CO, para formar un aducto, que resulta ser un tautómero de la MOb 94 OHC O CH 3COCH 3 1) EtONa 2) HCHO CH3 HO CH3 MOb 94 CH3 OHC EtONa CH3 Ph CH3 EtONa/EtOH CH3 O HO PhN=CH2 DMSO N N O CH3 CH3 O CH3 CH3 CH2 CH3 CH3 Ph CH3 CH3 126 Wilbert Rivera Muñoz [email protected] 8.2.3. Cicloadiciones Las cicloadiciones más estudiadas, son las que ocurren entre compuestos heterocíclicos pentagonales como los oxazoles y algunos dienófilos, que pueden combinarse con ellos por adición electrocíclica y una posterior eliminación de una molécula pequeña, para producir anillos piridínicos. Ejemplos: CN CN CN H CH2 HAc (ac) O 90ªC HO HO O H H3C N H3C N H3C N N H3C COOH COOH H3C CH2 COOH H3C -H 2O O C6H6 H3C 30ªC O H3C H COOH H HO H3C N H3C N H3C N N H3C 8.3. Heterociclos condensados Los heterociclos condensados de mayor importancia sintética y en la industria farmacéutica, son: N N N N H N Quinoleina Isoquinoleina Quinazolina (Benzodiazinas Indol O Benzofurano S Benzotiofeno 8.3.1. Síntesis de Quinoleinas 5 gamma 4 6 3 beta 7 8 N 1 2 alfa Las quinoleinas se encuentran en numerosos alcaloides, en cierto tipo de colorantes y en un considerable número de fármacos, por lo que son de gran interés comercial en los laboratorios industriales. Aquí se mencionarán sólo aquellos métodos de síntesis, que producen rendimientos aceptables en sus reacciones: 8.3.1.1. Síntesis de COMBES En este método, inicialmente se realiza la condensación de un compuesto 1,3-diCO con una anilina o su derivado, para formar una β-aminoenona, que posteriormente se cicla en medio ácido concentrado al correspondiente derivado quinolénico. En términos retrosintéticos, la síntesis de COMBES, se expresaría del siguiente modo: 127 Wilbert Rivera Muñoz [email protected] R R OH N R N R O O C-C IGF R R NH R R C-N imina R R b-aminoenona R = H, R iguales ó diferentes, Ar N R R R + O NH2 O R 1, 3-diCO R 1, 3-dielectrófilo 1, 3-dinucleófilo Proponer un plan de síntesis para la MOb 95, partiendo de materiales simples y asequibles: MOb 95: OCH3 CH3 N CH3 OCH3 Análisis: Inicialmente se funcionaliza la MOb 95, para luego desconectar, según Combes y generar de este modo equivalentes sintéticos que conducen un compuesto 1,3-dinucleófilo y un 1,3-dielectrófilo. OCH3 OCH3 H3C CH3 IGF N OCH3 N OCH3 OH CH3 NH N CH3 OCH3 C-N OCH3 OCH3 RGF CH3 OCH3 CH3 + IGF NO 2 OH CH3 O OCH3 OCH3 IGF OCH3 CH3 O C-C CH3 MOb 95 OCH3 OH O NH2 O + CH3 CH3 OCH3 OCH3 1, 3-diCO CH3 O OMe O CH3 Síntesis: La hidroquinona permite formar el 2,5-dimetoxianilina como 1.3 dinucleófilo. La acetona y el acetato de metilo, conducen a la 2,4-pentanodiona, que funciona como un 1,3- 128 Wilbert Rivera Muñoz [email protected] dielectrófilo. Combinados ambas moléculas precursoras, utilizando ácido sulfúrico concentrado y un por un calentamiento posterior se llega a formar la MOb 95 OCH3 OH 1) Me2SO4 2) HNO 3/H2SO4 3) Sn/HCl OCH3 OCH3 CH3 CH3 NH2 OCH3 OH O O calor CH3 CH3 2) O N 1) EtONa O CH3 O OMe OCH3 H3C CH3 OCH3 CH3 OCH3 OCH3 CH3 O NH CH3 H2SO4 conc OH CH3 calor H MOb 95 N N + CH3 OCH3 CH3 OCH3 8.3.1.2. Síntesis de CONRAD-LIMPACH-KNORR (Quinolonas) En este método, se utiliza un β-cetoéster como compuesto 1,3-diCO y como 1,3dinucleófilo una arilamina adecuada y la ciclación intramolecular se efectúa a temperaturas altas, para la formación de una QUINOLONA. La quinolona que se forme dependerá de la temperatura de la reacción entre la arilamina y el β-cetoéster. A bajas temperaturas, se obtiene el producto de control cinético (4-quinolona) y a temperaturas altas el producto de control termodinámico (2-quinolona): OEt O Me + 250º N H Me CH3 t. amb N H Me Me OH Me Me O Me CH3 CH3 NH2 CH3 O OH 250º NH O OET 140º O OEt NH CH3 250º 250º N H O CH3 N H O O CH3 8.3.1.3. Síntesis de SKRAUP El calentamiento inicial de anilina, glicerina con ácido sulfúrico concentrado, produce una dihidroquinoleina, que luego es oxidada por nitrobenceno a la correspondiente quinoleina. 129 Wilbert Rivera Muñoz [email protected] Se postula que la glicerina se deshidrata y genera “in situ” ACROLEINA (1,3-dielectrófilo) que se combina con la anilina (1,3-dinucleófilo) por una adición de Michael, catalizada por el ácido, que conduce a la 1,2-dihidroquinoleina. El análisis retrosintético de una quinoleina formada por la síntesis de Skraup, muestra las siguientes desconexiones: OH O IGF RGF N H C-C N H NH N H H H H HO + NH2 HO C-N O CH3 CH2 NH acroleina Este procedimiento no se puede utilizar cuando existan sustituyentes sensibles a los medios ácidos. Otra limitante es que en las anilinas sustituidas en meta, pueden darse lugar a quinoleinas sustituidas en la posición 5 y en 7. MOb 96 MOb 97 MeO CH3 Proponer un diseño de síntesis para las H3C siguientes moléculas: N N NO 2 Ph Análisis La funcionalización de la MOb 96 y su posterior desconexión, según la síntesis de Conrad-Limpach-Knorr, generan las moléculas precursoras, p-metilanilina como el 1,3dinucleófilo y el 1-fenil-1,3-butanodiona como el dielectrófilo necesario CH3 H3C H3C OH H3C H3C H3C N MOb 96 O IGF SGF N Ph N Ph Ph C-C H3C H3C H3C SGF IGF + O NH2 CH 3COCH 3 O + Ph PHCOOCH3 130 Wilbert Rivera Muñoz [email protected] Síntesis El tolueno y la acetona, son los materiales de partida, para formar el 1,3dinucleófilo y 1l 1,3-dielectrófilo, respectivamente, que se combinan con catálisis del ZnCl2. Un calentamiento con H2SO4 concentrado., origina la ciclación intramolecular y deshidratación, para generar la MOb 96. H3C H3C 1) HNO 3/H2SO4 H3C 2) Fe/HCL H3C NH2 H3C 1) EtONa/EtOH CH 3COCH 3 O ZnCl 2/calor O N Ph 2) PhCOOCH3 O FeCl 3 Ph CH3 H3C OH H3C H3C H2SO4 calor MOb 96 N N Ph Ph 4,6-dimethyl-2-phenylquinoline Br Br Análisis. La MOb 97, es un derivado de la quinoleina con sustituyentes en el anillo bencénico, por lo que sus desconexiones pueden postularse, considerando que la síntesis Br OH IGF RGF N H N MOb 97 N H CH3 CH3 CH3 5-bromo-8-methylquinoline C-C Br Br O O + NH2 CH3 CH3 H C-N H CH2 NH CH3 toluene corresponde al método de Skraup. Síntesis. La 5-bromo-2-metilanilina, se prepara a partir del tolueno. La misma se combina con la acroleína. El cierre del anillo y deshidratación se efectúan como en el anterior ejemplo. La aromatización se consigue con el As2O3, para generar la MOb 97 131 Wilbert Rivera Muñoz [email protected] O Br Br H CH2 1) Br2/FeBr3 2) HNO 3/H2SO4 NH2 3) Fe/HCl CH3 O H ZnCl 2/calor CH3 Br NH FeCl 3/calor CH3 Br As2O 3 Br OH H2SO4/calor N H N N H CH3 CH3 CH3 MOb 97 8.3.1.4. La síntesis de DÖBNER-MILLER9. El método requiere inicialmente la formación de un compuesto 1,3-diO, que generalmente es resultado de la condensación aldólica, así como un aldehído α,β-insaturado, que se adiciona a la anilina en 1,4, según la reacción de Michael, catalizado por HCl y calor o ZnCl2. Requiere también el uso de un agente oxidante para contrarrestar el poder reductor del hidrógeno formado en la reacción. Este método, suele dar rendimientos menores que la síntesis de Skraup, pero tiene la ventaja de operar con materiales de partida más baratos y de permitir la sustitución en cualquiera de ambos anillos de la quinoleina. Es quizá la más versátil de todas las síntesis de quinoleinas, pero su pobre rendimiento la limita en la práctica a aminas y compuestos carbonílicos que se obtienen a bajo costo. La retrosíntesis del método de Döbner-Miller, para la preparación de quinoleinas, puede postularse de la siguiente manera: OH OHC RGF N CH3 C-C IGF N H CH3 N H NH CH3 CH3 C-N OHC + NH2 1, 3-dinucleófilo CH3 1, 3-dielectrófilo Las limitaciones y ventajas de este método de síntesis, están sujetas a las que se presentan en las mismas condensaciones del tipo aldólico, utilizadas para generar el compuesto α,βinsaturado carbonílico. 9 . CASON J. Química Orgánica Moderna. Edit. URMO S.A. pág. 651 132 Wilbert Rivera Muñoz [email protected] Proponer un diseño de síntesis a partir de materiales simples, para las siguientes moléculas MOb 98 MOb 99 MOb 100 MOb 101 COOH CH3 CH3 N N N CH3 N CH3 OH Análisis. La MOb 98 es una quinoleina que sólo presenta sustituyentes en el anillo piridínico por lo que se puede desconectar, según el método de Döbner – Miller. Así, se llega a la anilina CH3 CH3 RGF CH3 IGF N H N MOb 98 N H CH3 CH3 CH3 C-C H3C H3C CHO CHO 1, 3-diO OHC CHO CH3 C-N + NH H2N CH3 CH3 CH3 y otras moléculas simples, como materiales de partida. Síntesis. La autocondensación del propanal, permite formar el 1,3-dielectrófilo que se combina con la anilina (el 1,3-dinucleófilo requerido). H3C H3C + CHO OHC CHO CHO CH3 H2N EtONa EtOH NH ZnCl 2 CH3 CH3 CH3 PhNO2 H2SO4 calor N H N H N CH3 CH3 CH3 CH3 MOb 98 OH CH3 CH3 La dihidroquinoleina, se somete a la acción del ác. sulfúrico en caliente y al final se utiliza un oxidante suave como en PhNO2, para formar la MOb 98 133 Wilbert Rivera Muñoz [email protected] Análisis La MOb 99, es muy parecida a la anterior, sólo se diferencia en la ubicación de los sustituyentes sobre el anillo piridínico, La serie de desconexiones nos conduce a un α,βinsat.CO, que tiene que ser preparado a partir de otros materiales. CH3 CH3 CH3 N H CH3 IGF RGF N MOb 99 OH CH3 N H CH3 C-C CH3 CH3 CH3 CHO OHC CHO 1, 3-diO + CHO H3C C-N + amina H2N H3C NH CH3 H2N Síntesis El compuesto α,βinsat.CO, se prepara a partir de dos aldehídos diferentes en medio ácido. El resto de reacciones es muy similar al anterior problema, sólo que esta vez CH3 CH3 OHC CH3 CHO CHO + CHO HAC calor NH H3C H3C CH3 CH3 CH3 ZnCl 2/calor OH CH3 N H CH3 H2SO4 DDQ calor N MOb 99 CH3 N H CH3 se utiliza el DDQ para formar la MOb 99. Análisis10. El único sustituyente en el anillo piridínico, orienta a que se inicie con una funcionalización y posterior desconexión de la MOb 100, según el método de DöbnerMiller. El benzaldehído y acetaldehído son los materiales de partida. 10 Una buena desconexión es: Aquella que permite obtener moléculas precursoras, cuya síntesis es mucho más fácil que la molécula desconectada La que conduce hacia un mecanismo conocido o aceptable de la reacción involucrada en la desconexión 134 Wilbert Rivera Muñoz [email protected] OH IGF RGF N N H Ph Ph N H MOb 100 Ph C-C OHC + OHC OHC 1, 3-diO CH3 C-N + amina OHC Ph NH NH2 Ph Ph H2N Síntesis. El benzaldehído se condensa con el acetaldehído, para luego reaccionar con la anilina, según la síntesis de DöbnerMiller. OHC + OHC OHC CH3 OHC Ph NH Ph Ph ZnCl 2/calor OH H2SO4 As2O 3 calor N Ph N H MOb 100 N H Ph Ph El benzaldehído mejora el rendimiento de la síntesis. Análisis La desconexión de la MOb 101, según Döbner-Miller conduce al ácido pirúvico y benzaldehído como materiales de partida. El ácido pirúvico es COOH COOH HO RGF N MOb 101 COOH IGF N H Ph Ph N H Ph C-C COOH COOH COOH ác. pirúvico O O 1, 3-diO CH3 O C-N + NH2 OHC Ph NH Ph Ph fácilmente obtenible por procesos de fermentación 135 Wilbert Rivera Muñoz Síntesis El carbonilo del benzaldehído es el más reactivo por lo que en medio ácido, reacciona con el enol del ácido pirúvico. [email protected] COOH COOH COOH O O + CH3 H + O PhNH2 ZnCl 2 calor calor OHC Ph NH Ph N H Ph Ph COOH COOH H2SO4/calor DDQ N Luego la anilina, se combina con el compuesto HO COOH Ph N H Ph MOb 101 α,β-insat.CO, para luego ciclarse con el ZnCl2 y aromatizarse con el DDQ, para obtener la MOb 101 8.3.1.5. Síntesis de FRIEDLÄNDER La reacción de condensación del tipo aldol, del 2-aminobenzaldehído con un aldehído (alifático o aromático) en medio básico, seguido de calentamiento y que produce una quinoleina, es conocida como la síntesis de Friedländer de las quinoleinas. La dificultad enorme que representa la preparación del orto-aminobenzaldehído, ha permitido la generación de otras alternativas, como por ejemplo utilizar un ortonitrobenzaldehido que luego de la condensación del grupo aldehído, el grupo nitro es reducido a amino, asimismo se recurre a la utilización de una orto-nitrobenzofenona, que prácticamente sigue un procedimiento similar. Sin embargo, pese a las variantes, la formación de la quinoleina, resulta de la condensación y ciclación intramolecular del intermedio formado de un compuesto 1,4-electrófilonucleófilo y un carbonilo enolizable como 1,2-electrófilo-nucleófilo. La orientación en la condensación y por tanto en el cierre del anillo depende de las condiciones utilizadas. En medio básico a bajas temperaturas (control cinético) la reacción transcurre más rápidamente por el enolato menos impedido estéricamente. En medio ácido a altas temperaturas (control termodinámico) la reacción tiene lugar a través del enol más estable (más sustituido). En todo caso ésta síntesis debe responder y seguir básicamente el camino inverso del siguiente análisis retrosintético: 136 Wilbert Rivera Muñoz [email protected] OH IGF C -N imina CHO N CHO NH2 NH2 1, 3-diO CHO CH3 + CHO NH2 1, 4-electrófilo-nucleófilo 1, 2-electrófilo-nucleófilo Proponer un diseño de síntesis, para cada una de las siguientes moléculas: MOb 102 MOb 103 MOb 104 MOb 105 CH3 CH3 MOb 106 Ph Ph COOEt CH3 N N N CH3 CH3 N N CH3 CH3 Análisis. La MOb 102, presenta una estructura ideal, para proponer sus desconexiones, según la síntesis de Friedländer. CH3 CHO CH3 C-N 1, 3-diO imina + CHO N MOb 102 CH3 CHO NO 2 NO 2 IGFs CH3 H3C AGFs CH3 RGF HO 3S NO 2 NO 2 El tolueno es el material de partida para la síntesis. Síntesis. El o-nitro benzaldehído, se condensa con el propanal en medio básico. La reducción del grupo nitro en medio ácido, permite al mismo tiempo obtener la MOb 102. H3C CH3 CH3 H2SO4 dil 1) H 2SO4 calor 2) HNO 3/H2SO4 HO 3S NO 2 NO 2 CrO 3 2 Ac2O OAc CH3 MOb 102 SnCl2 HCl CHO NO 2 CHO CH 3CH 2CHO H3O + OAc EtONa EtOH NO 2 NO 2 Análisis. La MOb 103, se desconecta según Friedländer 137 Wilbert Rivera Muñoz [email protected] CH3 CH3 C- N imina + O NO 2 N CH3 MOb 103 CHO CH3 1, 3-diO O NO 2 CH3 CH3 Síntesis. El o-nitro benzaldehído se condensa con la 3-pentanona, se reduce y cierra el heterociclo para formar la MOb 103. CH3 1) H O CH3 CH3 + SnCl2 2) CHO HCl O NO 2 CH3 N MOb 103 CH3 NO 2 CH3 Análisis. La MOb 104, se desconecta según las orientaciones de Friedländer. COOEt C-N imina N MOb 104 O NO 2 CH3 COOEt 1, 3-diO CHO CH3 NO 2 + COOEt O CH3 Síntesis Se utiliza un β-cetoéster para la condensación y llegar a formar la MOb 104 COOEt COOEt 2 CH3COOEt EtONa 1) Sn/HCl 1) EtONa 2) O CHO O NO 2 CH3 2) EtOH/H + MOb 104 CH3 NO 2 Análisis. La desconexión de la, MOb 105, según Friedländer, conduce a la onitrobenzofenona y a la 2-butanona, como precursores simples. CH3 CH3 CH3 CH3 C-N imina N Ph Ph Ph O 1, 3-diO O NO 2 + NO 2 CH3 MOb 105 O CH3 IGF Cl CH3 O IGFs NO 2 NO 2 Síntesis. El o-nitrotolueno, permite formar la o-nitrobenzofenona, que luego se condensa en medio ácido con el enol de la 2-butanona. 138 Wilbert Rivera Muñoz [email protected] La reducción del grupo nitro en medio ácido, permite la formación de un enlace imínico y la conformación de la MOb 105 Cl CH3 O 1) KMnO4 Ph 2) SOCl 2 NO 2 O NO 2 CH3 CdCl 2 NO 2 Ph2Cd PhMgBr O + CH3 , Ph H Ph CH3 CH3 Sn/HCl MOb 105 calor N O NO 2 CH3 CH3 2,3-dimethyl-4-phenylquinoline Ph Análisis. La MOb 106, se desconecta según Friedländer y se obtienen los mismos materiales de partida, que en el ejercicio anterior. Ph Ph CH3 1, 3-diO C-N + imina O NO 2 N MOb 106 O O NO 2 CH3 CH3 CH3 CH3 CH3 S S SH SH + H CH 3CHO S S CH3 Síntesis. La condensación de la o-nitro benzofenona, se efectúa con el enolato de la 2butanona, por lo que debe trabajarse en medio básico para esta finalidad. La reducción del grupo nitro y el cierre del anillo piridínico se efectúa en medio ácido y se forma CH3 SH CH 3CHO H SH H + Ph CH3 S S 1) nBuLi 1) EtONa O O 2) 2) CH 3CH 2Cl + 3) HgCl 2/H CH3 NO 2 Ph Ph Sn/HCl calor MOb 106 N CH3 O NO 2 CH3 así la MOb 106. 139 Wilbert Rivera Muñoz [email protected] 8.3.2. Síntesis de Isoquinoleinas. 5 4 6 3 N 2 7 8 1 Las isoquinoleinas difieren estructuralmente de las quinoleinas en la posición del nitrógeno, ya que esta última, no se encuentra fusionada, por lo que presenta una “reactividad alifática”. El ciclo de la isoquinoleina se encuentra en algunos alcaloides. Los métodos sintéticos más conocidos para la preparación de isoquinoleinas son: La síntesis de Pomeranz-Fritsch, la síntesis de Bischler-Napieralski, síntesis de Pictet-Gams y la síntesis de Pictet-Spengler. 8.3.2.1. Síntesis de POMERANZ-FRITSCH. Este método de síntesis de la isoquinoleina, se produce en dos etapas: En primer lugar, se condensa el benzaldehído (1,3-electrófilo-nucleófilo) con el dietilacetal del aminoacetaldehido (1,3-nucleófilo-electrófilo) para formar una aldimina estable. EtO EtO OEt EtO - H 2O 100 ºC O N H2N H benzaldehído OEt OEt N H H dietilacetal del aminoacetaldehido OH H Aldimina Seguidamente, la aldimina cicla en un medio ácido fuerte, a una imina, con eliminación simultánea de etanol, para producir una isoquinoleina. H EtO OEt + H conc. N + Et O EtO H N H + -EtOH N -EtOH N Aldimina Esta segunda etapa, al ser una sustitución electrofílica, está sujeta al efecto que tienen en dicha reacción los sustituyentes aceptores o donadores de electrones sobre el anillo bencénico. La hidrólisis de la imina en el medio ácido fuerte utilizado en la reacción, reduce el rendimiento del proceso. Este método, permite acceder a isoquinoleinas sustituidas en el C-1, para lo cual se han probado cetonas aromáticas, con rendimientos muy bajos. Sin embargo, se ha tenido mayor éxito al utilizar la variante de las bencilaminas adecuadamente sustituidas como1,4dinucleófilos y el dietilacetal del glioxal como. 1,2-dielectrólfilos 140 Wilbert Rivera Muñoz [email protected] EtO OEt H2SO4 NH2 O MeO + 160ºC H 2 EtOH N MeO CH3 CH3 Algo que debe quedar en claro, es que el método de Pomeranz-Fritsch y su variante, anteriormente analizada, no permiten preparar isoquinoleinas sustituidas en el C-3 y el C-4 del heteroátomo. El análisis retrosintético de este método, muestra los posibles intermediarios implicados en la reacción y los materiales probables de partida. OH OHC C-C IGF N N N R R R si R = H OHC + NH2 CHO 1, 3-electrófilo-nucleófilo1, 3-nucleófilo-electrófilo MOb 107 MOb 108 Br Proponer un diseño de síntesis, para cada una de las siguientes isoquinoleinas: N MeO N Ph Br Análisis. La desconexión de la MOb 107, se plantea siguiendo a Pomeranz-Fritsch. Así se arriba al tolueno como material de partida simple y asequible, para la síntesis. OEt Br OEt Br EtO Br IGF OEt Br C-C N N Br MOb 107 N Br AGF IGF Br Br OEt + CHO CHBr 2 CH3 CH3 EtO Br Br Br Br C-N imina Br AGF N NH2 Br 141 Wilbert Rivera Muñoz [email protected] Síntesis. El 2,4-dibromobenzaldehido, se combina con el diacetal del aminoacetaldehido. Se utiliza un medio ácido fuerte, y como catalizador el P2O5, para llagar a formar la MOb 107 EtO OEt EtO Br 1) Br2/FeBr3 2) Br2/calor CH3 NH2 3) H 2O OEt Br N CHO Br H2SO4 cc Br Br OEt Br H2SO4 cc MOb 107 N P 2O 5 N Br Br Análisis. La presencia de un sustituyente en el C1 de la isoquinoleina, conduce a desconectar la MOb 108, según Pomeranz-Fritsch. EtO OEt N OEt C-C IGFs N N MeO MeO MeO MOb 108 C-N imina Br EtO NO 2 + MeO OEt NH2 MeO + CHO NO 2 MeO Síntesis Se prepara el derivado de la bencialmina, para hacer reacciona con el diacetal del aminoaldehído, según la síntesis de Pomeranz-Fritsch, para formar la MOb 108. 142 Wilbert Rivera Muñoz [email protected] Br NH2 NO 2 MeO NO 2 MeO MeO Fe HCl EtONa OEt EtO OEt EtO H2SO4 MOb 108 N MeO H2SO4 OEt N CHO MeO cc P 2O 5 8.3.2.2. Síntesis de BISCHLER-NAPIERALSKI11. Este método sintético de las isoquinoleinas, implica la reacción de una Fenetilamina (1,5dinucleófilo) con un cloruro o anhídrido de ácido (electrófilo) para formar una amida, cuya ciclación con pérdida de agua conduce a una 2,4-dihidroisoquinoleina con un sustituyente en el C-1, que se oxida a isoquinoleina con Pd-C o disulfuro de fenilo. El paso de ciclación es una sustitución electrofílica aromática y por tanto se verá favorecida por sustituyentes electrodonadores en el anillo aromático de la fenetilamina. Las fenetilaminas m-sustituidas conducen exclusivamente a isoquinoleinas sustituidas en el C6, debido a la ciclación en la posición para respecto del grupo activante. El análisis retrosintético de las isoquinoleinas que se preparan por este método es como sigue RGF R C-C IGF N N R NH NH R O R OH C-N amida X + R= Alquil o aril NH2 1, 5-dinucleófilo O R electrófilo X = Cl, Br, OR, OCOR Los agentes de ciclación que con mayor frecuencia se utilizan en esta síntesis, son: P2O5 (pentóxido de fósforo) 11 CASON J. Op. Cit. Pág. 665 143 Wilbert Rivera Muñoz [email protected] POCl3 (oxicloruro de fósforo) y SOCl2 (cloruro de tionilo) MOb 109 Proponer un plan de síntesis para las siguientes isoquinoleinas: MOb 110 MeO N N H3C CH3 Análisis. Se funcionaliza a la hidroisoquinoleina de la MOb 109, lo que implica que el cierre del anillo pudo efectuarse por acilación con un grupo amida sobre el benceno, según Bischler-Napieralski. RGF IGF N N MOb 109 NH OH Ph Ph Ph C-C Cl CN IGF + NH2 C-N O Ph NH ami da O IGF Ph IGF Br OH Síntesis. El alcohol bencílico, es un buen material de partida para formar la fenetilamina, que se combina con el cloruro de benzoilo. El producto se cicla y aromatiza con Pd/C y calor para formar la MOb 109 Cl O 1) PBr3 OH Ph 2) KCN NH NH2 3) LiAlH4 O Ph P 2O 5 Pd/C MOb 109 N AlCl3 calor N NH calor OH Ph Ph Ph 144 Wilbert Rivera Muñoz [email protected] Análisis. La MOb 110, se desconecta, siguiendo a Bischler-Napieralski. Así se arriba a las moléculas de partida como el nitrometano y el 3-metoxibenzaldehido. MeO MeO MeO IGF RGF N MOb 110 NH N Ph Ph Ph MeO C-C MeO O IGF MeO Cl + NH2 Ph NO 2 OH C-N O AGF NH Ph MeO C-C MeO CHO + NO 2 CH3 NO 2 Síntesis. El 3-metoxibensaldehido, puede obtenerse con buenos rendimientos a partir del fenol. Éste se condensa con nitrometano. El grupo nitro luego se reduce a amino, que ahora se combina con cloruro de benzoilo, que calentado en presencia de un catalizador como el P2O5, se cicla. Finalmente se calienta con Pd/C, para llegar a la MOb 110. CH3 MeO CHO MeO MeO 1) H 2/Pd NO 2 3-methoxybenzaldehyde O MeO MeO Cl 1) AlCl3 Pd/C MOb 110 NH2 NO 2 2) Fe/HCl EtONa calor N 2) P 2O5, calor Ph O NH Ph Ph 8.3.2.3. Síntesis de PICTET – GAMS. Es una variante de la síntesis de Bischler-Napieralski, en este método se utilizan Fenetilaminas potencialmente insaturadas, obteniéndose un heterociclo totalmente aromático, no siendo por lo tanto necesaria la aplicación de oxidantes. El análisis retrosintético de este método, muestra las siguientes reconexiones y materiales de partida potenciales 145 Wilbert Rivera Muñoz [email protected] OH OH R R N O amida NH + NH2 O R R= Alquil o aril X R C-N C-C R electrófilo 1, 5-dinucleófilo R X = Cl. OR MOb 111. Proponer un diseño de síntesis para la siguiente isoquinoleina: MeO CH3 N CH3 Análisis. Se sigue a Pictet-Gams, para la desconexión de la MOb 111 OH MeO CH3 CH3 N MOb 111 OH MeO MeO CH3 NH H3C CH3 NH OH O CH3 OH Cl O MeO MeO CH3 CH3 + NH2 MeO CH3 MeO O CH3 CHO + Ph3P=CHCH 3 Síntesis. Se aplica la síntesis de Pictet-Gams, por lo que no es necesario utilizar un oxidante al final, para llegar a la formación de la MOb 111. MeO OH O CHO MeO 1) Ph3P=CHCH 3 CH3 MeO 2) MCPBA 2) H 3O + NH2 OH OH MeO CH3 POCl3 MOb 111 CH3 1) NH 3 Cl MeO CH3 O AlCl3 CHCl 3 calor NH H3C OH calor CH3 NH O CH3 146 Wilbert Rivera Muñoz [email protected] 8.3.2.4. Síntesis de PICTET – SPENGLER Las Fenetilaminas también pueden reaccionar con aldehídos con buenos rendimientos, dando aldiminas que puede ciclar en medio ácido a 1,2,3,4-tetrahidroisoquinoleinas, que deben ser oxidadas para producir isoquinoleinas. Esta ciclación precisa de sustituyentes activantes colocados adecuadamente, para activar las posiciones orto al grupo aminoetilo, razón por la cual el cierre del anillo ocurre siempre en posición para al activante. Cuando el anillo aromático está activado con sustituyentes hidroxílicos, el cierre del anillo se produce en condiciones muy suaves, debido al efecto fuertemente activador del OHEl análisis retrosintético de una isoquinoleina formada por el método de Pictet-Spengler12, muestra las desconexiones y materiales de partida siguientes: C-C RGF N R N NH NH R R R= Alquil o aril + NH2 Fenetilamina CHO R aldehído ….. MOb 113 MOb 112 HO MeO Proponer un plan de síntesis para la siguientes Isoquinoleinas: R C=N N NH HO O O Análisis. La MOb 112, se desconecta, según lo propuestos por Pictet-Spengler. Los materiales de partida son formaldehído un derivado del benzaldehído y un nitrometano 12 Amé Pictet (1857-1937) fue uno de los seis miembros de la representación suiza y actuó como secretario del Congreso de Química de Ginebra. Como representante de la Helvética Chemica Acta, una de las principales revistas internacionales de química, siguió realizando una intensa labor en las reformas de la nomenclatura química que siguieron a la de Ginebra. 147 Wilbert Rivera Muñoz [email protected] MeO MeO MeO C-C IGFs NH NH N HO OH H MOb 112 H IGF MeO CHO + MeO CH3 C-C MeO + NO 2 HCHO C-N NH2 N H Síntesis. La ciclación ocurre en medio ácido y se utiliza el DDG, para aromatizar la hidroisoquinoleina formada para llegar a preparar la MOb 112 MeO MeO MeO CHO HCHO 1) CH 3NO 2 NH2 EtONa/EtOH 2) Sn/HCL NH HO H MeO MeO HCl/calor DDQ MOb 112 N Análisis Siguiendo a Pictet – Spengler, para la desconexión de la MOb 113, se arriba al material de partida, como el 4-(2hidroxietil)-1,2bencenodiol N HO HO O Protec RGF N NH HO N HO O MOb 113 OH OH OH O OH O C=N O O CHO NH2 O O CH2OH + CHO CHO HO O HO OH O OH 148 Wilbert Rivera Muñoz [email protected] CHO CH2OH Síntesis Se aplica la síntesis de Pictet – Spengler, para formar la MOb 113 1) PCC HO 2) HCHO/H + HO HO O PH O 6-7 NH HO O O CHO 1) NH 3 2) LiAlH4 O NH2 O OH DDQ OH MOb 113 8.3.3. Síntesis de BENZODIAZINAS Las estructuras de las benzodiazinas, se encuentran en muchos alcaloides, principalmente como un sistema de anillo quinazolónico. Los otros derivados de la benzodiazina, como las cinnolinas, quinoxalinas y fatalizinas, son también parte importante de muchos fármacos de un espectro de uso significativo, que los hacen en general, muy importantes dentro la síntesis orgánica y particularmente la farmacoquímica. Así, se los puede encontrar como antiinflamatorios, antihipertensivos, antibacterianos, analgésicos, antibióticos, etc. N N N N . N N N N Quinoxalina Ftalizina Cinnolina Quinazolina 8.3.3.1. Síntesis de las Cinnolinas De acuerdo a la estructura que presenta la cinnolina, se tiene las siguientes opciones para su síntesis: Síntesis de von Richter: OH COOH COOH COOH H2O HONO R HCl NH2 R 70ºC + N2 Cl- R N N calor OH R N N 149 Wilbert Rivera Muñoz [email protected] Síntesis de Widman – Stoermer: R R CHR' R R' CHR' HONO calor HCl N + NH2 N2 Cl- N MOb 114 OMe Proponer un plan de síntesis para la siguiente molécula: Ph N N Análisis La MOb 114, se empieza a desconectar, tomando en cuenta la síntesis de WidmanStoermer. El resto de desconexiones, corresponden a reacciones muy comunes. Así se arriba al orto-nitrotolueno, como material de partida OMe OMe OMe Ph Ph Ph N + N MOb 114 N H H N Cl- NH2 OMe OMe Cl CH3 O + NO 2 NH2 + Ph3P=CHPh O NH2 Síntesis La formación de la MOb 114, por el diseño que se propone, estará limitada por el rendimiento bajo que se obtiene en la síntesis del orto-nitrotolueno 150 Wilbert Rivera Muñoz [email protected] Cl CH3 1) KMnO4/H + OMe O 2) Fe/HCl NO 2 3) PCl 5 NH2 OMe HO AlCl3 OMe Me2SO4 O Ph3P=CHPh NH2 OMe OMe Ph H calor NH2 NaNO 2 HCl Ph Ph MOb 114 N + N N H N Cl 8.3.3.2. Síntesis de las quinazolinas. Dentro de las síntesis clásicas para las quinazolinas, se pueden mencionar a las siguientes: O Cl O i. Síntesis de R' Niementowski: PCl OH N N RCONHR' NH2 5 N N R R ii. Otras variantes: Ph Cl N H2NCONH 2, HCOOH Ph ( 87%) Cl N O Ph Cl NH2 Me N (MeNH)2CO, HCOOH ( 17%) N NH2 N NH2 N RCN N R 151 Wilbert Rivera Muñoz [email protected] R R O N NH 3 NHCOR' N R' R iii. Más reacciones que forman buenos precursores de la quinazolina: R NHR CH3 NOH N NHCOR' + N R' O- N (EtO)3CH NH2 NH2 N N NHR N R MOb 115 CH3 Proponer un diseño de síntesis, para la siguiente quinazolina: N N Ph OMe Análisis. Se inicia la desconexión de la MOb 115, con una IGF, para desconectar por el enlace C-N, y llegar a una molécula precursora o equivalente sintético, que hace vislumbrar la síntesis de esta molécula por una de las variantes de la síntesis de Niementowski N N OMe CH3 CH3 CH3 NH O N IGF N H Ph Ph OMe OMe MOb 115 CH3 Ph NH OH CH3 C-N imina CH3 O O O O IGFs + C-N Ph O amida Cl NH Ph NH2 OMe OMe OMe Síntesis Puede partirse del benceno o la 3-metoxiacetofenona, fácilmente obtenible a partir del benceno y seguir con la nitración de la misma, para introducir el grupo amino, que transformado en amida y amoniaco permiten llegar a la MOb 115. 152 Wilbert Rivera Muñoz [email protected] CH3 CH3 CH3 O 1) HNO 3/H2SO4 O O O Ph Cl 2) Fe/HCl O NH NH2 OMe OMe OMe CH3 NH 3 CH3 N N Ph N H OMe CH3 N POCl3 MOb 115 Ph NH O calor Ph NH OH OMe Ph OMe 8-methoxy-4-methyl-2-phenylquinazoline 8.3.3.3. Síntesis de Ftalizinas. La Ftalizinas, pueden prepararse en función del siguiente análisis retrosintético: R R N C=N O N R' O + NH2 NH2 R' Las limitaciones de esta síntesis, están en relación a aquellas que se presentan en la preparación del compuesto 1,2-dicarbonílico aromático. MOb 116 Cl Proponer un diseño de síntesis para la siguiente molécula: N N S Análisis. Con los IGFs necesarios de la MOb 116, se forma una molécula precursora cuya desconexión, muestra el uso de la hidrazina, sobre un compuesto dicarbonílico aromático y el tiofeno. 153 Wilbert Rivera Muñoz La molécula de partida previsible es el anhídrido ftálico. [email protected] O Cl O NH N OEt IGFs N NH2 C-N N O NH2 S C-C S S O MOb 116 O OEt IGF O S + O O O Síntesis. El anhídrido ftálico es un buen material de partida por su bajo costo y fácil preparación. O OEt O + OEt 1) MeOH/H O tiofeno O SnCl4 2) SOCl 2 O CH 2Cl 2 O S Cl NH2 NH2 H2O/EtOH O OH Cl El resto de reacciones, permiten mostrar el uso de la hidrazina. Se utiliza el POCl3, como agente directo para desplazar el OH e introducir el Cl N NH N N N S S S N POCl3 MOb 116 Cl, para la síntesis de la MOb 116. 8.3.3.4. Síntesis de Quinoxalinas Las quinaxolinas, posiblemente sean los isómeros de la benzodiazina más fáciles de preparar. Así, la síntesis de las Quinaxolinas podría encararse según el criterio que se siga en la desconexión inicial de la molécula a ser sintetizada y la presencia de sustituyentes en ambos anillos. N NH2 R R' R' N R' O R O R' + NH2 154 Wilbert Rivera Muñoz Sintetizar moléculas: las [email protected] siguientes MOb 117 MOb 118 O H3C N H3C N N N N O N Análisis. El F, de la MOb 117, es fácilmente sustituido por un nucleófilo, como la pirrolidina. La desconexión C=N, imínica se efectúa en una de las formas tautoméricas del precursor formado. H3C N N C-N H3C N F + amina H3C N MOb 117 H3C H3C H2N O F O H3C N H3C N F C-N + H3C HN N imina H2N Síntesis. El compuesto dicetónico y el diamino aromático, no presentan dificultad en su preparación, como materiales de partida de la MOb 117. H3C O H2N F H3C N H3C N F + H3C biacetyl O HN H2N EtONa 2-amino-4-fluorophenylamine H3C N H3C N N MOb 117 2,3-dimethyl-6-pyrrolidin-1-ylquinoxaline Análisis. Se inicia la desconexión por el enlace C-N de la amida presente en la MOb 118 y posteriormente por los enlaces imínicos. El 3-amino-4-nitrobenzoato de etilo, puede ser todavía desconectado hasta la anilina como material de partida 155 Wilbert Rivera Muñoz [email protected] O O . N N NH C-N N amida O EtO + O N MOb 118 N morpholine C- N imina O O NH2 NH2 EtO EtO + CHO NH2 NO 2 CHO Síntesis. A partir de la anilina se forma el intermediario 3-amino-nitrobenzoato de etilo, que se combina con el oxaldehido y posteriormente con la morfolina para formar la MOb 118 O O O NH2 EtO NH2 Sn EtO CHO CHO N EtO HCl N NH2 NO 2 O ethyl 3-amino-4-nitrobenzoate NH N O N MOb 118 O N 6-(morpholin-4-ylcarbonyl)quinoxaline 8.3.4. Síntesis de INDOLES El sistema de anillos del indol se ha encontrado en muchos compuestos naturales de gran interés químico y bioquímico. Así, el triptófano es un aminoácido esencial, el índigo un colorante y el ácido indolil-3-acético, una hormona de crecimiento vegetal. Por otro lado, el interés en estas moléculas surge de su uso farmacológico, son un ejemplo el sumatriptan (antimigrañas) y el frovatriptan también antimigrañas. Los métodos de síntesis clásicos de indoles, son los de Fischer, Bischler, Reissert y Leimgruber-Batcho 8.3.4.1. Síntesis de FISCHER Consiste en calentar fenilhidrazonas de cetonas o aldehídos, con cloruro de zinc anhidro, trifluoruro de boro, ácido polifosfórico, o algún otro catalizador acido, para producir indoles. Ocurre una transposición, catalizada por ácidos, de una fenilhidrazona con eliminación de agua y NH3. Los grupos electrodonadores favorecen la ciclación y los electroatractores la dificultan. 156 Wilbert Rivera Muñoz [email protected] Con cetonas asimétricas, la ciclación intramolecular de la hidrazona puede conducir a dos indoles isómeros en distintas proporciones según las condiciones utilizadas, en medios fuertemente ácidos, puede predominar el indol menos sustituido. CH3 CH3 a b a CH3 b CH3 N N H N H NH (2Z)-butan-2-one phenylhydrazone HAc 100 0 PPA 50 50 22 78 MeSO3H, P4O 10 CH3 Cuando existen sustituyentes en meta, respecto al nitrógeno de la hidrazona, la ciclación puede tener lugar en dos posiciones, que conducen a dos indoles isómeros: G H3C 4 R G G N H NH R + R N 6 N H Si el sustituyente G es electroatractor, los dos isómeros (4- y 6-) se forman aproximadamente en la misma proporción. En cambio si G es un sustituyente electrodonador, se forma mayoritariamente el isómero sustituido en 6R El análisis retrosintético del indol formado por la síntesis de Fischer, se puede plantear de la siguiente manera: R R H R1 R1 AGF R1 + H H H H R H + N N N N H H R R H R1 NH R1 + N NH2 H R NH2 + N H H R H R R1 R1 NH NH N R1 H R1 N NH NH2 O NH 157 Wilbert Rivera Muñoz [email protected] Proponer un plan de síntesis para las siguientes moléculas: MOb 119 MOb 120 O O O N H H3C N H Análisis. La desconexión fundamental en los indoles que se supone, se forman por la síntesis de Fischer, corresponde a una retro-transposición, que se muestra en la desconexión de la MOb 119. La siguiente desconexión genera un precursor derivado de la fenilhidrazina. Transpo NH N H H3C N NH NH H3C C-N imina H3C 5-methyl-1,2,3,3a,4,8b-hexahydrocyclopenta[b]indole MOb 119 + NH2 NH + N2 Cl- NO 2 O H3C CH3 CH3 1-methyl-2-nitrobenzene Síntesis. Se parte del 1.metil-2-nitrobenceno para formar el derivado fenilhidrazìnico requerido, para combinarse con la ciclopentanona y por transposición de esta molécula formar la MOb 119. Na 2SO3/H2O 1) Fe/HCl 2) NaNO 2/HCl NH2 + NO 2 N2 Cl- CH3 NH O H3C CH3 ZnCl 2 MOb 119 N 170 H3C N H NH NH H3C NH H3C 158 Wilbert Rivera Muñoz [email protected] Análisis. La retro-transposición de la MOb 120, permite ver las estructuras de la cetona y el derivado de la fenilhidrazina, utilizados en la su síntesis. O O O O O O transpo O O O MOb 120 N NH N H NH NH C-N imina O HO O IGF O HO O + IGF O NO 2 NH2 + N2 Cl- 4-nitrobenzene-1,2-diol NH Síntesis. Se protege los OH de la molécula de partida, formando un acetal cíclico y se reduce el grupo nitro para luego diazotar el amino. La reducción del diazocompuesto formado con sulfito de sodio, permite obtener el derivado de fenilfidrazina, que se combina con la ciclohexanona, que luego condice a la MOb 120. O O 1) Fe/HCl HO 2) HCHO/H + Na 2SO3/H2O O 3) NaNO 2/HCl HO O NH2 + N2 Cl- NO 2 NH O O MOb 120 O O O ZnCl 2 calor O O NH NH N NH 8.3.4.2. Síntesis de BISCHLER Consiste en una ciclación, catalizada por ácidos, de una α-arilaminocetona, que se prepara a partir de una anilina y un α-halocarbonilo. Utilizando α-aminocetonas N-aciladas, la ciclación es más controlable y permite obtener indoles sustituidos en el anillo heterocíclico 159 Wilbert Rivera Muñoz [email protected] R R HO R AGF C-C N N H R O AGF N N COCF 3 CF 3 COCF 3 O C-N + CF 3COCl NH2 C-N R O amida NH COCF 3 Br ….. MOb 122 MOb 121 Ph Proponer un diseño de síntesis para las siguientes moléculas: N CH3 N H H3C Análisis. La MOb 121, el 3-fenil- 1H-indol, puede llevarse por dos IGFs hacia una estructura, desconectable por un enlace C-C, según propone la síntesis de Bischler.La anilina es una buena molécula departida para la síntesis de la MOb 121. Ph Ph HO Ph IGF AGF N H MOb 121 N N CF 3 CF 3 C-C O O Ph O Ph NH2 Cl + C-N C-N O NH CF 3 O CF 3 O N + CF 3 Br O Síntesis. Partiendo de la anilina, se puede obtener la amida requerida, que luego reaccionará con el α-bromo benzofenona, para formar una molécula que cicla con PPA- La aplicación de una base como el KOH y calor, se forma la MOb 121 160 Wilbert Rivera Muñoz [email protected] Ph O Cl Ph O CF 3 Br O N NH NH2 CF 3 CF 3 O O PPA calor Ph Ph KOH N MOb 121 N H 3-phenyl-1H-indole CF 3 O Análisis. La MOb 122, 1,2-dietil-1H indol se desconecta según las previsiones de una síntesis de Bischler. Lo que conduce a la anilina como material de partida simple y asequible. OH OHC IGF C-C Et Et Et N N N Et 1,2-diethyl-1H-indole MOb 122 Et Et C-N OHC C-N + Et + Br NH NH2 Et Br Et Síntesis. Nuevamente, se inicia la síntesis de la MOb 122, con la anilina y según la síntesis de indoles de Bischler y un alfa-bromo butanal OHC Et Et Br NH2 OHC Br NH Et Et N PPA calor Et Et PPA: acido polifosforico N MOb 122 Et 161 Wilbert Rivera Muñoz [email protected] 8.3.4.3. Síntesis de REISSERT En este método es fundamental que los hidrógenos del sustituyente en la posición orto al grupo nitro sean suficientemente ácidos, y por lo tanto el nucleófilo esté garantizado en su formación, para combinarse con un compuesto carbonílico. R R R AGF COOEt AGF COOEt N H N H OH N H C-N R R R EtO + COOEt COOEt IGF COOEt C-C O O O NH2 NO 2 NO 2 Proponer un plan de síntesis para las siguientes moléculas: MOb 123 MOb 124 Ph COOEt Ph N H H3C N H Análisis. La MOb 123, es un derivado del indol, que puede plantearse su desconexión, tomando en cuenta la síntesis de indoles de Reissert. Así, se llega al p-xileno como material de partida. IGF COOEt H3C MOb 123 COOEt N H H3C N H CH3 C-N EtO COOEt COOEt + O NH2 H3C OH H3C NH2 O IGF CH3 H3C CH3 RGF NO 2 1,4-dimethyl-2-nitrobenzene H3C p-xylene 162 Wilbert Rivera Muñoz [email protected] Síntesis. El p-xileno se transforma en un nitroderivado, como el intermediario requerido, para ciclarse, descarboxilarse y así formar la MOb 123. CH3 1`) HNO 3/H2SO4 2) EtOK/EtOH COOEt 3) (COOEt) 2 H3C NO 2 O H3C H2, Pd/C p-xylene COOEt N H ethyl 6-methyl-1H-indole-2-carboxylate H3C MOb 123 Análisis. La MOb 124, se empieza a desconectar según la estrategia que mejor convenga, para vincularlo con la síntesis de Reissert. Ph Ph Ph Ph Ph Ph IGF AGF COOEt COOEt N H N H 3,5-diphenyl-1H-indole MOb 124 Ph OH N H Ph Ph Ph + NO 2 EtO COOEt COOEt NO 2 O O 3-benzyl-4-nitro-1,1'-biphenyl Síntesis. El material de partida que se propone para la síntesis de la MOb 124, puede prepararse a partir del benceno Ph Ph Ph 1) EtOK/EtOH Ph 2) (COOEt) 2 COOEt NO 2 H2 NO 2 O 3-benzyl-4-nitro-1,1'-biphenyl Pd/C Ph Ph Ph Ph MOb 124 1) H 3O calor N H 3,5-diphenyl-1H-indole + COOEt N H 8.3.4.4. Síntesis de LEIMGRUBER-BATCHO Al igual que en el anterior método, se tiene que garantizar la acidez del sustituyente en la posición orto al grupo nitro, el electrófilo que se requiere lo aporta el aminodiacetal. 163 Wilbert Rivera Muñoz [email protected] Me Me + N N H N H CH3 EtO N Me NH2 OEt OEt OEt + NMe2 NMe2 NMe2 Aminodiacetal NO 2 Me NH2 NO 2 ….. MOb 126 MOb 125 Proponer un plan de síntesis para las siguientes moléculas: H3C CH3 N H N Et Análisis. Se utiliza la estrategia de desconexión que emerge de la síntesis de LeimgruberBatcho, para la MOb 125 H3C H3C MOb 125 H3C H3C CH3 AGF N N H N H CH3 C-N + N NH2 CH3 CH3 AGF CH3 OEt H3C H3C OEt OEt IGF + NO 2 NMe2 NMe2 NMe2 NO 2 NH2 Síntesis. El intermedio 2,4-dimetil-1-nitrobenceno, puede prepararse a partir del benceno y continuar con las reacciones previstas en el método de Leimgruber-Batcho, para la síntesis de la MOb 125. EtO H3C OEt H3C CH3 H3C OEt NMe2 OEt H2 NMe2 EtOK/EtOH NO 2 NO 2 Pd/C NMe2 NH2 calor 2,4-dimethyl-1-nitrobenzene H3C CH3 N H3C CH3 calor + calor N H H3C N H N CH3 NH2 CH3 MOb 125 5-methyl-1H-indole 164 Wilbert Rivera Muñoz [email protected] Análisis. El grupo metilo en el C2 del indol, obliga a que las desconexiones se vinculen a la presencia de un grupo acetilénico, que se llegará a combinar con el grupo amino. La MOb 126, puede así, sintetizarse a partir del 1-bromo-2-nitrobenceno. CH3 CH3 N MOb 126 CH3 C-N NH Et NH2 IGF Et CH CH3 Br NO 2 NO 2 NO 2 1-bromo-2-nitrobenzene Síntesis. Para introducir el grupo acetileno en el benceno, se hace reaccionar un organomagnésico, con el acetileno. La ciclación se produce por una reacción del grupo amino con el triple enlace. Las reacciones siguientes permiten formar la MOb 126. CH Br CH3 1) Mg/eter 1) NaNH 2 2) HC 2) CH 3Br CH Fe/HCl NO 2 NO 2 NO 2 1-ethynyl-2-nitrobenzene CH3 CH3 calor EtBr CH3 NH2 NH N Et Et 1-ethyl-2-methyl-1H-indole MOb 126 8.3.5. Síntesis de BENZOFURANOS El benzofurano, usualmente llamado cumarona, es un liquido incoloro, que es aislado del alquitrán de hulla y es mucho más estable al atasque químico que el furano. Se hará mención y desarrollaran las síntesis más clásicas para la preparación de benzofuranos: a. A partir de la cumarina. Br + COO- K Br Br2 O O KOH O Br O- K+ O destilacion COOH CaO O O b. A partir de una reacción de condensación de Claisen interna. 165 Wilbert Rivera Muñoz [email protected] HO COR R COR COOEt EtONa BrCH 2COOEt ONa COOEt O O EtONa/EtOH R COOEt O c. A partir de una transposición de Claisen H2C ClCH2CCl=CH2 K2CO 3/ Me2CO OH Cl Cl calor PhNEt2 CH2 OH O HCl conc. CH3 O ….. MOb 128 MOb 127 H3C Ph Proponer un diseño de síntesis, para los siguientes benzofuranos: O O Análisis. La estrategia de desconexión, en la MOb 127, se direcciona hacia un intermediario, que es un derivado de la cumarina, la cual a su vez se prepara por reacción de condensación del tipo aldólico entre el acetato de etilo y un, derivado del benzaldehído. H3C H3C H3C COO-K AGF COOH O O O-K + + Br MOb 127 Br H3C H3C H3C Br RGF COOEt OH H3C O O O O CHO + CH3 COOEt OH Síntesis. El intermediario 2-hidroxi-5-metilbenzaldehido, se prepara a partir del benceno. El derivado de la cumarina que se forma, se halogena hidroliza en sol de KOH y posteriormente se calienta con CaO, para descarboxilar y así formar la MOb 127 166 Wilbert Rivera Muñoz [email protected] H3C H3C CHO H EtONa CH3 + EtOH COOEt OH 2-hydroxy-5-methylbenzaldehyde COOEt OH O O Br2/CCl 4 H3C H3C + H3C COO-K calor COOH O-K + KOH Br Br + H3C Br O O CaO/calor O H3C MOb 127 O 5-methyl-1-benzofuran Análisis. La MOb 128 se funcionaliza con la adición de un grupo –COOEt, que permite luego desconectar por el enlace C=C. El compuesto dicarbonílico intermedio se forma por la reacción de un bromo éster con un derivado cetónico del fenol. Ph Ph Ph OH AGF IGF COOEt COOEt O O MOb 128 O Ph Ph COOEt O O + COOEt O Br OH Síntesis. Se utiliza la condensación de Claisen, para formar los intermediarios que suegra ciclarse y descarboxilarse con el calentamiento final y así formar la MOb 128 Ph Ph Ph OH COOEt O + Br EtOK EtOK O COOEt COOEt OH (2-hydroxyphenyl)(phenyl)methanone O O Ph EtOK/EtOH Ph 1) H 3O + COOEt 2) CaO/calor MOb 128 O O 3-phenyl-1-benzofuran 167 Wilbert Rivera Muñoz [email protected] 8.3.6. Síntesis de BENZOTIOFENOS El benzotiofeno, es la impureza azufrada más importante del naftaleno técnico, por lo que el benzotiofeno mismo tiene poco valor comercial, pero alguno de sus derivados en forma de colorante de índigo tiene un gran valor. Los métodos sintéticos del benzotiofeno, son similares a los utilizados para el benzofurano, pero se pueden mencionar los siguientes métodos. a. A partir de benzotioderivados adecuados: Li (SCH 2CH(OMe)2)2 S S PPA SH MeO OMe BrCH 2CH(OMe)2 b. Por intermedio de una reacción de Diels-Alder O O O O + O descarboxilacion S deshidrogenacion H2C S S c. Por desplazamiento de grupos orto a un grupo ciano (que conducen a compuestos 3-amino) o aldehído en un anillo bencénico por un nucleófilo azufrado adecuado y subsiguiente ciclización. CHO CHO HSCH2COOMe COOMe base, o DMF NO 2 HNO 3 S SCH2COOMe Proponer un plan de síntesis factible para las siguientes moléculas: ….. MOb 130 MOb 129 H3C COOEt S S Análisis. MOb 129 H3C H3C OMe MeO H3C MeO OMe + S S SH Br MOb 129 168 Wilbert Rivera Muñoz Síntesis MOb 129 [email protected] H3C MeO OMe OMe MeO H3C + SH Análisis MOb 130 H3C PPA S MOb 129 S Br COOEt + COOEt S COOEt CHO CHO HS S NO 2 MOb 130 CHO Síntesis MOb 130 CHO COOEt DMF EtONa COOEt EtOH + COOEt S NO 2 HS S MOb 130 PROBLEMAS: Proponer un diseño de síntesis, a partir de materiales simples y asequibles para las siguientes moléculas: 1 2 3 CH3 4 O N CH3 N H H3C O N O N H N 5 H3C H N H3C N N O Ph 6 7 8 9 10 CH3 CH3 CH3 OH CH3 O O CH3 N N H Ph OMe O N H N Ph H3C N 169 Wilbert Rivera Muñoz 11 [email protected] 12 13 Ph 14 O 15 H3C NH2 O N H N N N R O CH3 O N O N CH3 O N H CH3 16 17 18 Br 19 20 Ph Ph N Ph N CH3 N Ph N H N CH3 N N Ph Ph H3C 21 22 23 Ph N 24 N 25 O Ph N N N COOEt N N O CH3 H3C N O CH3 COOEt Ph 26 27 28 29 Br CHO 30 Me Ph Br N N N N CF 3 31 32 O O O O 34 H O N O O N CH2Ph Et Ph 35 H H O H N H Et 33 N Et N CF 3 tBu PhCH2 Ph H COOMe N N N CH3 H CH3 Ph H 170 Wilbert Rivera Muñoz 36 [email protected] 37 38 39 MeO 40 CH3 O H N N N NH N H3C NH N MeO N N O N O N CH3 N O CH3 O CH3 N N CH3 CH3 41 42 Ph 43 COOEt CH3 NH2 44 H3C HN CH3 O N N CH3 45 Ph NH CH3 O Ph N O N N N CH3 N Ph Ph CH3 REFERENCIAS BIBLIOGRAFICAS 1. ACHESON R.M. “Química Heterocíclica”. 1ra. Edición, México 1981. Publicaciones Cultural S.A. 2. ALCÁNTARA A.R. Grupo de Biotransformaciones. Dpto. Química Orgánica y Farmacia. Facultad de Farmacia UCM. 3. ALCUDIA F. et.al. “Problemas en Síntesis Orgánica”. Edit. Alambra S.A. Madrid. 1978 4. BORRELL J.I. “Introducción al Análisis Retrosintético”. Laboratori de Sintesi. Grup d’Enginyería Molecular (GEM). Institut Químic de Sarriá, Universitat Ramon Llull. España. (Diapositivas de apoyo para Clases) 5. CASON J. Química Orgánica Moderna. Urmo S.A. Ediciones. 1975 6. ESCOBAR G.A. Curso de Síntesis Orgánica en línea. Universidad de Antioquia. 7. FONT A. M. Apuntes de Química Farmacéutica I. Facultad de Farmacia Universidad de Navarra 8. FOX M.A.-WHITSELL J. “Química Orgánica”. 2da. Edición. Edit. Pearson Educación 200 9. KOCOVSKY P. Organic Syntesis 1 (Level 3) 10. MAHLER G. Apuntes de Síntesis de Fármacos. Heterociclos. 2006 11. McMURRY J. “Química Orgánica”. 6ta. Edición. Edit. Thomson. 2004. 12. MONSON R.S. Advanced Organic Síntesis. Methods and Techniques. Dpto de Chemistry Californis State. College Hayward. Academic. Press. New Cork an London. 1971 13. RAVELO S. J.L. Compuestos Heterocíclicos. Tema 9. 171 Wilbert Rivera Muñoz [email protected] 14. RIVERA M. W. Síntesis de Fármacos. Apuntes de Clase UATF. 2009 15. _____________. Síntesis de Compuestos Heterocíclicos (el método del sintón). Apuntes de Clase. UATF. 2008 16. WARREN S. Diseño de Síntesis Orgánica (Introducción programada al método del sintón). Edit. Alhambra S. A.. 1983. España. 17. ___________. Workbook for Organic Síntesis. J. Wiley & Sons Chichester. 1982 Sitios Webb de referencia: http://www.organic.wsu.edu/crouchweb/chem240/lab_main.htm http://www.washburn.edu/cas/chemistry/sleung/o_chem_online_problems/pdf_files/ http://www.drugfuture.com/OrganicNameReactions/ONR153.htm http://www.anpro.com/support/MSDS.pdf http://monographs.iarc.fr/ENG/Monographs/vol60/volume60.pdf http://www.organic-chemistry.org/Highlights/ http://www.organic-chemistry.org/reactions.htm 172