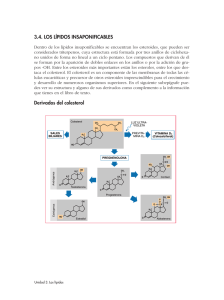
Química Unidad 3. Principios de química orgánica Ciencias de la Salud Biológicas y Ambientales | Ingeniería en Biotecnología Químico Unidad 3. Principios de química orgánica Unidad 3. Principios de química orgánica Presentación de la unidad En esta tercera unidad profundizarás en el estudio de los átomos de carbono, hidrógeno, oxígeno, nitrógeno y halógenos (F, Cl, Br, I y At), los cuales forman diversos compuestos tales como: Alcanos Alquenos Alquinos Cetonas Alcoholes Aminas Amidas Halogenuros, entre otros. Figura 1. Imagen tomada de: http://www.scienceclarified.com/OiPh/Organic-Chemistry.html También identificarás las principales reacciones que se llevan a cabo en química orgánica. Para finalizar, estudiarás algunas biomoléculas como son: los lípidos, las proteínas y los carbohidratos, con la finalidad de conocer sus funciones, y revisarás las reglas para nombrar a las sustancias orgánicas establecidas por la IUPAC. ¡Adelante! Propósito Identificar la estructuración y formulación de los compuestos orgánicos, los cuales tienen como base fundamental al carbono Identificar las propiedades físicas y químicas que les confieren los diferentes grupos funcionales a los compuestos orgánicos Emplear las reglas que marca la IUPAC para nombrar a los compuestos orgánicos. Universidad Abierta y a Distancia de México 1 Químico Unidad 3. Principios de química orgánica Competencia específica Distinguir las propiedades de los compuestos orgánicos para identificar los grupos funcionales mediante el estudio de la estructura y la nomenclatura establecidas por la IUPAC. Temario Unidad 3. Principios de química orgánica 3.1. Introducción a la química orgánica 3.1.1. Nomenclatura, propiedades físicas y químicas del carbono 3.1.2. Características físicas, químicas y nomenclatura de los Alcanos, alquenos y alquinos 3.1.3. Características físicas, químicas y nomenclatura de los Alcoholes, esteres, tioles y aminas 3.1.4. Características físicas, químicas y nomenclatura de los Aldehídos, cetonas, ácidos carboxílicos y ésteres 3.1.5. Principales reacciones de adición, eliminación y sustitución 3.2. Principales Macromoléculas 3.2.1. Carbohidratos 3.2.2. Lípidos 3.2.3. Proteínas Universidad Abierta y a Distancia de México 2 Químico Unidad 3. Principios de química orgánica 3.1. Introducción a la química orgánica El término de química orgánica, de acuerdo con Bruice (2008) se introdujo en el año 1807 por Jons Jacob Berzelius, con la finalidad de nombrar el estudio de los compuestos derivados de los recursos naturales. En aquella época se consideraba que los compuestos orgánicos estaban unidos por una fuerza vital y que ello los distinguía de los compuestos inorgánicos. Figura 2. Friedrich Wöhler. Imagen tomada de: http://images.fineartamerica.com/ima ges-medium-large/friedrich-whler1800-1882-granger.jpg Fue hasta el año 1823 cuando Friedrich Wöhler, alumno de Berzelius, observó la evaporación de una sustancia llamada cianato de amonio, la cual formaban cristales incoloros de gran tamaño. Para su sorpresa, el producto obtenido era urea, un compuesto orgánico. De esta forma, concluye que es posible sintetizar compuestos orgánicos en un laboratorio. Hoy sabemos que el elemento que se encuentra en mayor proporción en el mundo es el carbono, y es precisamente la química orgánica la que se encarga del estudio de aquellos compuestos que contienen carbono, como por ejemplo: El plástico La gasolina La ropa Los alimentos, entre otros. El carbono se encuentra en toda la naturaleza, está presente en el ADN, las proteínas y los lípidos, entre otros compuestos. Por ello es considerado el elemento de la vida y constituye el 18% de nuestro cuerpo, formando parte esencial de las estructuras de mantenimiento, organización y funcionalidad de cada una de las células de todos los seres vivos. A continuación estudiaremos sus propiedades y nomenclatura. Universidad Abierta y a Distancia de México 3 Químico Unidad 3. Principios de química orgánica 3.1.1. Nomenclatura propiedades físicas y químicas del carbono En química orgánica lo más importante es identificar y diferenciar a cada uno de los compuestos orgánicos con la finalidad de comprender su comportamiento físico y químico. La nomenclatura resulta esencial para nombrar o estructurar las sustancias de tipo orgánico, dicha nomenclatura sigue una serie de reglas o fórmulas establecidas por la Unión Internacional de Química Pura y Aplicad-a (IUPAC), establecidas con la finalidad de emplear un mismo lenguaje en todo el mundo. Así, en cualquier lugar y contexto el carbono es sombrado con una C. Figura 3. IUPAC. Imagen tomada de: http://www.chemcys.be/images/I UPAC.png Por lo anterior, en primera instancia revisaremos las reglas que establece la IUPAC, para nombrar o formular los compuestos y los grupos funcionales. A continuación estudiarás algunos conceptos necesarios que ayudarán a comprender el comportamiento de los compuestos orgánicos. El carbono puede formar estructuras muy variadas: cadenas largas, cadenas ramificadas, ciclos, con enlaces sencillos, dobles o triples, como se puede apreciar en la siguiente Tabla “Tipos de cadenas y enlaces”. Tipo de cadenas Cadena Larga Imagen Cadena Ramificada Universidad Abierta y a Distancia de México 4 Químico Unidad 3. Principios de química orgánica Cadenas Cíclicas Cadenas con enlaces sencillos, dobles y triples Formaldehido Dos simples y uno doble Metano Cuatro simples Etino Uno simple y uno triple Tabla 1. Tipos de cadenas y enlaces. Imágenes tomadas de: http://web.educastur.princast.es/proyectos/biogeo_ov/2BCH/B1_BIOQUIMICA/t11_BIOMOLECULA S/informacion.htm A continuación te mostramos algunas diferencias que poseen los compuestos orgánicos de los inorgánicos: Compuestos orgánicos Están formados principalmente por: C, H, O, N. El número de compuestos supera al de compuestos inorgánicos. Prevalece el enlace covalente. Son generalmente insolubles en agua. No son buenos conductores de la electricidad. Son sensibles al calor y descomponen fácilmente. Poseen bajos puntos de fusión y ebullición. Compuestos inorgánicos Están constituidos por átomos de cualquier elemento. El número de compuestos es mucho menor al de los orgánicos. Prevalece el enlace iónico. Generalmente son solubles en agua. En disolución o fundidos son buenos conductores de la electricidad. Resisten temperaturas altas, sin sufrir cambios. Poseen altos puntos de fusión y de ebullición. Tabla 2. Diferencias entre compuestos orgánicos e inorgánicos. Universidad Abierta y a Distancia de México 5 Químico Unidad 3. Principios de química orgánica El carbono es un elemento que se puede encontrar en la familia IV-A de la tabla periódica. Tiene número atómico 6 y su configuración electrónica es la siguiente, mencionada por el autor Fieser (1985): 6C 1s2 2s2 2p2 Si desarrollamos la estructura del carbono según el modelo de Lewis, se observan sus 4 electrones de valencia en su última capa: Figura 4. Estructura de Lewis del carbono. Estos 4 electrones permiten al carbono formar 4 enlaces, y en consecuencia unirse con otros átomos, es decir que al carbono se le puede agregar otro carbono o hidrógeno o nitrógeno o halógeno, compartiendo sus electrones hasta completar ocho y así cumplir con la regla del octeto de Lewis, siendo estable el nuevo compuesto. Dicha propiedad se conoce como la tetravalencia del carbono, es decir, el carbono siempre va a formar cuatro enlaces con otros átomos, sobre todo en dobles y triples enlaces. En conclusión el número de átomos va a depender de los enlaces A continuación mostramos la estructura del compuesto denominado metano, el cual es la estructura más pequeña que se forma entre el carbono y 4 hidrógenos: Figura 5. Molécula del metano. Imagen tomada de: https://www.google.com.mx/search?q=imagenes+de+estructura+de+lewis+del+carbono Universidad Abierta y a Distancia de México 6 Químico Unidad 3. Principios de química orgánica La molécula de metano se puede representar de manera tridimensional, esto es porque las moléculas tienen traslación, rotación, flexión y contracción, sin embargo en el momento de representarla aparece siempre de forma plana. Obedece a la Teoría de Repulsión de Pares de Electrones de Valencia, por sus siglas (TRPEV), al tomar al carbono como elemento base. Hay cuatro densidades electrónicas, lo que le da la estructura tridimensional. Como ya se había mencionado, otra característica importante es que el carbono puede formar dobles y triples enlaces con otros carbonos, formando alquenos y alquinos. Para ejemplificar mostramos otros ejemplos: Figura 6. Ejemplo del compuesto eteno. Imagen tomada de: https://www.google.com.mx/search?q=imagenes+del+eteno Figura 7. Ejemplo del compuesto etino. Imagen tomada de: https://www.google.com.mx/search?q=imagenes+del+etino Cabe señalar que se necesita unir otro carbono junto con sus hidrógenos para formar los dobles o triples enlaces, es decir, lo mínimo que necesitamos son dos carbonos para hacerlo, de lo contrario no es posible este caso. Desglosando los ejemplos anteriores vemos que en el eteno, al presentarse tres densidades electrónicas alrededor del carbono, el mejor arreglo es la disposición de un triángulo equilátero. Esto se presenta Universidad Abierta y a Distancia de México 7 Químico Unidad 3. Principios de química orgánica debido a que cada elemento posee un radio atómico, entonces se empieza acomodar de mejor manera, dando cierta geometría distinta al de cada compuesto por separado. En cambio para el etino, las densidades electrónicas se encuentran alrededor del carbono, por lo que su arreglo será lineal. Ahora analicemos, los enlaces carbono-carbono: tienen características diferentes, los enlaces sencillos se conocen como enlaces sigma (σ) y son muy fuertes. Para romper un enlace sigma se requiere de mucha energía; en el caso del metano, 104 kcal/mol para romper tan solo uno de los enlaces C-C. El otro tipo de enlace presente en los compuestos con doble o triple unión, es el enlace pi (π) el cual es menos fuerte que el sigma, y por ello reacciona o se rompe más fácilmente. Figura 8. Enlace sigma y pi, presente en compuestos orgánicos. Imagen tomada de: https://www.google.com.mx/search?q=imagenes+de+dobles+y+triples+enlaces Según Geissman (2004) dentro de una molécula puede haber distintos tipos de carbonos, esto es por su posición. Difieren entre sí no sólo por el número de hidrógenos que poseen, sino también por su reactividad. Por lo anterior podemos decir que algunos carbonos tendrán preferencia para reaccionar sobre otros. Existen cuatro tipos de carbonos, los cuales se mencionan a continuación: Tipo de carbonos Imagen H Carbonos primarios: son aquellos que están unidos a otro carbono por medio de un enlace simple. C C C H Primario Universidad Abierta y a Distancia de México 8 Químico Unidad 3. Principios de química orgánica C Carbonos secundarios: son lo que se encuentran unidos a dos átomos de carbonos o a otro carbono mediante un doble enlace. C C H H Secundario C Carbonos terciarios: estos se encuentran unidos a otros tres carbonos mediante enlaces sencillos o a dos carbonos, uno con simple y el otro con doble enlace. C C H C Terciario C Carbonos cuaternarios: se encuentran unidos a cuatro átomos de carbono o a dos carbonos con doble enlace. C C C C Cuaternario Tabla 3. Tipos de carbonos. Imágenes tomadas de: https://www.google.com.mx/search?q=imagenes+del+carbono+primario En la química siempre hay fórmulas y representaciones que son las formas de dar a conocer de manera gráfica qué sucede, haciendo uso de los elementos para dicha representación, y la química orgánica no es la excepción. Entonces podemos decir que la composición de cada sustancia se representa mediante fórmulas. En química orgánica existen tres tipos que son: la condensada, la semidesarrollada y la desarrollada, de manera muy general, sin embargo, también existe otra forma de representar que es la de zigzag, muy utilizada en los libros para ahorrar espacio y tiempo. Universidad Abierta y a Distancia de México 9 Químico Unidad 3. Principios de química orgánica La fórmula condensada: indica el total de átomos de cada especie presentes en una molécula. Por ejemplo la fórmula condensada del etano es C2H6, que nos indica que esta molécula contiene 2 átomos de carbono y 6 de hidrógeno. La fórmula semidesarrollada: muestra únicamente los enlaces carbono-carbono y el número de hidrógenos contenidos en cada carbono. En el caso del etano su fórmula semidesarrollada sería: CH3-CH3 La fórmula desarrollada: indica en un plano la estructura de la molécula. Representan el modo de agrupación de todos los átomos que la forman y señalan los enlaces por medio de líneas. La fórmula desarrollada del etano sería: De esta manera, las diferentes fórmulas de los compuestos orgánicos nos permiten comprender la forma en que se enlazan los átomos. Condensada Semidesarrollada C3H8 CH3 - CH2 - CH3 Desarrollada Zigzag Figura 9. Diferentes representaciones de fórmulas de compuestos orgánicos. Imágenes tomadas de: http://ocwus.us.es/quimica-organica/quimica-organicai/temas/1_estructura_y_enlace_en_los_compuestos_de_carbono/leccion2_con_images/pagina_13. htm Los compuestos orgánicos que sólo se agrupan con dos elementos distintos al carbono, como es el caso de hidrógeno, reciben el nombre de hidrocarburos, pero existen otras agrupaciones de átomos que dan origen a otros compuestos, con propiedades físicas y químicas diferentes a los nuevos compuestos. Universidad Abierta y a Distancia de México 10 Químico Unidad 3. Principios de química orgánica Tabla 4. Grupos funcionales. Imagen tomada de: http://ejerciciosfyq.com/Formulacion_organica/32_grupos_funcionales.html Lo anterior es a manera de introducción, a continuación veremos cada uno de los grupos funcionales, iniciaremos el estudio con los alcanos, alquenos y alquinos. Universidad Abierta y a Distancia de México 11 Químico Unidad 3. Principios de química orgánica 3.1.2. Características físicas, químicas y nomenclatura de los Alcanos, alquenos y alquinos Retomando el tema de los hidrocarburos, vamos a incluir las familias químicas que son: los alcanos, alquenos y alquinos, principalmente. El estudio es de gran importancia para entender la naturaleza de los demás compuestos orgánicos; por lo que vamos a analizar cada uno de estas familias. Empezaremos con los alcanos, estos compuestos están formados únicamente por carbono e hidrógeno, formando un enlace sencillo, denominados también enlaces sigma σ, recordemos que éste tipo de enlace es fuerte y poco reactivo. Los alcanos por la forma de conformarse se clasifican en lineales, ramificados y cíclicos. Analicemos la estructura y nombre de los siguientes alcanos para que el tema de nomenclatura sea más fácil. Tabla 5. Algunos alcanos lineales. Imagen tomada de: https://www.google.com.mx/search?q=imagenes+de+dobles+y+triples+enlaces Estos alcanos siguen la fórmula general, según (Lamarque & Zygadio, 2008) que es CnH2n+2 en donde n es el número de carbonos; por ejemplo si requieres conocer la Universidad Abierta y a Distancia de México 12 Químico Unidad 3. Principios de química orgánica fórmula del heptano, entonces sabremos que el compuesto contiene 7 carbonos y 14 hidrógenos, al sustituir el número de carbonos en la fórmula general. Veamos el desglose a manera de ejemplificar: n=7, que es el número de carbonos, entonces cómo obtengo el número total de hidrógenos: Cn H2 n + 2 Sustituyendo C7 H2 (7)+2 C7 H16 Entonces: Tengo 7 carbonos y 16 hidrógenos Los nombres metano, etano, propano y butano tienen raíces históricas, pero a partir del pentano (5 carbonos) los alcanos se nombran mediante los prefijos griegos numerales, que señalan el número de carbonos: Número de C 1 2 3 4 5 6 7 8 9 10 Numeral griego Meta Eta Propa Buta Penta Hexa Hepta Octa Nona deca Número de C 11 12 13 14 15 16 20 21 22 23 Numeral griego Undeca Dodeca Trideca Tetradeca Pentadeca Hexadeca Eicos Heneicos Docos Ticos Número de C 30 31 32 40 50 60 70 80 90 100 Numeral griego Triaconta Hentriaconta Dotraiconta Tetraconta Pentaconta Hexaconta Heptaconta Octaconta Nonaconta Hecta Tabla 6. Prefijos utilizados en química orgánica. Imagen tomada de: https://www.google.com.mx/search?q=imagenes+de+prefijos+quimica+orgánica Universidad Abierta y a Distancia de México 13 Químico Unidad 3. Principios de química orgánica Todos los alcanos tienen la terminación –ano. Si todos los alcanos fueran lineales sería muy fácil nombrarlos, sin embargo, la mayoría de ellos son ramificados. Para nombrar a los alcanos y a todas las familias de compuestos se siguen las reglas de la Unión Internacional de Química Pura y Aplicada (IUPAC). La IUPAC ha desarrollado un sistema detallado de nomenclatura y sus reglas aplican en todo el mundo para nombrar dichos compuestos orgánicos. Antes de pasar a los diversos ejemplo de cómo nombrar a los compuestos orgánicos alcanos es necesario que conozcas que para formar compuestos, los compuestos deben perder un hidrógeno para poderse pegar en la fórmula, dando entonces los conocidos radicales: como son semejantes a los iones en inorgánica forman una carga que inmediatamente se unirán al carbono. En química orgánica son radicales llamados grupos alquilo, por lo general estos grupos son ramificaciones que salen de la cadena principal y es de suma importancia reconocerlos, sin esta debida identificación sería imposible nombrarlos. Los radicales alquilo provienen de los alcanos más sencillos y para formarlos únicamente se debe eliminar un átomo de hidrógeno de uno de los carbonos, quedando listos para unirse al respectivo carbono y la nomenclatura bastará sustituir la terminación –ano por – il, como se muestra en la Tabla siguiente: Tabla 7. Grupos alquilo abajo mencionada. Imagen tomada de: https://www.google.com.mx/search?q=imagenes+de+grupos+alquilo+orgánica Universidad Abierta y a Distancia de México 14 Químico Unidad 3. Principios de química orgánica Los alcanos ramificados se nombran siguiendo las reglas de nomenclatura establecidas por la IUPAC, para describirlas veamos el siguiente ejemplo: 1. Localiza la cadena principal. En el compuesto se localiza la cadena más larga de átomos de carbono. 2. Numerar la cadena principal. Se numeran los carbonos contenidos en la cadena principal, a partir del extremo por el cual se obtenga la menor numeración posible para indicar la posición de las ramificaciones. 3. Nombrar los grupos alquilo. Se identifican y nombran las ramificaciones unidas a la cadena principal, en estricto orden alfabético. La posición y el nombre de los radicales se separan mediante el uso de guiones. 3-etil, 2-metil, 2-metil, 5-metil Universidad Abierta y a Distancia de México 15 Químico Unidad 3. Principios de química orgánica 4. Organizar grupos múltiples. Cuando estén presentes más de un mismo radical alquilo, se utilizan los prefijos di-, tri-, tetra-, penta-, etcétera señalando la posición de los mismos. 3-etil, 2,2,5-trimetil 5. Nombrar cadena principal. Después de escribir el nombre de todas las ramificaciones, se nombra la cadena principal como si fuera un alcano lineal. 3-etil, 2,2,5-trimetilheptano Veamos nuevamente el procedimiento para asignar el nombre a un alcano, mediante las siguientes imágenes: Nomenclatura Alcanos Universidad Abierta y a Distancia de México 16 Químico Unidad 3. Principios de química orgánica 3-etil, 2-metil, 2-metil, 5-metil, 6-metil, 6-metil Universidad Abierta y a Distancia de México 17 Químico Unidad 3. Principios de química orgánica 3-etil, 2,2,5,6,6-pentametil 3-etil, 2,2,5,6,6-pentametilheptano Tabla 8. Nomenclatura de los Alcanos. Tenemos el nombre, ahora se requiere la fórmula química. Para ello es recomendable dibujar la cadena principal como la de un alcano lineal, posteriormente los grupos alquilo y finalmente completar los hidrógenos faltantes en cada uno de los carbonos de la cadena, para completar su tetravalencia. Por ejemplo, para dibujar la estructura del compuesto 2-metil-4-etilhexano primero dibujamos la cadena de carbonos, en este caso son seis por el prefijo numeral hexano. C –C –C –C –C –C En seguida colocamos los grupos alquilo mencionados en la posición señalada: 2-metil-4-etilhexano En seguida colocamos los grupos alquilo mencionados en la posición señalada: 2-metil-4-etilhexano Universidad Abierta y a Distancia de México 18 Químico Unidad 3. Principios de química orgánica CH3 C -C -C -C -C -C H2 C CH3 Finalmente, se completan con hidrógenos los carbonos de la cadena principal 2-metil-4-etilhexano CH3 CH3-CH-CH2-CH-CH2-CH3 H2C CH3 Ahora vamos a estudiar el caso de los alquenos también son hidrocarburos, pero se caracterizan por tener dobles enlaces (un enlace sigma σ y un enlace pi π), el enlace pi es más débil y reactivo. Al igual que los alcanos, poseen una la fórmula general condensada, para calcular el número de hidrógenos y su fórmula general es: CnH2n. Donde: n=número de carbono Entonces a manera de ejemplo, si nos solicitan calcular el número de hidrógenos del compuesto del propeno, el propeno tiene 3 carbonos, entonces ¿cuántos hidrógenos tiene? Aplicando la fórmula general tenemos lo siguiente: C3H2(3) C3H6 Si queremos realizar la estructura quedaría de la siguiente manera: CH3CH=CH2 Universidad Abierta y a Distancia de México 19 Químico Unidad 3. Principios de química orgánica Entonces al nombrarlos, los alquenos se nombran de forma similar a los alcanos, iniciando con el prefijo numeral griego que indica el número de carbonos, y en este caso finaliza con la terminación –eno, tal y como se muestra en la Tabla 9. Nombre de algunos alquenos. Tabla 9. Nombre de algunos alquenos. Imagen tomada de: https://www.google.com.mx/search?q=imagenes+de+alquenos+quimica+orgánica En los alquenos sabemos que tiene el doble enlace, puede estar localizado en cualquiera de los carbonos de la cadena principal, es por eso que es necesario mencionar dónde se encuentra el doble enlace, veamos un ejemplo el buteno: tiene 4 carbonos y 8 hidrógenos, lo puedes comprobar utilizando la fórmula general. Este compuesto tiene dos posibles estructuras, como se muestran a continuación: CH2=CH-CH2CH3 CH3-CH=CH-CH3 1-buteno 2-buteno Entonces, dependiendo dónde se encuentre el doble enlace será el nombre, pero aquí es necesario aclarar en qué número de carbono se encuentra la doble ligadura. Cabe señalar que también existen alquenos ramificados, éste tipo de hidrocarburos también sigue las reglas para nombrar establecidas por la IUPAC, con la diferencia que la cadena principal debe contener el doble enlace y la cadena principal se nombra con la terminación –eno, sin olvidar indicar la posición del doble enlace en esta. Universidad Abierta y a Distancia de México 20 Químico Unidad 3. Principios de química orgánica A manera de esquematizar lo anterior, veamos el siguiente ejemplo: 1. Localizar la cadena principal. Se identifica a la cadena más larga de átomos de carbono que contenga el doble enlace. 2. Numerar la cadena principal. Se enumera la cadena a partir del extremo por el cual se obtenga la menor numeración posible para el doble enlace y las ramificaciones. 3. Nombrar los grupos alquilo. Se nombran las ramificaciones unidas a la cadena principal, en estricto orden alfabético. Universidad Abierta y a Distancia de México 21 Químico Unidad 3. Principios de química orgánica 5-etil, 4-isopropil, 7-metil 4. Organizar grupos múltiples. Cuando estén presentes más de un mismo radical, se utilizan los prefijos di-, tri-, tetra-, penta-, etcétera señalando la posición de los mismos. 5-etil-4-isopropil-7-metil 5. Nombrar cadena principal. Después de escribir el nombre de todas las ramificaciones, se nombra la cadena principal con la terminación –eno, y anteponiendo el número del carbono en el que inicia el doble enlace. 5-etil-4-isopropil-7-metil-2-octeno El otro grupo de los hidrocarburos son los alquinos, los cuales se representan por un triple enlace entre carbono-carbono (1 enlace sigma σ y 2 enlaces pi π). La fórmula general de los alquinos es: CnH2n-2 Universidad Abierta y a Distancia de México 22 Químico Unidad 3. Principios de química orgánica Para continuar con el siguiente grupo de nombre alquinos está compuesto del prefijo numeral griego, que nos indica el número de átomos de carbono de la cadena y la terminación, en este caso –ino , ver la Tabla 9. Algunos nombre de alquinos. Tabla 10. Algunos nombre de alquinos. Imagen tomada de: https://www.google.com.mx/search?q=imagenes+de+alquinos+quimica+orgánica Para el caso de los alquinos ramificados al nombrarlos se siguen las mismas reglas utilizadas para la nomenclatura de los alquenos, con la única diferencia que la terminación –eno es cambiada por –ino. A manera de ejemplo veamos el siguiente compuesto: 1. Localizar la cadena principal. Se identifica a la cadena más larga de átomos de carbono que contenga el triple enlace. 2. Numerar la cadena principal. Se enumera la cadena a partir del extremo por el cual se obtenga la menor numeración posible para el triple enlace. Universidad Abierta y a Distancia de México 23 Químico Unidad 3. Principios de química orgánica 3. Nombrar grupos alquilo. Se nombran las ramificaciones unidas a la cadena principal, en estricto orden alfabético. 6-etil, 8-etil 4. Organizar grupos múltiples. Cuando estén presentes más de un mismo radical, se utilizan los prefijos di-, tri-, tetra-, penta-, etcétera señalando la posición de los mismos. 6,8-dietil 5. Nombrar cadena principal. Después de escribir el nombre de todas las ramificaciones, se nombra la cadena principal con la terminación –ino, y anteponiendo el número del carbono en el que inicia el doble enlace. 6,8-dietil-4-nonino Universidad Abierta y a Distancia de México 24 Químico Unidad 3. Principios de química orgánica En muchas ocasiones para facilitar la escritura de los compuestos orgánicos se utilizan líneas en zig zag, en las que cada uno de los vértices representa un carbono con sus respectivos hidrógenos. Por ejemplo, el pentano de 5 átomos de carbono lo podríamos representar de la siguiente manera: CH3-CH2-CH2-CH2-CH3 = De igual manera los dobles y triples enlaces se pueden representar en este tipo de simbología. CH3-CH2-CH=CH-CH2-CH3 = Pero no todos los hidrocarburos son lineales, existen los no lineales, es decir forman ciclos, estos compuestos se clasifican en: cicloalcanos, cicloalquenos y cicloalquinos, y si observas las terminaciones de las palabras anteriores, puedes notar que son de los diversos grupos de hidrocarburos, debido a que presentan enlaces simples, dobles y triples respectivamente, podemos decir que van a tener la misma terminación pero anteponiendo la palabra ciclo, los cuales no escapan para la IUPAC, el nombrarlos con ciertas reglas que a continuación veremos. Observa los siguientes ejemplos: ciclohexano ciclopenteno ciclobutino En los ciclos también hay ramificaciones, entonces, para nombrarlos se toma en cuenta la arborescencia más compleja en el caso de los cicloalcanos, y la doble o triple ligadura en los cicloalquenos y cicloalquinos. Universidad Abierta y a Distancia de México 25 Químico Unidad 3. Principios de química orgánica 4-etil-2-metil-ciclohexeno 1-isopropil-4-metilciclohexano 3-metilciclohexino Anexando a la información anterior hay compuestos que tienen más de un doble enlace, por lo tanto solo se debe mencionar en donde están los dobles o triples enlaces, como lo podemos apreciar a continuación. Figura 10. Ejemplos con más de un doble enlace. Imágenes tomadas de: https://www.google.com.mx/search?q=imagenes+de+dienos+quimica+orgánica Existe otro grupo de hidrocarburos importante en química orgánica, es un ciclo con 3 dobles enlaces, con características determinadas, denominado benceno, la estructura cíclica consta de 6 átomos de carbono con 3 dobles enlaces intercalados y 6 hidrógenos tal y como se muestra en la “Estructura del benceno”. Universidad Abierta y a Distancia de México 26 Químico Unidad 3. Principios de química orgánica Figura 11. Estructura del benceno. Imagen tomada de: https://www.google.com.mx/search?q=imagenes+de+benceno+quimica+orgánica La característica principal es que los dobles enlaces se pueden mover a través de los carbonos, debido a que están intercalados, esto se conoce como resonancia, motivo que al benceno se representa con un hexágono y un círculo en el centro que simboliza la movilidad de sus enlaces. Habrás notado que en el benceno contienen carbonos e hidrógenos, los cuales pueden ser sustituidos por algún radical alquilo, halógeno o grupo funcional. Los bencenos pueden clasificarse en monosustituidos, disustituidos o polisustituidos. Se sigue una regla para nombrar a los bencenos, basta con escribir el prefijo del sustituyente y añadirle la palabra benceno, como se muestra a continuación: HO Br metilbenceno isopropilbenceno bromobenceno hidroxibenceno Para los bencenos disustituidos, vamos indicar la posición de los sustituyentes con los prefijos orto (posición 1 y 2), meta (posición 1 y 3) y para (posición 1 y 4). Universidad Abierta y a Distancia de México 27 Químico Unidad 3. Principios de química orgánica Cl orto-dimetilbenceno o-dimetilbenceno meta-clorometilbenceno m-clorometilbenceno para-etilmetilbenceno p-etilmetilbenceno Hay una situación que debemos mencionar en química orgánica, y es que existen en el grupo bencénico sustituidos nombres comunes, es decir, reciben el nombre a veces de quien lo descubrió o se le ocurrió dependiendo en ocasiones del olor que despiden, debido a que primero se descubrieron, y después se empezaron a nombrar bajo reglas, que en éste caso estableció la IUPAC. En la actualidad debemos de conocer ambos, sobre todo porque el nombre común es eso, el más usado, pero como estudiante de las ciencias, necesitamos conocer las reglas de la IUPAC. A continuación veremos algunos ejemplos de diversos compuestos y sus nombres, como es el caso del metilbenceno que también se conoce como tolueno. Estructura HO NH2 Nombre IUPAC (sistemático) Metilbenceno Nombre común Tolueno Hidroxibenceno Fenol Aminobenceno Anilina p-dimetilbenceno p-xyleno Tabla 11. Nombres comunes y la IUPAC. Imagen tomada de: https://www.google.com.mx/search?q=imagenes+de+quimica+orgánica Ahora revisaremos otros compuestos, que aparte de tener carbono e hidrógeno, pueden integrar a sus cadenas otros elementos como: oxígeno, halógenos, nitrógeno, formándose otras familias, conocidos como: alcoholes, éteres, ésteres, aminas, amidas, halogenuros de alquilo y halogenuros de arilo, entre otros. Universidad Abierta y a Distancia de México 28 Químico Unidad 3. Principios de química orgánica 3.1.3. Características físicas, químicas y nomenclatura de los Alcoholes, esteres, tioles y aminas El oxígeno al integrarse a la cadena de carbonos, originan la formación de diversos compuestos, donde encontramos a los alcoholes, aldehídos, cetonas, ácidos carboxílicos, éteres y esteres, que dependiendo de la posición del oxígeno y enlaces se forman los anteriores, como lo podemos apreciar en la siguiente figura. Figura 12. Compuestos orgánicos con oxígeno. Imagen tomada de: http://www.imp.mx/petroleo/?imp=comp Además de los hidrocarburos, existen una gran variedad de compuestos que son de gran utilidad en la industria además de estar presentes en la naturaleza. Entre estos compuestos encontramos a los alcoholes. Los alcoholes son compuestos con una característica contienen un grupo hidroxilo –OH. Estos compuestos, de acuerdo a la posición del átomo de carbono al que estén unidos, se clasifican de la siguiente forma: Universidad Abierta y a Distancia de México 29 Químico Unidad 3. Principios de química orgánica Tabla 12. Clasificación de alcoholes. Imagen tomada de: http://www.imp.mx/petroleo/?imp=comp Para nombrar a los alcoholes sencillos, se indica el prefijo numeral griego de acuerdo al número de átomos de carbono o el radical alquilo y se adiciona la terminación –ol. Por ejemplo: CH3 H3C OH H3C OH H3C H3C OH metanol propanol etanol OH isopropanol En el caso de estructuras ramificadas, se utiliza como base las reglas de nomenclatura de los alcanos, indicando la posición del grupo hidroxilo (-OH) y cambiando la terminación – ano por –ol. Por ejemplo, veamos cómo se nombra el siguiente compuesto: CH3 H3C H3C OH CH3 1. Localizar la cadena principal. Se identifica a la cadena más larga de átomos de carbono que contenga el grupo hidroxilo (-OH). En este caso la cadena está señalada en rojo. Universidad Abierta y a Distancia de México 30 Químico Unidad 3. Principios de química orgánica CH3 H3C OH H3C CH3 2. Numerar la cadena principal. Se enumera la cadena a partir del extremo por el cual se obtenga la menor numeración posible para indicar la posición del carbono que soporta el grupo hidroxilo. 6 H3C CH3 5 OH 4 3 2 H3C 1 CH3 3. Nombrar grupos alquilo. Se nombran las ramificaciones unidas a la cadena principal, en estricto orden alfabético. 6 H3C metilo CH3 5 OH 4 3 2 H3C 1 CH3 etilo 4-etilo, 5-metilo 4. Organizar grupos múltiples. Cuando estén presentes más de un mismo radical, se utilizan los prefijos di-, tri-, tetra-, penta-, etcétera señalando la posición de los mismos. 6 H3C metilo CH3 5 OH 4 3 2 H3C 1 CH3 etilo 4-etilo-5-metilo 5. Nombrar cadena principal. Después de escribir el nombre de todas las ramificaciones, se nombra la cadena principal con la terminación –ol, anteponiendo el número del carbono en el que localiza el grupo hidroxilo. Universidad Abierta y a Distancia de México 31 Químico Unidad 3. Principios de química orgánica metilo CH3 6 H3C 5 OH 4 3 2 H3C 1 CH3 etilo 4-etilo-5-metilo-3-hexanol Otro grupo importante es el de los éteres, los cuales se caracterizan por contener un oxígeno unido a dos radicales alquilo. Para nombrarlos se mencionan los grupos alquilo unidos al oxígeno, en orden alfabético, seguidos de la palabra éter. Como se muestra a continuación: O O H3C O CH3 H3C CH3 dimetiléter O H3C CH3 CH3 etilmetiléter difeniléter etilisopropiléter En el caso de éteres con estructuras más complejas, se nombra según la IUPAC considerando que uno de los radicales (el mayor si se trata de un éter asimétrico) es un hidrocarburo que lleva como sustituyente el grupo alquilo pequeño con el oxígeno, al que se denomina grupo alcoxi. CH3 O CH3 H3C CH3 CH3 O H3C H3C CH3 2-metoxipentano O O CH3 1-isopropoxi-2-metilpropano (isobutilisopropiléter) O H3C 1,3,5-trimetoxibenceno Empezaremos ahora con las aminas, grupo también importante que por lo regular está presentes en gran parte de los compuestos estructurales de los seres vivos, como son las proteínas. Estas aminas se caracterizan por contener, el elemento nitrógeno, en temas anteriores examinamos la sustitución del hidrógeno por el oxígeno, para éste caso la sustitución del hidrógeno será por nitrógeno, las aminas se clasifican en primarias, secundarias y Universidad Abierta y a Distancia de México 32 Químico Unidad 3. Principios de química orgánica terciarias, dependiendo al número de sustituyentes alquilo del nitrógeno, como se muestra a bajo. CH3 H3C H3C NH H3C CH3 CH3 NH2 Amina primaria N Amina secundaria Amina terciaria Figura 13. Clasificación de aminas. Imagen obtenida en http://www.hablandodeciencia.com/articulos/2013/01/28/cuidado-con-las-aminas/ Para nombrar al grupo de aminas usaremos el prefijo, es decir, el radical o radicales unidos al átomo de nitrógeno, en estricto orden alfabético, y como sufijo la palabra – amina, con la finalidad de ampliar analiza lo siguiente: CH3 H3C H3C H3C NH2 metilamina N NH H3C CH3 CH3 etilmetilamina H3C NH H3C CH3 etilisopropilmetilamina etilisoEpropilamina Figura 14. Ejemplo de nombre de grupo de aminas. Imagen tomada de: https://www.google.com.mx/search?q=imagenes+de+halogenuros+de+arilo Existe una consideración importante en las aminas, cuando la función de la amina interviene como sustituyente en la cadena principal, utilizaremos el prefijo –amino, tal y como lo observamos a continuación. NH2 H3C CH3 CH3 2-amino-4-metilpetano Universidad Abierta y a Distancia de México 33 Químico Unidad 3. Principios de química orgánica Otro grupo de los compuestos orgánicos con nitrógenos son las amidas. Observa los siguientes ejemplos. Figura 15. Amidas. Imagen obtenida en http://www.infoescola.com/quimica/funcao-amida/ Las amidas sustituidas tienen ésta definición porque, ya sea que uno o varios hidrógenos fueron sustituidos por otros grupos, como es el caso de la N,N-dimetilacetamida. Dicho compuesto se considera una amina, ejemplo de lo comentado es la acetildimetilamina. Las naturales de las amidas es, generalmente, neutra respecto a la capacidad de reacción en comparación con los ácidos o aminas que derivan y algunas son ligeramente resistentes a la hidrólisis. Las amidas de estructura pequeña, llamadas también simples de los ácidos carboxílicos alifáticos a excepción de la formamida, se encuentran en un estado sólido a temperatura ambiente, y las amidas sustituidas de los ácidos carboxílicos alifáticos son líquidas, con puntos de ebullición altos. Las amidas de los ácidos carboxílicos aromáticos o sulfónicos se encuentran generalmente, sólidas. Los nombres comunes para las amidas lo observamos en la siguiente tabla. Amida Fórmula Química Formamida Acetamida Propionamida Universidad Abierta y a Distancia de México 34 Químico Unidad 3. Principios de química orgánica Butiramida Isobutiramida Tabla 13. Nombres comunes para las amidas. Imagen tomada de: http://quimicorganica2012.wikispaces.com/CONTENIDO Si necesitamos o nos solicitan en nombre de una amida con base a la IUPAC, entonces seguimos las siguientes reglas: se reemplaza la terminación -oico del nombre IUPAC del ácido precursor por la palabra amida. El ácido carboxílico más simple es el ácido metanoico, el nombre de su amida cambiará a metanamida, para el caso de la acetamida cambia a etanamida, otro ejemplo: la propionamida cambia a propanamida, butiramida a butanamida y por último, isobutiramida cambia a 2-metilpropanamida. Entonces en las amidas sustituidas el nombre del grupo o grupos R se adicionan al nombre, para posteriormente colocar el prefijo N antes del nombre para identificar los grupos que están unidos al átomo de nitrógeno. Veamos las siguientes amidas sustituidas: Figura 16. Amidas sustituidas. Imagen obtenida en http://quimicorganica2012.wikispaces.com/CONTENIDO Universidad Abierta y a Distancia de México 35 Químico Unidad 3. Principios de química orgánica Bien, continuamos con otros compuestos orgánicos, ahora estudiarás a los aldehídos, ácidos carboxílicos, cetonas y ésteres. 3.1.4. Características físicas, químicas y nomenclatura de los Aldehídos, cetonas, ácidos carboxílicos y ésteres Los aldehídos poseen un grupo carbonilo (-C=O) unido al menos a un hidrógeno (HC=O). Para nombrar a los aldehídos, la cadena principal debe contener al carbono carbonílico y ser la más larga y ramificada posible, cuyo nombre será el del alcano correspondiente, pero ahora con la terminación –al. O O H H metanal CH3 H etanal O O H CH3 propanal H CH3 butanal Para nombrar a los aldehídos ramificados, deben seguirse las reglas descritas para nombrar a los alcanos. Cabe señalar que no es necesario indicar la posición del carbono carbonílico, dado que siempre lleva el número 1. Las cetonas son otro grupo de compuestos que, al igual que los aldehídos, poseen en su estructura un carbono carbonílico (-C=O), pero con la diferencia de que en las cetonas no poseen enlaces con hidrógeno, de modo que está unido a otros dos carbonos mediante enlaces sigma. La nomenclatura IUPAC de las cetonas sigue las mismas reglas y consideraciones que se aplican para los alcanos, con la diferencia de que la terminación del nombre de la cadena principal cambia de –ano a –ona, aquí se debe indicar la posición del carbono carbonílico. Universidad Abierta y a Distancia de México 36 Químico Unidad 3. Principios de química orgánica O O CH3 H3C CH3 H3C 2-propanona CH3 O H3C 2-butanona CH3 3-pentanona O H3C O H3C CH3 O CH3 H3C CH3 H3C CH3 4-etil-2,5-dimetil-3-hexanona 3-metilciclohexanona 3-metil-2-butanona Veamos a los ácidos carboxílicos son compuestos que contienen además de carbono carbonílico (-C=O) el grupo hidroxilo (-OH). Y para nombrar a esta familia de compuestos, se inicia con la palabra ácido seguida del prefijo griego que indica el número de carbonos (incluyendo el carbonílico) y finalizando con la terminación –oíco. O H3C O O OH Ácido etanoíco HO CH3 Ácido propanoíco HO CH3 CH3 Ácido 3-metilbutanoíco Existen compuestos que contienen más de un grupo funcional en su estructura, para ello se elige el grupo de mayor prioridad de acuerdo a la Tabla 14, en ella se puede apreciar los compuestos de mayor prioridad son los ácidos carboxílicos, seguidos por los aldehídos y cetonas, alcoholes, aminas y por último los alquenos y alquinos. El sufijo del nombre del compuesto corresponde al grupo funcional de mayor prioridad, los demás grupos se citan como sustituyentes (prefijos). Grupo funcional Ácido carboxílico Aldehído cetona amina alqueno alquino alcano Nombre como sufijo Ácido -oíco -al -ona -amina -eno -ino -ano Nombre como prefijo carboxi oxo oxo amino alquenil alquinil alquil Tabla 14. Prioridad de los grupos funcionales. Imagen tomada de: https://www.google.com.mx/search?q=imagenes+de+prioridad+y+grupos+funcionales. Universidad Abierta y a Distancia de México 37 Químico Unidad 3. Principios de química orgánica Para comprender mejor esta situación, veamos los siguientes ejemplos: O CH3 H3C CH3 O OH 3-hidroxi-7-metil-5-nonanona OH CH3 H3C O H 2-(1-hidroxietil)-3-oxohexanal En el primer caso, el grupo de mayor prioridad es la cetona y en el segundo caso el aldehído, los grupos restantes fueron nombrados como sustituyentes de la cadena principal, según (Klages, 2005). Otro grupo son los ésteres que proviene de condensar a los alcoholes y para nombrarlos se considera la sal del ácido del que provienen, como lo podemos apreciar a continuación, claro respetando la nomenclatura IUPAC, va a cambiar la terminación -oico del ácido por -oato, finalizando con el nombre del grupo alquilo unido al oxígeno. Figura 17. Nombre del grupo alquilo unido al oxígeno. Imagen tomada de: http://organicaudla3.wikispaces.com/%C3%89steres A manera de ejemplo de nuestra vida diaria, observa las fórmulas de algunas de las frutas y trata de identificar los grupos funcionales que aparecen. Universidad Abierta y a Distancia de México 38 Químico Unidad 3. Principios de química orgánica Figura 18. Frutas y grupos funcionales a los que pertenecen. Imagen obtenida en http://www.quimicayalgomas.com/wpcontent/uploads/2011/10/Esteres-portada.jpg Por último veremos al grupo de los halogenuros, conocidos también como haluros. Recordarás que cuando la molécula pierde un hidrógeno, se forma un grupo alquilo y que puede sustituirse por otro elemento o unirse a otro carbono. Ahora bien, el otro elemento, que nos falta es el de los halógenos (F, Cl, Br y I), entonces cuando se une al compuesto recibe el nombre de halogenuros de alquilo, formándose de esta manera un enlace polar, debido a la electronegatividad de los halógenos que es más fuerte que el carbono. Ver la siguiente imagen. Universidad Abierta y a Distancia de México 39 Químico Unidad 3. Principios de química orgánica Figura 19. Halogenuros de alquilo Imagen tomada de: http://ocwus.us.es/quimicaorganica/quimica-organicai/temas/5_haluros_de_alquilo/leccion_9/page_04.htm/ Para nombrarlos de acuerdo con (Berzosa & Llopis, 2002), se iniciará con el grupo de halógenos presentes en la cadena de carbonos. En la siguiente tabla puedes apreciar las dos formas de nombrar a los compuestos orgánicos el de la IUPAC y el común. Figura 20. Formas de nombrar a los compuestos orgánicos el de la IUPAC. Imagen obtenida en http://prepa8.unam.mx/academia/colegios/quimica/infocab/unidad332.html Universidad Abierta y a Distancia de México 40 Químico Unidad 3. Principios de química orgánica Las características principales de los halogenuros de alquilo, también llamados haluros de alquilo, es que presentan densidades y puntos de ebullición más altos que los correspondientes alcanos, y esto es debido al peso molecular del halógeno. Otro grupo de haluros, son los halogenuros de arilo, de igual forma son compuestos orgánicos unidos a halógenos. La diferencia radica que están junto a un aromático que es el benceno, entonces reciben el nombre de halogenuros de arilo. Figura 21. El nombre de éste compuesto es cloro benceno. Imagen tomada de: http://www.rena.edu.ve/cuartaUnidad/quimica/Tema14.html Algo importante que hay que aclarar que el halógeno yodo (I), lo vamos a escribir con “i” y no con “y”, es necesario aclarar para que no te vayas a confundir a la hora de nombrarlos, como se muestra en el siguiente compuesto. CH3-CHI-CH2-CH3 2-iodobutano. Peso molecular: 183,90 g/mol. Observa que el compuesto base que es el butano pierde su hidrógeno, viene el yodo y se posiciona en el carbono 2, también puede posicionarse en el carbono 1, por lo tanto en química orgánica se pueden formar varios isómeros. Con el grupo de los halogenuros damos por terminado el estudio de los grupos funcionales y pasamos al tema de las reacciones químicas, para química orgánica. 3.1.5. Principales reacciones de adición, eliminación y sustitución Según Morrison & Neilson (2000), los cambios que se dan en las estructuras de los compuestos orgánicos, proporcionan como consecuencia una modificación, y los podemos apreciar a través de las reacciones químicas donde se rompen enlaces y se originan nuevos enlaces. Estas rupturas pueden realizarse mediante dos tipos, la homolítica y la heterolítica. A continuación explicamos cada una. a) La Ruptura homolítica, tiene lugar cuando el enlace covalente se rompe de manera equitativa; es decir, a cada uno de los fragmentos se lleva consigo a uno de los Universidad Abierta y a Distancia de México 41 Químico Unidad 3. Principios de química orgánica electrones que formaban el enlace original. Este proceso origina especies química llamadas radicales libres. A manera de desglosar ver el siguiente esquema. b) Y la Ruptura heterolítica; es cuando la rotura del enlace es asimétrica, es decir, uno de los fragmentos del enlace se queda con los dos electrones del enlace original. Este proceso produce la formación de iones, semejante a la química inorgánica, es decir hay una especie cargada negativamente (anión) y otra cargada positivamente (catión). Veamos el siguiente esquema. En los compuestos orgánicos los principales tipos de reacciones son: la adición, la sustitución y la eliminación, analicemos cada una de estas reacciones. Las reacciones de adición son las que se presentan al haber enlaces múltiples como en el caso de los alquenos y los alquinos, así como en el grupo carbonilo de aldehídos y cetonas, residen en la adición de dos especies químicas al enlace múltiple de una molécula insaturada (es aquella que posee un enlace doble o triple), tal y como se aprecia en la siguiente ecuación: Universidad Abierta y a Distancia de México 42 Químico Unidad 3. Principios de química orgánica H H C H + C A H Z H H H C C H A Z Para este caso la reacción se lleva a cabo mediante la formación de iones, por una adición electrofílica porque comienzan con el ataque del electrófilo (acepta electrones) al enlace múltiple, seguido de la adición del nucleofilo (dona electrones). Es más común que se presenten las reacciones de adición en los alquenos y los alquinos. Nombre de reacción Ejemplo H3C CH CH2 + H2 CH3 H3C CH2 H3C CH CH2 H3C CH CH2 Cl Cl Hidrogenación H3C H3C C CH CH + CH2 H2 + Cl Cl Halogenación H3C H3C Hidrohalogenación Hidratación H3C H3C C CH C CH CH + Cl CH2 CH + H + H CH2 Cl H3C Cl Cl + H2O Universidad Abierta y a Distancia de México H3C CH Cl Cl CH CH2 Cl H H3C H3C C C CH Cl H CH CH2 OH H 43 Químico Unidad 3. Principios de química orgánica H3C C CH + H2O H3C C CH H3C OH H C CH2 O H Tabla15. Reacciones de adición. Imagen tomada de: http://ocwus.us.es/quimica-organica/quimicaorganicai/temas/6_alquenos/leccion13/pagina_06.htm Después de analizar la anterior tabla apreciamos que los grupos que se adicionan al doble o triple enlace, lo pueden hacer en cualquiera de los dos carbonos, siempre y cuando el doble enlace sea simétrico, es decir sean de igual número de hidrógenos en cada átomo de carbono, de ahí que se obtengan mezclas de compuestos, los cuales se llaman isómeros; sin embargo, cuando el enlace es asimétrico y la molécula a adicionarse contiene hidrógeno, se adicionará al carbono con mayor número de hidrógenos, dicho fenómeno se explica mediante la regla de denominada de Markovnikoff que dice: Cuando un reactivo asimétrico se adiciona a de la insaturación que tenga el número mayor de hidrógenos, tal y como se muestra a continuación: CH3-CH = CH2 + HBr → CH3-CH2 – CH2Br (menor producción) CH3-CH = CH2 + HBr → CH3-CHBr – CH3 (mayor producción) Para las reacciones de sustitución se llevan a cabo en un átomo o grupo atómico, el cual es sustituido o desplazado por otro, clasificándose como reacciones de sustitución por radicales libres, llamados de sustitución nucleofila o de sustitución electrófila, a manera de ejemplificar, veamos la siguiente ecuación que representa al proceso de sustitución. H H C H H A + Z H C Z + A H En las reacciones de eliminación, son aquellas que crean el proceso inverso a las reacciones de adición y consiste en la pérdida de átomos o grupo de átomos de una molécula, formando enlaces múltiples o anillos. Universidad Abierta y a Distancia de México 44 Químico Unidad 3. Principios de química orgánica H H H C C H A Z H H C H + C A Z H A continuación vemos un ejemplo de la reacción de eliminación, en caso específico la deshidratación de alcoholes para formar otro grupo que será un alqueno, o otro ejemplo puede ser la reacción de deshidrobromación inducida por bases. Con todo lo anterior y conjuntando los conocimientos anteriores, a continuación estudiaremos a las macromoléculas. 3.2. Principales Macromoléculas Las macromoléculas, (Marvel, 1998), son sustancias de una elevada masa molecular, es decir, contienen unidades estructurales repetidas, las cuales son llamadas monómeros. Para el presente caso estudiaremos a las denominadas biomoléculas constituyentes de todos los seres vivos. Las denominadas biomoléculas, son compuestos orgánicos, que están constituidos principalmente por carbono, hidrógeno, oxígeno, fósforo y azufre, siendo las más importantes: los carbohidratos, proteínas y lípidos. Conocerás sus características y propiedades a continuación. 3.2.1. Carbohidratos Los carbohidratos son reconocidos como la fuente principal de energía para los seres vivos. Son compuestos que contienen carbono, hidrógeno y oxígeno, que durante el metabolismo son quemados para producir una gran cantidad de energía y liberar dióxido de carbono y agua. Los carbohidratos se clasifican en tres grupos: Universidad Abierta y a Distancia de México 45 Químico Unidad 3. Principios de química orgánica Monosacáridos Disacáridos Polisacáridos Los monosacáridos son los carbohidratos más sencillos y también son conocidos como azúcares simples. A continuación mostramos los tres más comunes: glucosa, fructosa y galactosa, respectivamente H HO O OH OH O H H HO H H H HO O H OH H OH HO H OH H OH H OH OH OH OH OH Figura 22. Monosacáridos. Imagen tomada de: http://biologia.laguia2000.com/bioquimica/monosacridos En la estructura de los monosacáridos están presentes los grupos funcionales aldehído, cetona y alcoholes, estos últimos compuestos orgánicos son los que dieron inicio al nombre de carbohidratos, debido a que se pensaba que eran moléculas hidratadas. La glucosa la encontramos en frutas, verduras y otros vegetales. Es el principal metabolito para obtener energía, se oxida para producir dióxido de carbono y agua, que se eliminan gracias a la respiración. Para el caso de la fructosa se encuentra en la miel de abeja y algunos jugos de frutas y la galactosa se forma, cuando las enzimas fraccionan a la lactosa o azúcar de la leche. Se pueden representar en forma abierta, de acuerdo con Battaner (2012), sin embargo, los monosacáridos de cinco o más carbonos están fundamentalmente en forma cerrada, esto es debido a que el grupo carboxilo forma parte de un anillo hemiacetalico, al reaccionar con un alcohol de la misma molécula. El anillo puede ser de 5 ó 6 átomos. Cuando tienen cinco átomos de carbono se les conoce como furanosa, por analogía con la estructura del heterociclo furano, y para los 6 átomos, se llama piranosa, por su semejanza con la estructura del pirano. Universidad Abierta y a Distancia de México 46 Químico Unidad 3. Principios de química orgánica La formación de hemiacetales, son cuando los monosacáridos forman anillos al reaccionar con los alcoholes de la misma molécula, a manera de ejemplo, veamos lo siguiente: Figura 23. Formación del hemiacetal en la glucosa. Para el caso anterior, se forman la α-D-glucopiranosa (alcohol en carbono 1 hacia arriba) y la β-D-glucopiranosa (alcohol en carbono 1 hacia abajo), llamadas piranosas por su similitud con el pirano, como ya se mencionó. En cambio, los disacáridos, son compuestos de azúcares simples, que necesita el cuerpo para convertirlos en monosacáridos y así asimilarlos. Ejemplos de disacáridos son: la sacarosa, la lactosa y la maltosa. El nombre científico del azúcar que habitualmente usamos para endulzar nuestras bebidas, se llama sacarosa. La lactosa es un disacárido que lo encontramos en la leche humana y animal a la maltosa se encuentra en las semillas germinadas, en un disacárido los monosacáridos se unen mediante enlaces glicosídicos. Abajo te mostramos dichos enlaces: Universidad Abierta y a Distancia de México 47 Químico Unidad 3. Principios de química orgánica Compuesto Maltosa Sacarosa Lactosa Celobiosa Unidades componentes (glucosa- glucosa) (glucosa-fructosa) (glucosa-galactosa) (glucosa-glucosa) Tabla 16. Monosacáridos componentes de algunos disacáridos. Imagen tomada de: https://www.google.com.mx/search?q=imagenes+de+disacaridos El otro grupo a estudiar son los polisacáridos son los carbohidratos más complejos, como ejemplos de polisacáridos tenemos: el almidón y la celulosa. El almidón constituye una fuente de energía importante para los seres humanos, es una mezcla de dos polímeros, los cuales son: la amilopectina (80%), insoluble en agua y la amilosa (20%), soluble en agua. En ambos casos, son un homopolímero de la D-glucosa, donde los enlaces glucosídicos son α-1,4´ en su mayoría y α-1,6´en menor proporción, los encontramos en los granos de cereales, en las raíces comestibles tales como las papas, liberándose el almidón durante la cocción, debido a que el calor rompe los gránulos. Cabe señalar que cuando consumimos en exceso carbohidratos, nuestro organismo tiende a depositarlos en el tejido adiposo debajo de la piel, esto es porque los convierte en grasa, motivo por el cual no debemos de exceder en nuestra dieta a los carbohidratos ni cenar después de las 20:00 para que no se acumulen. La celulosa es un homopolímero de la D-glucosa y es insoluble en agua. Los enlaces glucosídicos del acetal son beta, lo que pone a los sustituyentes en posición ecuatorial, dando como resultado un polímero estable, forma parte de la madera y del algodón. A continuación se muestran ambas moléculas. Universidad Abierta y a Distancia de México 48 Químico Unidad 3. Principios de química orgánica Figura 24. Estructuras de la celulosa y el almidón 3.2.2. Lípidos Los lípidos son sustancias insolubles en agua, así como en algunos otros disolventes polares y solubles en disolventes no polares, como lo es el benceno, el éter, la acetona, el cloroformo, entre otros. Los lípidos desempeñan funciones importantes para los seres vivos, entre las que destacan las siguientes: a) Estructural: son componentes estructurales de las membranas celulares. b) Energéticas: sirven de reserva energética, pues proporcionan una gran cantidad de energía. c) Protectora: las ceras impermeabilizan las paredes celulares de los vegetales y de las bacterias y tienen funciones protectoras en los insectos y en los vertebrados. d) Transportadora: Sirven de transportadores de sustancias en los medios orgánicos. e) Reguladora del metabolismo: Contribuyen al funcionamiento normal del organismo: las vitaminas A, D, K y E, las hormonas sexuales, entre otras. f) Reguladora de la temperatura: Regulan la temperatura corporal de algunos animales de aguas frías. Los lípidos se clasifican en: Ácidos grasos Acilglicéridos Ceras Fosfolípidos Esteroides Universidad Abierta y a Distancia de México 49 Químico Unidad 3. Principios de química orgánica Los ácidos grasos son aquellos ácidos orgánicos de elevado número de átomos de carbono. La cadena puede o no contener dobles enlaces. Para el primer caso se dice que el ácido graso es insaturado y en el segundo se consideran saturados. Los ácidos grasos se distinguen por el número de carbonos y la posición de los dobles enlaces. Figura 25. Estructura de un ácido graso saturado e insaturado. Las grasas o también llamados acilglicéridos son ésteres de la glicerina y de los ácidos grasos, debido a que si un ácido graso se une a la glicerina, tendremos a un monoaciglicérido, y si son dos, un diacilglicérido, y si son tres, un triacilglicérido o triglicérido, que también se les conoce como grasas neutras. Los ácilglicéridos o grasas son sencillos, debido a que contienen un solo tipo de ácido graso, mientras que los mixtos tienen ácidos grasos diferentes. A continuación se muestra lo expuesto. Figura 26. Estructura de un acilglicérido o triglicérido. Universidad Abierta y a Distancia de México 50 Químico Unidad 3. Principios de química orgánica Ahora veamos a las ceras, las cuales son ésteres también pero de un monoalcohol y de un ácido graso, ambos de cadena larga, en los que encontramos: Los fosfolípidos que forman parte de las membranas celulares. Se derivan de la glicerina o de la también llamada esfingosina, que es un alcohol más complejo. Los derivados de la glicerina se llaman fosfoglicéridos y los que derivan de la esfingosina son los esfingolipidos. Los lípidos derivados del ciclo del esterano (ciclopentano-perhidrofenantreno), también llamados esteroides, son sustancias importantes para los seres vivos, los esteroides o derivados de los esteroides, por ejemplo: el colesterol, los ácidos biliares, las hormonas sexuales, las hormonas de la corteza suprarrenal, alcaloides, entre otros. Veamos sus estructuras de los esteriodes. Veamos las siguientes estructuras. Universidad Abierta y a Distancia de México 51 Químico Unidad 3. Principios de química orgánica Figura 27. Estructuras de algunos esteroides. 3.2.3. Proteínas Las proteínas son moléculas orgánicas complejas que se encuentran en células animales y vegetales. Son polímeros en los que se tienen unidades monoméricas a los aminoácidos (palabra formada de dos vocablos, una que contiene un grupo amino y ácido que contiene un grupo carboxilo), dichas proteínas tienen diversas funciones, destacando la función enzimática, y actúan como catalizadores para acelerar los procesos bioquímicos de los seres vivos. Universidad Abierta y a Distancia de México 52 Químico Unidad 3. Principios de química orgánica Figura 28. Proteína. Imagen obtenida en https://cienciaaldia.wordpress.com/2009/04/24/destruyeaminoacidos/ Las proteínas están constituidas de cadenas largas de sustancias llamadas aminoácidos. Se han identificado por hidrólisis de proteínas, alrededor de 20 aminoácidos distintos. Existen algunos aminoácidos naturales que pueden ser sintetizados por las células del organismo humano a partir de materiales sencillos que contengan C, O, H y N, pero otros tienen que adquirirse necesariamente con la dieta (sustancias que se ingieren regularmente como alimento). A estos últimos se les conoce como aminoácidos esenciales para la especie humana y son: valina, leucina, isoleucina, treonina, metionina, fenilamina, triptófano y lisina. Dichas proteínas se forman de los aminoácidos mediante enlaces peptídicos; siendo un enlace covalente que se establece entre el grupo carboxilo de un aminoácido y el grupo amino del siguiente, dando lugar al desprendimiento de una molécula de agua. A continuación te mostramos los enlaces de algunos aminoácidos esenciales. Figura 29. Formación del enlace peptídico entre dos aminoácidos Universidad Abierta y a Distancia de México 53 Químico Unidad 3. Principios de química orgánica Las proteínas presentan diversas estructuras clasificadas en 4; la primaria, la secundaria, la terciaria y la cuaternaria. En la estructura primaria es determinada por la secuencia de aminoácidos en la cadena proteica, es decir, el número de aminoácidos y el orden en que están enlazados: Figura 30. Estructura primaria de una proteína En la estructura secundaria es la disposición de la secuencia de aminoácidos en el espacio. Los aminoácidos, a medida que van enlazando y gracias a que tienen capacidad de giro en los enlaces, adquieren una posición espacial estable. Existen dos tipos de estructura secundaria: 1. La alfa-hélice 2. La lamina beta Figura 31. Estructuras secundarias de una proteína. Universidad Abierta y a Distancia de México 54 Químico Unidad 3. Principios de química orgánica La estructura terciaria conforma una estructura globular, esto es por la disposición del polipéptido al plegarse sobre sí misma. Figura 32. Estructura terciaria de una proteína. Y en la estructura cuaternaria se forma de la unión, mediante enlaces débiles o no covalentes de las cadenas polipeptídicas con una estructura terciaria, formando un complejo proteíco. Cada una de estas cadenas recibe el nombre de protómero. Figura 33. Estructura cuaternaria de la proteína hemoglobina Hemos finalizado el estudio de la química orgánica, esperamos haya despertado tu interés e investigues más de cada uno de los temas, donde descubrirás el mar de información que hay, pero te servirá de apoyo todo lo visto en la unidad 3. Si quieres ampliar tu aprendizaje, te invitamos a que consultes los siguientes recursos. Universidad Abierta y a Distancia de México 55 Químico Unidad 3. Principios de química orgánica Recursos para tu ruta de aprendizaje Si deseas repasar los diferentes grupos funcionales, revisa el siguiente enlace: http://www.google.com.mx/url?sa=t&rct=j&q=&esrc=s&source=web& cd=9&ved=0CD4QFjAI&url=http%3A%2F%2Fdcb.fic.unam.mx%2FCoordinacionesAcademicas%2FFisicaQuimica%2FQ uimica%2Fclases_virtuales%2F2Tona%2Fquimica_organica%2528A CPL%2529.pps&ei=8zTVK3kKbjCsATImYKoCQ&usg=AFQjCNGdb6ZyQPK_GmHm4vgKf yD1DC0eGg&bvm=bv.85464276,bs.1,d.d2s En este documento encontraras todo lo referente a la forma correcta de nombrar cada uno de los compuestos orgánicos, así como los eventos que se llevarán a cabo en ésta disciplina. http://www.iupac.org/ Actividades La elaboración de las actividades estará guiada por tu docente en línea, mismo que te indicará, a través del Planeación didáctica para el docente en línea, la dinámica que tú y tus compañeros llevarán a cabo, así como los envíos que tendrán que realizar. Autorreflexiones Para la parte de autorreflexiones debes responder las Preguntas de Autorreflexión indicadas por tu docente en línea y enviar tu archivo. Cabe recordar que esta actividad tiene una ponderación del 10% de tu evaluación. Universidad Abierta y a Distancia de México 56 Químico Unidad 3. Principios de química orgánica Cierre de la unidad En la unidad 3, se revisaron los principales tipos de enlace que se establecen entre los átomos al formar los diversos compuestos y moléculas, así como las propiedades que estas uniones le confieren a las sustancias. De igual manera, se analizaron las reglas establecidas por la Unión Internacional de Química Pura y Aplicada (IUPAC) para nombrar y formular a los compuestos orgánicos y estudiaron los diversos grupos funcionales. A partir de ahora puedes observar el entorno e identifica los grupos orgánicos que hay en cada objeto que usamos en nuestra vida diaria. ¡Felicidades, haz concluido esta asignatura! Para saber más En materia de Química orgánica, da clic en la siguiente liga http://www.quimicaorganica.org/, donde encontraras diversos documentos referentes a los antecedentes de la química orgánica, así como los equipos utilizados para la identificación de compuestos orgánicos. Para el tema de la formulación, da clic en la siguiente liga http://ejerciciosfyq.com/Formulacion_organica/, hallarás ejercicios, simulación tridimensional de algunas estructuras de los compuestos orgánicos, así como las estructuras. Si te interesa la historia de la química orgánica, da clic en el siguiente enlace http://www.izt.uam.mx/cosmosecm/QUIMICA_ORGANICA.html, encontraras, la evolución y las instituciones educativas que se dedican a la investigación de la química orgánica, en México. Si te interesa saber que hacen las asociaciones en materia de química, consulta la siguiente liga, dando clic en el link Academia Mexicana de Química Orgánica A.C. Referencias Battaner, E. (2012). Biomoléculas. Una introducción estructural a la bioquímica. España: Salamanca. Berzosa, I., & Llopis, J. (2002). Formulación en química orgánica. Valencia: Universidad Politecnica de Valencia. Bruice, P. (2008). Química orgánica. Estado de México: Pearson. Fieser, F. (1985). Química orgánica fundamental. España: Reverté, S.A. García, M. (2005). Química orgánica. México: Progreso. Universidad Abierta y a Distancia de México 57 Químico Unidad 3. Principios de química orgánica Geissman, T. (2004). Principios de química orgánica. Barcelona: Reverté, S.A. Klages, F. (2005). Tratado de química orgánica, Tomo 1 (primera parte). Barcelona: Reverté. Lamarque, A., & Zygadio, J. (2008). Fundamentos teórico-prácticos de química orgánica. Argentina: Encuentro, grupo editor. Marvel, C. (1998). Introducción a la química orgánica de las macromoléculas de síntesis. New York: Reverté. Mc Murry, J. (2012). Química orgánica. México: Cengage learning. Morrison, R., & Neilson, R. (2000). Química orgánica. México: Pearson. Patiño Olivares, A. (2007). Introducción a la Ingeniería Química (Balances de Masa y Energía) . México DF: Universidad Iberoamericana. Richard, F. M., & Ronald, R. W. (2004). Principios Elementales de los Procesos Químicos. México DF: Limusa Wiley. Rojas, M., & Garzón, R. (2010). Estructura y función de biomoléculas. Colombia: Universidad del Rosario. Universidad Abierta y a Distancia de México 58