tercera ley de termodinámica, energía libre de gibbs
Anuncio

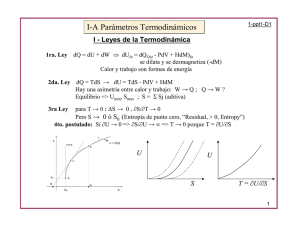
I. TERCERA LEY DE TERMODINÁMICA, ENERGÍA LIBRE DE GIBBS-HELMHOLTZ Y GIBBS Estadística (entropía) - aumento en el desorden de la energía y configuración espacial. A. T = configuración B. Ejemplo: 1. Probabilidad de que se encuentre en uno de los dos lados del envase depende del tamaño del envase: Para una partícula Para dos partículas Para N partículas C. El estado más probable es aquel que tenga el número mayor de configuraciones. D. Entropía: (B) I. LA TERCERA LEY DE TERMODINÁMICA ESTABLECE: Para un cristal perfecto y puro de una sustancia pura, su entropía se aproxima a cero a medida que la temperatura se aproxima a 0 K. A. S = k ln T = k ln (1) = 0 Ya que T = 1 debido a que es una sola configuración. B. La entropía de un sistema se determina: (1) (2) © 1997 - 2000 I. Nieves Martínez Página - 1 - TERCERA LEY DE TERM ODINÁMICA, ENERGÍA LIB RE DE GIBBS-H ELMHOLTZ Y GIBBS C. )S de una reacción química: C6O12O6(s) + 6 O2(g) º 6 CO2(g) + 6 H2O(l) 1. (4) 2. 3. D. (3) (5) ) Stot = 0 ) Stotal > 0 ) Stotal < 0 para reacciones en equilibrio para procesos espontáneos para procesos no espontáneos (6) Sistemas cerrados: Desigualdad de Calussius: 1. 2. (7) Por lo tanto: (8) E. II. Sistemas aislados: T dS $ 0 (9) Función de Energía Libre de Helmholtz, (A); [sistemas cerrados] A. Derivación: 1. (10) (11) (12) (13) (14) 2. A T constante: dwASS $ dA wASS $ )A wSSA # - )A wSSA = - )A reversible © 1997 - 2000 I. Nieves Martínez (15) (16) (17) (18) Página - 2 - TERCERA LEY DE TERM ODINÁMICA, ENERGÍA LIB RE DE GIBBS-H ELMHOLTZ Y GIBBS 3. B. A volumen constante y T constante, usando la ecuación (16): - P dV = wASS = 0 $ )A (19) Ecuaciones y definición: 1. A = U - TS (20) 2. dA = dU - TdS - SdT (21) 3. dA = -PdV + TdS - TdS - SdT (22) 4. dA = -PdV - SdT (23) 5. Criterio de Euler: Primera relación de Maxwell (24) 1a RM III. Energía Libre de Gibbs: A. Derivación: 1. TdS $ dq = dU + PdV - dwe Donde we representa todos los trabajos menos el de expansión. 2. TdS - dU - PdV $ - dwe 3. d(TS) - dU - d(PV) $ - dwe a T y a P constante 4. -d(U + PV - TS) $ -dwe 5. -d(H + TS) $ -dwe 6. -dG $ -dwe ASS # dwe 7. (dG)T,P 8. )G # we 9. )G # 0 solo trabajo de expansión 10. Proceso espontáneo: )G < 0 11. Proceso en equilibrio: )G = 0 12. Proceso no espontáneo: )G > 0 B. Ecuaciones: 1. G = H - TS = (U + PV) - TS 2. dG = dH - d(TS) = dU + PdV + VdP - TdS - SdT 3. dG = TdS - PdV + PdV + VdP - TdS - SdT 4. dG = VdP - SdT © 1997 - 2000 I. Nieves Martínez (25) (26) (27) (28) (29) (30) (31) (32) (33) (34) (35) (36) (37) (38) (39) (40) Página - 3 - TERCERA LEY DE TERM ODINÁMICA, ENERGÍA LIB RE DE GIBBS-H ELMHOLTZ Y GIBBS 5. Criterio de Euler: Segunda relación de Maxwell 2a RM (41) 3a RM (43) 4a RM (44) 1a RM (24) 6. IV. RESUMEN A. Procesos y criterios de espontaneidad y equilibrio: Tipo de proceso Criterio de espontaneidad Criterio de equilibrio Observaciones general TdS > dq TdS = dqrev cualquier cambio q=0 w=0 aislado dS > 0 dS = 0 )S > 0 )S = 0 isotermal -dA > dwirrev -dA = dwrev )A = wrev A = U - TS isotermal e isocórico dA < 0 dA = 0 )A = 0 función de t rabajo isotermal e isobárico dG < 0 dG = 0 G = H - TS © 1997 - 2000 I. Nieves Martínez )G = 0 Página - 4 - TERCERA LEY DE TERM ODINÁMICA, ENERGÍA LIB RE DE GIBBS-H ELMHOLTZ Y GIBBS B. Ecuaciones Importantes: Definición Ecuación fundamental Funcionalidad Variable física asociada Relación de Maxwell U=q+w dU = TdS - PdV )U = f(S,V) RM 44 (45) H = U + PV dH = TdS + VdP )H = f(S,P) RM 43 (46) A = U - TS dA = -SdT - PdV )A = f(T,V) RM 24 (47) G = H - TS dG = -SdT + VdP )G = f(T,P) RM 41 (48) C. V. Relaciones de Propiedades y Leyes termodinámicas: 1. Propiedades mecánicas: PyV 2. Primera Ley: UyT 3. Segunda Ley: SyT 4. Primera y Segunda Ley: H, A y G 5. Si we = 0 y solo se hace trabajo PV, se pueden relacionar: P, V, T, U, S, H, A y G. Aplicaciones y ejemplos: A. Un mol de gas ideal a 25°C se expande isotermalmente y reversiblemente desde un volumen de 10 L a uno de 20 L. Determine )A y )G para el proceso. (Respuestas: )A = -1717 J y )G = -1717 J) B. Con las mismas condiciones del problema anterior (A), pero una expansión irreversible. Determine w, )A y )G. C. Aplicaciones de las relaciones de Maxwell: 1. Cálculo de a. dU = TdS - PdV a T constante Dividiendo la ecuación (49) por dV a T constante (49) (50) b. © 1997 - 2000 I. Nieves Martínez Pero si sustituimos la ecuación de Maxwell (24) en la ecuación (50): Página - 5 - TERCERA LEY DE TERM ODINÁMICA, ENERGÍA LIB RE DE GIBBS-H ELMHOLTZ Y GIBBS (24) c. (51) d. Para gas ideal: e. Sustituyendo (52) en (51): (52) (53) 2. Cálculo de a. dH = TdS + VdP b. Dividiendo la ecuación (54) entre P a T constante: (54) (55) c. Sustituyendo la Relación de Maxwell (41): en la ecuación (55). d. (56) e. Para gas ideal: f. Sustituyendo (57) en (56): (57) (58) 3. Coeficiente de Joule-Thompson: (59) a. © 1997 - 2000 I. Nieves Martínez Sustituyendo la ecuación (56) en la ecuación (59): Página - 6 - TERCERA LEY DE TERM ODINÁMICA, ENERGÍA LIB RE DE GIBBS-H ELMHOLTZ Y GIBBS (60) 4. Usando las relaciones de Maxwell convenientes demuestre que: (61) D. Energía Libre de Gibbs en función de T y P: 1. dG = VdP - SdT a. Isotermal (1) dGT = VdPT (2) (62) (63) (64) (3) dG es proporcional a dP y a V (dG " dP " V) (4) para una reacción química: (5) separando variables: (65) (66) (6) para gases ideales: (67) (7) Integrando: (68) (8) Isotermal y por Ley de Boyle: (69) b. Isobárico: (1) dGP = - S dT cuando S > 0 (70) (2) (71) (3) © 1997 - 2000 I. Nieves Martínez dG es proporcional a dT y a -S (dG " dT " -S) (72) Página - 7 - TERCERA LEY DE TERM ODINÁMICA, ENERGÍA LIB RE DE GIBBS-H ELMHOLTZ Y GIBBS (4) (5) Una relación más práctica es: G = H - TS Despejando la ecuación (73) por -S: (73) (74) (6) (7) (8) Sustituyendo la ecuación (74) en (71): (75) dividiendo MG entre temperatura (T) en la parte izquierda de la ecuación (75) y derivando (G/T): (76) (9) Sacando denominador común y sustituyendo la ecuación (75) (77) (10) © 1997 - 2000 I. Nieves Martínez (78) Página - 8 -