Energía libre y equilibrios físicos
Anuncio

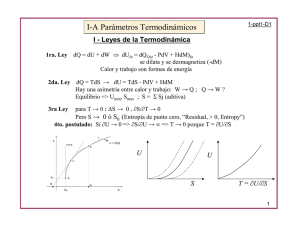
TEMA 3 ENERGÍA LIBRE Y EQUILIBRIOS FÍSICOS 1. ENERGÍA LIBRE Tema 3 2. VARIABLES NATURALES 3. RELACIONES DE MAXWELL 4. EQUILIBRIO FÍSICO Energía libre y equilibrios físicos 5. POTENCIAL QUÍMICO 6. DIAGRAMA DE FASES P-T 7. DIAGRAMA DE FASES P-V 8. ECUACIÓN CLAUSIUS-CLAPEYRON 9. DIAGRAMA DE FASES DE SUSTANCIAS PURAS 10. REGLA DE LAS FASES 11. EQUILIBRIO DE FASES EN SISTEMAS MULTICOMPONENTES 12. APLICACIONES BIOLÓGICAS 1 1 2 ENERGÍA LIBRE ENERGÍA LIBRE dSuniverso = dS sistema + dS entorno ≥ 0 ∂Q dS sistema − cedido ≥ 0 T ∂Qcedido • Función de Estado • Propiedad Extensiva F = U-TS Energía libre de Helmholtz G = H-TS Energía libre de Gibbs • Unidades (J) La energía libre es el máximo trabajo que puede realizar el sistema = Calor cedido por el sistema Si T y V cte Si T y P cte ∂Qcedido = ∂Qv = dU ∂Qcedido = ∂QP = dH (T cte) dU ≥0 T dU − TdS ≤ 0 dH ≥0 T dH − TdS ≤ 0 dS − dS − dU − TdS = dF ≤ 0 Condición de espontaneidad F= Energía libre de Helmholtz dF = ∂W dF = dU − TdS − SdT = ∂Q + ∂W − TdS = ∂W (Proceso reversible) F = Máximo trabajo que puede realizar el sistema a T cte dG = dH − TdS − SdT = dU + pdV − Vdp − TdS = ∂Q + ∂W + pdV − TdS (T cte) dH − TdS = dG ≤ 0 G= Energía libre de Gibbs 3 U = Q +W Variables naturales (S y V) H = U + pV dH = dU + pdV + Vdp C6H12O6 (s) + 6 O2(g) Æ 6CO2(g) + 6 H2O(l) ∆Uº=-2808 kJ/mol; ∆Sº=+182.4 J/K.mol dH = TdS − pdV + pdV + Vdp = TdS + Vdp a) Sin hacer ningún cálculo razonar si el trabajo máximo será superior o inferior a la energía interna del sistema b) ¿Que parte de la energía se puede extraer como trabajo? F = U − TS dF = dU − TdS − SdT = dF = TdS − pdV − TdS − SdT = − pdV − SdT G = H − TS dG = dH − TdS − SdT = 5 4 VARIABLES NATURALES dU = TdS − pdV Se oxida un mol de glucosa a 25 ºC y a volumen constante (Proceso reversible) G = Máximo trabajo (no mecánico) que puede realizar el sistema a T y P cte 2 EJEMPLO Cálculo del trabajo máximo disponible (p cte) dG = ∂W + pdV = ∂Wmecanico + ∂Wotros + pdV = ∂Wotros dF = TdS + Vdp − TdS − SdT = Vdp − SdT Variables naturales (S y p) Variables naturales (V y T) Variables naturales (p y T) 6 1 3 RELACIONES DE MAXWELL RELACIONES DE MAXWELL (II) Teorema de Schwartz: igualdad de las derivadas parciales cruzadas → ⎛ ∂T ⎞ ⎛ ∂p ⎞ ⎜ ⎟ = −⎜ ⎟ ⎝ ∂V ⎠ S ⎝ ∂S ⎠V ∂2H ∂2H = ∂p∂S ∂S∂p → ⎛ ∂T ⎜⎜ ⎝ ∂p ∂2F ∂2F = ∂V ∂T ∂T ∂V → ⎛ ∂p ⎞ ⎛ ∂S ⎞ ⎟ ⎟ =⎜ ⎜ ⎝ ∂ V ⎠ T ⎝ ∂ T ⎠V → ⎛ ∂S ⎞ ⎛ ∂V ⎞ ⎜⎜ ⎟⎟ = − ⎜ ⎟ ∂ p ⎝ ∂T ⎠ p ⎝ ⎠T ∂ 2U ∂ 2U = ∂V ∂S ∂S ∂V ∂ 2G ∂ 2G = ∂p∂T ∂T ∂p U = Q +W ⎞ ⎛ ∂V ⎞ ⎟⎟ = ⎜ ⎟ ⎠ S ⎝ ∂S ⎠ p Primera derivada Segunda derivada ⎛ ∂U ⎞ ⎜ ⎟ =T ⎝ ∂ S ⎠V ∂ 2U ⎛ ∂T ⎞ =⎜ ⎟ ∂S∂V ⎝ ∂V ⎠ S ⎛ ∂U ⎞ ⎟ = −p ⎜ ⎝ ∂V ⎠ S ∂ 2U ⎛ ∂p ⎞ = −⎜ ⎟ ∂V ∂S ⎝ ∂S ⎠V RELACCIÓN DE MAXWELL 8 F = U − TS dF = dU − TdS − SdT = Variables naturales (S y p) Variables naturales (V y T) dF = TdS − pdV − TdS − SdT = − pdV − SdT ∂2H ∂2H = ∂ ∂ ∂ ∂ Segunda derivada ⎛ ∂H ⎜⎜ ⎝∂ ⎞ ⎟⎟ = ⎠ ∂ H ⎛ =⎜ ∂ ∂ ⎜⎝ ⎞ ⎟⎟ ⎠ ⎛ ∂H ⎜⎜ ⎝∂ ⎞ ⎟⎟ = ⎠ ∂2H ⎛ =⎜ ∂ ∂ ⎜⎝ ⎞ ⎟⎟ ⎠ 2 ⎞ ⎟⎟ ⎠ ⎞ ⎛ ⎟⎟ = ⎜⎜ ⎠ ⎝ ⎛ ⎜⎜ ⎝ Primera derivada ⎛ ∂F ⎜⎜ ⎝∂ ⎞ ⎟⎟ = ⎠ ⎛ ∂F ⎜⎜ ⎝∂ ⎞ ⎟⎟ = ⎠ ⎛ ∂2F =⎜ ∂ ∂ ⎜⎝ G = H − TS dG = dH − TdS − SdT = Variables naturales (p y T) dF = TdS + Vdp − TdS − SdT = Vdp − SdT ⎛ ∂G ⎜⎜ ⎝∂ ⎞ ⎟⎟ = ⎠ ∂ 2G ⎛ =⎜ ∂ ∂ ⎜⎝ ⎞ ⎟⎟ ⎠ ⎛ ∂G ⎜⎜ ⎝∂ ⎞ ⎟⎟ = ⎠ ∂ 2G ⎛ =⎜ ∂ ∂ ⎜⎝ ⎞ ⎟⎟ ⎠ ⎛ ⎜⎜ ⎝ ⎞ ⎛ ⎟⎟ = ⎜⎜ ⎠ ⎝ ⎞ ⎟⎟ ⎠ ⎛ ⎜⎜ ⎝ ⎞ ⎛ ⎟⎟ = ⎜⎜ ⎠ ⎝ ⎞ ⎟⎟ ⎠ EQUILIBRIO FÍSICO Una misma sustancia a diferentes condiciones de presión y temperatura puede existir como sólido, como líquido o como gas. ∂ 2G ∂ 2G = ∂ ∂ ∂ ∂ Segunda derivada ⎞ ⎟⎟ ⎠ RELACCIÓN DE MAXWELL 10 4 RELACIONES DE MAXWELL (V) ∂2F ∂2F = ∂ ∂ ∂ ∂ Segunda derivada ⎛ ∂2F =⎜ ∂ ∂ ⎜⎝ RELACCIÓN DE MAXWELL 9 Primera derivada ⎛ ∂T ⎞ ⎛ ∂p ⎞ ⎜ ⎟ = −⎜ ⎟ ⎝ ∂V ⎠ S ⎝ ∂ S ⎠V RELACIONES DE MAXWELL (IV) dH = TdS − pdV + pdV + Vdp = TdS + Vdp Primera derivada ∂ 2U ∂ 2U = ∂S ∂V ∂V ∂S 7 RELACIONES DE MAXWELL (III) H = U + pV dH = dU + pdV + Vdp Variables naturales (S y V) dU = TdS − pdV ⎞ ⎟⎟ ⎠ RELACCIÓN DE MAXWELL 11 Existen también condiciones específicas de cada sustancia que permiten la coexistencia entre dichas fases. El estudio teórico de las condiciones de tal coexistencia se conoce como Equilibrio Físico. 12 2 5 POTENCIAL QUÍMICO POTENCIAL QUÍMICO Energía libre de Gibbs (o entalpía libre) Función de estado extensiva ∆G Representa el trabajo químico útil (trabajo no mecánico) Proporciona la condición de equilibrio (∆G = 0) y de espontaneidad ( ∆G ≤ 0 ) para una reacción química Al aumentar T, el potencial químico de una sustancia pura (µ°) disminuye (S° > 0) La energía de Gibbs molar parcial, es lo que se conoce con el nombre de potencial químico µi = Gi _ = Gi n Gtotal = ∑ µi X i _ _ _ d G = dµ = − S dT + V dp Ecuación de Gibbs-Duhem 6 Fracción molar del componente i ⎛ ∂G ⎞ ⎜ ⎟ = −S ⎝ ∂T ⎠ p dG = − SdT + Vdp A las temperaturas de transición de fase µ es igual para las dos fases ( Unidades: J/mol ) − ⎛ ∂µ ⎞ ⎜ ⎟ = −S ⎝ ∂T ⎠ p µ sol ,Tf = µliq ,Tf ⎛ ∂G ⎞ ⎜⎜ ⎟⎟ = V ⎝ ∂p ⎠T ⎛ ∂µ ⎜⎜ ⎝ ∂p − ⎞ ⎟⎟ = V ⎠T µliq ,Tb = µ gas ,Tb 13 DIAGRAMA DE FASES PP-T 14 DIAGRAMA DE FASES PP-T Punto crítico: coexisten la fase líquida y la gaseosa. Delimita la zona del gas de la zona del vapor Línea de sublimación:desde el cero absoluto hasta el punto triple. Vapor: licua al enfriarlo. Gas: no licua al enfriarlo. Punto triple: coexisten las tres fases: sólida, líquida y gaseosa. La presión en cada punto de las líneas de sublimación y vaporización es la presión de vapor del sólido y del líquido a esa temperatura. Línea de fusión: desde el punto triple sin límite superior conocido. Línea de vaporización: desde el punto triple al crítico. Cuando dos fases a y b están en equilibrio se cumple que µ a = µb Ta = Tb pa = pb 15 7 8 DIAGRAMA DE FASES PP-V 16 ECUACIÓN CLAUSIUSCLAUSIUS-CLAPEYRON En el equilibrio de las fases 1 y 2 de un cuerpo puro se cumple Al variar P y T, pero permaneciendo en la curva de equilibrio, el cambio en G (y por tanto de µ) de las dos fases debe ser igual: Este diagrama muestra la influencia del cambio de fase en el volumen. µ1 = µ 2 dµ1 = dµ 2 Sustituyendo los potenciales químicos: Las isotermas se hacen horizontales durante el cambio de fase. dp ∆S ∆H = = T∆V dT ∆V − S 1 dT + V 1 dp = − S 2 dT + V 2 dp ( S 2 − S1 ) dT = (V2 − V1 ) dp La curva binodal une los puntos de líquido saturado, como a, el punto crítico y los puntos de vapor seco, como b. Ecuación de Clapeyron Si se considera que una de las fases es de vapor Vsólido ≈ Vlíquido <<<< Vvapor dp ∆ H GI ∆H = = p dT T V vapor RT 2 17 ∆H dp = dT p RT 2 Ln ∆H ⎛ 1 p2 1 ⎞ ⎜ ⎟ = − p1 R ⎜⎝ T1 T 2 ⎟⎠ Ecuación de Clausius-Clapeyron 18 3 9 ECUACIÓN CLAUSIUSCLAUSIUS-CLAPEYRON P GL Diagrama de fases del CO2 Curva de fusión Cristales GC < GL = GC DIAGRAMAS DE FASES DE SUSTANCIAS PURAS Ecuación de Clapeyron Líquido GL < GC 1. No hay CO2 líquido a presión y temperatura ambiente. dp ∆S = dT ∆V 2. Pendiente P/T > 0, como casi todas las sustancias. 3. Como la presión del punto triple es mayor que 1 atm sublima 4. El CO2 supercrítico (Tc = 32 °C y Pc = 73 atm) se usa para extraer la cafeína del café. T 19 20 CO2 (s): hielo seco DIAGRAMAS DE FASES DE SUSTANCIAS PURAS 10 Diagrama de fases del agua REGLA DE LAS FASES Para caracterizar completamente un sistema termodinámico es necesario conocer el valor de un número de variables intensivas independientes (L). El hielo es menos denso que el agua (pendiente P/T < 0) L=C–F+2 Componentes Fases Sustancia pura: C = 1 21 El número de variables independientes se reduce aún más cuando en el sistema: Tienen lugar r reacciones químicas F=1 L = 1 - 1 +2 = 2 TyP F=2 L = 1 - 2 +2 = 1 T (o P) F=3 L = 1 - 3 +2 = 0 22 DE FASES EN SISTEMAS 11 EQUILIBRIO MULTICOMPONENTES L=C–F+2-r DISOLUCIONES IDEALES Existen además relaciones estequiométricas o de conservación de la electroneutralidad L=C–F+2-r-a • Estructuralmente soluto y disolvente son muy similares • Cada componente de la disolución ejerce una presión de vapor que es proporcional a su fracción molar en el líquido y a la presión de vapor del componente puro (a T) Ejemplo Mezcla gaseosa : N2, H2 y NH3: 1. Mezcla gaseosa C=3 F=1 L = 3 - 1 +2 = 4 T , P, X1 y X2 2. Mezcla gaseosa con catalizador C=3 F=1 r=1 2NH3 ↔N2 +3 H2 L=3– 1+2–1=3 T, P, X1 (KP) 3. NH3 con catalizador para establecer el equilibrio 2NH3 ↔N2 +3 H2 C=3 F=1 r = 1 a = 1 [X(H2) = 3X(N2)] L=3– 1+2–1-1=2 T, P p i = X i Pi 0 Ley de Raoult 23 24 4 EQUILIBRIO DE FASES EN SISTEMAS MULTICOMPONENTES El conocimiento de la P del sistema en función de las fracciones molares del líquido y el gas permite dibujar el diagrama de la presión frente a la composición de ambos a T constante DISOLUCIONES NO IDEALES En general, las disoluciones no se comportan como disoluciones ideales, solo en el caso en que la fracción molar del disolvente tienda a uno, disolución diluida ideal, su comportamiento se puede asemejar al de una disolución ideal. Ejemplo Sistema Benceno-Tolueno 25 DISOLUCIONES NO IDEALES DISOLUCIÓN IDEAL DESVIACIÓN POSITIVA 26 DESVIACIÓN NEGATIVA DISOLUCIONES NO IDEALES Mezclas de líquidos Mezclas de líquidos Un azeótropo es una mezcla líquida de dos o más componentes que poseen un único punto de ebullición constante y fijo, y que al pasar al estado vapor se comporta como un líquido puro, es decir, como si fuese un solo componente. Cuando se forma un azeótropo no es posible separar los componentes de la mezcla por destilación simple. Azeótropo de ebullición máxima Azeótropo de ebullición mínima Ambos tipos de azeótropos presentan una característica común, que la composición de la fase líquida y vapor en equilibrio líquido-vapor es idéntica en el punto donde se forma el azeótropo. 27 EQUILIBRIO DE FASES EN SISTEMAS MULTICOMPONENTES Los sistemas azeotrópicos de ebullición mínima son más frecuentes que los de ebullición máxima. 28 Diagramas líquido-sólido Equilibrio de fases sólido líquido en sistemas de dos componentes µBliquido = µBsolido Llamaremos disolvente al componente más abundante (B) y soluto al menos abundante (A) Cuando enfriamos una disolución a P=cte se produce la solidificación A + B (líquido) A + B (líquido) A (sólido) + disolución sobresaturada B (sólido) eutéctico Ts única Punto de solidificación de la disolución 29 30 5 DIAGRAMAS DE FASE CON MÁS DE DOS COMPONENTES DIAGRAMAS DE FASE CON MÁS DE DOS COMPONENTES Diagrama de fases ternario 1 componente: SiO2 3 componentes (sistema ternario) CaMgSi2O6 - Mg2SiO4 - Mg2Si2O6 0.2 TBA Sistema anhidro, P = cte = 20 kbar 0.65 DTBP 2 componentes (sistema binario) CaAl2Si2O8 - CaMgSi2O6 P = cte 0.2 DTBP 0.15 H2O 31 12 32 APLICACIONES BIOLÓGICAS Los cristales líquidos (moléculas alargadas) tienen un ordenamiento intermedio entre sólidos y líquidos. Se distinguen 2 fases principales: 1. Fase nemática (del griego: fibra) En 1888 el botánico austríaco Friedrich Reinitzer observó que los cristales de benzoato de colesterol fundían a 145 °C formando un líquido opaco, estable hasta 178 °C, donde formaba un líquido claro. Reinitzer and Lehman llamaron a la fase estable entre 145 y 178 °C, “cristal líquido”. Kelker y Scheurle (1969) observaron que el MBBA (4-metoxi-benciliden-4′-butilanilina se comportaba como cristal liquido a temperatura ambiente. Actualmente hay un gran serie de moléculas que se comportan como cristales líquidos a temperatura ambiente, hechos por Merck en Alemania y por Hoffman La Roche en Suiza. 2. Fase esméctica (del griego, jabón) Esméctica tipo 1 Esméctica tipo 2 33 34 6