I_A Param Termod 11 Clase
Anuncio
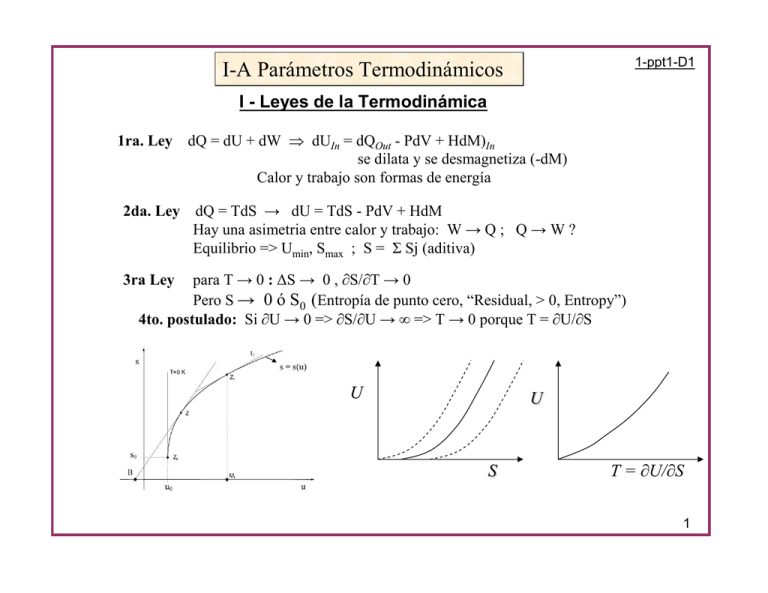
1-ppt1-D1 I-A Parámetros Termodinámicos I - Leyes de la Termodinámica 1ra. Ley dQ = dU + dW ⇒ dUIn = dQOut - PdV + HdM)In se dilata y se desmagnetiza (-dM) Calor y trabajo son formas de energía 2da. Ley dQ = TdS → dU = TdS - PdV + HdM Hay una asimetria entre calor y trabajo: W → Q ; Q → W ? Equilibrio => Umin, Smax ; S = Σ Sj (aditiva) para T → 0 : ∆S → 0 , ∂S/∂T → 0 Pero S → 0 ó S0 (Entropía de punto cero, “Residual, > 0, Entropy”) 4to. postulado: Si ∂U → 0 => ∂S/∂U → ∞ => T → 0 porque T = ∂U/∂S 3ra Ley U U S T = ∂U/∂S 1 Tipo de Parametros: intensivos (T, p, h..E,Tension..., µ) (Σ Tj = ?) extensivos (S, V, M...D, Deform.., N) (Σ Vj = Vtot) si Y conjudado de X → Y = δG/ δX pseudo intensivos: por unidad de masa, de volumen, ..... Externos (controlables) e Internos (no controlables): parámetros de control (externos) = Presión, Campo, Composición ej: CV ≠ CP (CH vs CM) parámetros internos = orden configuracional, defectos T Aleaciones (amorfos, vidrios) ; Sistemas Frustrados (Spin-Ice) Abriata, Laughlin; Prog. Mater. Sci 49 (2004) 367 2 Función de estado: si una función u(x,y) tiene un valor inicial defnido, p.ej. ui= 0 y su valor solo depende del estado final uf(x,y), entonces “u” es una función de estado. Hay 4 (usuales) funciones de estado: Energia Interna: U(S, V, -M) → dU =TdS - pdV + hdM ; Entalpia: E(S, p, h) → dE=TdS + Vdp - Mdh Potencial de Gibbs: G(T, p, h) → dG= - SdT + Vdp - Mdh (intensivos) Potencial de Helmholtz: F(T, V, -M) → dF= - SdT - pdV + hdM (T, extensivos) dG = - SdT + Vdp - Mdh – µdN δG/ δxi: S V M µ(εF) δ2G/ δxi2: CP κ χ ? δ2G/ δxiδyj : αth λH (αth = Expans.Térmica, λH = Magnetostricción) medibles: Cp ; V ; M ; χ-ac ; → S ; γ ; αth ; λH ; χ-dc 3 Relaciones entre parámetros “mecánicas” “magnéticas” Relaciones de Maxwell 4 Técnicas Experimentales 5 Ejemplo de : lim(T→0) ∂V/∂T)P = 0 data from R. Kuechler PhD Thesis, Dresden 2005. CePd1-xRhx 60 [10-6 ] // a (VT - V 6K ) / V ∆L // a = 0.87 , 0.90 0 Rh 0.87 Rh 0.90 ( Vx - V0.8 ) / V -10 -20 TN 2 0.55 0 20 -20 Sereni et al; J of Optoel. & Adv. Mat. 10 (2008) 1645, data from R. Kuechler PhD Thesis, Dresden 2005. 0 Rh 0.80 Rh 0.80 Rh 0.85 Rh 0.85 40 Thermal variation of volume: VT = ∫ β dT , referred to its value at 6K (V6K). -2 0.80 0.70 0.65 -4 0 1 -30 4 0.80 -40 2 3 4 5 T [K] Ortorombico → Direccional ! conjugada de V puede ser un tensor 6 CeIn3-xSnx 0.70 // b , c 1 3 T [K] 0.55 -40 0 2 0.65 -50 0 1 2 3 4 5 6 T [K] Non monotonous variation of V(T=0; x) respect to V(T=0; 0.80) Cubico – FCC (fluctuaciones cuánticas – 3ra Ley) 6 Relaciones entre parámetros Volumen vs Presión (exper. vs teoría) (CP – CV ) /T = (∂S/∂T)P - (∂S/∂T)V = (W) = (∂S/∂P)T (∂P/∂T)V Maxwell => (∂S/∂P)T = - (∂V/∂T)P = - V β (∂P/∂T)V = - (∂P/∂V)T (∂V/∂T)P = - (∂V/∂T)P / (∂V/∂P)T = - β / κ (W) = V β2 / κ => CP - CV = T V β²/ κ β Sólidos => presión del “gas de electrones’ (elástica) caso CeAl3 => dep. de las escalas de temperatura κ 7 Expansión Térmica ∂S/ ∂P = - ∂V/ ∂T = - α Relaciones entre parámetros Compresibilidad CP /T = f(p) → ∆S(T,P)→ κ(T) T [K] 0 1 2 3 4 5 0.5 0.4 ∆Sm / Rln 2 (a) 0 GPa 0.25 0.61 1.0 1.4 κ=1/V ∂V/ ∂P ; ∂S/ ∂P α / γ = ss pre 0.3 ∂S/∂P * 1/V ∂V/∂T * ∂T/ ∂S = 1/V * ∂V/∂P 0.2 div1 0.1 CeCu2 (Si0.9Ge0.1 )2 κ = dS/dp * α / γT [~ 10 /Kbar] 4 -6 0.0 0.15 medido -6 -1 α [10 K ] 0.10 0.05 calculado δ S / δ p [a.u.] 0.00 1 2 3 4 2 1 0 0 -0.05 0 3 5 1 2 3 4 5 T [K] T [K] 8 Relaciones entre parámetros 1.0 H=0 0.5 T 1T 2T S / 2RLn2 0.8 ∂S/ ∂H = ∂M/ ∂T Ce1.9Pd2.4In0.7 0.6 0.4 H 0.2 Ce1.9 Pd2.4 In0.7 0.0 10 0T 0.3 0.5 0.7 M / B [emu / mol Oe] 2 1 2 3 4 4 5 6 B= 1T 4 0 3 0.8 B = 1T 0 2 1.0 B = 2T 6 1 T [K] 2 Cm [J / mol K ] 8 0 5 δM / δΤ < 0 0.6 0.4 0.2 6 0.0 T [K] PRB 81 (2011) 184429 2 4 6 T [K] 8 10 9 Relaciones entre parámetros Metamagn. trans. del CeRu2Si2 λH = ∂V/ ∂H = ∂2G/ ∂P ∂H χ = ∂M/∂H = ∂2G/ ∂H2 αth = ∂V/ ∂T = ∂2G/ ∂P ∂T 0.5K 1K 3 δα / δT 2 ∂αth / ∂H = ∂3G/ ∂P ∂T ∂H 1 0 7.4 7.5 7.6 7.7 7.8 µ o H (T) γ = CP /T = ∂2G / ∂T2 Deriv.(?) expan. térmica 10 Parámetro de Grüneisen ≠ f(T) Generalización } U = - T2 δ(F/T)/δT |V (Demo 3.) de Debye U = 9R T4/θ3 ∫0Xmx x3/(ex-1) dx con x = θ /T Sistema simple vibraciones atómicas x 10-5 Γ~2 11











