º º h<
Anuncio

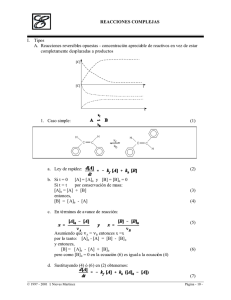
TEORIA DEL COMPLEJO ACTIVADO O ESTADO DE TRANSICIÓN I. Equilibrio: A. B. A + B º X º P Energía de vibración clásica = Energía de vibración cuántica: = h< = Ecuant = kBT Eclas (1) (2) Rapidez en que el complejo activado se mueve a través de la barrera de energía potencial (3) (4) C. Por el equilibrio: (5) D. Sustituyendo (5) en (4): (6) E. Si definimos: (7) F. Sustituyendo (7) en(6) (8) G. II. K se calcula por termodinámica estadística ypropiedades físicas fundamentales para react ivos y complejo activado (largo de enlace, frecuencia de vibración, masas y momento de iniercia). Relación de K con parámetros termodinámicos: A. ) G° = - RT ln K y ) G° = ) H° - T) S° (9) B. (10) C. Sustituyendo (10) en (7): (11) III. Asociación de Eyring con Arrhenius (12) A. De la ecuación (7) © 1997 - 2001 I. Nieves Martínez Página - 19 - T E O R I A C O M P L EJ O A C A T IV A D O (13) (14) Pero: Sustituyendo (14) en (13): (15) Pero: (16) Sustituyendo (16) en (15) (17) B. Equivalencia con Arrhenius: (18) C. Energía de activación equivale a: (19) Por lo tanto: (20) D. Pero la ecuación (11) Igualando (20) con (11): (21) (22) © 1997 - 2001 I. Nieves Martínez Página - 20 - TEORÍA DE COLISIONES I. Reacción bimolecular en el estado gaseoso. A. Redistribución de energía para choques intermoleculares (movimiento relativo) 1. Esferas rígidas: (1) 2. Distribución: (2) 3. Energía: (3) (4) B. Rapidez: (5) C. Constante específica de rapidez de acuerdo a la teoría de colisiones: (6) (7) (8) (9) (10) (11) © 1997 - 2001 I. Nieves Martínez Página - 21 -