REACCIONES COMPLEJAS I. Tipos A. Reacciones reversibles
Anuncio
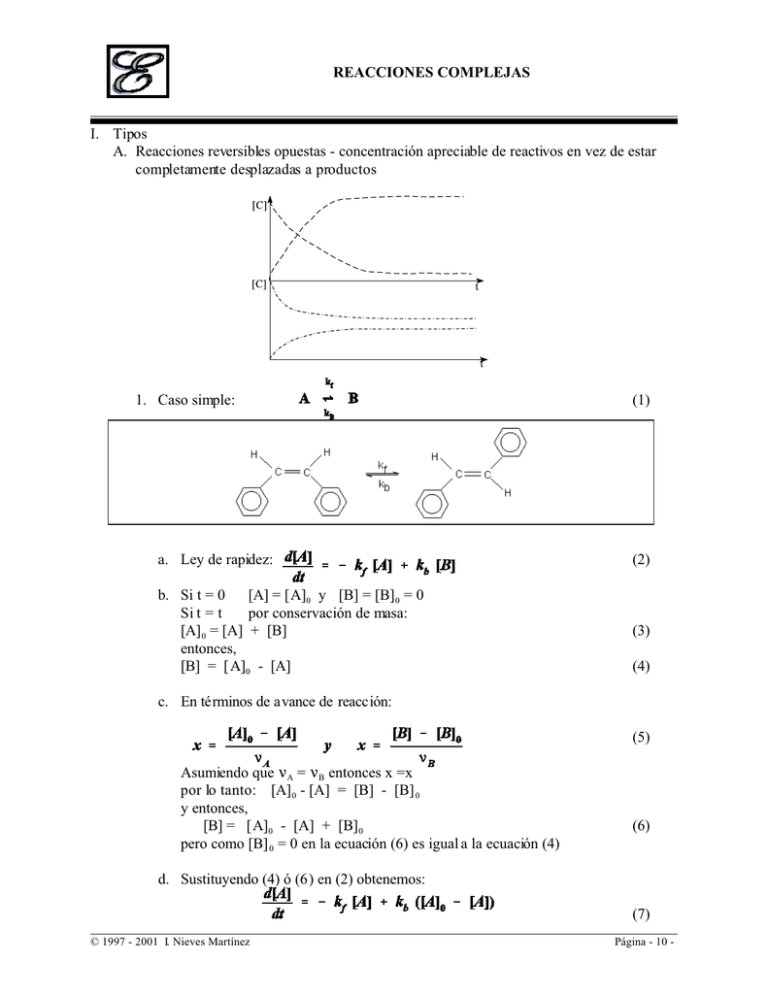
REACCIONES COMPLEJAS I. Tipos A. Reacciones reversibles opuestas - concentración apreciable de reactivos en vez de estar completamente desplazadas a productos 1. Caso simple: (1) a. Ley de rapidez: (2) b. Si t = 0 [A] = [A]0 y [B] = [B] 0 = 0 Si t = t por conservación de masa: [A] 0 = [A] + [B] entonces, [B] = [A]0 - [A] (3) (4) c. En términos de avance de reacción: (5) Asumiendo que <A = <B entonces x =x por lo tanto: [A] 0 - [A] = [B] - [B] 0 y entonces, [B] = [A]0 - [A] + [B] 0 pero como [B] 0 = 0 en la ecuación (6) es igual a la ecuación (4) (6) d. Sustituyendo (4) ó (6) en (2) obtenemos: (7) © 1997 - 2001 I. Nieves Martínez Página - 10 - REACCIONE S COMPL EJAS (8) e. Simplificando: Cuando t º 4 Rf = Rb y por lo tanto y [A] = [A] eq entonces la ecuación (8) se puede expresar: (9) y por lo tanto: (10) Sustituyendo (10) en (8): (11) (12) f. Separando variables e integrando: (13) (14) (15) (16) B. Reacciones paralelas de primer orden: © 1997 - 2001 I. Nieves Martínez Página - 11 - REACCIONE S COMPL EJAS 1. Ley de rapidez: (17) 2. Separando variables e integrando: (18) (19) (20) 3. Para el producto B la ley de rapidez: (21) Sustituyendo (20) en (21): (22) Separando variables e integrando: (23) (24) Para determinar la constante si t = 0 [B]0 = 0 y entonces la ecuación (24) se puede expresar: (25) (26) por lo tanto: (27) © 1997 - 2001 I. Nieves Martínez Página - 12 - REACCIONE S COMPL EJAS Susytituyendo (27) en (24): (28) 4. Determinación de [C] por conservación de masa: [A] 0 = [A] + [B] + [C] en cualquier t por lo tant o: [C] = [A] 0 - [A] - [B] (29) (29) (30) 5. Observen que: Si las reacciones no son reversibles y k 1 >>>k2 las concentraciones siguen un control cinético Si las reacciones son reversibles y las especies siguen un control termodinámico. C. Reacciones consecutivas: (CH3)2CO º C=CO + CH4 C=CO º 1/2 C2H4 + CO (31) 1. a t =0 [A] = [A]0 y [B] = [B]0 = 0 = [C]0 = [C] 2. Ley de rapidez: (32) (33) (34) Como [B] = [B] 0 = 0 = [C]0 = [C] entonces separando variables e integrando la ecuación (32) (35) © 1997 - 2001 I. Nieves Martínez Página - 13 - REACCIONE S COMPL EJAS (36) Sustituyendo (36) en (33): (37) Rearreglando: (38) El lado izquirdo de la ecuación (38) es una ecuación diferencial del tipo: (39) La ecuación (38) se resuelve si se multiplica por ek2t a ambos lados (40) (41) Separando variables: (42) Integrando: (43) (44) Para determinar la constante c: t = 0 [B] 0 = 0 (45) Sustituyendo (45) en (44): (46) Dividiendo (46) entre ek2t a ambos lados: (47) © 1997 - 2001 I. Nieves Martínez Página - 14 - REACCIONE S COMPL EJAS Sustituyendo (47) en (34) (48) Sería mucho más fácil si usaramos conservación de masa donde: [C] = [A] 0 - [A] [B], combinando y sacando denominador común (49) 3. Gráficas a. para k1 >>>> k2 paso lento es el # 2 t4 [C] º [A] 0 [C] = f (k2) [C]t . [A]0 (1 - e-k2t) b. para k2 >>> k1 paso lento es el # 1 1. [B] es extremadamente reactiva: [C]t . [A] 0 (1 - e-k1t) . [A]rx (50) (51) pero k2 >> k1 entonces, º (52) La ecuación (52) es una fracción pequeña y [B] es constante c. Concentración estacionaria: Esto es cierto en un intervalo de tiempo t>0yt<4 4. Aproximación del estado estacionario a. Condiciones para utilizarla © 1997 - 2001 I. Nieves Martínez Página - 15 - REACCIONE S COMPL EJAS 1. Especie bien reactiva: kdesap >>> kforma i.e. átomos, radicales, iones, especies excitadas: [Productos] >> [I] << [Reac] 2. 3. Se utiliza para sistemas complejos; (reacción en cadana) (53) (54) (55) depende del paso lento. 5. Reacciones en cadana: H2 + Br2 º 2HBr a. Ley de rapidez: (56) 1. El producto está actuando como inhibidor en etapas lejos de t º 0. 2. En t º 0 n º 3/2 b. Mecanismo: Christiansen, Herzefeld y Polanyi k1 1. M + Br2 º 2 Br• + M iniciacón (57) k2 2. Br + H2 º HBr + H• • propagación (58) k3 3. H• + Br2 º HBr + Br• propagación (59) k4 4. HBr + H º Br• + H2 • inhibición (60) k5 5. M + 2 Br º Br2 + M terminación • (61) c. Rapidez de reacción neta = rapidez de formación + rapidez de desaparición (62) © 1997 - 2001 I. Nieves Martínez Página - 16 - REACCIONE S COMPL EJAS Como los intermediarios no se pueden determinar experiment almente se asume la aproximación del estado estacionario para esas especies. (63) (64) Sumando (63) y (64): Despajando: (65) De la ecuación (63): (66) (67) Sustituyendo (65) en (67): (68) Sustituyendo (68) y (65) en (62) (69) Sacando denominador común y luego factor común combinando y luego dividiendo entre k4[Br4] toda la expresión arriba y abajo: (70) © 1997 - 2001 I. Nieves Martínez Página - 17 - REACCIONE S COMPL EJAS Dividiendo arriba y abajo por k3/k4 (71) Si: (72) Entonces las ecuación (71) es igual a la experimental. II. Aproximación del paso lento ó determinante A. I- + OClº Cl+ OIB. Ley de rapidez experimental: (73) (74) (75) (76) (77) k3 >> k2 por lo tanto: (78) © 1997 - 2001 I. Nieves Martínez Página - 18 -