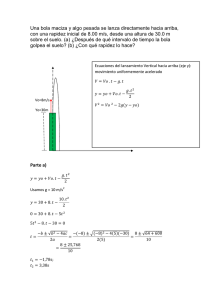
a. Determinar la constante de rapidez
Anuncio

INFLUENCIA DE LA TEMPERATURA SOBRE LA RAPIDEZ DE LA REACCIÓN. OBJETIVO GENERAL Estudiar el efecto de la temperatura sobre la rapidez de reacción. OBJETIVOS PARTICULARES Determinar la constante de rapidez de reacción a varias temperaturas. b. Obtener la Ea de reacción y el factor a. preexponencial «A» de la ecuación de Arrhenius. PROBLEMA Obtener la ecuación que relaciona la variación de la constante de rapidez de reacción con la temperatura. EFECTO DE LA TEMPERATURA SOBRE LA RAPIDEZ DE REACCIÓN • 1884 Steven Arrhenius. Teoría de Arrhenius • 1918 Lewis Teoría de las colisiones • 1935 Eyring y Polanyi Teoría de las velocidades absolutas Teoría de Arrhenius • Es la ecuación donde se observa la dependencia entre la K con la temperatura. • En 1884 se descubrió empíricamente que la K esta relacionada con la temperatura absoluta. • K= Ae-B/T donde A y B son ctes. • Una regla aproximada, válida para muchas reacciones en disolución, es que cerca de la temperatura ambiente, k se duplica o triplica por cada aumento de temperatura de 10°C. medida que se incrementa la temperatura, la rapidez de las reacciones químicas así como la rapidez de muchos procesos fisiológicos se incrementa.. A La teoría de Arrhenius El aumento de la temperatura provoca un aumento en la rapidez de la reacción, debido a que el numero de colisiones entre las especies reaccionantes aumenta. «ACTIVADAS» Ec Ea El modelo matemático que describe este comportamiento es: K = Ae − Ea / RT La ecuación solo es valida para reacciones sencillas de una sola etapa Para hacerla mas manejable se lineariza K = Ae − Ea / RT ln K = ln A − ( E A / RT ) y = b + mx ln K = ln A − ( E A / RT ) A = factor preexponencial, factor de Arrhenius o factor de frecuencia, esta relacionado con la frecuencia de las colisiones y la probabilidad de orientación de los reaccionantes para que ocurra la reacción. EA = Energía de activación R = Constante de los gases 8.314 J/mol K T = Temperatura absoluta (K) A medida que la EA se incrementa, la K se hace mas pequeña debido a que la fracción de moléculas que poseen la energía requerida, disminuye. Por lo tanto, la rapidez de reacción disminuye a medida que la barrera energética se incrementa. E ‡ Complejo activado Ea Y+Z ∆E A+B ξ Existen otras teorías para explicar el efecto de la temperatura: Teoría de las colisiones (Lewis) K = ZPe − Ea / RT Teoría del estado de transición de Eyring K = ( RT / Nh)e ∆H ≡ Ea ∆S # / R e − ∆H # / RT PROCEDIMIENTO EXPERIMENTAL Experimentalmente Medir ABSORBANCIAS a diferentes TEMPERATURAS Tomar lecturas de absorbancia a la λ seleccionada cada 60 seg. Calibración del espectrofotómetro Mezcla de reactivos a la misma temperatura, tomando el tiempo MEZCLA TEMP Calcular la concentración a partir de la ecuación de la curva patrón VASO 1 VASO 2 observacione s 1 AMBIENT ACETONA + HCL 4 mL 2 mL Sol. Yodo 4 mL Se sigue la cinética en la celda 2 Aumentar entre 30-35° 20 mL 20 mL Después de leer desechar 5 mL Llenar la siguiente tabla y graficar para comprobar el orden de reacción, para cada temperatura t (seg) Abs C Ln C 1/C i 0.0 c c c Con los valores de K obtenidos de las graficas anteriores, construir la siguiente tabla: T 0C T (K) 1/T K Ln K i 0.0 0.00 0.0 0.0 Trazar una grafica ln K vs 1/T Ln K 0 1/T De la pendiente (Ea/R) se calcula la energía de activación De la ordenada al origen (ln A) se calcula el factor preexponencial