Dependencia con la temperatura
Anuncio

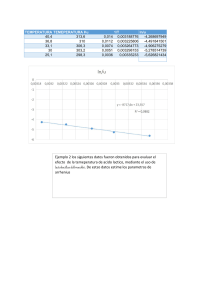
Dependencia de (k vs. T): k ≡ f (T ) Expresiones empíricas para el estudio de la dependencia de k con la temperatura: Ecuación de Arrhenius: k = Ae − Ea / RT Svante Arrhenius (1859-1927) Premio Nobel, 1903 A: factor exponencial (depende de la temperatura) R: constante de los gases (R=8.314472 J mol-1 K-1) Ea: energía de activación 1 k = Ae − Ea / RT Aplicando logaritmos: Ea constante Ea ln(k ) = ln( A) − RT Ea varía con T Derivando respecto a 1/T: d ln(k ) Ea =− d (1 / T ) R Gráfico de Arrhenius Gráficos de Arrhenius no lineales: k = A´T m e − E0 / RT A´, m, E0 : parámetros independiente de T E0 2 Gráficos de Arrhenius no lineales: k ln ( k ) = ln ( A´) + m ln (T ) − = A´T m e − E 0 / RT E0 RT ln ( k ) m E0 E + mRT = + = 0 2 dT T RT RT 2 d ln ( k ) d (1/ T ) =− Ea R ≡ d ln ( k ) Ea =− d (T ) RT 2 Ea = E0 + mRT “Energía de Activación” Barrera de Reacción: E1 − E−1 = ΔU 3 Constante de Equilibrio: k1 ⎯⎯ →Y + Z A + B ←⎯ ⎯ k−1 υ1 = υ−1 k1 [ A][ B ] = k−1 [Y ][ Z ] ⎛ [Y ][ Z ] ⎞ Kc = ⎜ ⎜ [ A][ B ] ⎟⎟ ⎝ ⎠eq ∴ d ln ( k1 ) E = − 12 d (T ) RT ΔU ⎛ ∂ ln K c ⎞ ⎜ ⎟ =− RT 2 ⎝ ∂T ⎠ P Kc = k1 k −1 d ln ( k−1 ) E = − −12 d (T ) RT E1 − E−1 = ΔU Energía de las Moléculas, Distribución Estadística: Maxwell-Boltzman (Clásica) f (E) = ≅e -E´/kB T 1 Ae E / k BT kB (Constante de Boltzman) =1.38 x 10-23 J.grado-1 Bose-Einstein (Cuántica) 1 f ( E ) = E / k BT Ae −1 Fermi-Dirac (Cuántica) 1 f ( E ) = E / k BT Ae +1 4 “Energía de Activación” Barrera de Reacción Mecánica Estadística: Velocidad de Reacción TST: υ = ν ⎡⎣ AB ≠ ⎤⎦ [AB≠] : número de especies con suficiente energía para superar la barrera (concentración de complejo activado) ν: frecuencia con que AB≠ se descompone en productos Energía de una vibración: Ecuacion de Planck: E=hν Términos Clásicos: E=kBT Para calcular [AB≠] se emplea la hipótesis del equilibrio: A + B ↔ AB≠ → C hν = k BT Ke = k T ν= B h [AB ] ≠ [A][B] [AB≠]=Ke[A][B] υ= k BT ⋅ K e [ A][B ] h 5 Según la mecánica estadística, para la reacción general: aA + bB + " → " + yY + zZ " qYy ⋅ qZz − RT0 Ke = a b e q A ⋅ qB " E donde: q: funciones de partición totales, por unidad de volúmen. (q = qe qv qr qt) E0: cambio de energía (a 0 K) correspondiente a la reacción de a moles de A con b moles de B. ∴ Para el cuasi-equilibrio: A + B ↔ AB≠ E − 0 q≠ Ke = e RT q A ⋅ qB " E Substituyendo Ke = − 0 q≠ e RT q A ⋅ qB " υ= en k BT ⋅ K e [ A][B ] h E − 0 k BT q≠ ⋅ υ= e RT [A][B ] h q A ⋅ qB " E − 0 k BT q≠ ⋅ k= e RT h q A ⋅ qB " TST 6 Formulación Termodinámica: Constante de equilibrio en términos termodinámicos: ≠ K e = e −Δ G 0 / RT Δ≠G0: variación de energía libre estándar de Gibbs cuando el complejo activado se forma a partir de los reaccionantes Δ≠ G 0 = Δ≠ H 0 − TΔ≠ S 0 ≠ Ke = e− Δ S 0 Δ≠S0: variación de entropía estándar Δ≠H0: entalpía de activación estándar / R − Δ≠ H 0 / RT e k= υ= k BT ⋅ K e [ A][B ] h kT −Δ≠ S 0 / R −Δ≠ H 0 / RT e e h Ejercicio: Calcular k (298 K) para la reacción A + B → AB, sabiendo que para una molécula lineal el momento de inercia viene dado por (qe=1): 2 I = d AB m A mB m A + mB m(A)=1 au m(B)=16 au d(A-B)*=2Å E0=1.2 kJ/mol kB=1.38x10-23J.K-1 h=6.63x10-34 J.s 7