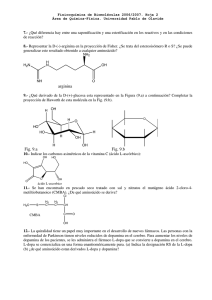
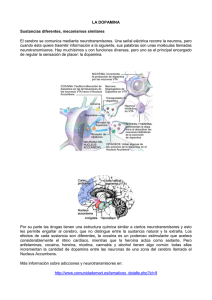
efectos de la isatina sobre la neurotransmisión dopaminérgica en el
Anuncio

EFECTOS DE LA ISATINA SOBRE LA NEUROTRANSMISIÓN DOPAMINÉRGICA EN EL NÚCLEO ESTRIADO. UN ESTUDIO IN VIVO MEDIANTE MICRODIÁLISIS CEREBRAL. Tesis Doctoral Lorenzo Antonio Justo Cousiño Vigo 2014 Departamento de Biología Funcional y Ciencias de la Salud Facultad de Biología EFECTOS DE LA ISATINA SOBRE LA NEUROTRANSMISIÓN DOPAMINÉRGICA EN EL NÚCLEO ESTRIADO. UN ESTUDIO IN VIVO MEDIANTE MICRODIÁLISIS CEREBRAL. Tesis Doctoral presentada por: Lorenzo Antonio Justo Cousiño Vigo, Octubre de 2014 i ii La Dra. Lilian Rosana Ferreira Faro y el Dr. Rafael Durán Barbosa, Profesora Contratada Doctora y Profesor Titular, respectivamente, del Departamento de Biología Funcional y Ciencias de la Salud de la Universidad de Vigo. Certifican que: El presente trabajo titulado “EFECTOS DE LA ISATINA SOBRE LA NEUROTRANSMISIÓN DOPAMINÉRGICA EN EL NÚCLEO ESTRIADO. UN ESTUDIO IN VIVO MEDIANTE MICRODIÁLISIS CEREBRAL”, presentado por D. Lorenzo Antonio Justo Cousiño para alcanzar el grado de Doctor por la Universidad de Vigo, ha sido realizado bajo nuestra dirección. Considerando que se encuentra concluido, autorizamos su presentación para que pueda ser juzgado por el Tribunal correspondiente. Y para que así conste, firmamos el presente en Vigo a 29 de octubre de 2014. Fdo. Dra. LILIAN ROSANA FERREIRA FARO iii Dr. RAFAEL DURÁN BARBOSA iv Si el cerebro humano fuera tan simple que pudiéramos entenderlo, entonces seríamos tan simples que no podríamos entenderlo. Emerson M. Pugh Daría todo lo que sé, por la mitad de lo que ignoro. René Descartes A mi familia, porque sin ella nada de esto sería posible. A Santiago Cousiño, porque siempre será eterno. En general, a todos mis seres queridos porque este trabajo lleva un poco de cada uno de ellos. v vi El presente trabajo de investigación fue realizado bajo un Contrato Predoctoral de la Consellería de Educación de la Xunta de Galicia, que se engloba dentro de las “Axudas de apoio á etapa predoutoral do Plan Galego de Investigación, Innovación e Crecemento 2011-2015 (Plan I2C) para o ano 2011”, publicado en el Diario Oficial de Galicia el 15 de julio de 2011. vii viii AGRADECIMIENTOS Efectos de la isatina sobre la neurotransmisión dopaminérgica en el núcleo estriado. Un estudio in vivo mediante microdiálisis cerebral. x Aunque ya pasaron algunos años, aún recuerdo cuando fascinado visualizaba los primeros cromatogramas desde el primer minuto hasta el último. Finalizaba el año 2009 y yo me adentraba de lleno en el mundo de la neuroquímica, de la cirugía extereotáxica, de la microdiálisis, de la cromatografía, de los domingos y festivos en el laboratorio, de las revisiones bibliográficas, de los congresos y seminarios, de las vacaciones que se convierten en valiosos períodos de trabajo, de la docencia universitaria,… En definitiva, lo que yo denomino un aprendizaje basado en problemas llevado a su máxima expresión. Sin embargo, si tuviera que volver a decidir, escogería este mismo camino por diversos motivos: por las increíbles experiencias que he vivido a lo largo de estos años (tanto dentro como fuera de la universidad), por todo lo que he aprendido (y lo muchísimo que aún me falta por aprender), pero sobre todo por todas esas personas que se han cruzado conmigo a lo largo de este período y han enriquecido mi vida. Debido a limitaciones espaciales resulta imposible recordar a cada una de ellas en este apartado de agradecimiento, aunque a todas las guardo en mi pensamiento. En primer lugar, quiero agradecer profundamente a mis directores de tesis, los doctores Rafael Durán, Miguel Alfonso y Lilian Faro. Gracias por haberme guiado tan acertadamente en mis comienzos científicos, por transmitirme con pasión la metodología en la que sois tan duchos, pero también por permitirme exponer ideas, debatir (y volver a debatir), probar y aprender por mí mismo. Algunas veces he acertado y en otras no tanto, pero en todas he aprendido. También tengo que decir que no solo habéis sido un ejemplo en el plano profesional, sino que además lo habéis sido en el plano personal, para mí constituís un ejemplo de personas que esta sociedad tanto necesita. Es necesario agradecer a todo el equipo de neuroquímica de la Universidad de Vigo: a las Dras. Iris Machado y Brenda Nunes que me ayudaron tanto en los inicios, a la Dra. Rosa Carmina por todos sus consejos y su ayuda en la cromatografía de fluorescencia, a Hanna Tak por su fantástica compañía en el laboratorio y a todos los que han estado de forma más puntual por nuestro laboratorio. xi De este fantástico equipo de investigación requiere una mención especial Daniel Fajardo, ya que iniciamos juntos la dura profesión de investigación. Ha sido un inmejorable compañero en el campo de batalla y como un hermano en los duros momentos. También quiero agradecer a todo el equipo docente de la Facultad de Fisioterapia por enriquecer tanto mi experiencia docente siendo un equipo tan implicado. Aunque el ambiente de trabajo es excepcional con todos, quiero citar especialmente al Dr. Manuel Gutiérrez, ya que sin sus consejos esta tesis no tendría existencia. A mi familia, gracias básicamente por TODO. Aunque generalmente se diga que la familia te toca, no se elige, yo considero que en realidad la familia se forma por el apoyo incondicional, el cariño y la unión. Si pudiera, yo os volvería a escoger a todos: a mi padre, a mi madre, a mi hermana, a mi sobrina y a todos mis primos y tíos. A todos mis amigos, este trabajo va por vosotros, ya que siempre confiasteis en mí. También a esa persona que durante este tramo final ha estado conmigo y es capaz de hacerme sonreír siempre. A la gran familia que forma Os Coribantes, gracias por estar siempre ahí y por proporcionarme, a través de la música y vuestra amistad, una vía de escape para todos los problemas. Quiero agradecer todo el apoyo institucional y financiero recibido por parte de la Universidad de Vigo, donde destacan la Facultad de Biología y la Facultad de Fisioterapia, la Xunta de Galicia y el Ministerio de Educación Cultura y Deporte del Gobierno de España. xii ÍNDICE Efectos de la isatina sobre la neurotransmisión dopaminérgica en el núcleo estriado. Un estudio in vivo mediante microdiálisis cerebral. xiv 1. INTRODUCCIÓN………………………………….………………..1 1.1. NEUROTRANSMISIÓN DOPAMINÉRGICA ................................. 3 1.1.1. Síntesis de la dopamina ................................................................... 5 1.1.2. Almacenamiento de la dopamina .................................................... 6 1.1.3. Liberación de la dopamina .............................................................. 8 1.1.4. Inactivación de la dopamina ............................................................ 9 1.1.4.1. Inactivación de la dopamina por medio de la MAO.............. 11 1.1.5. Receptores dopaminérgicos........................................................... 18 1.1.6. Sistemas dopaminérgicos .............................................................. 21 1.1.6.1. 1.2. Los ganglios basales .............................................................. 22 ENFERMEDAD DE PARKINSON ................................................... 29 1.2.1. Epidemiología de la enfermedad de Parkinson ............................. 30 1.2.2. Etiopatogenia y diagnóstico de la EP ............................................ 31 1.2.3. Farmacoterapia antiparkinsoniana ................................................. 36 1.3. 1.2.3.1. Levodopa (L-DOPA)............................................................. 36 1.2.3.2. Agonistas dopaminérgicos .................................................... 38 1.2.3.3. Inhibidores de la catecol-O-metiltransferasa (ICOMT) ........ 40 1.2.3.4. Inhibidores de la monoamino oxidasa B (IMAO-B) ............. 41 1.2.3.5. Anticolinérgicos .................................................................... 44 1.2.3.6. Amantadina ........................................................................... 44 1.2.3.7. Otros agentes farmacológicos ............................................... 46 ISATINA .............................................................................................. 51 1.3.1. Antecedentes históricos ................................................................. 51 1.3.2. Propiedades físico-químicas de la isatina ...................................... 52 1.3.3. Localización de la isatina .............................................................. 53 xv 1.3.4. Metabolismo de la isatina .............................................................. 55 1.3.5. Actividad de la isatina sobre la neurotransmisión dopaminérgica 60 1.3.6. Relación entre la isatina y la enfermedad de Parkinson ................ 64 1.3.7. Otros efectos biológicos de la isatina ............................................ 65 2. JUSTIFICACIÓN Y OBJETIVOS……………………………….71 2.1. ANTECEDENTES Y JUSTIFICACIÓN .......................................... 73 2.2. OBJETIVOS ........................................................................................ 79 2.2.1. Objetivo general ............................................................................ 79 2.2.2. Objetivos específicos..................................................................... 79 3. MATERIAL Y MÉTODOS………………………….…...………..81 3.1. ANIMALES DE EXPERIMENTACIÓN ......................................... 83 3.2. REACTIVOS Y PATRONES ............................................................ 83 3.3. MICRODIÁLISIS CEREBRAL ........................................................ 86 3.3.1. Fundamentos de la técnica ............................................................ 86 3.3.1.1. Breve reseña histórica y estado actual de la técnica .............. 86 3.3.1.2. Descripción de la técnica....................................................... 88 3.3.1.3. Características de la microdiálisis cerebral ........................... 89 3.3.2. Implantación de la sonda en el núcleo estriado ............................. 91 3.3.3. Administración de sustancias y recogida de muestras .................. 94 3.3.4. Rendimiento de las sondas de microdiálisis cerebral .................... 97 3.3.4.1. Cálculo de la recuperación y administración in vitro ............ 99 xvi 3.4. ANÁLISIS DE LOS DIALIZADOS: CROMATOGRAFÍA DE LÍQUIDOS DE ALTA RESOLUCIÓN (HPLC)........................................ 102 3.4.1. Fundamentos de la técnica .......................................................... 102 3.4.1.1. Breve reseña histórica ......................................................... 102 3.4.1.2. Descripción de la técnica..................................................... 103 3.4.2. Equipo cromatográfico ................................................................ 108 3.4.2.1. Equipo cromatográfico para detección de dopamina y sus metabolitos …………………………………………………………….108 3.4.2.2. 3.4.3. Equipo cromatográfico para la detección de aminoácidos .. 109 Condiciones cromatográficas para la determinación de dopamina y sus metabolitos............................................................................................ 111 3.4.4. Condiciones cromatográficas para la determinación de aminoácidos neurotransmisores ....................................................................................... 112 3.5. DISEÑO EXPERIMENTAL ............................................................ 114 3.5.1. Efecto de las diferentes concentraciones de isatina..................... 115 3.5.2. Caracterización de la liberación de dopamina estriatal estimulada por isatina.................................................................................................... 116 3.5.3. Mediación de las isoformas de la MAO en el efecto de la isatina sobre la liberación de dopamina ................................................................. 118 3.5.4. Efectos de la isatina junto con compuestos con acción antiparkinsoniana sobre la neurotransmisión dopaminérgica ..................... 119 3.5.5. Mediación de los receptores glutamatérgicos en el efecto de la isatina sobre la liberación de dopamina ...................................................... 122 3.5.6. Mediación del óxido nítrico en el efecto de la isatina sobre la liberación de dopamina ............................................................................... 123 3.5.7. Efecto de la isatina sobre aminoácidos neurotransmisores en el núcleo estriado ............................................................................................ 123 xvii 3.6. EXPRESIÓN DE LOS RESULTADOS Y TRATAMIENTO ESTADÍSTICO ............................................................................................. 124 4. RESULTADOS…………………….………...……………………127 4.1. RESULTADOS CROMATOGRÁFICOS ...................................... 129 4.2. EFECTO DE LA PERFUSIÓN INTRAESTRIATAL DE ISATINA SOBRE LA LIBERACIÓN DE DOPAMINA ............................................ 131 4.3. CARACTERIZACIÓN DE LA LIBERACIÓN DE DOPAMINA ESTRIATAL ESTIMULADA POR ISATINA........................................... 134 4.3.1. Administración de isatina disuelta en un medio Ringer sin Ca++..135 4.3.2. Efecto de la isatina en animales tratados con TTX ..................... 137 4.3.3. Efecto de la isatina en animales tratados con reserpina .............. 139 4.3.4. Efecto de la isatina en animales tratados con nomifensina ........ .141 4.3.5. Administración de isatina en un medio Ringer con alta concentración de K+ .................................................................................... 143 4.4. MEDIACIÓN DE LAS ISOFORMAS DE LA MAO EN EL EFECTO DE LA ISATINA SOBRE LA LIBERACIÓN DE DOPAMINA .................................................................................................. 145 4.4.1. Efecto de la isatina en animales tratados con clorgilina .............. 145 4.4.2. Efecto de la isatina en animales tratados con selegilina .............. 147 4.5. EFECTOS DE LA COADMINISTRACIÓN DE ISATINA Y COMPUESTOS DE ACCIÓN ANTIPARKINSONIANA ........................ 151 4.5.1. Efecto de la isatina en animales tratados con tropolona y dinitrocatecol .............................................................................................. 152 4.5.2. Efecto de la isatina en animales tratados con atropina ................ 156 4.5.3. Efecto de la isatina en animales tratados con ropinirol ............... 158 xviii 4.5.4. Efecto de la isatina en animales tratados con amantadina ........... 160 4.5.5. Efecto de la isatina en animales tratados con L-DOPA .............. 162 4.6. MEDIACIÓN DE LOS RECEPTORES GLUTAMATÉRGICOS EN EL EFECTO DE LA ISATINA SOBRE LA LIBERACIÓN DE DOPAMINA .................................................................................................. 166 4.6.1. Efecto de la isatina en animales tratados con AP-5 ..................... 167 4.6.2. Efecto de la isatina en animales tratados con MK-801 ............... 169 4.7. MEDIACIÓN DEL ÓXIDO NÍTRICO EN EL EFECTO DE LA ISATINA SOBRE LA LIBERACIÓN DE DOPAMINA .......................... 171 4.7.1. Efecto de la isatina en animales tratados con L- NAME…………………………………………………………………….172 4.7.2. Efecto de la isatina en animales tratados con 7- NI………………………………………………………………………… 174 4.8. EFECTO DE LA ISATINA SOBRE AMINOÁCIDOS NEUROTRANSMISORES EN EL NÚCLEO ESTRIADO ...................... 176 5. DISUSIÓN…..…...............................…………………….………..183 5.1. EFECTO DE LA PERFUSIÓN INTRAESTRIATAL DE ISATINA SOBRE LA LIBERACIÓN DE DOPAMINA ............................................ 188 5.2. CARACTERIZACIÓN IN VIVO DE LA LIBERACIÓN DE DOPAMINA ESTRIATAL ESTIMULADA POR ISATINA ................... 195 5.2.1. Administración de isatina en un medio Ringer sin Ca++ ............. 199 5.2.2. Efecto de la isatina en animales tratados con TTX ..................... 201 5.2.3. Efecto de la isatina en animales tratados con reserpina .............. 202 5.2.4. Efecto de la isatina en animales tratados con nomifensina ......... 205 5.2.5. Administración de isatina en un medio Ringer con alta concentración de K+ .................................................................................... 208 xix 5.2.6. Sumario de la caracterización de los posibles mecanismos neuroquímicos de la isatina......................................................................... 210 5.3. MEDIACIÓN DE LAS ISOFORMAS DE LA MAO EN EL EFECTO DE LA ISATINA SOBRE LA LIBERACIÓN DE DOPAMINA .................................................................................................. 211 5.4. EFECTOS DE LA COADMINISTRACIÓN DE ISATINA Y COMPUESTOS DE ACCIÓN ANTIPARKINSONIANA SOBRE LA LIBERACIÓN DE DOPAMINA ................................................................. 218 5.4.1. Efecto de la isatina en animales tratados con tropolona y dinitrocatecol .............................................................................................. 218 5.4.2. Efecto de la isatina en animales tratados con atropina ................ 223 5.4.3. Efecto de la isatina en animales tratados con ropinirol ............... 225 5.4.4. Efecto de la isatina en animales tratados con amantadina ........... 226 5.4.5. Efecto de la isatina en animales tratados con L-DOPA .............. 227 5.4.6. Sumario de la coadministración de isatina y compuestos de acción antiparkinsoniana ........................................................................................ 231 5.5. MEDIACIÓN DE LOS RECEPTORES GLUTAMATÉRGICOS EN EL EFECTO DE LA ISATINA SOBRE LA LIBERACIÓN DE DOPAMINA .................................................................................................. 232 5.6. MEDIACIÓN DEL ÓXIDO NÍTRICO EN EL EFECTO DE LA ISATINA SOBRE LA LIBERACIÓN DE DOPAMINA .......................... 235 5.7. EFECTO DE LA ISATINA SOBRE AMINOÁCIDOS NEUROTRANSMISORES EN EL NÚCLEO ESTRIADO ...................... 237 xx 6. CONCLUSIONES…..…………………………………..………..241 7. REFERENCIAS BIBLIOGRÁFICAS….……………..………..245 xxi xxii ABREVIATURAS Efectos de la isatina sobre la neurotransmisión dopaminérgica en el núcleo estriado. Un estudio in vivo mediante microdiálisis cerebral. xxiv 3-MT 3-metoxitiramina 6-OHDA 6-hidroxidopamina 7-NI 7-Nitroindazol ACh Acetilcolina AD Aldehído deshidrogenasa AMPc Adenosín monofosfato cíclico ANOVA Análisis de varianza AP-5 Ácido DL-2-Amino-5-fosfatopentanoico ASP Aspartato ATP Adenosín trifosfato Ca++ Calcio CaCl2 Cloruro de calcio COMT Catecol-o-metiltransferasa DA Dopamina DAT Transportador de dopamina DDC DOPA descarboxilasa DMSO Dimetil sulfóxido DNC Dinitrocatecol DOPAC Ácido dihidroxifenilacético EDTA Ácido etilendiaminotetraacético EEM Error estándar de la media EP Enfermedad de Parkinson GABA Ácido gamma-aminobutírico GLI Glicina GLU Glutamato xxv GMPc Guanosín monofosfato cíclico GP Globo pálido H3PO4 Ácido fosfórico HIAA Ácido 5-hidroxiindolacético HPLC-EC Cromatografía de líquidos de alta resolución con detección electroquímica HVA Ácido homovanílico i.e. Intraestriatal i.m. Intramuscular i.p. Intraperitoneal ICOMT Inhibidor de la catecol-o-metiltransferasa IMAO Inhibidor de la monoamino oxidasa K+ Potasio KCl Cloruro de potasio KH2PO4 Fosfato potásico L-DOPA L-3,4-dihidroxifenilalanina L-NAME L-NG-nitroarginina metil-éster MAO Monoamino oxidasa MK-801 Dizolcipina MPTP 1-metil-4-fenil-1,2,3,6-tetrahidropiridina Na+ Sodio NAC N-acetil-Cisteína NaCl Cloruro de sodio NaOH Hidróxido de sodio xxvi NMDA N-metil D-aspartato NO Óxido nítrico NOM Nomifensina NOS Sintasa del óxido nítrico OPA O-ftalaldehído RES Reserpina SN Sustancia negra SNC Sistema Nervioso Central SNP Sistema Nervioso Periférico SOS Octano sulfonato sódico TAU Taurina TH Tirosina hidroxilasa TTX Tetrodotoxina VEJ Virus de la encefalitis japonesa VMAT-2 Transportador vesicular de monoaminas-2 xxvii xxviii LISTA DE FIGURAS Efectos de la isatina sobre la neurotransmisión dopaminérgica en el núcleo estriado. Un estudio in vivo mediante microdiálisis cerebral. xxx Figura 1.1: Estructura química de la dopamina ................................................. 3 Figura 1.2: Síntesis y metabolismo de la dopamina......................................... 11 Figura 1.3: Reacción de la desaminación oxidativa realizada por la monoamino oxidasa (MAO) en el metabolismo de las monoaminas ................ 12 Figura 1.4: Diagramas de cinta de las unidades monoméricas de las dos isoformas de la monoamino oxidasa (MAO) de humanos ................................ 14 Figura 1.5: Tomografía de emisión de positrones (PET) donde se observan las regiones de mayor acumulación de inhibidores selectivos e irreversibles de la MAO marcados con radiotrazadores ................................................................. 16 Figura 1.6: Representación esquemática de la sinapsis dopaminérgica ........... 20 Figura 1.7: Distribución de los grupos neuronales dopaminérgicos en el cerebro de roedores ........................................................................................... 22 Figura 1.8: Conexiones anatómicas de los ganglios basales ............................ 23 Figura 1.9: Circuito de los ganglios basales en condiciones normales ............ 26 Figura 1.10: Circuito de los ganglios basales en la EP .................................... 28 Figura 1.11: Principales alteraciones neuropatológicas en la EP ..................... 32 Figura 1.12: Representación esquemática del modo de acción de los principales compuestos antiparkinsonianos ...................................................... 46 Figura 1.13: Algoritmo de tratamiento para la EP ........................................... 49 Figura 1.14: Autorradiograma donde se muestran los sitios de unión de la [3H]isatina ......................................................................................................... 54 Figura 1.15: Representación esquemática de la formación y degradación de la isatina ................................................................................................................ 56 Figura 3.1: Secuenciación temporal y eventos en un experimento de microdiálisis inversa.......................................................................................... 87 Figura 3.2: La sonda de microdiálisis mimetiza la función de un vaso sanguíneo........................................................................................................... 89 xxxi Figura 3.3: Procedimiento para la implantación de la cánula-guía y colocación de la sonda. Presentación histológica de la localización de la sonda de microdiálisis en el núcleo estriado .................................................................... 93 Figura 3.4: Representación de la sonda de microdiálisis ................................. 94 Figura 3.5: Equipo suministrado por CMA Microdialysis que se empleó en la experimentación ................................................................................................ 95 Figura 3.6: Cronograma representativo de un experimento de 3 horas de duración ............................................................................................................. 96 Figura 3.7: Cronograma representativo de un experimento de 4 horas de duración ............................................................................................................. 96 Figura 3.8: Gráficas proporcionadas por CMA Microdialysis que muestran la recuperación relativa de las sondas CMA/12 en función de la longitud de la membrana y en función del flujo aplicado ....................................................... 98 Figura 3.9: Cálculo de la recuperación in vitro y cálculo del paso de sustancias administradas a través de la membrana ........................................................... 100 Figura 3.10: Voltamograma hidrodinámico de patrones de DOPAC, dopamina y HVA ............................................................................................................. 109 Figura 3.11: Equipo cromatográfico utilizado en la experimentación ........... 110 Figura 3.12: Esquema general de microdiálisis cerebral y HPLC utilizado en esta investigación ............................................................................................ 113 Figura 3.13: Cronograma que muestra el protocolo de administración de isatina en ratas a las que se les administró sistémicamente benserazida y LDOPA .............................................................................................................. 122 Figura 4.1: Cromatograma representativo de patrones de las sustancias analizadas por medio de HPLC-EC y superposición de cromatogramas de dializados de muestras experimentales ........................................................... 130 Figura 4.2: Efecto de la perfusión de isatina (1, 5, 10 mM) y DMSO (5%) sobre los niveles estriatales de dopamina, DOPAC y HVA............................ 133 xxxii Figura 4.3: Efecto de la perfusión intraestriatal de isatina (10 mM) diluida en un medio Ringer sin Ca++ sobre los niveles estriatales de dopamina, DOPAC y HVA ............................................................................................................... 136 Figura 4.4: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de dopamina, DOPAC y HVA en animales tratados con TTX (10 µM) ........................................................................................................... 138 Figura 4.5: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de dopamina, DOPAC y HVA en ratas reserpinizadas ..... 140 Figura 4.6: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de dopamina, DOPAC y HVA en animales tratados con nomifensina (50 µM)....................................................................................... 142 Figura 4.7: Efecto de la perfusión intraestriatal de isatina (10 mM) disuelta en un medio Ringer con alta concentración de KCl (50 mM) sobre los niveles estriatales de dopamina, DOPAC y HVA ...................................................... 144 Figura 4.8: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de dopamina, DOPAC y HVA en animales tratados con clorgilina (1 mM) ............................................................................................ 146 Figura 4.9: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de dopamina, DOPAC y HVA en animales tratados con selegilina (1 mM) ............................................................................................ 148 Figura 4.10: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de dopamina, DOPAC y HVA en animales pretratados con selegilina (1 mM) ............................................................................................ 150 Figura 4.11: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de dopamina, DOPAC y HVA en animales tratados con tropolona (1 mM) ............................................................................................ 154 Figura 4.12: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de dopamina, DOPAC y HVA en animales tratados con dinitrocatecol (100 µM) .................................................................................. 155 xxxiii Figura 4.13: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de dopamina, DOPAC y HVA en animales tratados con atropina (1 mM) .............................................................................................. 157 Figura 4.14: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de dopamina, DOPAC y HVA en animales tratados con ropinirol (5 mM) ............................................................................................. 159 Figura 4.15: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de dopamina, DOPAC y HVA en animales tratados con amantadina (5 mM) ......................................................................................... 161 Figura 4.16: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de dopamina, DOPAC y HVA en animales tratados con LDOPA (25 µM) ............................................................................................... 163 Figura 4.17: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de dopamina, DOPAC y HVA en animales tratados con LDOPA i.p (500 mg/kg) y benserazida i.p. (80 mg/kg) .................................... 165 Figura 4.18: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de dopamina, DOPAC y HVA en animales tratados con AP5 (650 µm) ....................................................................................................... 168 Figura 4.19: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de dopamina, DOPAC y HVA en animales tratados con MK801 (500 µm) ................................................................................................... 170 Figura 4.20: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de dopamina, DOPAC y HVA en animales tratados con LNAME (100 µm) ............................................................................................. 173 Figura 4.21: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de dopamina, DOPAC y HVA en animales tratados con 7-NI (100 µm) .......................................................................................................... 175 Figura 4.22: Cromatograma representativo de patrones de los aminoácidos analizados y superposición de cromatogramas de dializados de muestras experimentales................................................................................................. 177 xxxiv Figura 4.23: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de aspartato ........................................................................ 178 Figura 4.24: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de glutamato ....................................................................... 179 Figura 4.25: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de glicina ............................................................................ 180 Figura 4.26: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de taurina ............................................................................ 181 xxxv xxxvi LISTA DE TABLAS Efectos de la isatina sobre la neurotransmisión dopaminérgica en el núcleo estriado. Un estudio in vivo mediante microdiálisis cerebral. xxxviii Tabla 1.1: Principales sustratos de la monoamino oxidasa (MAO) ................ 13 Tabla 1.2: Principales características físico-químicas de la isatina.................. 53 Tabla 3.1: Listado de los reactivos donde se muestran los compuestos utilizados, su acción y su procedencia............................................................... 85 Tabla 3.2: Ventajas y limitaciones de la microdiálisis cerebral ...................... 90 Tabla 3.3: Factores que limitan la recuperación in vivo en experimentos de microdiálisis ..................................................................................................... 97 Tabla 3.4: Porcentaje de recuperación de las sondas utilizadas en esta investigación .................................................................................................. 101 Tabla 3.5: Resumen de todos los compuestos aplicados, especificando la concentración utilizada y agrupados según la duración de la experimentación ......................................................................................................................... 114 Tabla 3.6: Protocolo de administración de diferentes concentraciones de isatina en el núcleo estriado ....................................................................................... 115 Tabla 3.7: Protocolo de administración intraestriatal de isatina disuelta en una solución Ringer sin Ca++ ................................................................................. 116 Tabla 3.8: Protocolo de administración intraestriatal de isatina en ratas pretratadas con TTX ....................................................................................... 117 Tabla 3.9: Protocolo de administración intraestriatal de isatina en ratas pretratadas sistémicamente con reserpina ...................................................... 117 Tabla 3.10: Protocolo de administración intraestriatal de isatina en ratas tratadas con nomifensina ................................................................................ 117 Tabla 3.11: Protocolo de administración intraestriatal de isatina disuelta en un medio Ringer alto K+....................................................................................... 118 Tabla 3.12: Protocolo de administración intraestriatal de isatina en ratas tratadas con inhibidores de la MAO (clorgilina y selegilina).......................... 118 Tabla 3.13: Protocolo de administración intraestriatal de isatina en ratas pretratadas con selegilina ............................................................................... 119 xxxix Tabla 3.14: Protocolo de administración intraestriatal de isatina en ratas tratadas con inhibidores de la COMT (tropolona y dinitrocatecol) ................. 120 Tabla 3.15: Protocolo de administración intraestriatal de isatina en ratas pretratadas con atropina .................................................................................. 120 Tabla 3.16: Protocolo de administración intraestriatal de isatina en ratas tratadas con ropinirol ...................................................................................... 120 Tabla 3.17: Protocolo de administración intraestriatal de isatina en ratas tratadas con amantadina ................................................................................. 121 Tabla 3.18: Protocolo de administración intraestriatal de isatina en ratas tratadas con L-DOPA ..................................................................................... 121 Tabla 3.19: Protocolo de administración intraestriatal de isatina en ratas pretratadas con antagonistas glutamatérgicos NMDA (AP-5 y MK- 801) ..... 122 Tabla 3.20: Protocolo de administración intraestriatal de isatina en ratas pretratadas con inhibidores de la NOS (L-NAME y 7-NI) ............................. 123 Tabla 3.21: Protocolo de administración intraestriatal de isatina para su posterior análisis con HPLC fluorimétrica para determinación de aminoácidos neurotransmisores .......................................................................................... 124 Tabla 4.1: Valores basales (expresado en ng/20 min) para la dopamina, el DOPAC y el HVA .......................................................................................... 131 Tabla 4.2: Valores basales (expresados en ng/20 min) para el aspartato (ASP), el glutamato (GLU), la taurina (TAU) y la glicina (GLI) ............................... 176 xl RESUMEN Efectos de la isatina sobre la neurotransmisión dopaminérgica en el núcleo estriado. Un estudio in vivo mediante microdiálisis cerebral. xlii La isatina (indol-2,3-diona) es un inhibidor endógeno de la monoamino oxidasa (MAO) que presenta una amplia variedad de efectos biológicos. Diversos investigadores han demostrado que la administración de isatina incrementa los niveles cerebrales de dopamina y se ha evidenciado que los niveles de isatina en orina aumentan en relación al grado de severidad de la enfermedad de Parkinson. Este trabajo de investigación se justifica en base a que existe escasa experimentación in vivo sobre el efecto de la isatina en la neurotransmisión dopaminérgica y a que en investigaciones previas se describieron resultados contradictorios. Además, se desconocen los mecanismos neuroquímicos por los que actúa la isatina sobre el sistema dopaminérgico y no se ha descrito la posible interacción neuroquímica de la isatina con fármacos utilizados en la enfermedad de Parkinson. Por último, el elevado potencial terapéutico de la isatina como un posible candidato dentro de la farmacoterapia antiparkinsoniana suscita mayor interés para su estudio. El objetivo general de esta tesis doctoral consistió en determinar los efectos de la isatina sobre la neurotransmisión dopaminérgica en el núcleo estriado de ratas conscientes y en libre movimiento. Para ello, se utilizaron las técnicas de microdiálisis cerebral y cromatografía de líquidos de alta resolución (HPLC). Inicialmente, se realizó una evaluación dosis-repuesta de la administración estriatal de isatina. En segundo lugar, se evaluó el mecanismo por el cual la isatina incrementa los niveles estriatales de dopamina. Además, se estudió la mediación de las isoformas de la MAO, de los receptores glutamatérgicos y del óxido nítrico en el efecto de la isatina sobre la neurotransmisión dopaminérgica estriatal. También se determinaron los efectos de la coadministración de isatina y compuestos con acción antiparkinsoniana. Por último, se estudió el efecto de la isatina sobre aminoácidos neurotransmisores en el núcleo estriado. Las principales conclusiones de este trabajo de investigación son: La administración intraestriatal de isatina incrementa de forma concentración-dependiente la liberación de dopamina en el núcleo estriado y esta liberación es de tipo exocitótico. Además, en la liberación de dopamina estimulada por isatina podrían estar involucrados los receptores de NMDA de glutamato y el óxido nítrico. En la concentración utilizada en este estudio la isatina también podría producir una inhibición no selectiva de la MAO. Asimismo, los compuestos con acción antiparkinsoniana que presentan mejor interacción neuroquímica con la isatina serían: los inhibidores de la COMT, la amantadina y la L-DOPA. xliii xliv 1 INTRODUCCIÓN Efectos de la isatina sobre la neurotransmisión dopaminérgica en el núcleo estriado. Un estudio in vivo mediante microdiálisis cerebral. INTRODUCCIÓN 1.1. NEUROTRANSMISIÓN DOPAMINÉRGICA La dopamina (DA) o 3,4-dihidroxifeniletilamina es una amina biógena que pertenece al grupo de las catecolaminas. Está formada por un grupo catecol (anillo bencénico 3,4 dihidroxilado) unido a un grupo amino en cadena lateral y es producida a partir del aminoácido tirosina (Figura 1.1). La dopamina es el neurotransmisor catecolaminérgico más importante del Sistema Nervioso Central (SNC) que interviene en la regulación de una gran variedad de funciones como la conducta, la emotividad, la afectividad y la comunicación neuroendocrina. En el Sistema Nervioso Periférico (SNP) modula la función cardíaca y renal, el tono vascular y la motilidad gastrointestinal (Bahena-Trujillo et al. 2000). Figura 1.1: Estructura química de la dopamina. La función de los sistemas dopaminérgicos ha sido una temática de estudio en el campo de las Neurociencias, puesto que alteraciones en la transmisión dopaminérgica se ha relacionado, directa o indirectamente, con trastornos severos del SNC, como la enfermedad de Parkinson (EP), la esquizofrenia y la dependencia de sustancias de abuso (Bahena-Trujillo et al. 2000; Harsing 2008; Meiser et al. 2013). 3 INTRODUCCIÓN La dopamina fue sintetizada inicialmente en 1910, antes de que se descubriera su importancia como neurotransmisor, pero su investigación fue abandonada al tener bajo efecto periférico sobre la presión sanguínea en comparación con la adrenalina (Bahena-Trujillo et al. 2000; Harsing 2008; Meiser et al. 2013). La investigación de la neurotransmisión dopaminérgica se remonta a la década de 1950, época en la cual destacan los trabajos de Carlsson y Greengard que les llevaron a ganar el premio Nobel de Medicina y Fisiología en el año 2000. En la década de 1960 se generaron las primeras evidencias de la relación entre las alteraciones dopaminérgicas y la EP o algunos trastornos psiquiátricos, como la esquizofrenia. En la década de 1970 se estudió la distribución de los receptores para este neurotransmisor y se planteó la existencia de dos familias de receptores dopaminérgicos, denominadas D1 y D2 que incluyen un total de 5 tipos. En la última década se utilizaron diferentes estrategias experimentales para el estudio in situ e in vivo de los sistemas dopaminérgicos, así como para la caracterización farmacológica y molecular de sus receptores (Bahena-Trujillo et al. 2000; Harsing 2008; Meiser et al. 2013). Las neuronas dopaminérgicas representan una pequeña proporción de la población neuronal total en el SNC (aproximadamente medio millón de neuronas en humanos, de las cuales un 70% se ubican en la sustancia negra). Sin embargo, por medio de su alta y divergente ramificación, ese pequeño número de neuronas puede influenciar amplios territorios cerebrales. Además, teniendo en cuenta la baja cantidad de neuronas y el amplio número de funciones en las que interviene, han llevado a postular a la dopamina como un neuromodulador (Björklund y Dunnet 2007; Iversen e Iversen 2007; Schultz 2007). 4 INTRODUCCIÓN Por otra parte, el mecanismo preciso mediante el cual la dopamina regula la actividad fisiológica en las neuronas estriatales no se entiende completamente. Los estudios electrofisiológicos sugieren que puede realizar tanto una acción excitatoria como inhibitoria (Calabresi et al. 2007). 1.1.1. Síntesis de la dopamina La dopamina es sintetizada en el citosol de las neuronas dopaminérgicas a partir de la L-tirosina, aminoácido semiesencial que puede ser obtenido a través de la dieta o sintetizado en el hígado a partir de la fenilalanina. La tirosina llega al encéfalo atravesando la barrera hemato-encefálica utilizando un sistema de transporte específico para aminoácidos neutros (Harsing 2008; Meiser et al. 2013). Se pueden considerar dos etapas enzimáticas en la biosíntesis de la dopamina. En primer lugar, la tirosina es hidroxilada para obtener L-3,4dihidroxifenilalanina (L-DOPA) por medio de la enzima citosólica tirosina hidroxilasa (TH; EC 1.14.16.2), que utiliza como cofactores el oxígeno molecular, la tetrahidrobiopterina (BH4) y el Fe+2. Posteriormente, la L-DOPA es descarboxilada por medio de la enzima DOPA descarboxilasa (DDC; EC 4.1.1.28) dando lugar a la dopamina y utilizando como cofactor el fosfato de piridoxal (Harsing 2008; Meiser et al. 2013). Ambas vías enzimáticas están altamente reguladas. Altos niveles de dopamina inhiben la TH y la DDC, regulando su propia concentración intracelular, lo que se denomina inhibición por productos finales (BahenaTrujillo et al. 2000; López y Arancibia 2008). 5 INTRODUCCIÓN Otra forma de control de la síntesis de dopamina es la regulación por medio de receptores. Aquí podemos encontrar la regulación por medio de autorreceptores y heterorreceptores. La activación de autorreceptores ubicados en la terminal dopaminérgica, por medio de agonistas dopaminérgicos, inhibe la síntesis y liberación de dopamina. El receptor que parece estar implicado es el subtipo D3 que pertenece a la familia D2 (Bahena-Trujillo et al. 2000). Mediante la activación de otros receptores ubicados en la terminal dopaminérgica también se puede modular su síntesis. La activación de los receptores N-metil-D-aspartato (NMDA) de glutamato estimulan la actividad de la TH, mientras que la activación de los receptores de ácido gamma-aminobutírico de tipo B (GABAB) inhiben su síntesis (Volkow et al. 1996; Bahena-Trujillo et al. 2000). Además de la clásica vía de biosíntesis se han observado vías alternativas para la formación de dopamina en roedores. Hallazgos en el cerebro de ratas in vivo¸ muestran que la tirosina se descarboxila a tiramina que puede ser hidroxilada por proteínas pertenecientes a la superfamilia de citocromo P450 (concretamente la familia 2 y subfamilia D; CYP2D), aunque la contribución de esta vía sobre el total de dopamina parece ser pequeña. Otra posibilidad sintética es la hidroxilación de tirosina por medio de la tirosinasa (EC 1.14.18.1), principal fuente de catecolaminas observada en ratones Knockout para TH (Meiser et al. 2013). 1.1.2. Almacenamiento de la dopamina En la terminal presináptica, la dopamina se puede encontrar en tres depósitos: dos reservorios vesiculares y un reservorio citoplasmático. 6 INTRODUCCIÓN Una vez formada, la dopamina es almacenada en vesículas por medio de un transportador de alta afinidad denominado transportador vesicular de monoaminas-2 (VMAT-2), ubicado en la membrana de las vesículas (Bahena-Trujillo et al. 2000; Harsing 2008; López y Arancibia 2008; Meiser et al. 2013). Este almacenamiento se realiza por medio de una bomba ATP-protón dependiente que genera un gradiente ácido. En las vesículas se puede alcanzar una concentración de hasta 500 mM. El almacenamiento vesicular está presente en alta densidad en las terminales nerviosas. Este almacenamiento vesicular previene la degradación enzimática y la generación de estrés oxidativo en el citosol (Bahena-Trujillo et al. 2000; Harsing 2008; López y Arancibia 2008; Meiser et al. 2013). En cuanto a los reservorios vesiculares, se describe un reservorio designado como “liberable”, que está constituido por las vesículas próximas a la membrana presináptica que liberan el neurotransmisor ante la llegada del potencial de acción. El otro reservorio vesicular es un gran almacén inactivo que se comunica con el anterior (Harsing 2008). El almacenamiento vesicular es muy dinámico y se caracteriza por tener una pérdida pasiva de dopamina que se fuga del almacenamiento vesicular. Esta pérdida es contrarrestada activamente por la acción de los transportadores vesiculares. Debido a ello, parte de la dopamina es degradada en el citosol de la propia célula que la genera. En condiciones de reposo, se considera que el metabolismo de la dopamina podría reflejar más un proceso de fuga pasivo que un proceso activo de exocitosis seguido de una recaptación neuronal (Eisenhofer et al. 2004; Harsing 2008). Además, la dopamina está presente en bajas concentraciones en el citosol donde es susceptible de degradación enzimática. Este reservorio se 7 INTRODUCCIÓN constituye por la dopamina recaptada del espacio sináptico y la dopamina que difunde desde las vesículas. Desde este reservorio la dopamina puede ser liberada por acción inversa del transportador de dopamina (DAT), puede ser almacenada en las vesículas o ser degradada por enzimas. Adicionalmente, la dopamina se puede encontrar en la hendidura sináptica y en el espacio extrasináptico (Harsing 2008). 1.1.3. Liberación de la dopamina La liberación de la dopamina se produce principalmente mediante un proceso de exocitosis dependiente de Ca++, como consecuencia de la llegada del potencial de acción. El gradiente electroquímico generado por la entrada de iones Ca++ provoca un debilitamiento de la unión de las vesículas al citoesqueleto, por medio de la fosforilación de las proteínas de anclaje (sinapsina I y II). De este modo, la vesícula es transportada a la zona activa para fusionarse con la membrana celular y liberar su contenido a la hendidura sináptica. En este proceso se ven involucradas diversas proteínas: sinaptotagmina, sintaxtina, proteínas asociadas a sinaptosomas (SNAP-25), factor sensible a N-etilmaleimida (NSF), proteínas de unión a NSF o SNAPs y otras (Bahena-Trujillo et al. 2000; López y Arancibia 2008). La liberación de dopamina calcio-dependiente también se denomina liberación fásica. La dopamina liberada de esta forma es eliminada por medio del proceso de recaptación, aunque dicho proceso no captura toda la dopamina. La dopamina que permanece en el espacio extrasináptico puede ser monitorizada por medio de microdiálisis cerebral (Harsing 2008). Se puede producir liberación de dopamina independiente de Ca++ por medio del DAT, que en determinadas condiciones puede operar en sentido inverso y en vez de introducir dopamina del espacio sináptico la libera del 8 INTRODUCCIÓN citoplasma (lo que también se denomina liberación tónica). Compuestos como la anfetamina y sus análogos tras entrar en la terminal dopaminérgica provocan un descenso de dopamina en el reservorio citoplasmático, ya que mediante la reversión del transportador esta dopamina es liberada en la hendidura sináptica (Bannon 2005; Harsing 2008). La liberación de dopamina está determinada por tres factores: La descarga espontánea de las neuronas dopaminérgicas. La capacidad autorregulatoria de las neuronas dopaminérgicas, que incluyen: la regulación de la liberación, de la síntesis y la tasa de disparo de las neuronas. La regulación por medio de las aferencias inhibitorias y excitadoras mediadas por heterorreceptores en las neuronas dopaminérgicas. A nivel estriatal, la regulación por medio de heterorreceptores de glutamato y GABA está bien caracterizada. Además, la liberación de dopamina puede ser controlada por un gran número de factores locales como el óxido nítrico (NO) que es liberado por interneuronas estriatales (Harsing 2008). 1.1.4. Inactivación de la dopamina Una vez en la hendidura sináptica, la dopamina interactúa tanto con receptores pre- como post-sinápticos. Tras haber ejercido su acción en el terminal sináptico puede seguir tres vías diferentes: ser recaptada hacia el terminal sináptico (principalmente por el DAT), sufrir degradación enzimática (por las enzimas monoamino oxidasa, MAO y catecol-ometiltransferasa, COMT) o difundir fuera de la hendidura sináptica (Bahena-Trujillo et al. 2000; López y Arancibia 2008). 9 INTRODUCCIÓN El DAT es una proteína transmembrana que pertenece a la familia de transportadores dependientes de Na+ y Cl-. Se expresa exclusivamente en neuronas dopaminérgicas. La dopamina es introducida en contra de su gradiente de concentración utilizando el gradiente de entrada de Na+. La recaptación de dopamina limita la duración de la acción en los receptores y su difusión a otras sinapsis. Además, permite el reciclaje y reutilización de la dopamina no metabolizada. La recaptación es el principal procedimiento para la inactivación de la dopamina (Bannon 2005; Harsing 2008). Los principales metabolitos ácidos derivados de la degradación de la dopamina son: el ácido dihidroxifenilacético (DOPAC) y el ácido homovanílico (HVA). La dopamina es metabolizada por la MAO (EC 1.4.3.4) dando lugar al dihidrofenilacetaldehído (DOPAL), que al ser muy inestable es rápidamente oxidado a DOPAC por medio de la aldehído deshidrogenasa (AD; EC 1.2.1.3). Posteriormente, el DOPAC sale de la neurona y es captado por la glía donde se ejerce la acción de la COMT (EC 2.1.1.6) generando HVA. La COMT degrada la dopamina a 3-metoxitiramina (3MT) que por acción de la MAO se transforma en 3-metoxi-4hidroxiacetaldehido (MHPA), transformándose en HVA por medio de la aldehído deshidrogenasa (Meiser et al. 2013). En la Figura 1.2 se representa la síntesis y degradación de la dopamina con las enzimas implicadas. Alteraciones en los niveles de los metabolitos de la dopamina (DOPAC y HVA) reflejan cambios en la actividad de la MAO y se utilizan comúnmente para medir la actividad de la MAO tanto in vivo como in vitro (Youdim y Bakhle 2006; Harsing 2008). 10 INTRODUCCIÓN -Enzimas implicadas: AD: Aldehído deshidrogenasa. COMT: Catecol-o-metiltransferasa. DDC: DOPA descarboxilasa. MAO: Monoamino oxidasa TH: Tirosina hidroxilasa. . Figura 1.2: Síntesis y metabolismo de la dopamina. Abreviaturas: 3-MT, 3Metoxitiramina; AD, aldehído deshidrogenasa; COMT, catecol-o-metiltransferasa; DDC, DOPA descarboxilasa; DOPAL, dihidrofenilacetaldehído; L-DOPA, L-3,4Dihidroxifenilalanina; MAO, Monoamino oxidasa; MHPA, 3-metoxi-4- hidroxiacetaldehído; TH, tirosina hidroxilasa (modificada de Laatikainen et al. 2013). 1.1.4.1. Inactivación de la dopamina por medio de la MAO La MAO es una flavoenzima (utiliza como cofactor el dinucleótido de flavina adenina, FAD) ubicada en la membrana externa mitocondrial que cataliza la desaminación oxidativa de un amplio número de monoaminas dando lugar a la producción de peróxido de hidrógeno (H2O2), como se muestra en la Figura 1.3 (Shih et al. 1999; Edmonson et al. 2007; Bortolato y Shih 2011). La importancia de esta enzima se pone en manifiesto con la incipiente investigación que se ha realizado sobre la misma, de la que se pueden 11 INTRODUCCIÓN constatar más de 20 000 publicaciones desde el año 1950 (Edmonson et al. 2007). Figura 1.3: Reacción de la desaminación oxidativa realizada por la monoamino oxidasa (MAO) en el metabolismo de las monoaminas. El primer producto de la acción de la MAO sobre las monoaminas es el correspondiente aldehído, que normalmente se oxida rápidamente por la aldehído deshidrogenasa (AD) en el ácido carboxílico, que es el metabolito final excretado. El ciclo FAD-FADH2 genera peróxido de hidrógeno que requiere inactivación por una catalasa o, en el cerebro, por la glutatión peroxidasa (Youdim y Bakhle 2006). Dependiendo de la selectividad por el sustrato y de la sensibilidad al inhibidor se pueden diferenciar dos isoformas de la MAO (denominadas MAO-A y MAO-B), que además presentan una distribución anatómica y una regulación comportamental diferente. Aunque se ha observado en diferentes especies que ambas presentan una similitud aminoacídica del 70 % y una organización intrón-exón idéntica, en humanos un solo aminoácido resulta crucial para las variaciones de la especificidad de cada isoforma (la isoleucina-335 y la tirosina-326, para las isoformas A y B respectivamente) (Thorpe et al. 1987; Riederer et al. 1987; Edmonson 1995; Binda et al. 2001; Geha et al. 2001; Binda et al. 2003; Ma et al. 2004; Nicotra et al. 2004; Edmonson et al. 2007; Bortolato y Shih 2011). 12 INTRODUCCIÓN En la Tabla 1.1 podemos observar los principales sustratos de la MAO. Principales sustratos de la MAO Indolaminas Serotonina Dopamina Triptamina Catecolaminas Noradrenalina Adrenalina Otras aminas Feniletilamina Tiramina Tabla 1.1: Principales sustratos de la monoamino oxidasa (MAO) (modificada de Bortolato y Shih 2011). La MAO-A está compuesta por 527 aminoácidos, es inhibida selectivamente por clorgilina y sus sustratos preferentes son la serotonina (la de mayor afinidad) y la noradrenalina. La MAO-B está compuesta por 520 aminoácidos, es selectivamente inhibida por selegilina (deprenil) y los sustratos por lo que presenta mayor afinidad son: la feniletilamina y la benzilamina. Los diagramas de cinta de ambas isoformas se muestran en la Figura 1.4 (Thorpe et al. 1987; Shih et al. 1999; Geha et al. 2001; Edmonson et al. 2007; Bortolato y Shih 2011). 13 INTRODUCCIÓN Figura 1.4: Diagramas de cinta de las unidades monoméricas de las dos isoformas de la monoamino oxidasa (MAO) de humanos. En la izquierda, la isoforma A y en la derecha, la isoforma B (Finberg 2014). Existe controversia sobre la isoforma de la MAO que metaboliza la dopamina. En términos generales, se considera que la degradación de dopamina, triptamina y tiramina es mediada por ambas isoformas, pero la relativa contribución de ambas isoformas parece variar en relación al tejido y a la especie estudiada. En lo referente a la preferencia a los sustratos, la dicotomía MAO-A y MAO-B no es absoluta; se solapan parcialmente en su especificidad y en ausencia de una isoforma la otra puede metabolizar los sustratos no preferentes como mecanismo compensatorio (Saura et al. 1996; Binda et al. 2001; Nicotra et al. 2004; Binda et al. 2007; Bortolato et al. 2008; Olanow et al. 2009a; Bortolato y Shih 2011). Ambas isoenzimas se expresan en la mayoría de los tejidos apareciendo en diferentes ratios, la MAO-A es abundante en fibroblastos y placenta, mientras que la MAO-B es la única enzima expresada en 14 INTRODUCCIÓN plaquetas y linfocitos (Thorpe et al. 1987; Nicotra et al. 2004; Bortolato y Shih 2011). En el SNC ambas isoenzimas se encuentran en neuronas y células gliales. Igualmente, las dos isoformas están presentes en diversas regiones cerebrales, aunque algunas regiones presentan mayor expresión de una isoforma. La MAO-A está presente principalmente en los cuerpos celulares de neuronas dopaminérgicas y noradrenérgicas, mientras que la MAO-B es la única isoforma presente en neuronas serotonérgicas. El significado de esta ubicación es incierta, ya que la serotonina parece ser metabolizada preferentemente por la MAO-A. Esta compartimentalización, que parece controvertida, podría ser un mecanismo para proteger los sustratos específicos de la degradación enzimática y facilitar una metabolización más selectiva (Thorpe et al. 1987; Saura et al. 1996; Nicotra et al. 2004; Fowler et al. 2005; Bortolato y Shih 2011). Otros autores apuntan a que esta localización puede ser debida a un mecanismo de protección de las neuronas de la estimulación por la oxidación a aminas extrañas que puedan actuar como falsos neurotransmisores (Shih et al. 1999) o como mecanismo para prevenir la acumulación no específica de neurotransmisores (Fowler et al. 2005). Existen diferencias en la distribución de ambas isoformas de la MAO entre distintas especies. Aunque la dopamina es considerada un sustrato no selectivo para ambas isoformas, se considera que el metabolismo dopaminérgico es llevado a cabo por la MAO-A en roedores, mientras que en humanos y primates la dopamina es metabolizada principalmente por la MAO-B (Saura et al. 1996; Fowler et al. 2005; Bortolato et al. 2008; Bortolato y Shih 2011; Riederer y Laux 2011). 15 INTRODUCCIÓN En el cerebro humano la isoforma predominante en los ganglios basales es la MAO-B, que es la isoforma que lleva a cabo el 80% de la actividad MAO en esta región (Figura 1.5). Sin embargo, se considera que en ratas ambas isoformas pueden ejercer su función en el estriado para la degradación dopaminérgica, existiendo una relación 1:1 entre ambas isoformas (Youdim y Riederer 2004; Factor 2008). Aunque otros autores indican que el ratio MAO-A/MAO-B en estriado de roedores es de 2:1, mientras que en primates es 1:10 (Di Monte et al. 1996). Figura 1.5: Tomografía de emisión de positrones (PET) donde se observan las regiones de mayor acumulación de inhibidores selectivos e irreversibles de la MAO marcados con radiotrazadores. En la imagen izquierda se ha inyectado un inhibidor selectivo de la isoforma A ([11C]clorgilina) y en la imagen derecha se ha inyectado un inhibidor selectivo de la isoforma B ([ 11C]selegilina). Se puede apreciar mayor captación del inhibidor de la isoforma B en el cerebro humano (Fowler et al. 2005). La MAO-B tiene una ubicación predominantemente extraneuronal, principalmente en astrocitos. El incremento de esta isoenzima con la edad se ha atribuido a la proliferación de células gliales asociada a la pérdida neuronal. Este incremento de la MAO-B se considera que causa un incremento de estrés oxidativo, debido al aumento de H2O2 que puede interactuar con el hierro libre formando radicales hidroxilo, que pueden 16 INTRODUCCIÓN dañar ácidos nucleicos, proteínas, lípidos de membrana, lo que conlleva a la muerte neuronal. Pacientes con EP presentan elevada actividad de la MAO-B en la sustancia negra. Aunque también se indica que el H2O2 podría presentar funciones de señalización neuronal (Shih et al. 1999; Nicotra et al. 2004; Fowler et al. 2005; Novaroli et al. 2006; Edmonson et al. 2007; Factor 2008). Además, la MAO-B convierte el neurotóxico 1-metil-4-fenil-1,2,3,6tetrahidropiridina (MPTP) en su metabolito tóxico (1-metil-4- fenilpiridina, MPP+), que selectivamente destruye las neuronas dopaminérgicas de la sustancia negra causando un parkinsonismo secundario. Por este motivo y por su capacidad para generar especies reactivas de oxígeno, se considera que la MAO podría estar involucrada en la patogénesis de la EP (Thorpe et al. 1987; Shih et al. 1999; Binda et al. 2001; Ma et al. 2004; Edmonson et al. 2007). Además, se ha observado que niveles elevados de MAO-B podría inducir apoptosis en células neuronales y renales (Binda et al. 2001). Se han descrito diversos inhibidores de la MAO (IMAOs), tanto selectivos como no selectivos para cada isoforma, como agentes terapéuticos útiles en diversas enfermedades, desde trastornos afectivos hasta enfermedades neurodegenerativas. En este último caso, destaca la aplicación de inhibidores selectivos de la MAO-B en la EP, donde resaltan la selegilina y la rasagilina; más recientemente se está investigando la safinamida, que se encuentra en ensayos clínicos fase III (Shih et al. 1999; Eisenhofer et al. 2004; Youdim et al. 2006; Riederer et al. 2007; López y Linazasoro 2009; Puy-Núñez y Cebrián-Pérez 2012; Barbosa y Bossoni 2014; Finberg 2014). El efecto terapéutico de los IMAO-B en la EP se basa en su capacidad de reducir el metabolismo de la dopamina. De este modo, permiten el 17 INTRODUCCIÓN incremento del tiempo de permanencia de la dopamina en la sinapsis al inhibir su principal vía de degradación enzimática. Asimismo, se comienza a constatar la posibilidad de efectos neuroprotectores de los IMAO mediante la disminución de estrés oxidativo y radicales libres. Se han observado niveles elevados de dopamina y disminuidos de sus metabolitos en cerebros post-morten de pacientes tratados con selegilina. Además, la inhibición selectiva de esta isoenzima permite evitar los efectos secundarios de la inhibición de la MAO-A (Shih et al. 1999; Finberg y Youdim 2002; Eisenhofer et al. 2004; Youdim et al. 2006; Fernández et al. 2007). Aunque los IMAO-B también pueden presentar mecanismos neuroprotectores independientes a los de la inhibición de la MAO (Bortolato et al. 2008). Por otra parte, también se ha observado que algún inhibidor selectivo de la isoforma A, como la moclobemida, puede tener efectos antiparkinsonianos (Bortolato et al. 2008). A pesar de la larga historia de los inhibidores de la MAO en la medicina, la forma en la que afectan a la liberación neuronal de neurotransmisores monoaminérgicos aún requiere mayor investigación (Finberg 2014). 1.1.5. Receptores dopaminérgicos Los receptores de la dopamina pertenecen a la superfamilia de receptores acoplados a proteínas G. En base a sus características moleculares se han descrito 5 subtipos de receptores agrupados en 2 familias: la familia D1 y la familia D2. La familia D1 está constituida por los subtipos D1 y D5; que están acoplados a proteínas Gs y estimulan la adenilil ciclasa y por tanto incrementan la formación de adenosín monofosfato cíclico (AMPc). La familia D2 está constituida por los receptores D2, D3 y D4 y, al contrario que la familia D1, están acoplados a 18 INTRODUCCIÓN proteínas Gi/o por lo que inhiben la adenilil ciclasa disminuyendo la formación de AMPc (Figura 1.6). Existe una diferente distribución neuroanatómica de los distintos subtipos de receptores dopaminérgicos, siendo el subtipo D1 el más abundante en el SNC. Las diferencias en su distribución y comportamiento intracelular permiten a la dopamina ejercer múltiples funciones fisiológicas (Missale et al. 1998; Nicola et al. 2000; Pivonello et al. 2007). Debido al gran número de procesos en los que interviene la dopamina, se ha estudiado ampliamente el funcionamiento de los receptores dopaminérgicos, principalmente los que intervienen en las funciones motrices. Los tipos de receptores que intervienen principalmente en el control motor son D1, D2 y D3. La activación del subtipo D1, cuya expresión es exclusivamente postsináptica, incrementa moderadamente la actividad motora. El efecto que ejerce la activación de los subtipos D2 y D3 es más compleja ya que depende de su expresión presináptica y postsináptica. Los receptores D4 y D5 parecen ejercer poca influencia sobre el control motor ya que presentan poca expresión en las regiones motoras primarias. Sin embargo, se considera que la participación de ambas familias de receptores es necesaria para la actividad motriz (Bealieu y Gainetdinov 2011). 19 INTRODUCCIÓN Figura 1.6: Representación esquemática de la sinapsis dopaminérgica. La tirosina se transforma en L-DOPA por la tirosina hidroxilasa (TH) y la DOPA descarboxilasa convierte la L-DOPA en dopamina. La dopamina puede almacenarse en vesículas sinápticas para luego liberarse por exocitosis. Una vez liberada, la dopamina puede unirse a receptores post-sinápticos y autorreceptores, metabolizarse o recaptarse. La dopamina puede ser metabolizada por la monoamino oxidasa (MAO) o por la catecol-o-metiltransferasa (COMT). Abreviaturas: 3-MT, 3-metoxitiramina; AMPc, adenosín monofosfato cíclíco; DAT, transportador de dopamina (modificada de Blackstone 2009). 20 INTRODUCCIÓN 1.1.6. Sistemas dopaminérgicos Los sistemas dopaminérgicos son de gran interés puesto que su alteración se ha relacionado, directa o indirectamente, con diversos trastornos que afectan severamente al SNC, observándose alteraciones a nivel motor, cognitivo, motivacional y de aprendizaje (Bahena-Trujillo et al. 2000; Schultz 2007). La principal proporción de neuronas dopaminérgicas en el SNC se localiza en tres núcleos dopaminérgicos: sustancia negra pars compacta (SNc), área tegmental ventral y núcleo arqueado. Aproximadamente el 70% de la dopamina cerebral está contenida en el cuerpo estriado (Nicola et al. 2000; Fernández et al. 2006; Harsing 2008). Los sistemas dopaminérgicos han sido estudiados principalmente por técnicas de fluorescencia e inmunocitoquímica. Los grupos neuronales dopaminérgicos han sido denominados desde A8 hasta A17 atendiendo a la clasificación elaborada por Dahlström y Fuxe en 1964 (Figura 1.7). Se pueden describir 3 sistemas dopaminérgicos principales: Sistemas ultracortos: formados por células dopaminérgicas del bulbo olfatorio y neuronas interflexiformes de la retina. Sistemas de longitud intermedia: constituidos por el sistema tuberohipofisario, con neuronas localizadas en el hipotálamo dorsal y posterior y el grupo periventricular medular. Sistemas largos: este grupo incluye las neuronas de la región retrorubral, del área tegmental ventral y de la sustancia negra pars compacta. Las principales vías dopaminérgicas centrales de proyección larga son: la vía nigro-estriatal, la vía mesolímbica y la vía mesocortical. La vía nigro-estriatal interviene en el control de los movimientos complejos. La principal aportación de la dopamina al núcleo estriado la realiza la sustancia negra pars compacta, que 21 INTRODUCCIÓN además de proyectar hacia el estriado conduce dopamina hasta sus terminaciones. La disminución de este neurotransmisor en el núcleo estriado provoca cuadros artrocinéticos como la EP y la corea de Huntington. Las vías mesolímbica y mesocortical son importantes para los afectos, las emociones y la motivación (Bahena-Trujillo et al. 2000; Björklund y Dunnet 2007). Figura 1.7: Distribución de los grupos neuronales dopaminérgicos en el cerebro de roedores. Se utiliza la nomenclatura propuesta por Fuxe y Dahlström (Björklund y Dunnet 2007). 1.1.6.1. Los ganglios basales Los ganglios basales están constituidos por cinco núcleos interconectados que se localizan en el telencéfalo basal. Dichos núcleos son: el caudado, el putamen, el globo pálido, la sustancia negra y el núcleo subtalámico (Figura 1.8). A pesar de que el caudado y el putamen se encuentran separados por la cápsula interna, existen diversos puentes de células que conectan ambos núcleos, que además son similares funcional y anatómicamente. De hecho, habitualmente ambas estructuras se 22 INTRODUCCIÓN denominan núcleo estriado (Blandini et al. 2000; Herrero et al. 2002; Obeso et al. 2008). Figura 1.8: Conexiones anatómicas de los ganglios basales. Abreviaturas: GPe, globo pálido externo; GPi, globo pálido interno; SNc, sustancia negra pars compacta; SNr, sustancia negra pars reticulata (traducido de Lewis et al. 2003). 23 INTRODUCCIÓN El núcleo estriado es la estructura de mayor tamaño de los ganglios basales, está compuesto en un 95% por neuronas GABAérgicas espinosas de tamaño intermedio y es el principal receptor de los ganglios basales, siendo la mayoría de las conexiones que recibe de carácter excitatorio. A este núcleo llegan aferencias glutamatérgicas de la corteza, núcleos talámicos y estructuras límbicas (presenta la mayor densidad de receptores glutamatérgicos de los ganglios basales). La somatotopía cortical es preservada en los ganglios basales. Otra aferencia de elevada importancia que recibe el estriado procede de neuronas dopaminérgicas de la sustancia negra pars compacta y del área tegmental ventral. La dopamina ejerce una acción neuromoduladora sobre los impulsos excitatorios que recibe el estriado (Blandini et al. 2000; Nicola et al. 2000; Herrero et al. 2002; Fernández et al. 2006; Obeso et al. 2008). Los ganglios basales utilizan diversos tipos de neurotransmisores. Podemos observar moléculas pequeñas como la dopamina, noradrenalina, serotonina, GABA, glutamato y acetilcolina. Este tipo de moléculas son de efecto rápido y de corta duración, en general del tipo “todo o nada”. Por otra parte, los péptidos neuroactivos presentes en los ganglios basales (Sustancia P, encefalina y dinorfina) producen efectos preferentemente de larga duración y de carácter modulatorio, que suelen estar mediados por segundo mensajeros. Además, la actividad estriatal es modulada por moléculas como el óxido nítrico (NO) (Kiss 2000; Fernández et al. 2006). Habitualmente, la fisiología de las conexiones de los ganglios basales se explica en base al modelo de la vía directa e indirecta (Figura 1.9). Este modelo expone que el estriado transmite el flujo de información recibida de la corteza a los núcleos de salida (la sustancia negra pars reticulata y el globo pálido interno) por medio de dos vías: una directa y una indirecta. La activación de una vía u otra conllevaría acciones opuestas sobre el movimiento: la vía directa lo activa mientras que la indirecta lo inhibe 24 INTRODUCCIÓN (Blandini et al. 2000; Herrero et al. 2002; Lewis et al. 2003; Rodríguez y Obeso 2006; DeLong y Wichmann 2007). La vía directa es monosináptica. Tiene su origen en las neuronas espinosas GABAérgicas medias que coexpresan sustancia P, dinofirna y receptores de tipo D1. Su acción es inhibitoria (Lewis et al. 2003; Rodríguez y Obeso 2006; DeLong y Wichmann 2007). La vía indirecta es polisináptica. Parte de neuronas GABAérgicas estriatales que expresan encefalina y receptores de tipo D2. Se proyecta al globo pálido externo, el cual a su vez envía aferencias GABAérgicas al núcleo subtalámico, que establece sinapsis con los núcleos de salida mediante conexiones glutamatérgicas. Por lo tanto su acción es excitatoria (Lewis et al. 2003; Rodríguez y Obeso 2006). Los núcleos de salida proyectan mediante sinapsis GABAérgicas a los núcleos ventral lateral y ventral anterior del tálamo y a los núcleos troncoencefálicos. Las eferencias talamocorticales proyectan sobre las áreas sensitivo-motoras de la corteza, cerrando el circuito (Lewis et al. 2003; Rodríguez y Obeso 2006). Los datos actuales indican que la dopamina probablemente ejerza múltiple acciones en la fisiología neuronal del núcleo estriado, tanto inhibiendo como incrementando la actividad neuronal, dependiendo del nivel de despolarización de la membrana y el estado fisiológico de la neurona (Calabresi et al. 2007). 25 INTRODUCCIÓN Figura 1.9: Circuito de los ganglios basales en condiciones normales. Se pueden observar redes neuronales paralelas que surgen del estriado que conecta e integra funciones entre los ganglios basales, varias regiones de la corteza cerebral y el tálamo. En el circuito motor, que se muestra aquí, áreas de la corteza motora proyectan de forma somatotópica a la región posterolateral del putamen, donde sinaptan por medio de neuronas excitatorias glutamatérgicas con neuronas medias espinosas del estriado. Estas neuronas estriatales utilizan ácido gamma-aminobutírico (GABA) como principal neurotransmisor y sustancia P (SP) o encefalina (Enc) como cotransmisores, están organizadas en dos vías: la vía directa y la vía indirecta. La vía directa conecta el estriado el globo pálido interno (GPi) y la sustancia negra pars reticulata (SNr). El GPi y la SNr son los núcleos de salida de los ganglios basales y proyectan al tronco encefálico (núcleo pedúnculo-pontino; NPP) y al tálamo. Las conexiones de los núcleos de salida al tálamo son inhibitorias, mientras que la proyección tálamo-cortical es excitatoria. La vía indirecta conecta al estriado con los núcleos de salida, pero estas fibras previamente pasan por el globo pálido externo (GPe) y el núcleo subtalámico (NST), la salida de estos núcleos es excitatoria (traducido de Lewis et al. 2003). 26 INTRODUCCIÓN Mediante estudios neuroanatómicos más recientes se ha ampliado la conceptualización del circuito motor, observándose la existencia de circuitos transversales que se establecen entre los distintos núcleos o desde el tálamo, permitiendo cierta autorregulación de la circuitería. Otras conexiones que han ido adquiriendo relevancia son: conexiones recíprocas del núcleo pedúnculo-pontino con todos los ganglios basales, una vía hiperdirecta excitadora desde la corteza motora hasta el núcleo subtalámico e inervaciones dopaminérgicas extraestriatales desde la SNr hacia ambos segmentos del globo pálido (Braak y Tredici 2008; Obeso et al. 2008). La sintomatología motora de la EP se ha asociado a la pérdida de la aferencia dopaminérgica en el estriado provocada por la degeneración de la pars compacta de la sustancia negra. Este proceso neurodegenerativo causa una reestructuración funcional de esta circuitería que se traduce en un incremento de las eferencias GABAérgicas de los ganglios basales, lo que explicaría la bradicinesia (Figura 1.10) (Blandini et al. 2000; Herrero et al. 2002; Lewis et al. 2003; DeLong y Wichmann 2007). 27 INTRODUCCIÓN Figura 1.10: Circuito de los ganglios basales en la EP. La pérdida de dopamina va a provocar alteraciones en el circuito motor, que presentarán como resultante una fuerte influencia inhibitoria de los núcleos de salida sobre el tálamo. Esto provocará una disminución de las excitaciones del tálamo a la corteza, lo que clínicamente se manifiesta como bradicinesia. La influencia que recibe el núcleo pedúnculo-pontino (NPP) de los ganglios basasles alterados puede contribuir a las alteraciones de la marcha. Abreviaturas: Enc, encefalina; GABA, ácido gamma-aminobutírico; GPe, globo pálido externo; GPi, globo pálido interno; SNc, sustancia negra pars compacta, SNr, sustancia negra par reticulata; SP, sustancia P; NST, núcleo subtalámico (traducido de Lewis et al. 2003). 28 INTRODUCCIÓN 1.2. ENFERMEDAD DE PARKINSON La EP recibe su nombre de James Parkinson, un médico inglés que en 1817 publicó una obra titulada “Un ensayo sobre la parálisis agitante”, donde describe esta patología a través de 6 casos clínicos (Parkinson 2002). La EP es un trastorno neurodegenerativo progresivo que patológicamente se caracteriza por la degeneración de las neuronas dopaminérgicas de las sustancia negra pars compacta (Wirdefeldt et al. 2011; Fritsch et al. 2012; Gazewood et al. 2013). La etiología de este trastorno es desconocida, aunque estudios recientes señalan tanto la implicación de factores ambientales como la predisposición genética (Fernández 2012; Fritsch et al. 2012). Las principales características clínicas, que suponen el eje fundamental para el diagnóstico de la EP, son las alteraciones motoras (síntomas cardinales): temblor en reposo, rigidez, bradicinesia y alteraciones posturales, que se asocian a una respuesta positiva a LDOPA. Sin embargo, la EP no produce exclusivamente alteraciones motoras sino que se observa una afectación multisistémica con cambios cognitivos, neuropsiquiátricos y síntomas relacionados con trastornos en el SNA (Jankovic 2008; Sesar 2009; Fernández 2012; Fritsch et al. 2012; Mulero et al. 2012; Gazewood et al. 2013). La EP afecta principalmente a adultos mayores y presenta un curso de carácter crónico e irreversible, por lo que la búsqueda de una intervención que consiga ralentizar o frenar el transcurso de la enfermedad resulta de vital importancia. De momento no se ha alcanzado un tratamiento curativo, pero tanto el tratamiento farmacológico como no farmacológico 29 INTRODUCCIÓN ha mejorado sustancialmente la calidad de vida de los pacientes (Katzenschlager 2014). 1.2.1. Epidemiología de la enfermedad de Parkinson La EP es la segunda enfermedad neurodegenerativa más frecuente, después de la enfermedad de Alzheimer. Lo que conlleva un importante impacto en la calidad de vida de los pacientes así como en los cuidadores, además de suponer un importante gasto sanitario. Los estudios epidemiológicos de la EP presentan una serie de limitaciones, ya que existen diferencias metodológicas, genéticas y ambientales en las diversas poblaciones estudiadas. A nivel metodológico las principales variaciones son: distintos criterios diagnósticos (principalmente clínico), diferente edad de estudio y métodos de selección de casos (Abasolo-Osinaga et al. 2006; Wirdefeldt et al. 2011; GarcíaRamos et al. 2013). Aunque existe variabilidad entre los diferentes estudios, en términos generales se considera un incidencia anual mundial que varía de 1,5-22 pacientes/ 100 000 habitantes por año. Estimaciones más precisas en las que se comparan estudios con metodología similar muestran un incidencia de 17/ 100 000 habitantes por año, con un pico de incidencia máxima en la década de los 70 años y con un ligero predominio del sexo masculino. La prevalencia mundial varía entre 167- 5703 por 100 000 habitantes, aunque estudios menos estrictos establecen una prevalencia de 100-300 casos por 100 000 habitantes. Actualmente, en España se estima que existen más de 300 000 pacientes con EP, lo que puede llegar a suponer un gasto económico hasta más de 17 000 euros por paciente y en estos pacientes la mortalidad aumenta casi al doble (Wirdefeldt et al. 2011; García-Ramos et al. 2013). 30 INTRODUCCIÓN La Asociación Europea de la Enfermedad de Parkinson en su segunda declaración de consenso (2012) indica que existen más de 1,2 millones de personas que padecen EP en Europa y el gasto económico anual se establece en 13,9 billones de euros. Considerando los estudios de prevalencia, algunos autores estiman que en el año 2030 la cifra de pacientes de EP se duplicará, alcanzándose una cifra que oscila entre 8,7 y 9,3 millones de casos en el oeste europeo y en los países más poblados (Dorsey et al. 2007). 1.2.2. Etiopatogenia y diagnóstico de la enfermedad de Parkinson La etiología de la EP no se comprende completamente, es de carácter multifactorial involucrando tanto factores genéticos, como ambientales (Wirdefeldt et al. 2011; Fernández 2012).La patogenia de la EP se considera que es un proceso formado por una compleja cascada de eventos que culminan en la muerte celular por medio de la vía apoptótica (Jenner y Olanow 2006; Olanow et al. 2009a). El principal cambio patológico que destaca en la EP es la afectación de la neuronas dopaminérgicas de la sustancia negra pars compacta, con la consecuente pérdida de dopamina estriatal (Figura 1.11). La degeneración de la sustancia negra pars compacta provoca las principales alteraciones motoras observadas en la EP, lo que es la base diagnóstica de este patología (Jenner y Olanow 2006; Wirdefeldt et al. 2011; Pagonabarraga y Kulisevsky 2014). 31 INTRODUCCIÓN Figura 1.11: Principales alteraciones neuropatológicas en la EP. En la sección de la izquierda se muestra una sección transversal a nivel de la sustancia negra de un sujeto sano (superior) y de un paciente con EP (inferior) donde se puede apreciar la reducción del pigmento de neuromelanina en la sustancia negra pars compacta (SNc). En la sección central se puede observar la pérdida de neuronas dopaminérgicas en la SNc de un paciente de EP (inferior) en comparación con una muestra de sujeto sano. La sección de la derecha muestra una neurona dopaminérgica que presenta cuerpo de Lewy (Olanow et al. 2009a). Este proceso degenerativo involucra diversos mecanismos: Estrés oxidativo y nitrosativo: El origen de los radicales de oxígeno se considera que deriva de cambios bioquímicos indirectos, como incremento de los niveles de Fe+2 y alteración de los mecanismos antioxidantes. La generación de las especies de nitrógeno se relaciona con alteraciones en la actividad de la óxido nítrico sintasa (NOS; EC 1.14.13.39). Excitotoxicidad: La evidencia que apoya la hipótesis de excitotoxicidad se basa en la hiperactividad de la salida glutamatérgica del núcleo subtalámico y el incremento de tinción para 3-nitrotirosina en los cuerpos de Lewy. 32 INTRODUCCIÓN Inflamación: la respuesta inflamatoria puede ser debida a diversas causas. Se ha observado que la ingesta regular de aspirina y otros atiinflamatorios no esteroideos (AINES) disminuye el riesgo de padecer EP. Disfunción mitocondrial: Se han observado alteraciones en el complejo I mitocondrial y en la alfa-cetoglutarato deshidrogenasa. Se ha propuesto un origen tóxico y mecanismos genéticos para esta disfunción. Proteólisis alterada: existen diversas evidencias que apoyan que la proteólisis alterada contribuye a la muerte neuronal de las neuronas nigrales y a la formación de los cuerpos de Lewy. Aunque se desconoce cómo interactúan estos mecanismos y la implicación de cada uno de ellos en la generación de la EP (Jenner y Olanow 2006; Wirdefeldt et al. 2011). Generalmente en la patogénesis de la EP se describe la existencia de una vulnerabilidad selectiva de la vía nigro-estriatal, considerando únicamente la afectación de los sistemas dopaminérgicos. Este abordaje puede resultar útil a nivel práctico, pero es necesario tener en cuenta que la EP es un trastorno que produce una afectación multisistémica y donde otros sistemas de neurotransmisores se ven involucrados. Los cambios patológicos también incluyen degeneración en las neuronas noradrenérgicas del locus coeurulus, neuronas colinérgicas del núcleo basal de Meynert, neuronas serotonérgicas del rafe dorsal, células nerviosas del sistema olfatorio, núcleo pedúnculo pontino, núcleo motor dorsal del nervio vago y el sistema nervioso autónomo (Hardy y GwinnHardy 1998; Jenner y Olanow 2006; Olanow et al. 2009a; Mulero et al. 2012). Todos estos cambios podrían explicar la sintomatología, tanto 33 INTRODUCCIÓN motora como no motora, que no responden a la farmacología dopaminérgica (Jenner y Olanow 2006). El proceso neurodegenerativo de la EP comienza años antes de que se produzcan las manifestaciones motoras, lo que se denomina período premotor o preclínico. Las estimaciones iniciales indicaban que existía un período preclínico de 5 o 6 años, basado en hallazgos neuropatológicos en la sustancia negra y estudios de imagen de la dopamina estriatal (Sesar 2009; Savica et al. 2010). La presencia de cuerpos de Lewy y los estudios epidemiológicos de manifestaciones no motoras sugieren que el período preclínico se extiende hasta 20 años antes de las manifestaciones motoras. En esta fase premotora, las manifestaciones no motoras con las que se ha asociado la EP son: estreñimiento, alteraciones del sueño REM, ansiedad y anemia. La pérdida de olfato y la depresión también preceden a las alteraciones motoras, pero en un período más corto de tiempo. Además, esta sintomatología persiste en períodos posteriores de la enfermedad y puede llegar a ser tan discapacitante como la motora (Savica et al. 2010; Wirdefeldt et al. 2011; Fernández 2012; Mulero et al. 2012; Sprenger y Poewe 2013). Las manifestaciones motoras son la base para el diagnóstico de la EP. Estas manifestaciones extrapiramidales están presentes cuando la pérdida neuronal de la sustancia negra pars compacta es del 60-70% y la pérdida de dopamina en el estriado alcanza el 80% (Jankovic 2008; Sesar 2009; Wirdefeldt et al. 2011; Fernández 2012; Tsai y Yuan 2012; Gazewood et al. 2013). Los síntomas que sirven de guía para el diagnóstico de la EP son: temblor, rigidez y bradicinesia. La alteración de reflejos posturales también es característica, pero no está presente en los períodos iniciales 34 INTRODUCCIÓN (Jankovic 2008; Sesar 2009; Olanow et al. 2009a; Wirdefeldt et al. 2011; Fernández 2012). El temblor se caracteriza por ser un temblor de reposo, que se aprecia cuando el paciente tiene la extremidad relajada y desaparece con el movimiento. Presenta un comienzo insidioso y asimétrico, generalmente se inicia en una extremidad superior y posteriormente se extiende a la extremidad inferior del mismo lado. La frecuencia con la que se tiembla es de 4-6 Hz (Jankovic 2008; Sternberg et al. 2013). La rigidez consiste en un aumento del tono muscular que se caracteriza por una resistencia ante la movilización pasiva de un segmento. Esta rigidez se denomina en tubo de plomo puesto que es constante en todo el recorrido y si se combina con temblor se produce el fenómeno de rueda dentada (Sesar 2009; Solopova et al. 2014). La bradicinesia consiste en un enlentecimiento generalizado de las funciones motoras, es el síntoma más incapacitante de la EP. En las primeras fases se manifiesta como dificultad para realizar movimientos de precisión o alteración de la marcha; con el desarrollo de la EP se puede observar escasez de parpadeo, trastornos de deglución, hipomimia facial, hipofonia y bradilalia (Jankovic 2008; Daneault et al. 2013). Los criterios habitualmente utilizados para el diagnóstico de la EP se basan en los criterios del UK Parkinson´s Disease Society Brain Bank. Para el diagnóstico de la EP debe estar presente la bradicinesia y al menos alguno de los siguientes síntomas: rigidez, temblor de reposo a 4-6 Hz o inestabilidad postural. Se requieren al menos 3 de los siguientes criterios adicionales para EP definitivo: inicio unilateral, temblor de reposo, afectación progresiva, asimetría persistente, respuesta excelente a LDOPA, corea grave inducida por L-DOPA, respuesta a L-DOPA al menos durante 5 años y curso clínico de diez años o más (Jankovic 2008; Sesar 35 INTRODUCCIÓN 2009; Gazewood et al. 2013). También se utilizan los criterios propuestos por Gelb et al. (1999), que agrupa los hallazgos característicos de la EP (temblor de reposo, bradicinesia, rigidez e inicio asimétrico) y los hallazgos sugerentes de un diagnóstico alternativo. De todos modos, actualmente, la confirmación definitiva de la EP se realiza por medio de análisis histopatológico post mortem (Jankovic 2008; Sesar 2009). 1.2.3. Farmacoterapia antiparkinsoniana La farmacología antiparkinsoniana actual va enfocada a un abordaje sintomatológico de la EP que permita mejorar la calidad de vida del paciente. En este momento no se dispone de un tratamiento que modifique el transcurso de la enfermedad (Tsai y Yuan 2012; Conolly y Lang 2014). La L-DOPA es considerada el compuesto más efectivo para el tratamiento de los síntomas motores de la EP, aunque en muchos casos se inicia el tratamiento con otros compuestos para evitar las complicaciones motoras relacionadas con la levodopaterapia (Factor 2008; Tsai y Yuan 2012; Sprenger y Poewe 2013; Conolly y Lang 2014). 1.2.3.1. Levodopa (L-DOPA) La L-DOPA es el principal compuesto para el tratamiento de la EP. Es un aminoácido aromático, precursor de la dopamina natural. Cuando es administrada oralmente se absorbe en el intestino delgado y presenta una vida media de 90 minutos (Riederer et al. 2007; Tabernero 2009; PuyNúñez y Cebrián-Pérez 2012; Pagonabarraga y Kulisevsky 2014). Normalmente se administra L-DOPA con inhibidores de la DDC para reducir su metabolismo periférico y evitar los efectos adversos. De este modo, su metabolización es principalmente central, ya que ejerce su 36 INTRODUCCIÓN acción una vez transformada en dopamina. Los inhibidores de la DDC disponibles en el mercado son la benserazida y la carbidopa (Tabernero 2009; Puy-Núñez y Cebrián-Pérez 2012; Pagonabarraga y Kulisevsky 2014). Una vez que la L-DOPA atraviesa la barrera hematoencefálica, mediante un sistema transportador de aminoácidos neutros, es captada por las neuronas dopaminérgicas de la sustancia negra pars compacta, donde es convertida a dopamina y posteriormente liberada en todas aquellas regiones cerebrales inervadas por las vías nigroestriatal y mesolímbicocortical (Riederer et al. 2007; Puy-Núñez y Cebrián-Pérez 2012; Pagonabarraga y Kulisevsky 2014). El nivel de evidencia que ha mostrado el tratamiento con L-DOPA es fuerte (nivel A) y sigue considerándose como el tratamiento dopaminérgico más eficaz para la mejoría de la sintomatología motora de la EP, con un grado de recomendación A (Tabernero 2009; Pagonabarraga y Kulisevsky 2014). Debido a la precoz aparición de complicaciones motoras derivadas del tratamiento en monoterapia con dosis medio-altas de L-DOPA, en pacientes con una edad de inicio por debajo de los 60 años se ha consensuado el comienzo con agonistas dopaminérgicos e IMAO (Tsai y Yuan 2012; Conolly y Lang 2014). El tratamiento con L-DOPA se ha relacionado principalmente con el desarrollo de discinesias. Debido a la corta vida media de este compuesto se generan picos y valles de estimulación dopaminérgica en los ganglios basales (liberación pulsátil). Prácticamente todos los pacientes tratados con dosis altas y de larga evolución (más de 10 años) presentan fluctuaciones motoras o discinesias (Factor 2008; Tabernero 2009; Sprenger y Poewe 2013; Tsai y Yuan 2012; Conolly y Lang 2014). 37 INTRODUCCIÓN Con el objetivo de reducir las complicaciones asociadas con la administración oral de L-DOPA, en los últimos años se ha comenzado a practicar la infusión continua de L-DOPA/carbidopa intraduodenal (Duodopa®) en pacientes con EP avanzada. Mediante la administración intraduodenal se pretende evitar las complicaciones motoras derivadas de las fluctuaciones en plasma de los niveles de L-DOPA (Valldeoriola y Yáñez 2009; Hickey y Stacy 2011; García et al. 2012). A causa de la paulatina pérdida neuronal que se produce en la EP, existe una pérdida de efecto en el tratamiento con L-DOPA, ya que este compuesto requiere ser captado por las neuronas dopaminérgicas de la sustancia negra (Riederer et al. 2007; Pagonabarraga y Kulisevsky 2014). 1.2.3.2. Agonistas dopaminérgicos Los agonistas dopaminérgicos son fármacos capaces de activar los receptores dopaminérgicos postsinápticos, presentando cada agonista una afinidad diferente por cada subtipo de receptor. Aunque se desconoce la relevancia clínica de la afinidad de cada compuesto, algunos autores postulan como más relevantes los de la familia D2 (Tsai y Yuan 2012). La evidencia preclínica sugiere que la estimulación de receptores de la familia D1 y D2 proporcionaría mejores efectos que la estimulación de un tipo solo. Sin embargo, los estudios clínicos demuestran que la estimulación simultánea de D1 y D2 no es mayor que estimulación sola sobre D2 (Riederer et al. 2007). Los agonistas dopaminérgicos se dividen en derivados ergóticos (pergolida y cabergolina) y no ergóticos (pramiprexol, ropinirol, rotigotina y apomorfina). Debido a los efectos secundarios de los derivados ergóticos (serositis y valvulopatía cardíaca), en la práctica 38 INTRODUCCIÓN clínica se utilizan los agonistas no ergóticos (Factor 2008; Tsai y Yuan 2012; Sprenger y Poewe 2013). La inclusión de los agonistas dopaminérgicos en las guías de EP se realizó con la finalidad de disminuir el desarrollo de las complicaciones motoras del tratamiento mantenido de L-DOPA en monoterapia (Pagonabarraga y Kulisevsky 2014). La inclusión de estos agonistas ha permitido una importante disminución del desarrollo de complicaciones motoras derivadas de la LDOPA. Este efecto deriva de que los agonistas dopaminérgicos presentan una vida media más larga y de la disminución en los requerimientos totales de L-DOPA. Además, aunque exista neurodegeneración pueden estimular los receptores postsinápticos intactos (Factor 2008; Boll et al. 2011; Pagonabarraga y Kulisevsky 2014). Todos los agonistas han mostrado ser eficaces sobre los síntomas motores, tanto en monoterapia en fases iniciales, como combinados en fases medias y avanzadas, aunque el beneficio motor es mayor en combinación con L-DOPA. Sin embargo, no se han observado resultados positivos en los estudios que analizaron el posible efecto neuroprotector de este grupo farmacológico (Pagonabarraga y Kulisevsky 2014). Actualmente, se están diseñando diferentes formulaciones de agonistas dopaminérgicos que permitan una liberación prolongada para mantener una concentración plasmática estable: ropinirol de liberación prolongada, pramipexol retardado, parches transdérmicos de rotigotina y apomorfina subcutánea (Arbelo y Malo 2011; Sprenger y Poewe 2013). El principal inconveniente de los agonistas dopaminérgicos es el amplio espectro de efectos secundarios asociados. Además de los efectos gastrointestinales, los agonistas dopaminérgicos presentan efectos 39 INTRODUCCIÓN secundarios sistémicos (edemas en extremidades, hipersomnolencia diurna e hipotensión ortostática) y de la esfera neuropsiquiátrica (alucinaciones, ideación delirante y agitación psicomotriz), que pueden ser graves, discapacitantes e incluso perdurar tras la retirada del tratamiento (Factor 2008; Pagonabarraga y Kulisevsky 2014). 1.2.3.3. Inhibidores de la catecol-O-metiltransferasa (ICOMT) La L-DOPA es metabolizada en la periferia principalmente por la DDC y la COMT. Cuando la DDC es inhibida por la administración conjunta de L-DOPA con benserazida o carbidopa, el papel de la Ometilación es más importante. La COMT inactiva tanto a la L-DOPA como a la dopamina en el SNC, mientras que la inactivación periférica de la COMT incrementa la vida media periférica de la L-DOPA (Oertel et al. 2006; Mendoza y Duarte 2009). Los ICOMT bloquean la conversión periférica de la L-DOPA en 3-Ometildopa, lo que conlleva a un aumento de la disponibilidad sináptica de la L-DOPA y permite que esta mantenga su funcionalidad durante más tiempo (Factor 2008; Pagonabarraga y Kulisevsky 2014). Los ICOMT incrementan la concentración máxima alcanzada por cada toma de L-DOPA por lo que se reduce el riesgo de aumentar las discinesias de pico de dosis. Los ICOMT que se han utilizado en la práctica clínica son la tolcapona y la entacapona, presentando una mayor capacidad de atravesar la barrera hematoencefálica la tolcapona (Castro y Campos 2009; Mendoza y Duarte 2009; Pagonabarraga y Kulisevsky 2014). Estos compuestos están indicados para el tratamiento de las fluctuaciones motoras de la EP. 40 INTRODUCCIÓN La tolcapona por su mayor capacidad de atravesar la barrera hematoencefálica ha resultado ser más eficaz. Sin embargo, su utilización se ha limitado debido a la hepatotoxicidad que genera, su uso fue suspendido desde 1998 a 2009 (Factor 2008; Mendoza y Duarte 2009; Gazewood et al. 2013). Ambos ICOMT se han mostrado eficaces para disminuir las complicaciones asociadas al uso de la L-DOPA. Sin embargo, en estudios clínicos no pudo demostrarse un beneficio preventivo sobre las fluctuaciones motoras al incluir entacopna en el tratamiento con L-DOPA y carbidopa. Por tanto, los ICOMT se limitan al tratamiento de las fluctuaciones motoras (Castro y Campos 2009; Mendoza y Duarte 2009; Pagonabarraga y Kulisevsky 2014). 1.2.3.4. Inhibidores de la monoamino oxidasa B (IMAO-B) La dopamina es metabolizada por ambas isoformas de la MAO, pero se ha centrado la atención en los inhibidores de la isoforma B como agentes terapéuticos, ya que es la isoforma predominante en los ganglios basales en humanos y sus niveles se encuentran incrementados en pacientes con EP (Riederer et al. 2007; Factor 2008; López y Linazasoro 2009). Los IMAO-B impiden la oxidación de la dopamina incrementando la biodisponibilidad de dopamina en el SNC. La MAO-B controla tanto la concentración intraneuronal de dopamina libre como sus reservorios citoplasmáticos. Dentro de los IMAO-B utilizados en clínica para la EP encontramos la selegilina y la rasagilina. Un tercer compuesto de este grupo, la safinamida, aún se encuentra en fase III de ensayos clínicos (Riederer et al. 2007; López y Linazasoro 2009; Puy-Núñez y CebriánPérez 2012). 41 INTRODUCCIÓN La selegilina demostró un efecto sintomático sobre la clínica motora de la EP, tanto en pacientes iniciales administrada en monoterapia como en pacientes avanzados. La principal problemática de la selegilina es que se metaboliza a derivados anfetamínicos, por lo que se asocia con insomnio y trastornos conductuales (Olanow et al. 2009a; Pagonabarraga y Kulisevsky 2014). En cuanto a las recomendaciones con respecto a la selegilina, se considera que retrasa la incapacidad asociada a la fase precoz no tratada de la EP, pero aún no se ha determinado el mecanismo exacto por el cual lo hace (efecto neuroprotector, sintomático o ambos). La selegilina permite retrasar la introducción de L-DOPA en la EP inicial y presenta una eficacia leve-moderada sobre la clínica de la EP (López y Linazasoro 2009). Por otra parte, la rasagilina es un inhibidor selectivo e irreversible de la MAO-B. Esta pertenece a la familia de las propalgilaminas (siendo la más potente) y a diferencia de la selegilina no se metaboliza a derivados anfetaminínicos, además de presentar una mayor potencia y selectividad. El principal metabolito de la rasagilina es el aminoindano, que presenta capacidades antiparkinsonianas y neuroprotectoras por sí mismo. El efecto neuroprotector de la rasagilina parece asociarse al aminoindano que actúa a nivel de la permeabilidad mitocondrial y de la gliceraldehído-3fosfato deshidrogenasa (GAPDH) (Olanow et al. 2009b; López y Linazasoro 2009; Hickey y Stacy 2011; Pagonabarraga y Kulisevsky 2014). La rasagilina ha mostrado ser un compuesto eficaz en el manejo motor de la EP, tanto en monoterapia como en combinación con otros compuestos antiparkinsonianos (López y Linazasoro 2009; Boll et al. 2011; Pagonabarraga y Kulisevsky 2014). 42 INTRODUCCIÓN Una de las características destacables de la rasagilina es que es el único fármaco que ha demostrado un efecto modificador del curso evolutivo de la EP en dos ensayos clínicos, lo que ha generado nuevamente interés en este grupo farmacológico. Además, en algún ensayo se han observado mejorías cognitivas (atención mantenida, fluencia verbal y memoria de trabajo) (López y Linazasoro 2009; Boll et al. 2011; Hickey y Stacy 2011; Katzenschlager 2014). También se ha asociado con actividad antiapoptótica (Olanow y Schapira 2013). Por último, la safinamida es un nuevo IMAO que además de la inhibición enzimática produce inhibición de la recaptación de dopamina, bloquea los canales de sodio e inhibe la liberación de glutamato. Por estas características se considera que podría presentar efecto neuroprotector y efecto sobre las discinesias inducidas por L-DOPA (Olanow et al. 2009a; Boll et al. 2011; Hickey y Stacy 2011; Barbosa y Bossoni 2014). Las características que diferencian a la safinamida de la selegilina y la rasagilina son: es más selectiva para la MAO-B que ambas y su acción es reversible. Por tanto, en un principio, se puede considerar un fármaco más seguro que los otros en cuanto a los efectos secundarios de la inhibición de la MAO-B. Los últimos estudios muestran que la safinamida tiene efecto antiparkinsoniano, presenta buena tolerancia y mejora las discinesias inducidas por L-DOPA. Su efecto neuroprotector requiere más estudios (Barbosa y Bossoni 2014). Es necesario tener en cuenta que la limitada eficacia sintomática de la selegilina y la rasagilina en monoterapia se encuentra relacionada con el hecho de que los IMAO-B son dependientes de la dopamina endógena, que progresivamente disminuye con el transcurso de la patología (Riederer et al. 2007). 43 INTRODUCCIÓN 1.2.3.5. Anticolinérgicos Los compuestos anticolinérgicos fueron el primer tratamiento eficaz para la EP, pero dejaron de utilizarse tras la entrada de los agonistas dopaminérgicos y la L-DOPA. Actualmente, los fármacos anticolinérgicos se consideran marginales en el tratamiento de la EP y no se recomienda su uso salvo en casos excepcionales de temblor intenso resistente a otros tratamientos. Aunque pueden resultar clínicamente útiles en el tratamiento sintomático, el balance beneficios/efectos secundarios es generalmente desfavorable (Cubo y Burguera 2009; Olanow et al. 2009a; Puy-Núñez y Cebrián-Pérez 2012; Gazewood et al. 2013). Aún no se conoce el mecanismo exacto de los anticolinérgicos. Se ha postulado que en los ganglios basales existe un balance entre dopamina y acetilcolina, observándose que los compuestos colinérgicos incrementan la sintomatología parkinsoniana. De este modo, se considera que la principal acción de los anticolinérgicos es corregir el desequilibrio entre la actividad colinérgica y dopaminérgica en el núcleo estriado de pacientes con EP (Cubo y Burguera 2009; Olanow et al. 2009a). Los anticolinérgicos utilizados en la EP actúan sobre receptores muscarínicos, destacando: trihexifenidilo, benzatropina, orfenadrina, prociclidina y biperideno (Cubo y Burguera 2009; Olanow et al. 2009a). 1.2.3.6. Amantadina La amantadina es un fármaco antiviral con efecto sintomático sobre la EP. Inicialmente comercializado como antiviral, su acción antiparkinsoniana fue descubierta de forma accidental al ser administrado como antiviral en un paciente que presentaba la EP (Burguera y Cubo 2009; Boll et al. 2011; Puy-Núñez y Cebrián-Pérez 2012). 44 INTRODUCCIÓN La amantadina presenta un mecanismo de acción complejo con las siguientes capacidades: anticolinérgica, podrodopaminérgica y antiglutamatérgica. Por medio de la inhibición de la recaptación de dopamina la amantadina incrementa los niveles estriatales de dopamina. Además, es antagonista no competitivo de los receptores NMDA, mecanismo por el cual se considera que puede actuar sobre las discinesias inducidas por L-DOPA (Burguera y Cubo 2009; Pagonabarraga y Kulisevsky 2014). Con respecto a su eficacia clínica se ha observado una mejoría significativa con respecto al temblor, rigidez y bradicinesia en las fases iniciales, así como el control de las discinesias en terapias combinadas. Se considera que puede resultar eficaz tanto en monoterapia como coadyuvante en el control de las complicaciones motoras, produciendo una disminución de las discinesias relacionadas con L-DOPA (Burguera y Cubo 2009; Boll et al. 2011; Sprenger y Poewe 2013; Pagonabarraga y Kulisevsky 2014). También se ha postulado que podría presentar efecto neuroprotector por su actividad de antagonista NMDA, protegiendo a las neuronas dopaminérgicas de la excitotoxicidad (Olanow et al. 2009a; Boll et al. 2011). 45 INTRODUCCIÓN Algunos de los efectos adversos que presenta son: confusión, alucinaciones visuales, retención de orina, sequedad bucal y estreñimiento, entre otros (Burguera y Cubo 2009; Pagonabarraga y Kulisevsky 2014). Figura 1.12: Representación esquemática del modo de acción de los principales compuestos antiparkinsonianos: inhibidores de la catecol-o-metiltransferasa (ICOMT), inhibidores de la dopa-descarboxilasa (IDDC), L-DOPA, amantadina, anticolinérgicos, agonistas dopaminérgicos e inhibidores de la monoamino oxidasa B (IMAO-B) (Conolly y Lang 2014). 1.2.3.7. Otros agentes farmacológicos Otros agentes farmacológicos que intervienen en la neuroquímica cerebral son: zonisamida, anticolinesterásicos y antagonistas A2A de adenosina. Además, existe un gran número de sustancias que se están investigando y que podrían ser útiles para el manejo de la EP (Boll et al. 2011; Hickey y Stacy 2011). La zonisamida, derivado del benzisoxasol, es un compuesto antiepiléptico que desde el año 2009 se comenzó a estudiar para el 46 INTRODUCCIÓN tratamiento motor de la EP (Murata 2010; Boll et al. 2011; Puy-Núñez y Cebrián-Pérez 2012). Este compuesto presenta diversos modos de acción como antiparkinsoniano: activación de la síntesis de dopamina, inhibición de la MAO, inhibición de los canales de calcio tipo T e inhibición de la vía indirecta en los ganglios basales a través de receptores opioides. Además, se considera que puede tener efectos neuroprotectores (Murata 2010; Boll et al. 2011; Puy-Núñez y Cebrián-Pérez 2012). Los fármacos anticolinesterásicos se utilizan en la EP para el tratamiento de los síntomas cognitivos y conductuales. Su utilización se basa en que la EP con demencia presenta un déficit colinérgico. Los anticolinesterásicos comercializados en España son: donepezilo, rivastigmina y galantamina (Rivera y González 2007; Pascual-Sedano y Kulisevsky 2009; Sprenger y Poewe 2013; Gazewood et al. 2013). A pesar de los prometedores resultados que presentan estos compuestos sobre la demencia, existe la preocupación de que la modificación colinérgica por estos compuestos pueda agravar el cuadro motor (Rivera y González 2007; Pascual-Sedano y Kulisevsky 2009). Los antagonistas A2A de adenosina son una de las terapias no dopaminérgicas prometedoras para la EP. De los 4 subtipos de receptores de adenosina, el subtipo A2A se encuentra en altas concentraciones en los ganglios basales y puede influir en la acetilcolina, el GABA y la dopamina. El antagonismo de estos receptores facilita la liberación intraestriatal de GABA, reduciendo la hiperactividad estriadopalidal. Esta reducción ayuda a incrementar la salida inhibitoria desde el estriado al globo pálido, reestableciendo el balance de salida de los ganglios basales (Factor 2008; Olanow et al. 2009a; Hickey y Stacy 2011). 47 INTRODUCCIÓN El antagonista que más se ha estudiado en ensayos clínicos es la istradefilina, aunque también ha comenzado a estudiarse el preladenant y en fase preclínica se encuentra el vipadenent (Olanow et al. 2009a; Boll et al. 2011; Hickey y Stacy 2011). Además de un efecto sintomatológico también se postula un efecto neuroprotector mediante la modulación de glutamato y aspartato (Boll et al. 2011; Hickey y Stacy 2011). En la Figura 1.13 se muestra el algoritmo de tratamiento de la EP expuesto en la Guía oficial de práctica clínica en la enfermedad de Parkinson de la Sociedad Española de Neurología. 48 INTRODUCCIÓN Figura 1.13: Algoritmo de tratamiento para la EP (Martínez y Mir 2009). 49 INTRODUCCIÓN En cuanto a las recomendaciones y consideraciones sobre la terapéutica de la EP, que se establecen en la Guía oficial de práctica clínica en la enfermedad de Parkinson de la Sociedad Española de Neurología, podemos destacar: No existe un fármaco de primera elección para la EP, depende de las manifestaciones clínicas, estilo de vida y preferencias del paciente. Cuando se va a comenzar el tratamiento dopaminérgico se recomienda emplear L-DOPA (en la dosis más baja que resulte efectiva) en pacientes con afectación moderada-grave y pacientes mayores de 70 años. La evidencia científica indica que aún no se dispone de ningún tratamiento neuroprotector y que no está justificado retrasar el tratamiento con fármacos dopaminérgicos, ya que no se ha relacionado con una peor evolución (Martínez y Mir 2009). Las medicaciones que se están investigando en los últimos años son: diversas formulaciones de L-DOPA para la mejora de síntomas motores, antagonistas de adenosina A2A e inhibidores de la MAO-B tanto para mejora sintomatológica como por su potencial neuroprotector (Hickey y Stacy 2011). 50 INTRODUCCIÓN 1.3. ISATINA 1.3.1. Antecedentes históricos La isatina fue descubierta en 1841 por Erdmann y Laurent como producto de la oxidación del índigo por medio de ácido nítrico y crómico. A partir de este momento se produjo una incipiente investigación científica sobre este compuesto y sus derivados. Sin embargo, hasta 1940 no fue aislada biológicamente, año en el que Böhm notificó la presencia de isatina en orina de conejos que habían sido alimentados con ácido onitrofenilglioxílico (Sumpter 1943; Medvedev et al. 1996; Silva et al. 2001). En 1980 Glover et al. describieron en orina humana la presencia de un compuesto endógeno con capacidad inhibitoria de la MAO denominado tribulina. Posteriormente, por medio de cromatografía de gases y espectrometría de masas descubrieron que el principal constituyente de la tribulina, descrita previamente, se correspondía con la isatina. Este fue el primer reporte de la presencia de isatina endógena en animales, encontrándose en estado natural en orina humana, además de en cerebro y corazón de rata (Glover et al. 1988; Halket et al. 1991). Inicialmente, la tribulina era considerada un factor biológico con capacidad inhibitoria de la MAO, aunque actualmente existe cierta controversia sobre el concepto de tribulina: algunos autores lo consideran un marcador endógeno de estrés y ansiedad, mientras que otros investigadores consideran la propia tribulina como un factor biológico de importancia por sí mismo (Medvedev y Glover 2004). La bibliografía más reciente clasifica a la tribulina como una familia de sustancias endógenas no peptídicas que inhiben a la MAO y se unen a receptores de benzodiacepinas. De este modo, se distinguen diferentes 51 INTRODUCCIÓN tipos de tribulina: tribulina A (inhibe la MAO-A), tribulina B (inhibe la MAO-B) y tribulinas BZ (inhiben los receptores de benzodiacepinas centrales y periféricas). La isatina es el principal componente de la tribulina con capacidad inhibitoria de la MAO-B, aunque se considera que se trata de una sustancia independiente (Hamaue et al. 1990a; Pang et al. 1996; Medvedev y Glover 2004). Algunos autores indican que la tribulina es la isatina, haciendo referencia indistinta a ambas (Glover et al. 1988). En otros estudios se ha correlacionado el incremento de isatina con el incremento de tribulina (Jarman et al. 1991; Glover y Sandler 1993), mientras que en otras experimentaciones se cuantifica de forma independiente la actividad de la tribulina y de la isatina, observándose que existen variaciones independientes de ambas (Bhattacharya et al. 1991a; Doyle et al. 1996; Glover y Sandler 1993). En orina se han constatado otros compuestos con acción inhibitoria sobre la MAO-B independientes a la isatina (Pang et al. 1996). Desde su descubrimiento y por la versatilidad sintética que presenta, la isatina y sus derivados han sido ampliamente estudiados debido a sus propiedades biológicas y farmacológicas (Silva et al. 2001; Medvedev et al. 2007; Semwal et al. 2010; Bhrigu et al. 2010; Raj 2012; Mathur y Nain 2014; Rao et al. 2014). Por su importancia a lo largo de la historia, se han desarrollado diversos métodos para su cuantificación y se sigue trabajando en este campo (Mawatari et al. 2001; Han 2010). 1.3.2. Propiedades físico-químicas de la isatina La isatina (indol-2,3-diona) es un indol que presenta como fórmula química C8H5NO2 y un peso molecular de 147,13 g/mol. Tiene una coloración amarillenta brillante y se disuelve fácilmente en agua y disolventes orgánicos (Sumpter 1943; Hamaue et al. 1999a; Baluja et al. 52 INTRODUCCIÓN 2013). Las principales características físico-químicas de la isatina se resumen en la Tabla 1.2. ESTRUCTURA QUÍMICA Peso molecular 147,13 g/mol Fórmula química C8H5NO2 Nombre IUPAC 1H-indol-2,3-diona Clasificación Indol Estado físico Sólido Solubilidad en agua 2 g/l (20ºC) Coloración Amarillenta Olor Inodoro Temperatura ignición 220ºC Punto de fusión 193-195ºC Punto de inflamación 200ºC Densidad aparente 600 kg/m3 Tabla 1.2: Principales características físico-químicas de la isatina. En cuanto a la información toxicológica, la dosis letal mínima publicada en rata es de 5 000 mg/ kg. No ha mostrado irritabilidad cutánea ni ocular en conejo. 1.3.3. Localización de la isatina La determinación de isatina en tejido ha mostrado que la distribución de esta presenta diferente concentración en diversos órganos. En ratas en estado fisiológico la concentración de isatina en sangre puede exceder 1 53 INTRODUCCIÓN µM. En el cerebro de rata las regiones que presentan mayor concentración son: núcleos hipotalámicos y corteza cerebral (1,3 µM), hipocampo y cerebelo (1,2 µM) y núcleo estriado (1 µM). En los órganos periféricos la mayor concentración de isatina se ubica en las vesículas seminales y vasos deferentes (47,9-79 µM), aunque también se puede encontrar isatina en: corazón (3 µM), hígado (1,5 µM), pulmón (1,2 µM), así como en otros órganos como bazo y riñón (Medvedev et al. 2007). En los estudios por medio de radioligando ([3H]isatina) se observó que la estructura cerebral por la cual la isatina presentó mayor afinidad en rata era el hipotálamo, lo que concuerda con las variaciones de isatina en condiciones de estrés y ansiedad (Figura 1.14). Otras estructuras por las cuales mostró afinidad la isatina fueron: corteza, hipocampo, tálamo, estriado, núcleo arqueado y plexo coroideo (Crumeyrolle-Arias et al. 2003; Medvedev et al. 2005; Crumeyrolle-Arias et al. 2009). La administración de pargilina (un IMAO no selectivo) produjo una disminución de la unión de isatina en las estructuras citadas previamente, pero no una abolición absoluta de la unión de isatina, lo que pone en manifiesto que la isatina interactúa con otros elementos además de la MAO (Crumeyrolle-Arias et al. 2003; Crumeyrolle-Arias et al. 2009). Figura 1.14: Autorradiograma donde se muestran los sitios de unión de la [3H]isatina, donde se puede observar en color rojo una elevada afinidad por el hipotálamo, aunque presenta una amplia distribución de los sitios de unión concordante múltiples con sus actividades (Crumeyrolle-Arias et al. 2009). 54 INTRODUCCIÓN A pesar de que las proteínas a las que se une la isatina en el cerebro de ratón y rata son similares, solo un pequeño porcentaje son idénticas, lo que en parte explicaría los diferentes los efectos de la administración de isatina en ambas especies (Buneeva et al. 2010). Como se ha descrito previamente, la diversa y discontinua distribución de la isatina sugiere que realiza diversas funciones tanto a nivel central como periférico (Glover et al. 1998). 1.3.4. Metabolismo de la isatina Actualmente, se desconocen las vías y las enzimas que intervienen en la formación de isatina endógena. Existen evidencias in vitro de que la isatina puede formarse a partir del indol, producido por el catabolismo a nivel intestinal, donde se encuentra involucrado el citocromo P450. Se ha sugerido que el triptófano incluido en la dieta puede ser convertido en indol por la flora intestinal, para ser transportado al hígado donde es oxidado; a su vez, la isatina puede ser degradada originando diversos metabolitos (Figura 1.15) (Hamaue et al. 1999a; Medvedev et al. 2007). 55 INTRODUCCIÓN Figura 1.15: Representación esquemática de la formación de isatina a partir de indol y su degradación a ácido antranílico, 3-hidroxi-2-oxoindol e indirrubina (Medvedev et al. 2007). En bacterias se ha evidenciado la formación de isatina a partir de un metabolito oxidativo del triptófano (ácido-3-indolacético), y su degradación dando lugar al ácido antranílico (Jensen et al. 1995). El catabolismo de la isatina in vitro se puede realizar por medio de las vías de la oxidasa y de la reductasa (Figura 1.15). La reducción de isatina produce como resultado 3-hidroxi-2-oxindol. La oxidación de isatina da como resultado el ácido antranílico. La dimerización de la isatina da lugar a la indirrubina. Los metabolitos de la isatina se han encontrado en orina (Medvedev y Glover 2004; Medvedev et al. 2007). La importancia de la flora intestinal en la secreción de isatina urinaria se ha puesto en evidencia mediante el estudio de ratas normales y ratas axénicas (libres de gérmenes). En estas últimas, la secreción de isatina en orina era 50 veces menor que en las normales, aunque los niveles de 56 INTRODUCCIÓN isatina en tejido no presentaban diferencias significativas (Hamaue et al. 1999a; Medvedev et al. 2007). Tras observar que las ratas axénicas producían menos isatina en orina, mientras que la isatina cerebral no presentaba alteraciones, Sandier et al. (1991) postulan que la isatina secretada en orina y la presente en tejido podrían tener un origen diferente u otra ruta biosintética. Por otra parte, se ha observado un incremento de la concentración de isatina en diversas regiones tras someter los animales de experimentación a estrés agudo. La determinación en tejido ha mostrado que existe una diferencia significativa en la concentración de isatina entre ratas macho y hembra. La exposición a estrés agudo indujo un incremento de isatina a nivel de corazón, sangre y cerebro en el caso de los machos, mientras que en las hembras no se produjo incremento a nivel cerebral. Este hecho constata que la regulación de la isatina a nivel central puede diferir de la regulación periférica, aunque se necesita más investigación (Tozawa et al. 1998; Igosheva et al. 2004). Para generar una condición de estrés, Tozawa et al. (1998) utilizaron la privación alimenticia y la exposición al frío en roedores. Ambos tipos de agentes estresantes incrementaron los niveles de isatina en orina en 24 horas. Estos autores proponen una regulación central de la isatina por medio de células liberadoras de corticotropina y neuronas noradrenérgicas. Los resultados obtenidos mostraron que el pretatamiento con glucocorticoides y α-metil-p-tirosina disminuye la secreción úrica de isatina: el primero indica una generación de la isatina involucrando a la corticotropina y el segundo hace referencia a la disminución de la acción de la TH lo que hace que se libere menos isatina. Igosheva et al. (2004) observaron que la exposición de roedores a estrés mediante inmovilización y estimulación auditiva incrementaba los 57 INTRODUCCIÓN niveles de isatina en sangre y en corazón. Sin embargo, bajo este modelo de estrés no se observó modificación en los niveles cerebrales, lo que sugiere posibles mecanismos de regulación periférica y central diferentes. Además, las variaciones fueron diferentes entre ambos géneros, siendo mayor el incremento en los machos. Igualmente, los autores señalan que se desconoce el mecanismo por el cual se libera/produce isatina ante situaciones de estrés. Se sugiere que el aumento de isatina podría estar mediado por neuronas liberadoras de corticotropina y neuronas noradrenérgicas o por la estimulación periférica de receptores serotonérgicos (Igosheva et al. 2004). En conejos se ha observado que la administración de agentes ansiogénicos y proconvulsivantes producía un incremento de isatina a nivel cerebral, sin observarse variaciones en los niveles de isatina en hígado. Lo que lleva a los autores a postular que la isatina podría mediar la epilepsia y la ansiedad (Clow et al. 1989). Por otra parte, se ha observado un incremento de isatina cerebral tras someter a ratas a convulsiones por medio de electroshock, observándose un incremento de tipo estímulo-dependiente: cuanto más elevado era el shock provocado mayor era el incremento de isatina (Bhattacharya et al. 1991b). Existen pocos estudios sobre la isatina en humanos. Destaca el incremento de isatina observado en líquido céfalo-raquídeo en pacientes con bulimia nerviosa, lo que se corrobora con los estudios anteriormente expuestos sobre el posible papel en la regulación de la ansiedad, ingesta alimenticia y balance de agua. Sin embargo, los autores no pueden determinar si el incremento de isatina es causa o efecto de la bulimia nerviosa (Brewerton et al. 1995). 58 INTRODUCCIÓN En estudiantes se observó que los niveles de isatina en orina no se correlacionaban con los niveles de cortisol secretado ante el estrés generado por la realización de una exposición oral (Doyle et al. 1996). En pacientes diagnosticados con migraña se observó una tendencia a incrementar los niveles de isatina en orina durante los ataques de migraña, pero los cambios observados no fueron significativos. En este caso, los niveles de tribulina se correlacionaron con los niveles de isatina (Jarman et al. 1991). Pandey et al. (2002) midieron los niveles de isatina y cortisol en plasma en pacientes embarazadas. Los niveles de isatina eran mayores que en los casos control de mujeres no embarazadas. Las pacientes embarazadas con ansiedad maternal y estrés obstétrico mostraron niveles sanguíneos de isatina y cortisol más elevados, con respecto a las pacientes embarazadas con embarazos normales. Los autores postulan a la isatina como un biomarcador de estrés y ansiedad. La secreción de isatina en orina ante situaciones de estrés podría estar mediada por receptores serotoninérgicos 5-HT2A/2C. Los agonistas de estos receptores incrementan la secreción de isatina en orina en ratas. Para esta respuesta se considera que los agonistas serotoninérgicos producen una reacción similar a la del estrés, involucrando la activación de células corticotropas hipotalámicas y el sistema nervioso simpático. Como origen de la vía biosintética se propone que la isatina es un derivado del triptófano, cuya metabolización se vea incrementada por agentes estresantes produciendo metabolitos oxidativos como la isatina (Tozawa et al. 1999). Atendiendo a lo anteriormente expuesto, podemos resumir que un incremento de isatina se ha observado en diversas condiciones 59 INTRODUCCIÓN neuropatológicas como: estrés, ansiedad, bulimia nerviosa, epilepsia y EP. Aunque su vía metabólica no se ha dilucidado. 1.3.5. Actividad de la isatina sobre la neurotransmisión dopaminérgica A pesar de que la isatina fue descubierta por Glover en el año 1980 como principal componente de la tribulina en orina humana, no se obtuvieron datos objetivos acerca de las variaciones que producía en niveles de neurotransmisores hasta el año 1996 por Hamaue y su equipo (Glover et al. 1988; Hamaue et al. 1999a). La isatina destaca por su capacidad de inhibir la MAO, aunque a elevadas concentraciones también puede influir sobre otras enzimas (Medvedev y Glover 2004; Minami et al. 2006). Publicaciones recientes indican que las principales dianas de la isatina son la guanilato-ciclasa del receptor del péptido natriurético, la guanilato-ciclasa estimulada por óxido nítrico soluble y la MAO-B (Buneeva et al. 2010). Unos estudios in vitro demostraron que la actividad más potente de la isatina es la inhibición de la MAO-B con una concentración inhibitoria (IC50) de 3 µM (Glover et al. 1988). Otros estudios in vitro mostraron que una concentración de 10-4 M producía una inhibición de la MAO del 93% (Hamaue et al. 1999b). La unión de la isatina a la MAO-B humana se describe del siguiente modo: competitiva, estrecha, reversible y no covalente. La constante de inhibición (Ki) es aproximadamente de 3 µM. El grupo 2-oxo de la isatina se une a la enzima por medio de puentes de hidrógeno al pirrol NH, el balance de las interacciones de unión involucra diversos enlaces de van der Waals entre el anillo de la isatina y los residuos aminoacídicos de la cavidad del sustrato. Aunque también se ha observado que presenta 60 INTRODUCCIÓN capacidad inhibitoria sobre la MAO-A, pero su potencia es inferior que sobre la MAO-B (Ki = 15 µM) (Binda et al. 2003; Crumeyrolle-Arias et al. 2003; Manley et al. 2011). La isatina tiene la capacidad de atravesar la barrera hematoencefálica y se ha observado que el transporte al interior de algunos tipos celulares se puede realizar de forma activa por medio del transportador de serotonina, aunque también podría introducirse de forma pasiva (Medvedev et al. 2002; Xu et al. 2006). La administración de isatina 100 mg/kg i.p. resulta en una concentración cerebral de 120 µM en ratas (Igosheva et al. 2005). Se ha observado que la administración intraestriatal de isatina (10-6 y 10-4 M) en ratas Wistar producía un incremento significativo de los niveles extracelulares de dopamina y acetilcolina, siendo mucho mayor el incremento de dopamina que el de acetilcolina. También se observó que la administración intraperitoneal de isatina (50-200 mg/kg) incrementaba los niveles estriatales de dopamina y acetilcolina tras dos horas de su administración (Hamaue et al. 1999b). Del mismo modo, se han evaluado los efectos de la administración de isatina sobre diversos modelos experimentales de la EP como el modelo de reserpina y el de 6-hidroxidopamina (6-OHDA). Sin embargo, el modelo de Parkinson sobre el que se han realizado más estudios es sobre el modelo del virus de la encefalitis japonesa (VEJ) (Zhou et al. 2001; Hamue et al. 2004; Minami et al. 2006; Xu et al. 2006). Los estudios realizados por Hamaue et al. (2004) demuestran que la administración i.p. de isatina (100 mg/kg por día durante una semana) produce un incremento de dopamina estriatal en ratas parkinsonizadas con el VEJ. Del mismo modo, han observado que en el modelo experimental estudiado se producía un incremento de la tasa de conversión de dopamina 61 INTRODUCCIÓN en DOPAC en el estriado (relación DOPAC/DA) que era revertida a niveles basales con la administración de isatina, lo que no se observó con la administración de selegilina. Ante estos resultados, los autores sugieren que la isatina administrada exógenamente produjo mejoría en el parkinsonismo inducido por el VEJ, por medio del incremento de la concentración de dopamina en el estriado. Igualmente, Ogata et al. (2003), mediante la misma metodología (administrando 100 mg/kg i.p. en ratas parkinsonizadas con el VEJ), han observado que la isatina incrementó los niveles de dopamina en las ratas parkinsonizadas aunque no observaron modificaciones en el análisis neuropatológico (pérdida neuronal y gliosis). Estos hallazgos coinciden con los obtenidos por Xu et al. (2006), que también observaron que la administración intraperitoneal de isatina produjo un incremento de los niveles de dopamina en ratas reserpinizadas. En este caso se administró isatina de forma sistémica en una dosis de 100 mg/kg durante 4 días. La cuantificación de dopamina y sus metabolitos se realizó por medio de microdiálisis cerebral. Estos autores también indicaron que la isatina probablemente ejercía un efecto preventivo y terapéutico en la EP y que podría un compuesto con baja toxicidad de origen endógeno. Sin embargo, en la literatura científica podemos encontrar resultados contradictorios. Zhou et al. (2001) observaron que la administración de isatina (100 mg/kg i.p.) no producía modificaciones en los niveles de dopamina ni de sus metabolitos en ratas parkinsonizadas con 6-OHDA, mientras que sí mejoraba las alteraciones motrices observadas en dichos animales producidas por apomorfina. Estos hallazgos ligados a la determinación de un incremento de los niveles de serotonina, sin variaciones de su principal metabolito, llevan a concluir a estos autores 62 INTRODUCCIÓN que los efectos de la isatina sobre los niveles de dopamina in vivo parecen ser complejos y contradictorios, el mecanismo subyacente es incierto y no está claro el papel que juega la inhibición de la MAO. Además, proponen otros mecanismos que no involucran la inhibición MAO, como la liberación de catecolaminas por medio de la acción sobre los receptores de péptido natriurético atrial. La administración crónica por vía oral (200 mg/kg durante 4 semanas) de isatina incrementa la presión sanguínea en roedores, así como los niveles de catecolaminas en orina (noradrenalina y dopamina) y de serotonina a nivel hepático. Este incremento de la presión sanguínea se ha asociado a su capacidad de inhibir la MAO y de incrementar los niveles de monoaminas (Hamanue et al. 1996). Se ha observado que la isatina presenta diversas dianas en común con la selegilina, es decir, que presenta un comportamiento agonista parcial de la misma. La administración i.p. de 20 mg/kg de isatina en ratones produce modificaciones en la expresión génica en corteza de ratones similares a las modificaciones presentadas por la selegilina. Tanto en el caso de la isatina como de la selegilina no se encontraron diferencias en la expresión de ambas isoformas de la MAO (Fedchenko et al. 2008). Se ha observado que la isatina disminuye la actividad de la MAO-B e incrementa la de la superóxido dismutasa y glutatión peroxidasa en ratones parkinsonizados con MPTP, por lo que su posible actividad neuroprotectora podría derivar de estos mecanismos (Fang y Wang 2008). Zhang et al. (2011a) observaron que la isatina protegía a las células dopaminérgicas en cultivo de la exposición a H2O2. Los mecanismos que observaron para esta protección fueron: mitigación de la disfunción de la membrana mitocondrial y descenso de los niveles de calcio libre intracelular. 63 INTRODUCCIÓN El pretratamiento intraperitoneal de isatina en ratones expuestos a MPTP disminuye la expresión de proteínas Bax (que pertenecen a la familia de genes Bcl-2 y está involucrada en la apoptosis de las neuronas dopaminérgicas de la sustancia negra). De esta manera, la administración de isatina a ratones tratados con MPTP redujo de forma significativa la expresión de esta proteína, que había aumentado tras la administración de MPTP, lo que ha llevado a postular la isatina como un compuesto protector contra la toxicidad inducida por MPTP (Zhang et al. 2011b). 1.3.6. Relación entre la isatina y la enfermedad de Parkinson Existe una estrecha relación entre los niveles de isatina en orina y el grado de afectación de la EP. Entre los grados III y V (según los criterios propuestos por Hoehn y Yahr de 1967) se observa un incremento significativo de los niveles de isatina en orina; así como una tendencia a decrecer en pacientes en grado I con tratamiento en comparación con los que no recibieron tratamiento. Los niveles de isatina en orina pueden ser utilizados como un marcador endógeno de la severidad clínica de la EP (Hamaue et al. 2000). Actualmente, se desconoce la causa que provoca el incremento de isatina en la EP, aunque se postula que puede ser debido al estrés causado por la enfermedad o como mecanismo compensatorio en respuesta a los bajos niveles de la dopamina cerebral (Hamaue et al. 1999a; Minami et al. 2006). En diversos modelos experimentales de la EP en roedores se ha observado una mejoría de las alteraciones motrices tras la administración sistémica de isatina. De este modo se ha descrito: disminución de la bradicinesia inducida por el VEJ (Hamaue et al. 2004), reducción de la conducta rotacional en ratas expuestas a apomorfina tras lesión neuronal 64 INTRODUCCIÓN con 6-OHDA (Zhou et al. 2001) y recuperación de las alteraciones motrices inducidas por la reserpina (Xu et al. 2006). Además de actuar sobre otras proteínas, la isatina actúa sobre la GAPDH, considerada una posible diana neuroprotectora por su capacidad de interactuar con el citoesqueleto, lo cual resulta de interés en trastornos como la epilepsia, la EP y la demencia senil (Buneeva et al. 2010). La isatina puede funcionar como un compuesto endógeno similar a la selegilina y al igual que esta se puede considerar como un posible compuesto protector en la EP (Glover y Sandler 1993). Estos hallazgos han llevado a diversos autores a plantear el estudio de la isatina como posible factor neuroprotector y compuesto útil en la terapia antiparkinsoniana (Glover et al. 1988; Hamaue et al. 1999a; Ogata et al. 2003; Hamaue et al. 2004; Minami et al. 2006, Xu et al. 2006; Fang y Wang 2008; Buneeva et al. 2010). 1.3.7. Otros efectos biológicos de la isatina La isatina presenta una amplia variedad de efectos biológicos. Los diversos estudios realizados en roedores y primates muestran que su actividad se caracteriza por ser de tipo dosis-dependiente. Inicialmente, se observó en ratas que a dosis elevadas (80-400 mg/kg) presentaba actividad anticonvulsivante, mientras a dosis inferiores (20 mg/kg) es proconvulsivante. Para estas investigaciones se observó que la isatina administrada intraperitonealmente modificaba el efecto de compuestos con capacidad convulsivante. Los autores consideran que el efecto proconvulsivante de la isatina puede ser debido a la inhibición central de los receptores del péptido natriurético atrial y la estimulación de receptores serotonérgicos, en vez de su acción inhibitoria de la MAOB. Por otro lado, el efecto anticonvulsivante en altas dosis de isatina puede 65 INTRODUCCIÓN ser producido por sus propios metabolitos (Bhattacharya y Chakrabarti 1998; Glover et al. 1998). En relación a lo expuesto anteriormente, la administración i.p. de 180 mg/kg de isatina produce una disminución de ataques epilépticos de origen auditivo, así como una inhibición de reflejos posturales. La administración de isatina también produce cambios electroencefalográficos, observándose un incremento de la actividad rítmica episódica (Chocholová y Kolínová 1979). Otros hallazgos electroencefalográficos tras la administración de isatina fueron: disminución y retraso de onda lenta de sueño (sobre todo en fase REM) e incremento de vigilia (Chocholová y Kolínová 1981). En las dosis de 10-20 mg/kg en ratón y rata respectivamente presenta actividad ansiogénica. Estas observaciones se han llevado a cabo en test de campo abierto y de laberinto en ratones y en test de interacción social en ratas, siendo su efecto equiparable al de otro agente ansiogénico establecido (yohimbina) y disminuyendo ambos los efectos de fármacos ansiolíticos (Bhattacharya et al. 1991c; Bhattacharya y Chakrabarti 1998). Resultados similares se observaron en investigaciones en primates. La administración de isatina (20 mg/kg i.m.) produjo modificaciones comportamentales a otro compuesto ansiogénico (pentilenotetrazol). Ambos compuestos incrementaron los niveles de cortisol en sangre y su efecto se vio disminuido por el diazepam. Esto refuerza la idea de que, tanto en roedores como en primates, la isatina en pequeñas dosis induce una respuesta ansiogénica (Palit et al. 1997). Igualmente, la isatina en roedores podría inducir disrupción de la memoria. Se ha propuesto que este efecto es debido a una acción ansiogénica, por antagonizar los receptores serotoninérgicos y del péptido natriurétrico atrial (Satyan et al. 1995). Otros estudios muestran que en 66 INTRODUCCIÓN una dosis de 50 mg/kg i.p. puede inhibir la acción de otros péptidos natriuréticos (el tipo C y el cerebral), causando alteraciones en la memoria (Telegdy et al. 2000). Medvedev et al. (2005) observaron que los efectos ansiogénico y sedativo producidos por las diferentes dosis de isatina podrían ser debidos a que las diferentes concentraciones actuaban de manera diferente sobre los receptores de péptido natriurético tipo A y C: a bajas dosis antagoniza el efecto ansiolítico del tipo A y a altas dosis antagoniza el efecto ansiogénico del tipo C. Por medio de su antagonismo con los péptidos natriuréticos, se ha observado que la administración sistémica de isatina en ratas (5 mg/kg) reduce la hipertermia generada por la administración de dichos péptidos (Pataki et al. 2000). Abel (1995) observó resultados comportamentales diferentes a los expuestos previamente. En este caso, administró a ratas dosis de isatina de 0-160 mg/kg y las sometió a situaciones de estrés mediante el test de natación forzada y el test de campo abierto. El autor describe que la isatina presenta un efecto sedativo/ansiolítico puesto que las ratas manifestaron menor actividad en el test de natación y menor desplazamiento en el test de campo abierto. Esto le llevó a rechazar la hipótesis de que la isatina funciona como un compuesto de alarma en roedores. Hota y Achayra (1994) estudiaron los efectos de la isatina a nivel periférico en diversos modelos animales. Los resultados que obtuvieron fueron: actividad espasmogénica a nivel gastrointestinal (en cobaya, rata y conejo), actividad broncodilatadora, inhibición cardíaca en corazón de rana aislado, hipotensión y depresión respiratoria en perro y efecto antidiurético. 67 INTRODUCCIÓN También se ha observado que la isatina inhibe la ingesta de comida en ratones en una dosis de 25 mg/kg. Esto ha sugerido que la isatina puede ser un modulador endógeno de la ingesta de alimentos, e incluso estar involucrada en la anorexia nerviosa. En este caso, los autores no observaron modificaciones comportamentales en el test de campo abierto. El mecanismo para este efecto saciador puede ser debido al incremento de los niveles de serotonina en el hipotálamo y en el cerebro medio y al incremento de la dopamina por inhibición de la MAO, aunque también puede involucrar otros mecanismos como la inhibición de la acetilcolinesterasa (Morley et al. 1996). Algunos autores han observado que los efectos intracelulares que median la acción de la isatina sobre el péptido natriurético atrial difieren en las células dañadas, mientras que en células intactas su acción es mucho mayor, sugiriendo una regulación de sus efectos por medio de factores intracelulares (Medvedev et al. 2001). Estudios en sinaptosomas de roedores han mostrado que la isatina produce un incremento de ATP. Los autores proponen la existencia de un ciclo regulador previamente desconocido. Por un lado, la isatina produce un incremento de ATP que retrasa la potenciación de la isatina sobre el eje hipotálamo-hipofisario debido a la inhibición del péptido natriurético atrial. El uso posterior de ATP en diversas reacciones metabólicas típicas del estrés promovería la acción de la isatina sobre el péptido natriurético atrial e indirectamente incrementaría la acción del eje hipotálamohipofisario. Este es una hipótesis que requiere mayor validación (Globa et al. 2008). Estudios in vitro muestran que bajas concentraciones de isatina pueden inhibir la guanilato ciclasa activada por NO de plaquetas humanas, 68 INTRODUCCIÓN lo que puede promover diversos mecanismos de estrés (Medvedev et al. 2002; Severina et al. 2011). Las proteínas cerebrales con las que la isatina ha presentado alta afinidad y son homólogas entre diversas especies de mamíferos son: GAPDH, creatina fosfoquinasa, glucógeno fosforilasa y peroxiredoxina (Buneeva et al. 2010). En experimentaciones previas, los mismos autores observaron que, al igual que la selegilina, la isatina podría actuar sobre la piruvato quinasa, una enzima reguladora de la glucólisis, así como un factor regulador de las proteínas citoesqueléticas (Buneeva et al. 2007). El efecto sobre diversas proteínas que actúan sobre la reestructuración citoesquelética podría explicar el posible efecto antiproliferativo y proapoptótico (Buneeva et al. 2010). La evaluación de la isatina como posible compuesto anticancerígeno ha sido investigada por diversos autores y los derivados de la isatina son una interesante línea de investigación de antineoplásicos. El principal mecanismo descrito es la activación de la quinasa regulada por señales extracelulares, provocando apoptosis (Pandeya et al. 2005; Medvedev et al. 2007; Vine et al. 2009). Se ha observado que la isatina inhibe las líneas tumorales de la leucemia promielocítica y las células cancerígenas del neuroblastoma. A partir de la acción que realiza la isatina en estas líneas tumorales y los hallazgos observados en tejidos de mamífero in vivo, se deduce que el efecto de la isatina es dependiente de la concentración y de tiempo de exposición (Cane et al. 2000; Igosheva et al. 2005; Hou et al. 2008; JinLian y Li 2008; Cândido-Bacani et al. 2010; Song et al. 2013). Por su efecto en la inhibición de las enzimas cicloxogenasa-2 (COX2) y óxido nítrico sintasa (NOS) en líneas celulares de macrófagos de 69 INTRODUCCIÓN ratones, se ha postulado como posible agente antiinflamatorio, antitumoral y quimiopreventivo (Matheus et al. 2007). En general, se puede decir que los efectos de la isatina son muy diversos y los mecanismos subyacentes muy complejos. 70 2 JUSTIFICACIÓN Y OBJETIVOS Efectos de la isatina sobre la neurotransmisión dopaminérgica en el núcleo estriado. Un estudio in vivo mediante microdiálisis cerebral. JUSTIFICACIÓN Y OBJETIVOS 2.1. ANTECEDENTES Y JUSTIFICACIÓN La isatina es un compuesto generado de forma endógena que presenta amplia variedad de efectos biológicos, donde destaca su capacidad de inhibir la MAO. En diversos estudios se ha evidenciado que la administración i.p. de isatina incrementa los niveles centrales de dopamina, tanto en ratas normales como en ratas parkinsonizadas (Hamaue et al. 1999b; Ogata et al. 2003; Hamue et al. 2004; Minami et al. 2006; Xu et al. 2006). Actualmente, los papeles fisiológicos y patológicos de la isatina aún no están claros (Mathur y Nain 2014). No obstante, en la literatura científica se ha observado algún resultado contradictorio en el que la administración de isatina en ratas parkinsonizadas con 6-OHDA no produjo modificaciones sobre los niveles de dopamina, aunque produjo una mejoría de las alteraciones motrices en este modelo experimental. Este hecho conlleva a plantear la hipótesis de que la isatina podría presentar otros mecanismos neuroquímicos aún no dilucidados (Zhou et al. 2001). Esta hipótesis se ve reforzada por el hecho de que otros IMAO-B presentan más efectos neuroquímicos que la inhibición de la MAO-B que los caracteriza. Se puede citar el ejemplo de la safinamida (descrita en el apartado anterior), un IMAO-B que además inhibe la recaptación de dopamina, bloquea los canales de sodio e inhibe la liberación de glutamato (Olanow et al. 2009; Boll et al. 2011; Hickey y Stacy 2011; Barbosa y Bossoni 2014). Esto plantea la posibilidad de que la isatina pueda actuar sobre otros elementos del terminal dopaminérgico y sobre otros neurotransmisores diferentes a la dopamina, lo que al igual que la safinamida, le podría conferir mayor relevancia terapéutica. 73 JUSTIFICACIÓN Y OBJETIVOS Del mismo modo, existe escasa experimentación en la que se realice un muestreo in vivo de los efectos de la isatina sobre la dopamina estriatal. Adicionalmente, en el presente trabajo de investigación se utiliza un diseño experimental diferente, ya que en la mayoría de estudios la isatina es administrada intraperitonealmente (Hamaue et al. 1999b), mientras que en este caso se administra disuelta en el líquido de perfusión de microdiálisis. Por otra parte, los compuestos con capacidad para inhibir la MAO han sido ampliamente estudiados por sus beneficios terapéuticos en diversas patologías del SNC. Actualmente, los IMAO-B son utilizados en la EP, tanto por sus beneficios sintomatológicos como por su posible acción neuroprotectora. De todas formas, todavía no se dispone de ningún compuesto que modifique la progresión de la enfermedad (Youdim et al. 2006; Riederer et al. 2007; López y Linazasoro 2009; Riederer y Laux 2011; Conolly y Lang 2014; Finberg 2014). La posible utilidad clínica de la isatina se ha evidenciado en estudios en los que la administración sistémica de este compuesto en ratas parkinsonizadas provocó una mejoría de las alteraciones motrices (Zhou et al. 2001; Hamaue et al. 2004; Xu et al. 2006). Así, en ratas parkinsonizadas con el VEJ , la isatina mostró mejores resultados en la tasa de conversión de dopamina en DOPAC frente a la selegilina (Hamaue et al. 2004). Es necesario citar también, que diversos investigadores han postulado a la isatina como un posible candidato dentro de la farmacoterapia antiparkinsoniana (Glover et al. 1988; Ogata et al. 2003; Hamaue et al. 2004; Minami et al. 2006, Xu et al. 2006). Aunque el estudio de este compuesto se limita únicamente a investigaciones preclínicas. 74 JUSTIFICACIÓN Y OBJETIVOS Se debe destacar que en la 14ª edición del Congreso Mundial de Farmacología bajo la temática “Nuevos fármacos para el tratamiento de los trastornos del Sistema Nervioso Central” la isatina fue presentada como un compuesto antiparkinsoniano (Scriabine 2002). En este momento, la base de datos PubChem (pertenenciente al National Center for Biotechnology Information, NCBI) registra 12 estudios activos de la isatina con la MAO-B como diana (número de identificación de compuesto: 7054). Estos estudios se centran en la evaluación de la IC50 (9 de ellos) y de la Ki (los 3 restantes). Como inhibidor reversible de la MAO, la isatina presenta diversas ventajas sobre los inhibidores irreversibles, que son los que se utilizan actualmente en el tratamiento farmacológico de la EP. La inhibición reversible presenta las siguientes ventajas: la enzima se recupera una vez que el inhibidor se retira de los tejidos, debido a que presenta una menor duración de acción el riesgo de perder selectividad es menor frente a los inhibidores irreversibles y en caso de inhibición reversible competitiva la inhibición es aliviada cuando la concentración de sustrato incrementa (Prins et al. 2010). Además, Edmonson et al. (2007) indican que nuevos inhibidores reversibles podrían resultar útiles como neuroprotectores, considerando el incremento de MAO-B con la edad y su posible asociación con trastornos neurodegenerativos. Considerando lo expuesto previamente, los resultados de esta tesis doctoral podrían resultar útiles para generar datos preliminares para posteriores investigaciones con una notable aplicación clínica. Sin embargo, experimentaciones con isatina sobre algunas líneas tumorales han llevado a algunos autores a tomar precauciones a la hora de 75 JUSTIFICACIÓN Y OBJETIVOS postular a la isatina como posible agente terapéutico (Igosheva et al. 2005). Por el contrario, investigaciones más recientes indican que la isatina podría presentar efectos neuroprotectores como los observados en cultivos celulares y en ratones parkinsonizados con MPTP (Fang y Wang 2008; Zhang et al. 2011a; Zhang et al. 2011b). Medvedev et al. (2007) y Fedchenko et al. (2008) indican que la isatina también podría atenuar los efectos de ciertos agentes farmacológicos en dianas específicas como la MAO o compuestos neuroprotectores. Por otro lado, a pesar de que la mayoría de pacientes que sufren la EP reciben más de un fármaco antiparkinsoniano, las investigaciones tienden a centralizar en buscar los fármacos que pueden ser utilizados como primera línea terapéutica y han sido ignoradas las potenciales sinergias de los compuestos utilizados en la actualidad. Por este motivo, se plantea, además de la administración de la isatina, la coadministración de esta sustancia con diversos compuestos de acción antiparkinsoniana, para poder determinar la sinergia que puede resultar efectiva en aumentar los niveles de dopamina en el núcleo estriado. Del mismo modo, resulta interesante evaluar desde un punto de vista neuroquímico compuestos que mejoren la farmacocinética de la L-DOPA en el incremento de los niveles de dopamina. En cualquier caso, se debe señalar que hasta el momento aún persiste la necesidad de nuevas terapias que proporcionen beneficios sintomáticos no asociados a complicaciones motoras, tratamiento de la sintomatología no dopaminérgica y un tratamiento que revierta o ralentice la progresión de la EP (Olanow y Schapira 2013). 76 JUSTIFICACIÓN Y OBJETIVOS En síntesis, la justificación de esta tesis doctoral se podría resumir en los siguientes puntos: La isatina presenta un elevado potencial terapéutico y podría estar involucrada en diversos trastornos del SNC, donde destaca sobre todo la EP. En la literatura previa se observa escasa experimentación in vivo con este compuesto y existen resultados contradictorios. Se desconocen los mecanismos neuroquímicos por los que actúa la isatina sobre el sistema dopaminérgico y sus efectos sobre otros neurotransmisores. La isatina endógena podría interactuar con fármacos antiparkinsonianos administrados exógenamente y dicha interacción a nivel neuroquímico aún no se ha descrito. Finalmente, hay que considerar que la aplicación de isatina como agente terapéutico aún dista mucho de la clínica, pero es necesario tener en cuenta que las investigaciones previas describen que este compuesto es generado de forma endógena y niveles altos del mismo se han observado en pacientes con EP. Por ello, la isatina podría estar involucrada en la fisiopatología de la EP, generarse como mecanismo compensatorio o interferir con los compuestos administrados para su tratamiento. Esta tesis doctoral es realizada en modelos animales, por lo que se encuadra dentro de investigación básica, por ende los resultados deben ser considerados con la mesura precisa. 77 JUSTIFICACIÓN Y OBJETIVOS En este momento la isatina se encuentra en estudio preclínico y esto puede deberse a las limitaciones a las que se ve sometida la investigación de la EP: Alto coste y gran tiempo de desarrollo de la investigación. Aún se desconoce la etiología específica de la patología. Los modelos experimentales de EP manifiestan características limitadas. No existen biomarcadores validados. No existe un diseño de estudio que permita dilucidar con facilidad si un compuesto es neuroprotector (Olanow y Schapira 2013). 78 JUSTIFICACIÓN Y OBJETIVOS 2.2. OBJETIVOS 2.2.1. Objetivo general El objetivo general de este trabajo de investigación consiste en evaluar los efectos y los mecanismos de acción de la administración de isatina sobre la liberación in vivo de dopamina y sus principales metabolitos ácidos (DOPAC y HVA), en el núcleo estriado de ratas conscientes y en libre movimiento mediante las técnicas de microdiálisis cerebral y cromatografía de líquidos de alta resolución con detección electroquímica (HPLC-EC). 2.2.2. Objetivos específicos Los objetivos específicos de esta tesis doctoral son: 1. Estudiar los efectos de la administración intraestriatal de diferentes concentraciones de isatina sobre la liberación in vivo de dopamina y sus metabolitos en el núcleo estriado de ratas. 2. Determinar los posibles mecanismos neuroquímicos de acción de la isatina sobre la liberación in vivo de dopamina. 3. Estudiar los efectos de la administración intraestriatal de isatina sobre la liberación in vivo de dopamina y sus metabolitos en el núcleo estriado en ratas tratadas con inhibidores selectivos para cada isoforma de la MAO. 4. Estudiar los efectos de la administración intraestriatal de isatina combinada con diversos fármacos antiparkinsonianos sobre la liberación in vivo de dopamina y sus metabolitos en el núcleo estriado de ratas. 79 JUSTIFICACIÓN Y OBJETIVOS 5. Estudiar los efectos de la administración intraestriatal de isatina sobre la liberación in vivo de dopamina y sus metabolitos en el núcleo estriado en ratas tratadas con L-DOPA por vía intraperitoneal. 6. Determinar la posible mediación de receptores glutamatérgicos en el efecto de la isatina sobre la liberación de dopamina en el núcleo estriado de ratas. 7. Evaluar la posible participación del óxido nítrico en la liberación de dopamina inducida por isatina en el núcleo estriado. 8. Estudiar los efectos de la administración intraestriatal de isatina sobre la liberación in vivo de glutamato, aspartato, taurina y glicina en el núcleo estriado de ratas. 80 3 MATERIAL Y MÉTODOS Efectos de la isatina sobre la neurotransmisión dopaminérgica en el núcleo estriado. Un estudio in vivo mediante microdiálisis cerebral. MATERIAL Y MÉTODOS 3.1. ANIMALES DE EXPERIMENTACIÓN En todos los experimentos se utilizaron ratas hembra de la raza Sprague-Dawley con un peso comprendido entre los 250-300 g alimentadas mediante pienso comercial y agua ad libitum. Los animales se criaron y se mantuvieron en un estabulario en condiciones de temperatura constante (22 ± 2º C) y períodos de luz:oscuridad controlada (14:10 h), alojados en jaulas de polipropileno en un número de 4 por jaula. Después de la operación cada animal fue alojado en una jaula individual. Toda la experimentación ha sido realizada atendiendo a la Directiva Europea 2010/63/EU para la protección de animales de laboratorio y al Real Decreto 53/2013, en el que se establecen las normas básicas aplicables para la protección de los animales utilizados en experimentación; además de poseer la autorización del Comité Ético de Bienestar Animal (CEBA) de la Universidad de Vigo. 3.2. REACTIVOS Y PATRONES En todos los experimentos se utilizaron reactivos de pureza analítica y el agua fue previamente purificada con un sistema Milli Q (Millipore). Los reactivos utilizados en experimentación y su procedencia se muestran en la Tabla 3.1. 83 MATERIAL Y MÉTODOS Reactivo Compuesto Acción Procedencia Inhibidor de la NOS. 7-nitroindazol (7- NI) Sigma-Aldrich Ácido dihidroxifenilacético Utilizado como patrón. Sigma-Aldrich (DOPAC) Ácido DL-2-Amino-5- Antagonista fosfatopentanoico NMDA Tocris (DL- competitivo. AP5) Ácido homovanílico (HVA) Utilizado como patrón. Sigma-Aldrich Amantadina hidrocloruro Antiparkinsoniano. Sigma-Aldrich Liberador de dopamina. Aspartato Utilizado como patrón. Atropina Antagonista de Sigma-Aldrich los Sigma-Aldrich receptores muscarínicos de ACh. Benserazida clorhidrato Inhibidor de la DDC. Sigma-Aldrich Clorgilina clorhidrato Inhibidor de la MAO- A. Sigma-Aldrich Dimetil sulfóxido (DMSO) Disolvente orgánico. Sigma-Aldrich Dinitrocatecol (OR-486) Inhibidor de la COMT. Tocris Dizocilpina ((+)-MK- 801 Antagonista NMDA no Tocris maleato) competitivo. Dopamina Utilizado como patrón. Sigma-Aldrich Glicina Utilizado como patrón. Sigma-Aldrich Glutamato Utilizado como patrón. Sigma-Aldrich Hidrato de cloral Anestésico. Sigma-Aldrich Isatina Inhibidor de la MAO- B. Sigma-Aldrich L-dihidroxifenilalanina (L- Precursor DOPA) 84 dopamina. de la Sigma-Aldrich MATERIAL Y MÉTODOS L-dihidroxifenilalanina Precursor de la Sigma-Aldrich metil-éster clorhidrato (L- dopamina. DOPA metil-éster clorhidrato) L-NG-nitroarginina metil- Inhibidor de la NOS. Sigma-Aldrich éster (L- NAME metil-éster) N-Acetil-Cisteína (NAC) Reactivo para Sigma-Aldrich derivatización Nomifensina maleato Inhibidor del DAT. O-ftalaldehído (OPA) Reactivo Sigma-Aldrich para Sigma-Aldrich derivatización Reserpina Inhibidor del Sigma-Aldrich empaquetamiento vesicular de catecolaminas y serotonina. Ropinirol clorhidrato Agonista receptores de D3 los Sigma-Aldrich de dopamina. Selegilina clorhidrato Inhibidor de la MAO- B. Sigma-Aldrich Taurina Utilizado como patrón. Tetrodotoxina (TTX) Inhibidor selectivo de los Tocris canales de Sigma-Aldrich Na+ dependientes de voltaje. Tropolona Inhibidor de la COMT. Sigma-Aldrich Tabla 3.1: Listado de los reactivos donde se muestran los compuestos utilizados, su acción y su procedencia. 85 MATERIAL Y MÉTODOS 3.3. MICRODIÁLISIS CEREBRAL Para la administración intraestriatal de compuestos y recogida de las muestras se utilizó la técnica de microdiálisis cerebral. 3.3.1. Fundamentos de la técnica 3.3.1.1. Breve reseña histórica y estado actual de la técnica La microdiálisis cerebral es una técnica de muestreo, relativamente novedosa, que se ha utilizado principalmente en la caracterización neurofarmacodinámica de compuestos en animales de experimentación in vivo. Aunque la microdiálisis se puede aplicar en una gran diversidad de órganos y sistemas, su aplicación principal se puede observar en la investigación de la neurotransmisión y en particular en los efectos de fármacos sobre las monoaminas y aminoácidos neurotransmisores (Bourne 2003; Darvesh et al. 2011). Aunque inicialmente las aplicaciones de la microdiálisis se han descrito dentro de la investigación en Neurociencia, debido a su versatilidad, actualmente la microdiálisis no se aplica únicamente en esta área. En los últimos años adquirió relevancia en el campo de la Medicina clínica debido a su utilidad como potencial herramienta para la monitorización, el diagnóstico y el estudio farmacocinético de compuestos en fase clínica (Müller 2002; Tisdall y Smith 2006; Shannon et al. 2013). Podemos atribuir la invención de esta técnica a Bito, quien en 1966, describió la posibilidad de obtener una muestra de aminoácidos y otros electrolitos libres en el líquido extracelular cerebral y en el plasma sanguíneo de perro mediante la utilización de una membrana semipermeable. Posteriormente en 1972, Delgado y su equipo 86 MATERIAL Y MÉTODOS desarrollaron una versión primitiva de las sondas de microdiálisis denominadas “dialitrodo”- para la realización de una perfusión continua intracerebral en monos despiertos. Ungersted y Pycock llevaron a cabo el perfeccionamiento de esta técnica, consiguiéndose de este modo en 1974 la primera puesta a punto de la microdiálisis in vivo (Chaurasia 1999; Chaurasia et al. 2007; Chefer et al. 2009). A partir del año 1960 se pueden contabilizar más de 11.000 publicaciones científicas en las que se utiliza la microdiálisis cerebral, de las cuales más de 1.600 con aplicaciones en humanos. Los estudios en humanos comenzaron en la década de 1990 con el objetivo de determinar la concentración de diversas sustancias en el espacio extravascular (Chaurasia 1999; Chaurasia et al. 2007; Chefer et al. 2009). Tradicionalmente, esta técnica únicamente se utilizaba para la determinación intersticial de compuestos endógenos y fármacos. Sin embargo, posteriormente se ha ejecutado la administración de compuestos a través de la sonda, lo que se denomina “diálisis inversa” o “retrodiálisis” (Figura 3.1) (Höcht et al. 2007). Figura 3.1: Secuenciación temporal y eventos en un experimento de microdiálisis inversa. NT: Neurotransmisor, M: Metabolitos (modificado de Höcht et al. 2013). 87 MATERIAL Y MÉTODOS 3.3.1.2. Descripción de la técnica La microdiálisis cerebral es una técnica neuroquímica de muestreo que se rige por el principio de diálisis mediante la introducción de una membrana semipermeable en el tejido. Este principio se basa en la ley de difusión de Fick, que consiste en el paso de moléculas a favor de un gradiente de concentración. Aunque la difusión es el proceso por el que se transporta el analito en la membrana, se pueden producir otros procesos como la ultrafiltración por la modificación de la presión durante el manejo manual de las jeringas. En términos generales, la microdiálisis cerebral consiste en un sistema cerrado basado en la implantación de un una sonda de microdiálisis mediante cirugía estereotáxica. La sonda de microdiálisis es un dispositivo metálico que presenta un tubo de entrada y uno de salida. En la parte inferior del dispositivo se le acopla una membrana semipermeable, aunque existen diversos diseños de sondas. La sonda de microdiálisis es uno de los elementos principales de esta técnica. Mediante una bomba de infusión por un extremo de la sonda (tubo de entrada) se administra un líquido de perfusión fisiológicamente compatible a un flujo constante (generalmente de 0,3 a 3 µl/min) y por el extremo libre (tubo de salida) se recogen las muestras a intervalos regulares (los tiempos de recolección oscilan de 1 a 20 minutos). Puesto que la membrana de la sonda es semipermeable, las sustancias atraviesan la membrana en base al gradiente de concentración entre el medio de perfusión y el espacio extracelular, mimetizando la función de un capilar sanguíneo (Figura 3.2). La permeabilidad de membrana generalmente se limita a compuestos con una masa molecular menor a 100 000 Dalton, dependiendo del al tamaño de poro utilizado y del material de la membrana. Por tanto son muestras purificadas libres de proteínas. 88 MATERIAL Y MÉTODOS Figura 3.2: La sonda de microdiálisis mimetiza la función de un vaso sanguíneo. Cortesía de CMA Microdialysis. El paso se realiza en ambos sentidos lo que permite la obtención de sustancias endógenas y la administración exógena de compuestos, tanto en animales anestesiados como en libre movimiento (Chaurasia et al. 2007; Höcht et al. 2007; Chefer et al. 2009; Darvesh et al. 2011). Una vez obtenidos los dializados pueden ser analizados por medio de diversas técnicas analíticas. En este trabajo se utilizó HPLC con detección electroquímica y fluorimétrica para determinar los compuestos que se encuentran en las muestras y la concentración de los mismos. 3.3.1.3. Características de la microdiálisis cerebral En contraste con otras técnicas, la microdiálisis permite un continuo muestreo de compuestos de bajo peso molecular con una perturbación mínima del sistema que se está estudiando. Diversos estudios han demostrado su elevada sensibilidad en el muestreo de sustancias en el espacio extracelular de regiones cerebrales discretas, como el núcleo estriado, así como en la monitorización de la acción de sustancias exógenas (Chaurasia 1999; Bourne 2003). La microdiálisis cerebral in vivo presenta un amplio número de aplicaciones dentro de la Neurociencia: monitorizar alteraciones en los niveles basales de neurotransmisores ante la exposición a fármacos (tanto local como sistémica), monitorizar los compuestos en el líquido extracelular, administrar fármacos y toxinas en el espacio extracelular en regiones cerebrales concretas, modificar las concentraciones locales de 89 MATERIAL Y MÉTODOS iones por medio del dializado, monitorizar los niveles de fármacos y sus metabolitos, correlacionar modificaciones conductuales con alteraciones en la neurotransmisión, microestimulación de las vías próximas a la sonda evocando un incremento de neurotransmisor, determinar las constantes de eliminación en los estudios de binding in vivo y monitorizar eventos neuroquímicos en el espacio extracelular (Khan y Shuaib 2001; Bourne 2003; Plock y Kloft 2005). Las principales ventajas y limitaciones que presenta esta técnica se muestran en la Tabla 3.2. Ventajas Limitaciones Recolección de sustancias en el lugar de acción y liberación directa en el tisular, tejido diana. alteraciones en la permeabilidad de Facilidad de trabajo con sondas de la características muy similares. Aunque Muestreo continuo Posibilidad de acoplar diversos invasiva y bien Limitada resolución espacial y Baja recuperación para moléculas Requiere un análisis sensitivo y sistémica y local de sustancias, Nivel absoluto de compuesto en tejido difícil de estimar, la recuperación de la sonda no alcanza Compatibilidad con: administración estimulación y registro considerada volúmenes de muestra. sistemas de análisis químicos. es capaz de trabajar con pequeños Ausencia de degradación enzimática de neurotransmisores. hemato-encefálica. de elevado peso molecular. Obtención de muestras purificadas (libres de proteínas). y temporal. Facilidad para establecer una base de trabajo rutinaria. barrera reactiva tolerada. de fluido biológico. gliosis mínimamente altamente dinámico, por lo que no existe pérdida Técnica invasiva que genera daño el 100%. Dificultad asociada a compuestos electrofisiológico, estudios lipofílicos y compuestos unidos a comportamentales. proteínas. Tabla 3.2: Ventajas y limitaciones de la microdiálisis cerebral. 90 MATERIAL Y MÉTODOS En relación a las características de la microdiálisis, esta técnica ha sido muy empleada para el estudio de monoaminas por diversas razones: Las monoaminas están ampliamente distribuidas en el sistema nervioso central y periférico. Están implicadas en una gran variedad de funciones y su alteración contribuye a un gran número de patologías y trastornos (EP, depresión, dolor, adicciones…). La concentración extracelular de monoaminas es elevada y se ubica en estructuras de gran tamaño, como en el núcleo estriado. Sus características físico-químicas están bien caracterizadas y se dispone de instrumentación analítica sensible para su cuantificación en los dializados (Chefer et al. 2009). En comparación con otras técnicas de administración de compuestos, como la microinfusión, presenta las siguientes ventajas: no incrementa el volumen en el tejido de estudio, permite una concentración estable de compuesto en el tejido en la administración crónica, permite acceder a un tejido diana de mayor tamaño atendiendo a la superficie de membrana y facilita estudios dosis-respuesta en el mismo animal puesto que no es necesario el reimplante de la sonda para sucesivas dosis. Frente a otras técnicas de muestreo, como la voltametría, la microdiálisis permite la administración de compuestos para su estudio, aunque presenta menor resolución temporal y requiere un equipo específico para el análisis de los dializados (Bourne 2003; Höcht et al. 2007). 3.3.2. Implantación de la sonda en el núcleo estriado La obtención de dializados cerebrales requiere la implantación, por medio de cirugía estereotáxica, de una cánula-guía que sirva de soporte de la sonda. La implantación de la cánula-guía se realizó con ayuda de un aparato de estereotaxia, un dispositivo mecánico que fija totalmente la 91 MATERIAL Y MÉTODOS cabeza del animal, permitiendo llegar con precisión a cualquier punto del cerebro atendiendo a las coordenadas estereotáxicas especificadas en un atlas estereotáxico. Dicho atlas estereotáxico proporciona las coordenadas exactas en las tres direcciones del espacio (antero-posterior AP, lateral L y vertical V) con respecto a los puntos estereotáxicos de referencia (Paxinos y Watson 1986). En esta investigación, para la intervención quirúrgica los animales fueron anestesiados con hidrato de cloral (400 mg/kg i.p.) y fijados en el aparato de estereotaxia (Nashigire SR-6) para la implantación de una cánula-guía. Dichas cánulas-guía han sido comerciales y del tipo CMA/12 (CMA/ Microdialysis, Suecia). Para la implantación intraestriatal de la cánula-guía se siguieron las siguientes coordenadas establecidas por el atlas estereotáxico de Paxinos y Watson (1986): antero-posterior= 1.0 mm, lateral= 3.0 mm y vertical= 6.0 mm; tomando como punto de referencia el Bregma (punto de corte de la sutura longitudinal con la primera sutura transversal del cráneo). De este modo, toda la membrana de la sonda queda introducida en el estriado. Para alcanzar dichas referencias se realizó un corte longitudinal en la superficie craneal, después se efectuó un orificio en el cráneo por el cual se introdujo la cánula-guía mediante el micromanipulador del estereotáxico. En este punto la cánula se fijó por medio de cemento acrílico. Para favorecer la adhesión del cemento acrílico se colocaron dos tornillos en el cráneo en los huesos craneales adyacentes (Figura 3.3). 92 MATERIAL Y MÉTODOS Figura 3.3: 1.Procedimiento para la implantación de la cánula-guía y colocación de la sonda. En la sección A se introduce la cánula a través del orificio craneal y se coloca el tornillo de fijación, en la sección B se coloca el cemento dental para la fijación de la cánula. Previamente a la experimentación (sección C y D) se retira el protector de la cánula y se introduce la sonda. 2. Presentación histológica de la localización de la sonda de microdiálisis en el núcleo estriado de acuerdo con las coordenadas del atlas estereotáxico de Paxinos y Watson para el estriado: AP=1.0, L=3.0 y V=6.0 mm (Campos et al. 2008). En todos los experimentos los animales fueron operados bajo las mismas condiciones. Tras la cirugía estereotáxica se esperó 24 h para comenzar la recogida de muestras con el fin de permitir la recuperación post-quirúrgica (trauma generado en el tejido, alteración de la permeabilidad de la barrera hemotencefálica y gliosis reactiva). Una vez pasado este período se retiró el protector de la cánula-guía y se colocó la sonda, dando comienzo a la experimentación. Las sondas comerciales para microdiálisis utilizadas fueron el modelo CMA/12 14/03 PES (CMA/ Microdialysis, Suecia) con una membrana de diálisis de polietersulfona (PES) de 3mm de longitud y 0,5 mm de diámetro externo. La parte metálica de la sonda tiene una longitud de 14 mm, un diámetro externo de 0,64 mm y un volumen interno de 3 µl (Figura 3.4). 93 MATERIAL Y MÉTODOS Figura 3.4: Representación de la sonda de microdiálisis, en color gris se representa los compuestos endógenos que atraviesan la membrana para ser analizados posteriormente. En color naranja se representa el compuesto administrado en el líquido de perfusión que llega al espacio intersticial (modificada de Plock y Kloft 2005). Una vez finalizado el experimento se extrajo el cerebro del animal y se realizó la comprobación histológica de la ubicación de la sonda mediante un examen macroscópico, efectuando para ello un corte coronal a la altura de la entrada de la sonda, como se observa en la Figura 3.3. 3.3.3. Administración de sustancias y recogida de muestras Una vez colocada la sonda se conectó mediante tubos de teflón – etileno-propileno fluorado- (0,65 mm de diámetro externo y 0,12 mm de diámetro interno) a una bomba de microdiálisis CMA/402 (CMA Microdialysis, Suecia) a través de la cual se perfundió una solución Ringer (NaCl 147 mM, KCl 4 mM, CaCl2 3,4 mM; pH=7,4) a un flujo constante de 1,5 µl/min. Las muestras se recogieron cada 20 minutos mediante un microcolector de fracciones CMA/142 (CMA Microdialysis, Suecia). Considerando el flujo de perfusión y el tiempo de recolección el volumen final de cada muestra fue de 30 µl. 94 MATERIAL Y MÉTODOS En la Figura 3.5 se muestra el equipo suministrado por CMA/Microdialysis (CMA Microdialysis, Suecia) para la realización de los experimentos de microdiálisis cerebral. Figura 3.5: Equipo suministrado por CMA Microdialysis que se empleó en la experimentación. A. Sonda de microdiálisis/12. B. Cánula-guía CMA/12. C. Tubería de teflón. D. Adaptadores de tubería. E. Tornillo de anclaje para cirugía estereotáxica. F. Bomba de infusión CMA/402. G. Microjeringa de 1 ml. H. Microcolector de fracciones CMA/142. Cortesía de CMA Microdialysis. Los experimentos llevados a cabo en este trabajo de experimentación han tenido una duración de 3 y 4 horas. En ambos casos la primera y la última hora se corresponden con la administración de una solución Ringer para establecer los niveles basales de neurotransmisores y la restauración 95 MATERIAL Y MÉTODOS a las condiciones basales, respectivamente. Los experimentos de 3 horas de duración se han realizado para evaluar los efectos de la isatina y la coadministración de isatina con otros compuestos sobre la neurotransmisión. Los experimentos de 4 horas se han realizado cuando era necesario un pretratamiento o se aplicó una solución Ringer modificada. El protocolo experimental para cada grupo se detallará posteriormente en el apartado específico. Las Figuras 3.6 y 3.7 muestran los cronogramas generales de los protocolos experimentales. Figura 3.6: Cronograma representativo de un experimento de 3 horas de duración. En la parte superior se muestra el compuesto aplicado en cada período temporal y en la parte inferior el número de muestras. Figura 3.7: Cronograma representativo de un experimento de 4 horas de duración. En la parte superior se muestra el compuesto aplicado en cada período temporal y en la parte inferior el número de muestras. 96 MATERIAL Y MÉTODOS 3.3.4. Rendimiento de las sondas de microdiálisis cerebral En toda experimentación en la que se trabaja con microdiálisis es necesario considerar que no se recolecta el 100% de las sustancias presentes en el medio extracelular que rodea a la sonda, sino que se recoge tan solo una fracción del total dependiendo de los factores que se exponen a continuación (Tabla 3.3). •Flujo de la bomba de microdiálisis: La concentración de analito por muestra (recuperación relativa) es inversamente proporcional al flujo aplicado. Además, al reducir el flujo aplicado las tasas de agotamiento de analito próximo a la sonda decrecen. Por el contrario, la recuperación absoluta de analito (volumen de dializado) es proporcional al flujo aplicado, de este modo para obtener un volumen suficiente de muestra es necesario incrementar el flujo aunque de este modo se reducirá la eficiencia del muestreo y se pueden producir más alteraciones sobre el tejido que se aplica. •Propiedades de la membrana (longitud y Cut-Off): La recuperación es proporcional a la superficie de la membrana. La longitud de la membrana está limitada por el tamaño de la estructura de estudio. Los materiales de membrana también influyen en la recuperación, los más utilizados son: celulosa regenerada, poliacrilonitrilo y éter-policarbonato. •Propiedades del analito: Mediante microdiálisis se pueden recolectar un gran número de analitos, dependiendo de las condiciones de recolección la recuperación relativa presentará grandes variaciones. Las principales características del analito que influyen en la recuperación relativa son: el peso molecular y su hidrofobicidad; cuanto mayor sean ambas menor será la recuperación. •Otros factores: La temperatura influye sobre el coeficiente de difusión de diferentes moléculas y este se incrementa 1-2% por cada grado Celsius. Otros factores que influyen son factores tisulares, la difusión es menor que en una solución acuosa, esto se debe principalmente al reducido volumen de fluido y a la elevada trayectoria de difusión en el tejido (tortusidad). Tabla 3.3: Factores que limitan la recuperación in vivo en experimentos de microdiálisis (Khan y Shuaib 2001; Chaurasia et al. 2007; Chefer et al. 2009). 97 MATERIAL Y MÉTODOS Efecto de la longitud de membrana (A) y el flujo aplicado (B) sobre la recuperación. A B Figura 3.8: Gráficas proporcionadas por CMA Microdialysis que muestran la recuperación relativa de las sondas CMA/12 en función de la longitud de la membrana (A) y en función del flujo aplicado (B). Para conocer la cantidad de sustancia a analizar que atraviesa la membrana de la sonda bajo unas determinadas condiciones experimentales es necesario calcular la recuperación relativa de la sonda. Podemos definir la recuperación relativa de la sonda como la relación entre la concentración de una sustancia medida en el dializado recogido (Cdializado) y su concentración en el medio exterior a la membrana de diálisis (Cexterior), en este caso el medio extracelular. Esta recuperación se puede determinar tanto in vivo como in vitro y se expresa como porcentaje (Chaurasia 1999; Khan y Shuaib 2001; Watson et al. 2006). 98 MATERIAL Y MÉTODOS 3.3.4.1. Cálculo de la recuperación y administración in vitro El cálculo de la recuperación in vitro llevado a cabo en este trabajo de investigación se realizó como se describe a continuación. Se colocó la sonda en un vial con los patrones de las sustancias de estudio (dopamina, DOPAC, HVA, glutamato, aspartato, glicina, taurina) disueltas en Ringer en una concentración de 1ng/µl. Posteriormente se perfundió una solución Ringer en las mismas condiciones que se realizó la experimentación (flujo 1,5 µl/min). Una vez obtenidos los dializados estos se analizaron mediante HPLC con detección electroquímica para las aminas y con detección fluorimétrica (derivatización OPA-NAC) para los aminoácidos. La metodología se muestra en la Figura 3.9 –A. Finalmente se contrastaron los valores cromatográficos que muestran la solución de patrones inyectados directamente en el cromatógrafo (Cexterior) y el dializado (Cdializado) aplicando la siguiente fórmula: Recuperación in vitro= (Cdializado /Cexterior) x 100 La tasa de difusión de isatina a través de la sonda también fue calculada in vitro. La isatina fue disuelta en una solución Ringer a una concentración 10 mM y fue colocada en la microjeringa de la bomba de microdiálisis, para ser perfundida en una solución Ringer donde se ubicó la sonda. La metodología se muestra en la Figura 3.9 –B. Finalmente, se analizó la solución Ringer en la que se ubicó la sonda y se comparó con el patrón de concentración conocida, siguiendo la metodología descrita por Manabe et al. (1997). Las condiciones de administración fueron las mismas que durante la experimentación in vivo. Administración in vitro= (Clíquido sonda /Cmicrojeringa) x 100 99 MATERIAL Y MÉTODOS Figura 3.9: Cálculo de la recuperación in vitro (A) y cálculo del paso de sustancias administradas a través de la membrana (B) (modificada de Plock y Kloft 2005). En la Tabla 3.4 se muestran los valores de recuperación in vitro (expresados en %) obtenidos para: dopamina, sus metabolitos, aminoácidos neurotransmisores y los valores para la administración de isatina. 100 MATERIAL Y MÉTODOS Valores medios de recuperación de las sondas utilizadas en este trabajo Compuesto Recuperación sonda (%) ASP 14,29 ± 0,65 DA 13,45 ± 0,83 DOPAC 14,14 ± 0,93 GLI 12,29 ± 3,24 GLU 13,52 ± 1,53 HVA 19,75 ± 1,13 TAU 12,10 ± 2,97 ISA 1,01 ± 0,09 Condiciones de trabajo 3 mm Membrana 1,5 µl/ min Flujo Cut off 100 000 Dalton Membrana PES Tabla 3.4: Porcentaje de recuperación de las sondas utilizadas en esta investigación. Se expresan como la media ± E.E.M. de 41 sondas. En la interpretación de los resultados obtenidos por microdiálisis los métodos de cuantificación y cálculo de la recuperación suponen una temática controvertida. El cálculo de la recuperación in vitro presenta las ventajas de que posee una detección más sensitiva debido a la facilidad del muestreo y permite el almacenaje de las muestras. Sin embargo, la resistencia impuesta in vitro no se corresponde con la resistencia impuesta por el tejido, por lo que en el análisis de resultados es necesario tener en cuenta esa diferencia, la recuperación in vivo será menor que in vitro (Watson et al. 2006; Chefer et al. 2009). 101 MATERIAL Y MÉTODOS 3.4. ANÁLISIS DE LOS DIALIZADOS: CROMATOGRAFÍA DE LÍQUIDOS DE ALTA RESOLUCIÓN (HPLC) El análisis de neurotransmisores en dializados requiere métodos analíticos sensitivos para su cuantificación. En la actualidad disponemos de diversas metodologías. La cromatografía de líquidos con detección electroquímica ha sido comúnmente seleccionada para el análisis de catecolaminas en dializados. Esto se debe a que la separación en columna simplifica la detección simultánea de los compuestos en un período de tiempo adecuado. Por otra parte, la detección de aminoácidos en dializados mediante detección fluorimétrica permite medir cantidades del orden de picogramos utilizando o-ftalaldehído (OPA) como derivatizador, aunque los tiempos de retención son ligeramente mayores (Perry et al. 2009; Zapata et al. 2009). Las muestras obtenidas mediante microdiálisis cerebral fueron analizadas por cromatografía de líquidos de alta resolución con detección electroquímica (HPLC-EC) para la determinación de dopamina y sus metabolitos. El análisis de aminoácidos neurotransmisores en los dializados fue llevada a cabo mediante HPLC con detección fluorimétrica (derivatización con OPA-NAC). 3.4.1. Fundamentos de la técnica 3.4.1.1. Breve reseña histórica Podemos considerar que los inicios de la HPLC se remontan a la aproximación teórica realizada por Martin y Synge en 1941, donde postulan que se puede conseguir una mayor eficacia en la cromatografía de líquidos disminuyendo el tamaño de la partícula de la fase estacionaria e incrementando la presión en la fase móvil utilizada. 102 MATERIAL Y MÉTODOS A finales de 1960 se comienzan a realizar los primeros trabajos experimentales en los que se describe la HPLC. En estos trabajos se empieza a introducir diversas capas en las columnas cromatográficas con partículas de 40 µm de diámetro. En este período destaca la aportación de investigadores como: Horvath, Huber, Snyder y Kirkland, entre otros. Desde entonces, la HPLC ha sufrido un importante proceso de perfeccionamiento, extendiéndose su utilización más allá de la investigación (Karger 1997; Snyder 1997). Ungerstedt y colaboradores fueron los primeros en combinar HPLC con detección electroquímica para analizar la dopamina y sus metabolitos en dializados cerebrales. Desde comienzos de los 80 esta técnica fue mejorada por diversos laboratorios hasta convertirse en un método sensitivo con el que cuantificar catecolaminas e indolaminas (Zapata et al. 2009). Actualmente, la HPLC ha comenzado a dar paso a la ultracromatografía de líquidos de alta eficacia (UPLC) en algunos diseños experimentales, ya que presenta mayor sensibilidad, lo que permitiría menor volumen de muestra y menor cantidad de analito, con lo que se consigue mayor resolución temporal. Además una mayor resolución de picos permite un mejor análisis de los pequeños picos próximos a los metabolitos (Reinhoud et al. 2013). 3.4.1.2. Descripción de la técnica La cromatografía de líquidos es una técnica de separación en la cual una muestra se distribuye en las dos fases del sistema cromatográfico. Presenta una fase estacionaria (columna) que se caracteriza por ser sólida, porosa y con sustancias activas en sus paredes en forma de partículas de 103 MATERIAL Y MÉTODOS pequeño diámetro. Por otra parte, la fase móvil está formada por un líquido, existiendo diferentes tipos de solventes para su composición. La cromatografía se basa en la retención que sufren los componentes de una muestra cuando se hacen pasar a través de la fase sólida estacionaria (columna cromatográfica) empujados por una fase líquida (fase móvil). Existen diversos mecanismos de retención, aunque lo característico es que en todas las muestras, en las mismas condiciones, los diferentes compuestos presentan tiempos de retención específicos (Bidlingmeyer 1992; Meyer 2010). En función de la polaridad de la fase móvil y de la fase estacionaria podemos definir dos modalidades de cromatografía: cromatografía en fase normal y cromatografía en fase inversa. En la cromatografía en fase normal la fase móvil es apolar y la fase estacionaria es polar. Por tanto, un compuesto será más fuertemente retenido cuanto más polar sea, eluyendo más tarde que los componente apolares. En cambio, en la modalidad en fase inversa la fase móvil es polar y la estacionaria apolar, por lo que existirá mayor retención en la columna para los componentes apolares aumentando su tiempo de retención, ya que los componentes polares se transportan con mayor facilidad en la fase móvil (Meyer 2010). Asimismo, en función de la fase móvil podemos decir que la separación se produce en condiciones isocráticas cuando la composición de la fase móvil no se modifica y se denomina cromatografía en gradiente cuando la composición de la fase móvil se modifica durante el experimento. La modalidad de cromatografía utilizada en esta investigación es cromatografía en fase inversa bajo condiciones isocráticas; es decir, en la 104 MATERIAL Y MÉTODOS técnica cromatográfica empleada en este trabajo la fase estacionaria fue apolar y la fase móvil polar, no realizándose modificaciones en la composición de la misma a lo largo del experimento. Como se ha descrito anteriormente, la cromatografía es una técnica de separación, sin embargo una vez separados los compuestos deben ser cuantificados por medio de otras técnicas. En este caso se utilizó para las monoaminas la detección electroquímica, que se caracteriza por ser altamente sensible, de bajas dimensiones y presentar un coste y unos requerimientos energéticos bajos. Puesto que la detección electroquímica no requiere derivatización de la muestra (como la detección fluorimétrica) resulta un método más sencillo para el análisis de catecolaminas, aunque es más sensible a los cambios de flujo de la bomba, incrementado la relación de señal-ruido (Bicker et al. 2013). En términos generales, la detección electroquímica se basa en la medida de corriente resultante de la reacción de oxidación-reducción de los analitos del dializado. Esta corriente es inducida por electrodos ajustados a un determinado potencial. Podemos diferenciar dos modalidades de detección electroquímica en HPLC: amperométrica y coulométrica. En la amperométrica solo una fracción de analito es oxidada o reducida (normalmente del 5 al 15 %), mientras que en la detección coulométrica se produce la conversión del 100 % del analito (Tsunoda 2006; Zapata et al. 2009). La detección coulométrica se considera más sensible y específica, mostrando límites de detección más bajos que la amperométrica; requiriendo menor volumen de muestra. Igualmente la detección coulométrica muestra mejores resultados para la detección de todos los analitos relacionados con el catabolismo dopaminérgico. 105 MATERIAL Y MÉTODOS El detector coulométrico se compone de una célula analítica con dos electrodos ajustados a diferentes voltajes, de manera que se incrementa la selectividad de detección. El primer electrodo realiza la oxidación de los compuestos que no resultan de interés para el análisis y que pueden interferir en el registro del analito de interés. El segundo electrodo se ajusta al potencial de análisis para inducir la reacción electroquímica de los analitos de interés, para ello se realiza habitualmente un voltamograma hidrodinámico (Bicker et al. 2013). Para poder trabajar con detección electroquímica es necesario que los compuestos analizados sean electroactivos, es decir, que sean susceptibles de ser oxidados o reducidos a un potencial óptimo. La oxidación o reducción del compuesto genera una corriente que es directamente proporcional a la concentración del analito. Se ha evidenciado que la detección electroquímica permite una correcta determinación de la dopamina y sus metabolitos, ya que son fácilmente convertidos en quinonas y no se requiere derivatización (Durán et al. 1998; Tsunoda 2006). Por otra parte, la mayoría de aminoácidos son pequeñas moléculas alifáticas que no poseen fluorescencia ni capacidad electroactiva, lo que dificulta su análisis mediante HPLC. Para ello se requiere un proceso de derivatización que genere un aducto fluorescente. Existen diversos derivatizadores utilizados para el análisis de aminoácidos neurotransmisores, siendo el OPA uno de los que más se ha utilizado. Además, este presenta la ventaja sobre otros reactivos de que por sí mismo no presenta fluorescencia. El OPA reacciona con los aminoácidos en presencia de N-acetil-cisteína (NAC) para generar diastereoisómeros que pueden ser analizados por medio de HPLC en fase inversa (Shah et al. 2002; Fukushima et al. 2003). 106 MATERIAL Y MÉTODOS Podemos dividir los métodos de derivatización en dos categorías: precolumna y postcolumna. Los agentes de derivatización son aplicados generalmente mediante los métodos precolumna, es decir antes de la separación cromatográfica. Además este tipo de derivatización posee la ventaja de que incrementa la hidrofobicidad de los analitos lo suficiente para que sean retenidos en una fase estacionaria en modo inverso (Fukushima et al. 2003). Tras la separación en la columna los analitos son analizados mediante un detector de fluorescencia. La fluorescencia consiste en un proceso de emisión en el cual las moléculas son excitadas por la absorción de radiación electromagnética. Las especies excitadas pasan al estado fundamental por medio de la liberación del exceso de energía en forma de fotones, que son captados por el detector. Una lámpara emite una fuerte radiación, que es recogida por un filtro que determina el ancho de banda espectral de interés y enfoca este haz sobre una célula. Otra lente recoge la energía fluorescente, que es liberada de la célula por la estimulación del haz excitador, para llevarla a un fotomultiplicador que mide la fluorescencia emitida. Tanto en la detección electroquímica como en la fluorimétrica, el registro resultante de la separación de compuestos de la muestra tras su paso por el cromatógrafo y el equipo de detección se denomina cromatograma, en el cual cada sustancia se representa por un pico cromatográfico. La identificación de los componentes en el cromatograma se puede realizar utilizando patrones de sustancias puras y de esta forma se puede determinar el tiempo de retención característico para cada sustancia específica. La cuantificación se puede realizar comparando la altura de los picos o el área de los picos con los de patrones de concentración conocida. 107 MATERIAL Y MÉTODOS 3.4.2. Equipo cromatográfico Los componentes comunes de los equipos de cromatografía de líquidos son: un sistema de bombeo para impulsar la fase móvil a un flujo constante, una válvula de inyección para introducir la muestra en el sistema a alta presión y a un flujo continuo, una columna (que contiene la fase estacionaria), un detector y un sistema de registro para obtener los cromatogramas. 3.4.2.1. Equipo cromatográfico para la detección de dopamina y sus metabolitos En este trabajo de investigación se utilizó un sistema de bombeo Jasco PU-980 de doble pistón, una válvula de inyección Rheodyne 7125 con un bucle de inyección de 20 µl y una columna de fase inversa Dionex C18 de una longitud de 15 cm y 5 µm de tamaño de partícula. La detección se realizó mediante un detector electroquímico ESA Coulochem III, dotado de una célula de detección ESA 5011A. El potencial de oxidación al que se ajustó el primer electrodo fue de + 50 mV, mientras que el electrodo de análisis fue de +400 mV, ya que este potencial nos permite detectar la dopamina y sus metabolitos evitando el registro de otros compuestos no deseados. La determinación de este potencial se realizó mediante un voltamograma hidrodinámico de patrones (Figura 3.10). 108 MATERIAL Y MÉTODOS Figura 3.10: Voltamograma hidrodinámico de patrones de DOPAC, dopamina (DA) y HVA. Se observa la respuesta cromatográfica de los patrones a los diferentes potenciales aplicados en mV. Se puede apreciar como a 400 mV se obtiene una adecuada respuesta para los tres compuestos. Los datos han sido analizados con el programa de software cromatográfico Cromanec XP versión 1.0.4 (Micronec, España). 3.4.2.2. Equipo cromatográfico para la detección de aminoácidos Para la detección de aminoácidos se utilizó un sistema de bombeo Jasco PU-980 de doble pistón, una válvula de inyección Rheodyne 7125 con un bucle de inyección de 20 µl y una columna de fase inversa Kromasil 100 C18 (25 cm de longitud y 5 µm de tamaño de partícula). Se muestra en la Figura 3.11. 109 MATERIAL Y MÉTODOS La detección se realizó mediante un detector de fluorescencia CMA 280 (CMA Microdyalisis, Suecia). Como fuente de excitación utiliza una lámpara de tungsteno de 20 W, con una longitud de excitación entre 340360 nm y una longitud de emisión entre 395-545 nm. La determinación de la sensibilidad para la detección de cada aminoácido fue puesta a punto mediante el análisis de patrones. Los datos han sido analizados con el programa de software cromatográfico Cromanec XP versión 1.0.4 (Micronec, España). Figura 3.11 : Equipo cromatográfico utilizado en la experimentación. A. válvula de inyección Rheodyne 7125. B. Bomba Jasco PU-980. C. Tubería y adaptadores para HPLC. D. Columna cromatográfica. E. Detector electroquímico ESA Coulochem III (para análisis de la dopamina y sus metabolitos). F. Detector de fluorescencia CMA 280 (para análisis de aminoácidos). G. Célula analítica ESA 5011A. 110 MATERIAL Y MÉTODOS 3.4.3. Condiciones cromatográficas para la determinación de dopamina y sus metabolitos La detección electroquímica depende de la transferencia electrónica entre la fase móvil y el electrodo de detección. La fase móvil debe tener una constante dieléctrica suficientemente alta para permitir la ionización del electrolito y debe ser electroquímicamente inerte a la superficie del electrodo. Por tanto, la composición de la fase móvil resulta crítica (Zapata et al. 2009). Para el análisis de la dopamina, DOPAC y HVA se utilizó un solvente formado por KH2PO4 100mM, SOS 1mM, EDTA 1mM y 5% de metanol. El pH fue ajustado a 3,4 con ácido fosfórico (H3PO4). Una vez preparada la fase móvil se filtró a través de un filtro Whatman de 0,45 µm y se desgasificó con helio. El flujo al que se ajustó la bomba de la fase móvil fue de 1,5 ml/min, con una presión aproximada de 165 kg/cm2. Estas condiciones cromatográficas fueron desarrolladas específicamente para el estudio de la liberación de dopamina y sus metabolitos en el núcleo estriado de rata. De este modo se consigue una buena separación de dopamina, DOPAC y HVA en un tiempo total de registro inferior a 20 minutos. Estas condiciones de trabajo han sido utilizadas recientemente en nuestro laboratorio para la caracterización de los efectos de diversas sustancias sobre la dopamina en el núcleo estriado (Ferreira-Nunes et al. 2010; Machado et al. 2010; Faro et al. 2012a; Faro et al. 2013). Por otra parte, la composición, la polaridad y el pH de la fase móvil evita que el registro sea afectado por otros picos cromatográficos pertenecientes a sustancias del dializado que no son objeto de estudio, como es el caso del ácido úrico derivado del metabolismo celular (Durán et al. 1998). 111 MATERIAL Y MÉTODOS 3.4.4. Condiciones cromatográficas para la determinación de aminoácidos neurotransmisores La condiciones cromatográficas siguieron los protocolos aplicados previamente para el análisis de aminoácidos mediante fluorescencia en nuestro laboratorio (Cianca et al. 2009). El reactivo utilizado para la derivatización de las muestras fue OPANAC. El procedimiento fue el siguiente: 20 µl de la muestra se disuelven con 20 µl de NaOH 0,1M y 60 µl de tampón borato de sodio 0,01 M hasta un volumen final de 100 µl. Finalmente se añaden 5 µl de OPA-NAC dejando que reaccione durante 2 minutos a temperatura ambiente. Por último, se inyectan 20 µl de la disolución en el cromatógrafo. El análisis cromatográfico se realizó en condiciones isocráticas, la fase móvil estuvo compuesta por un 12% de acetonitrilo en un tampón de acetato de sodio 30 mM. El flujo aplicado fue de 1,5 ml/min. El pH fue ajustado a 5,5 utilizando ácido acético glacial. Una vez preparada la fase móvil fue filtrada a través de un filtro Whatman de 0,45 µm y se desgasificó con helio. En la Figura 3.12 se muestra el esquema completo de muestreo mediante microdiálisis cerebral asociada a HPLC donde se representan todos los elementos de la experimentación utilizada en esta investigación. 112 MATERIAL Y MÉTODOS Figura 3.12: Esquema general de microdiálisis cerebral y HPLC utilizado en esta investigación. 1. Bomba de microdiálisis con dos microjeringas para el tratamiento específico (A, B). 2. Sonda de microdiálisis ubicada sobre la cánula-guía. 3. Microcolector de fracciones. 4. Bomba de HPLC. 5. Fase móvil. 6. Columna cromatográfica. 7. Detector. 8. Sistema de registro -equipo de sobremesa (modificado de CMA). 113 MATERIAL Y MÉTODOS 3.5. DISEÑO EXPERIMENTAL Las concentraciones y dosis utilizadas para cada compuesto se han establecido atendiendo a los siguientes parámetros: - Experiencia previa de nuestro equipo de investigación. - Evidencia publicada en la literatura científica. - Pruebas preliminares antes de iniciar el grupo experimental. En la Tabla 3.5 se resumen las dosis/concentraciones utilizadas en los diferentes experimentos organizados en función si se aplicó un diseño experimental de 3 horas (coadministración con isatina) o de 4 horas (aplicando el compuesto como pretratamiento y posteriormente en coadministración). Experimentos de 3 horas Experimentos de 4 horas Compuesto Compuesto Concentración/ Dosis Concentración/ Dosis Isatina 1 mM Ringer sin Ca++ - Isatina 5 mM TTX 10 µM Isatina 10 mM Reserpina i.p. 10 mg/kg DMSO 5% Ringer alto K+ 50 mM Nomifensina 50 µM Selegilina 1 mM Clorgilina 1 mM Atropina 1 mM Selegilina 1 mM AP-5 650 µM Tropolona 1 mM MK-801 500 µM Dinitrocatecol 100 µM L-NAME 100 µM Ropinirol 5 mM 7 NI 100 µM Amantadina 5 mM L-DOPA i.e. 25 µM Otros diseños Benserazida 80 mg/kg L-DOPA (i.p.) 500 mg/kg Tabla 3.5: Resumen de todos los compuestos aplicados, especificando la concentración utilizada y agrupados según la duración de la experimentación. 114 MATERIAL Y MÉTODOS 3.5.1. Efecto de las diferentes concentraciones de isatina Los primeros grupos experimentales consistieron en el estudio de los efectos de la administración intraestriatal de isatina. Para ello, la isatina se disolvió directamente en el líquido de perfusión (Ringer) en las diferentes concentraciones usadas en este estudio (1, 5, y 10 mM) y administrada directamente a través de la sonda de microdiálisis en el núcleo estriado. Para la disolución de la isatina en la concentración de 10 mM fue necesario emplear DMSO (5 %). Para determinar que el efecto observado sobre la dopamina y sus metabolitos no era producido por el disolvente se realizó un grupo control donde se administró únicamente DMSO (5 %) disuelto en el líquido de perfusión. La isatina fue administrada durante una hora a un flujo de 1,5 µl/min tras una hora de recogida de muestras basales. Tras la administración de isatina se recogieron nuevamente muestras sometidas únicamente al líquido de perfusión. El esquema de administración se muestra en la Tabla 3.6. Tiempos 60 min 60 min 60 min Grupo 1 Ringer Isatina 1 mM Ringer Grupo 2 Ringer Isatina 5 mM Ringer Grupo 3 Ringer Isatina 10 mM Ringer Grupo 4 Ringer DMSO 5 % Ringer Tabla 3.6: Protocolo de administración de diferentes concentraciones de isatina en el núcleo estriado. 115 MATERIAL Y MÉTODOS 3.5.2. Caracterización de la liberación de dopamina estriatal estimulada por isatina Para determinar los mecanismos neuroquímicos por los cuales la isatina producía modificaciones en los niveles de dopamina y sus metabolitos, la isatina fue administrada en animales pretratados con otros compuestos o medios de perfusión modificados y se coadministró con otras sustancias de efecto farmacológico conocido sobre la terminal dopaminérgica. - Medio Ringer sin Ca++: en este caso la isatina se disolvió en una solución Ringer sin CaCl2 (manteniendo la osmolaridad del medio). El protocolo ejecutado fue el siguiente: tras una hora de muestras basales se perfundió el medio sin Ca++, posteriormente se administró isatina disuelta en este medio modificado durante una hora; durante la última hora se perfundió un medio sin modificar (Tabla 3.7). Tiempos 60 min 60 min 60 min Isatina 10 mM Grupo Ringer sin 60 min Ringer Ringer sin Ca Ca++ ++ + Ringer Ringer sin Ca++ Tabla 3.7: Protocolo de administración intraestriatal de isatina disuelta en una solución Ringer sin Ca++. - Pretratamiento con TTX: tras una hora de recogida de muestras basales, se administró la TTX (10 µM) durante otra hora, posteriormente se administró la isatina juntamente con la TTX durante una hora más. En la última hora de experimentación fue administrada una solución Ringer (Tabla 3.8). 116 MATERIAL Y MÉTODOS Tiempos 60 min 60 min 60 min 60 min Isatina 10 mM Grupo Ringer TTX TTX 10 µM + Ringer TTX 10 µM Tabla 3.8: Protocolo de administración intraestriatal de isatina en ratas pretratadas con TTX. - Pretratamiento con reserpina: la reserpina (10 mg/kg) fue administrada intraperitonealmente una hora antes del comienzo de la recogida de muestras mediante microdiálisis. La reserpina fue disuelta inicialmente en ácido acético glacial y posteriormente diluida en glucosa al 5,5 % hasta alcanzar una concentración final de 5 mg/ml (Tabla 3.9). Tiempos 60 min antes de 60 min 60 min Ringer Isatina 10 mM 60 min experimento Grupo Reserpina 10 mg/kg Reserpina intraperitoneal Ringer Tabla 3.9: Protocolo de administración intraestriatal de isatina en ratas pretratadas sistémicamente con reserpina. - Coadministración de nomifensina: la nomifensina fue disuelta en una solución Ringer hasta la concentración de 50 µM y administrada durante una hora después de la recogida de las muestras basales. En otro grupo se administró nomifensina (50 µM) e isatina conjuntamente en la segunda hora de experimentación (Tabla 3.10). Tiempos 60 min 60 min 60 min Grupo Ringer Nomifensina 50 µM Ringer Nomifensina Ringer Isatina 10 mM + Nomifensina 50 µM Ringer 50 µM Tabla 3.10: Protocolo de administración intraestriatal de isatina en ratas tratadas con nomifensina. 117 MATERIAL Y MÉTODOS - Medio Ringer con alta concentración de K+: el Ringer con alta concentración de K+ (50 mM) se perfundió durante una hora después de recoger las muestras basales. En otro grupo se administró isatina disuelta en este medio en la segunda hora de experimentación (Tabla 3.11). Tiempos 60 min 60 min 60 min Grupo Ringer Ringer Alto K+ 50 mM Ringer Ringer Alto Ringer Isatina 10 mM + Ringer Alto K+ 50 mM Ringer K + Tabla 3.11: Protocolo de administración intraestriatal de isatina disuelta en un medio Ringer alto K+. 3.5.3. Mediación de las isoformas de la MAO en el efecto de la isatina sobre la liberación de dopamina Para observar cómo varía el efecto de la isatina sobre la dopamina al inhibir las isoformas A y B de la MAO se coadministró isatina con un inhibidor selectivo de la isoforma A (clorgilina en una concentración 1 mM) o con un inhibidor selectivo de la isoforma B (selegilina en una concentración 1 mM). Ambos inhibidores se administraron durante una hora en la segunda hora de experimentación, primero de forma aislada y después en conjunto con la isatina (Tabla 3.12). Tiempos 60 min 60 min 60 min Grupo Ringer Clorgilina 1 mM Ringer inhibidores Ringer Isatina 10 mM + Clorgilina 1 mM Ringer de la MAO Ringer Selegilina 1 mM Ringer Ringer Isatina 10 mM + Selegilina 1 mM Ringer Tabla 3.12: Protocolo de administración intraestriatal de isatina en ratas tratadas con inhibidores de la MAO (clorgilina y selegilina). 118 MATERIAL Y MÉTODOS Debido a que la isatina se describe como un inhibidor selectivo de la isoforma B, la selegilina también se administró como pretratamiento (aplicándola una hora antes de la isatina y durante una hora más en conjunto) para determinar si una aplicación previa producía alteraciones en el efecto de la isatina (Tabla 3.13). Tiempos 60 min 60 min 60 min Isatina 10 mM Grupo Selegilina 60 min Ringer Selegilina 1 mM + Ringer Selegilina 1 mM pretatada Tabla 3.13: Protocolo de administración intraestriatal de isatina en ratas pretratadas con selegilina. 3.5.4. Efectos de la isatina junto con compuestos con acción antiparkinsoniana sobre la neurotransmisión dopaminérgica Para determinar las interacciones dopaminérgicas que pueden presentar otros compuestos antiparkinsonianos con los efectos de la isatina sobre los niveles de dopamina se coadministró la isatina juntamente con compuestos que se describen en la literatura científica como antiparkinsonianos o que presentan la misma acción que estos. - Coadministración con inhibidores de la COMT: los inhibidores de la COMT utilizados fueron la tropolona (1 mM) y el dinitrocatecol (100 µM). Estos fueron disueltos en Ringer y coadministrados juntamente con la isatina durante la segunda hora de experimentación (Tabla 3.14). 119 MATERIAL Y MÉTODOS Tiempos 60 min 60 min 60 min Grupo Ringer Tropolona 1 mM Ringer inhibidores Ringer Isatina 10 mM + Tropolona 1 mM Ringer de la COMT Ringer Dinitrocatecol 100 µM Ringer Ringer Isatina 10 mM + Dinitrocatecol 100 µM Ringer Tabla 3.14: Protocolo de administración intraestriatal de isatina en ratas tratadas con inhibidores de la COMT (tropolona y dinitrocatecol). - Pretratamiento con atropina: la atropina, antagonista competitivo de los receptores muscarínicos de la acetilcolina, fue disuelta en el líquido de perfusión (concentración 1 mM) y administrada durante una hora previa a la infusión de isatina. Posteriormente se coadministraron ambos compuestos durante una hora (Tabla 3.15). Tiempos 60 min 60 min 60 min Isatina 10 mM Grupo Atropina 60 min Ringer Atropina 1 mM + Ringer Atropina 1 mM Tabla 3.15: Protocolo de administración intraestriatal de isatina en ratas pretratadas con atropina. - Coadministración con ropinirol: el ropinirol, agonista dopaminérgico con mayor afinidad sobre receptores dopaminérgicos del subtipo D3, fue disuelto en el líquido de perfusión (concentración 5 mM) y coadministrado juntamente con la isatina durante la segunda hora de experimentación (Tabla 3.16). Tiempos 60 min 60 min 60 min Grupo Ringer Ropinirol 5 mM Ringer ropinirol Ringer Isatina 10 mM + Ropinirol 5 mM Ringer Tabla 3.16: Protocolo de administración intraestriatal de isatina en ratas tratadas con ropinirol. - Coadministración con amantadina: la amantadina es un antivírico que ejerce diversas acciones sobre la neurotransmisión: antagonista de los 120 MATERIAL Y MÉTODOS receptores glutamatérgicos de tipo NMDA, incrementa la liberación de dopamina y bloquea su recaptación. La amantadina fue disuelta en el líquido de perfusión (concentración 5 mM) y coadministrada con la isatina durante la segunda hora de experimentación (Tabla 3.17). Tiempos 60 min 60 min 60 min Grupo Ringer Amantadina 5 mM Ringer amantadina Ringer Isatina 10 mM + Amantadina 5 mM Ringer Tabla 3.17: Protocolo de administración intraestriatal de isatina en ratas tratadas con amantadina. - Coadministración intraestriatal con L-DOPA: la L-DOPA, precursor de la dopamina, fue disuelto en el líquido de perfusión (concentración 25 µM) y coadministrada con la isatina durante la segunda hora de experimentación (Tabla 3.18). Tiempos 60 min 60 min 60 min Grupo Ringer L-DOPA 25 µM Ringer L-DOPA i.e. Ringer Isatina 10 mM + L-DOPA 25 µM Ringer Tabla 3.18: Protocolo de administración intraestriatal de isatina en ratas tratadas con L-DOPA. - Administración sistémica de L-DOPA: para determinar el efecto que presenta la isatina sobre la dopamina en animales a los que se administró L-DOPA sistémicamente se diseñó un grupo experimental específico para ello, antes de comenzar el muestreo se administró benserazida i.p. (80 mg/kg) para inhibir la DOPA descarboxilasa (DDC), 40 minutos después de la administración de benserazida se administró L-DOPA (metil éster) i.p. a una dosis de 500 mg/kg. La isatina se administró en el estriado después de las 4 horas de muestreo con Ringer. Se realizaron grupos control específicos para la benserazida y la L-DOPA administradas por vía intraperitoneal (Figura 3.13). 121 MATERIAL Y MÉTODOS Figura 3.13: Cronograma que muestra el protocolo de administración de isatina en ratas a las que se les administró sistémicamente benserazida y L-DOPA. Los compuestos ubicados en la parte superior del cronograma muestran las sustancias perfundidas en cada período temporal específico. 3.5.5. Mediación de los receptores glutamatérgicos en el efecto de la isatina sobre la liberación de dopamina El siguiente grupo experimental tenía como objetivo determinar la implicación de los receptores glutamatérgicos de tipo NMDA en los efectos de la isatina sobre la liberación de dopamina estriatal. Con este fin se estudió el efecto de la isatina en presencia de AP- 5 (650 µM) o MK801 (500 µM), antagonista competitivo y no competitivo de los receptores glutamatérgicos NMDA, respectivamente. Para ello se realizó un pretratamiento con los antagonistas después de una hora de muestras, para posteriormente coadministrarlos intraestriatalmente durante otra hora con isatina (Tabla 3.19). Tiempos 60 min 60 min 60 min 60 min Grupo Ringer AP-5 650 µM Isatina 10 mM + Ringer AP-5 650 µM antagonistas glutamatérgicos Ringer MK- 801 500 Isatina 10 mM + µM MK- 801 500 µM Ringer Tabla 3.19: Protocolo de administración intraestriatal de isatina en ratas pretratadas con antagonistas glutamatérgicos NMDA (AP-5 y MK- 801). 122 MATERIAL Y MÉTODOS 3.5.6. Mediación del óxido nítrico en el efecto de la isatina sobre la liberación de dopamina Al igual que en el caso anterior se comprobó si el óxido nítrico podía tener alguna participación en la acción de la isatina sobre la liberación de dopamina. Para ello se administró la isatina en conjunto con inhibidores de la óxido nítrico sintasa (NOS; del inglés Nitric Oxide Synthase): el LNAME y el 7-NI. La disolución de ambos inhibidores se realizó en el líquido de perfusión hasta las concentraciones utilizadas (100 µM). Cada uno de los compuestos fue administrado intraestriatalmente durante una hora de forma aislada y después en conjunto con la isatina una hora más (Tabla 3.20). Tiempos 60 min 60 min 60 min 60 min Grupo Ringer L-NAME 100 µM Isatina 10 mM + L- Ringer NAME 100 µM antagonistas NOS Ringer 7-NI 100 µM Isatina 10 mM + 7-NI Ringer 100 µM Tabla 3.20: Protocolo de administración intraestriatal de isatina en ratas pretratadas con inhibidores de la NOS (L-NAME y 7-NI). 3.5.7. Efecto de la isatina sobre aminoácidos neurotransmisores en el núcleo estriado Para determinar el efecto de la isatina sobre la liberación de aminoácidos neurotransmisores en el núcleo estriado se administró, vía intraestriatal, la isatina (10 mM) durante una hora. Se siguió el mismo protocolo de administración que para el estudio del efecto de isatina 10 mM sobre la liberación de dopamina (Tabla 3.21). 123 MATERIAL Y MÉTODOS Tiempos 60 min 60 min 60 min Grupo Ringer Ringer Ringer aminoácidos Ringer Isatina 10 mM Ringer Tabla 3.21: Protocolo de administración intraestriatal de isatina para su posterior análisis con HPLC fluorimétrica para determinación de aminoácidos neurotransmisores. 3.6. EXPRESIÓN DE LOS RESULTADOS Y TRATAMIENTO ESTADÍSTICO Los resultados obtenidos en períodos de 20 minutos se expresan como porcentaje de liberación respecto al basal. En el caso de la dopamina y los aminoácidos los valores basales se determinaron calculando la media de las dos muestras anteriores a la administración de los diferentes tratamientos considerándolas como el 100% de liberación. En el caso del DOPAC y HVA se consideró como basal, para el cálculo del efecto de las sustancias, la muestra anterior a la administración de los compuestos. Esto se debe a que los metabolitos requieren más tiempo para su estabilización, por lo que resulta más apropiado considerar solo la tercera muestra inicial como basal. En todos los casos, los resultados fueron corregidos considerando los porcentajes de recuperación de cada sonda calculados in vitro para cada sustancia analizada. Dichos resultados se expresan como la media ± E.E.M. para un número de experimentos de n=5-7, a excepción del grupo de isatina 10 mM en el que se utilizó un n=11. Los resultados fueron tratados estadísticamente mediante el análisis de varianza (ANOVA) y el test de 124 MATERIAL Y MÉTODOS comparación múltiple de Student Newman-Kleus. Los niveles de significación considerados fueron: * a P< 0,05, **P<0,01 y ***P<0,001 respecto al basal. P< 0,05, bP<0,01 y cP<0,001 respecto al grupo de isatina 10 mM, en el mismo tiempo. 125 MATERIAL Y MÉTODOS 126 4 RESULTADOS Efectos de la isatina sobre la neurotransmisión dopaminérgica en el núcleo estriado. Un estudio in vivo mediante microdiálisis cerebral. RESULTADOS 4.1. RESULTADOS CROMATOGRÁFICOS Las condiciones cromatográficas utilizadas en esta investigación, descritas en el apartado anterior, fueron desarrolladas específicamente para el estudio de la liberación de dopamina y sus metabolitos en el núcleo estriado de ratas. En estas condiciones se consigue una buena separación de las sustancias analizadas en un corto período de tiempo, sin que se produzca interferencia por otras moléculas. En la Figura 4.1 se muestra un cromatograma representativo de patrones (A) en el que se pueden apreciar los picos correspondientes a la dopamina y sus metabolitos (DOPAC y HVA). Igualmente, en todos los cromatogramas aparece el principal metabolito de la serotonina, el ácido 5-hidroxiindolacético (HIAA). En la sección B de la figura se muestra una superposición de cromatogramas de muestras de dializados: en verde y azul se representan cromatogramas correspondientes a la administración de una solución Ringer (muestras basales), mientras que en magenta se representa la evolución de los cromatogramas anteriores tras la administración 10 mM de isatina, donde se aprecia claramente el incremento de la dopamina. 129 RESULTADOS A B Figura 4.1: A. Cromatograma representativo de patrones de las sustancias analizadas por medio de HPLC-EC en las condiciones cromatográficas descritas previamente. Todas las sustancias se han registrado a la misma sensibilidad. B. Superposición de cromatogramas de dializados cerebrales de muestras experimentales: en azul y verde se representan los cromatogramas de muestras basales y en magenta el de un dializado tras administrar 10 Mm de isatina. La dopamina fue registrada a una sensibilidad 10 veces mayor que el resto de compuestos. 130 RESULTADOS 4.2. EFECTO DE LA PERFUSIÓN INTRAESTRIATAL DE ISATINA SOBRE LA LIBERACIÓN DE DOPAMINA Los niveles extracelulares de dopamina y sus metabolitos en el núcleo estriado fueron estables durante el período de experimentación en las ratas control que no fueron sometidas a ningún tipo de tratamiento (únicamente perfusión continua de solución Ringer). Los valores basales, expresados en ng/20 min, se muestran en la Tabla 4.1. Compuesto Dopamina DOPAC HVA Valor basal (ng/ 20 min) 0,32 ± 0,04 33,62 ± 9,38 1,91 ± 0,33 Tabla 4.1: Valores basales (expresado en ng/20 min) para la dopamina, el DOPAC y el HVA. Para determinar el efecto de la administración de isatina sobre los niveles extracelulares de dopamina y sus metabolitos en el núcleo estriado se realizó la perfusión, a través de la sonda de microdiálisis, de diferentes concentraciones de isatina: 1 mM, 5 mM y 10 mM. Las diferentes intraestriatalmente concentraciones durante 60 de minutos isatina produjeron administradas incrementos significativos en los niveles extracelulares de dopamina, siendo estos incrementos dependientes de la concentración utilizada. Los incrementos obtenidos fueron: 355,2 ± 104,1 %; 699,4 ± 72,2 % y 1240,8 ± 145,9 %, respecto al basal, para las concentraciones de 1 mM, 5 mM y 10 mM respectivamente (Figura 4.2). En todos los casos, el incremento máximo se produjo 40 minutos después de comenzar la perfusión de la isatina. Tras dicho aumento máximo, los niveles extracelulares de dopamina tendieron a normalizarse, volviendo a los valores basales 40 minutos después del término de la administración de la isatina. 131 RESULTADOS En la Figura 4.2 también se muestran las variaciones en las concentraciones extracelulares de DOPAC y HVA, en relación al basal, para las distintas concentraciones de isatina. En este caso se observó que la administración de isatina en las concentraciones de 1 mM y 5 mM no produjo modificaciones estadísticamente significativas en los niveles estriatales de DOPAC y HVA. Sin embargo, la perfusión intraestriatal de isatina en una concentración de 10 mM produjo una disminución significativa de estos niveles, alcanzando los valores mínimos de 70,9 ± 12,6 % y 81,4 ± 6,4 %, con respecto al basal, para el DOPAC y el HVA, respectivamente. Los valores mínimos se observaron 80 minutos después del comienzo de la administración de isatina. Durante los 40 minutos restantes de los experimentos los valores de ambos metabolitos vuelven a equipararse a los basales. Para determinar si el DMSO (utilizado para disolver la isatina en una concentración de 10 mM) provocó modificaciones en los niveles estriatales de la dopamina y sus metabolitos se realizó un grupo control en el que se administró únicamente DMSO (5%) disuelto en Ringer. Los resultados obtenidos mostraron que el DMSO en esta concentración no alteró significativamente los niveles de dopamina, DOPAC y HVA durante toda la experimentación (Figura 4.2). 132 RESULTADOS DA (% respecto al basal) Isatina 10 mM Isatina 5 mM Isatina 1 mM Control 5 % DMSO A *** 1400 1200 *** 1000 *** *** 800 600 *** 400 ** * *** ** 200 *** *** * 0 20 40 60 80 100 120 140 160 *** *** ** 100 120 140 160 * ** * 120 140 160 180 HVA (% respecto al basal) DOPAC (% respecto al basal) Tiempo (min) B 180 160 140 120 100 80 60 40 20 0 20 40 60 80 Tiempo (min) C 180 160 140 120 100 80 60 40 20 0 20 180 40 60 80 100 180 Tiempo (min) Figura 4.2: Efecto de la perfusión de isatina (1, 5, 10 mM) y DMSO (5%) sobre los niveles estriatales de dopamina (A), DOPAC (B) y HVA (C). La isatina fue perfundida durante 60 minutos a partir del momento indicado por la flecha. Los resultados se muestran como la media ± EEM (n= 4-11) expresados como porcentaje en relación a los valores basales considerados el 100%. Niveles de significación: *P< 0,05, **P<0,01 y ***P<0,001, con respecto al basal. 133 RESULTADOS 4.3. CARACTERIZACIÓN DE LA LIBERACIÓN DE DOPAMINA ESTRIATAL ESTIMULADA POR ISATINA Para determinar los posibles mecanismos de acción de la isatina sobre la liberación de dopamina y sus metabolitos, los animales de experimentación fueron sometidos a diferentes tratamientos y modificaciones del medio de perfusión: Los medios de perfusión modificados que se utilizaron fueron: un medio Ringer sin Ca++ y un medio Ringer con alta concentración de K+ (50 mM). Para estudiar la implicación de los canales de Na+ dependientes de voltaje se utilizó TTX (10 µM). Para establecer si la dopamina liberada era de origen vesicular se utilizó reserpina (10 mg/kg i.p.). Para determinar la implicación del transportador de dopamina (DAT) se administró nomifensina (50 µM). De este modo, se consiguió investigar si el incremento en los niveles de dopamina inducidos por la isatina era debido a un mecanismo exocitótico (vesicular, dependiente de calcio y de voltaje) y/o mediado por el DAT. 134 RESULTADOS 4.3.1. Administración de isatina disuelta en un medio Ringer sin Ca++ Para evaluar el papel del calcio externo sobre la liberación de dopamina inducida por la isatina, se sustituyó el medio Ringer por uno modificado libre de Ca++. El efecto producido en los niveles extracelulares de dopamina y sus metabolitos se muestra en la Figura 4.3. Una hora después del comienzo de la perfusión del medio Ringer sin Ca++ se produjo un descenso significativo en los niveles de dopamina y DOPAC hasta un 55,0 ± 5,8 % y 79,7 ± 5,0 %, en relación al basal, respectivamente. No se observaron modificaciones significativas en los niveles de HVA. Los valores anteriores son considerados como basales para determinar el efecto de la isatina disuelta en un medio libre de Ca++. La administración de isatina disuelta en este medio produjo un ligero incremento en los niveles de dopamina hasta un 119,4 ± 20,4 %, respecto al basal (40 minutos después del comienzo de la administración de isatina). Los niveles de DOPAC no sufrieron modificaciones significativas. Los niveles de HVA descendieron hasta un 63,1 ± 6 % con respecto al basal; dicho descenso se produjo a los 40 minutos del término de administración de isatina y no se observó un regreso a los niveles basales al término de los experimentos. Estas variaciones en los niveles de dopamina fueron significativamente distintas a las producidas por la isatina en un medio Ringer normal, pues supuso una reducción del 90,4 % del efecto máximo de la isatina, lo que indica que la liberación de dopamina inducida por isatina es dependiente de Ca++ extracelular. 135 RESULTADOS HVA (% respecto al basal) DOPAC (% respecto al basal) DA (% respecto al basal) Isatina 10 mM 1400 Isatina 10 mM + Ringer sin calcio A *** 1200 *** 1000 *** 800 600 *** 400 200 *** a ** c *** *** * ** b ** 160 180 200 *** *** ** 160 180 200 * ** 0 20 40 60 80 100 120 140 220 240 220 240 Tiempo (min) 180 160 140 120 100 80 60 40 20 0 B ** * 20 180 160 140 120 100 80 60 40 20 0 40 60 80 100 ** 120 140 Tiempo (min) C ** * 20 40 60 80 100 120 140 160 180 * *** *** ***a 200 220 240 Tiempo (min) Figura 4.3: Efecto de la perfusión intraestriatal de isatina (10 mM) diluida en un medio Ringer sin Ca++ sobre los niveles estriatales de dopamina (A), DOPAC (B) y HVA (C). La isatina fue perfundida durante 60 minutos a partir del momento indicado por la flecha. La perfusión del Ringer sin Ca++ fue realizada durante 120 minutos, mostrado en la barra negra. Los datos se expresan como la media ± EEM (n= 4-11) de los valores basales considerados el 100%. Niveles de significación: *** a b c * P< 0,05, ** P<0,01, P<0,001, con respecto al basal y P< 0,05, P< 0,01, P< 0,001, con respecto al grupo de isatina (10 mM). 136 RESULTADOS 4.3.2. Efecto de la isatina en animales tratados con TTX Para evaluar el papel de los canales de Na+ dependientes de voltaje en la liberación de dopamina inducida por la isatina, se comprobó su efecto en animales tratados con TTX (10 µM). La administración intraestriatal de TTX, a través de la sonda de microdiálisis, durante 60 minutos disminuyó significativamente los niveles extracelulares de dopamina y DOPAC hasta un 59,8 ± 12,1 % y 51,8 ± 14,1 %, respecto al basal, respectivamente. No se produjeron modificaciones significativas en los niveles de HVA. Los valores anteriores fueron considerados como basales para determinar el efecto de la isatina en animales tratados con TTX. La administración de isatina en animales tratados con TTX produjo un ligero, pero significativo, incremento en los niveles de dopamina hasta un 204,9 ± 65,7 %, respecto al basal (60 minutos después del comienzo de la administración de isatina). Se observó un descenso máximo de los niveles de HVA hasta un 28,6 ± 9,8 %, con respecto al basal, produciéndose dicho descenso en la última muestra del experimento. Los niveles de DOPAC no sufrieron modificaciones estadísticamente significativas. Las variaciones en los niveles de dopamina fueron significativamente distintas a las producidas por la isatina sola, de modo que supuso una reducción de un 83,5 % del efecto máximo de la isatina, lo que indica que el tratamiento con TTX induce un bloqueo del efecto de la isatina sobre la liberación de dopamina (Figura 4.4). 137 RESULTADOS Isatina 10 mM Isatina 10 mM + TTX 10 µM DA (% respecto al basal) 1400 1200 1000 800 600 400 200 0 DOPAC (% respecto al basal) A 180 160 140 120 100 80 60 40 20 0 *** *** *** *** * 20 40 60 80 100 120 *** b *** c *** b 140 160 180 200 220 240 Tiempo (min) B *** ** ** *** 20 40 60 80 100 120 140 160 180 200 220 240 HVA (% respecto al basal) Tiempo (min) C 180 160 140 120 100 80 60 40 20 0 * * ** ** b *** a *** c *** c ***c 20 40 60 80 100 120 140 160 180 200 220 240 Tiempo (min) Figura 4.4: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de dopamina (A), DOPAC (B) y HVA (C) en animales tratados con TTX (10 µM). La isatina fue perfundida durante 60 minutos a partir del momento indicado por la flecha. La perfusión de TTX fue realizada durante 120 minutos, mostrado mediante la barra negra. Los datos se expresan como la media ± EEM (n= 6-11) de los valores basales considerados el 100%. Niveles de significación: *P< 0,05, **P<0,01, *** P<0,001, con respecto al basal y aP< 0,05, bP< 0,01, cP< 0,001, con respecto al grupo de isatina (10 mM). 138 RESULTADOS 4.3.3. Efecto de la isatina en animales tratados con reserpina Para comprobar si la liberación de dopamina inducida por isatina era de origen vesicular o citoplasmático, los animales fueron pretratados con reserpina (10 mg/kg i.p.) 60 minutos antes del inicio de los experimentos. Dos horas después de la administración de reserpina los niveles extracelulares de dopamina disminuyeron significativamente hasta un 68,7 ± 7,6 %, con respecto a los niveles basales. Los niveles de DOPAC y HVA también sufrieron descensos significativos hasta un 61,9 ± 4,4 % y 62,5 ± 6,9 %, con respecto al basal, respectivamente. Los valores anteriores fueron considerados como basales para determinar el efecto de la isatina en animales reserpinizados. La administración de isatina en animales reserpinizados produjo un incremento de los niveles de dopamina hasta un 267,8 ± 135,2 %, con respecto a los niveles basales (60 minutos después del comienzo de la administración de isatina). Los niveles de DOPAC y HVA sufrieron descensos significativos hasta un 52,3 ± 5,3 % y 40,5 ± 3,9 %, respectivamente, en relación al basal (80 minutos después del comienzo de la administración de isatina). Los niveles de HVA fueron significativamente más bajos que en el caso de la administración de isatina sola. Las variaciones observadas en los niveles de dopamina fueron significativamente distintas a las producidas por la isatina sola, lo que supuso un descenso del 78,4 % del efecto máximo de la isatina, indicando que la liberación de dopamina inducida por isatina es disminuida por la reserpina, siendo por lo tanto una liberación vesicular (Figura 4.5). 139 RESULTADOS DA (% respecto al basal) Isatina 10 mM 1400 Isatina 10 mM + RES 10 mg/kg A *** 1200 *** 1000 *** 800 600 400 *a * 200 *b *a *** 40 60 80 100 120 * * 0 20 *** 140 160 180 200 220 240 *** *** ** ** * ** 160 180 200 220 240 * ** * DOPAC (% respecto al basal) Tiempo (min) 180 160 140 120 100 80 60 40 20 0 B ** 20 40 60 80 100 120 140 HVA (% respecto al basal) Tiempo (min) 180 160 140 120 100 80 60 40 20 0 C 20 40 60 80 100 ** b 120 140 *c 160 ** b *** c ** b 180 200 220 *a 240 Tiempo (min) Figura 4.5: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de dopamina (A), DOPAC (B) y HVA (C) en ratas reserpinizadas. La reserpina se administró i.p. 60 minutos antes del inicio del experimento. La isatina fue perfundida durante 60 minutos a partir del momento indicado por la flecha. Los datos se expresan como la media ± EEM (n= 4-11) de los valores basales considerados el 100%. Niveles de significación: *P< 0,05, **P<0,01, ***P<0,001, con respecto al basal y aP< 0,05, bP< 0,01, cP< 0,001, con respecto al grupo de isatina (10 mM). 140 RESULTADOS 4.3.4. Efecto de la isatina en animales tratados con nomifensina Con el objetivo de investigar el posible papel del DAT en la liberación de dopamina inducida por isatina, se administró la isatina en animales tratados con nomifensina, compuesto que inhibe la recaptación de dopamina a través del transportador. La administración de nomifensina (50 µM) a través de la sonda de microdiálisis incrementó los niveles de dopamina hasta un 1178,8 ± 206,4 % respecto a los basales (40 minutos después del comienzo de la administración de nomifensina). La nomifensina no produjo modificaciones significativas en los niveles de los metabolitos. Cuando la isatina fue administrada juntamente con la nomifensina los niveles de dopamina se incrementaron hasta un 1398,8 ± 286,7 %, respecto a los basales (40 minutos después del comienzo de la administración de isatina). Además, se produjo un incremento significativo en los niveles extracelulares de DOPAC hasta un 179,1 ± 19,6 %, con respecto al basal (20 minutos después del comienzo de la administración), los niveles de este metabolito son significativamente diferentes a los de la administración de isatina sola. No se produjeron modificaciones significativas en los niveles de HVA. Este incremento en los niveles de dopamina no mostró diferencias significativas con respecto al efecto de la administración de isatina sola. Por tanto, la nomifensina no altera la liberación de dopamina inducida por isatina (Figura 4.6). 141 RESULTADOS DA (% respecto al basal) Isatina 10 mM Isatina 10 mM + NOM 50 µM NOM 50 µM A *** 1600 1400 1200 1000 800 600 400 200 0 *** ** *** *** *** *** *** *** ** 20 40 60 80 *** 100 120 140 160 180 180 DOPAC (% respecto al basal) Tiempo (min) B 250 *b 200 b a a 150 100 50 *** *** ** 100 120 140 160 * ** * 120 140 160 0 20 40 60 80 HVA (% respecto al basal) Tiempo (min) C 250 200 150 100 50 0 20 40 60 80 100 180 Tiempo (min) Figura 4.6: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de dopamina (A), DOPAC (B) y HVA (C) en animales tratados con nomifensina (50 µM). La isatina y la nomifensina fueron perfundidas durante 60 minutos a partir del momento indicado por la flecha. Los datos se expresan como la media ± EEM (n= 5-11) de los valores basales considerados el 100%. Niveles de significación: * P< 0,05, ** P<0,01, *** P<0,001, con respecto al basal y aP< 0,05, bP< 0,01, con respecto al grupo de isatina (10 mM). 142 RESULTADOS 4.3.5. Administración de isatina en un medio Ringer con alta concentración de K+ Para estudiar el efecto de la isatina sobre la liberación de dopamina inducida por despolarización se perfundió en el núcleo estriado un medio Ringer con 50 mM de KCl. La administración de este medio Ringer modificado, a través de la sonda de microdiálisis, incrementó los niveles de dopamina hasta 1179,1 ± 170,9 %, respecto a los basales (20 minutos después del comienzo de su administración). Los niveles de HVA se redujeron hasta un 58,30 ± 11,2 %, con respecto a los basales (40 minutos después del comienzo de la administración del medio). No se observaron modificaciones significativas en los niveles de DOPAC. La administración de isatina disuelta en este medio produjo un incremento en los niveles de dopamina hasta 3438,2 ± 644,9 %, respecto al basal (40 minutos después del comienzo de la administración de isatina). Los niveles de DOPAC y HVA sufrieron descensos significativos hasta 57,6 ± 3,96 % y 60,9 ± 5,5 %, respectivamente, en relación al basal (60 minutos después del comienzo de la administración de la isatina). Las variaciones observadas en los niveles de dopamina fueron significativamente distintas a las producidas por la isatina en un medio Ringer normal, suponiendo un incremento de 2,8 veces del efecto máximo de la isatina, lo que indica que la isatina aumenta la liberación de dopamina estimulada por KCl (Figura 4.7). 143 RESULTADOS DA (% respecto al basal) Isatina 10 mM 4000 3500 3000 2500 2000 1500 1000 500 0 Isatina 10 mM + KCl 50 mM A *** c KCl 50 mM *** c *** c *** *** 20 40 60 80 *** *** ** b *** *a 100 120 140 160 180 160 180 DOPAC (% respecto al basal) Tiempo (min) B 250 200 150 100 *** *** 50 *** *** ** 0 20 40 60 80 100 120 140 * ** *a ** *** *** 100 120 140 HVA (% respecto al basal) Tiempo (min) 250 C 200 150 100 50 * 0 20 40 60 80 160 180 Tiempo (min) Figura 4.7: Efecto de la perfusión intraestriatal de isatina (10 mM) disuelta en un medio Ringer con alta concentración de KCl (50 mM) sobre los niveles estriatales de dopamina (A), DOPAC (B) y HVA (C). La isatina y el medio Ringer con alta concentración de KCl fueron perfundidas durante 60 minutos a partir del momento indicado por la flecha. Los datos se expresan como la media ± EEM (n= 4-11) de los valores basales considerados el 100%. Niveles de significación: *P< 0,05, **P<0,01, *** P<0,001, con respecto al basal y aP< 0,05, bP< 0,01, cP< 0,001, con respecto al grupo de isatina (10 mM). 144 RESULTADOS 4.4. MEDIACIÓN DE LAS ISOFORMAS DE LA MAO EN EL EFECTO DE LA ISATINA SOBRE LA LIBERACIÓN DE DOPAMINA Con el objetivo de investigar cómo influyen las isoformas A y B de la MAO sobre el efecto de la isatina en la liberación in vivo de dopamina se administraron intraestriatalmente inhibidores selectivos e irreversibles para cada isoforma de la enzima (clorgilina para la isoforma A y selegilina para la isoforma B). 4.4.1. Efecto de la isatina en animales tratados con clorgilina La administración de clorgilina (1 mM) a través de la sonda de microdiálisis incrementó los niveles de dopamina hasta un 890,9 ± 214,9 %, respecto a los basales (40 minutos después del comienzo de la administración de la clorgilina). La clorgilina produjo un descenso significativo sobre el DOPAC y HVA hasta un 44,4 ± 12,2 % y 43,99 ± 10,3 %, con respecto al basal, respectivamente. Este descenso máximo se observó en la última muestra de los experimentos. Cuando la isatina fue administrada juntamente con la clorgilina los niveles de dopamina se incrementaron hasta un 890,9 ± 214,9 %, respecto a los basales (20 minutos después del comienzo de la administración de isatina). Además, se produjo un descenso significativo en los niveles extracelulares de DOPAC y HVA hasta un 71,3 ± 11,2 % y 55,9 ± 6,9 %, con respecto al basal, respectivamente (80 minutos después del comienzo de la administración de isatina). Este incremento en los niveles de dopamina no mostró diferencias significativas con respecto al efecto de la administración de isatina sola. Por tanto, la clorgilina no altera la liberación de dopamina inducida por isatina (Figura 4.8). 145 RESULTADOS DA (% respecto al basal) Isatina 10 mM Isatina 10 mM + Clorgilina 1 mM Clorgilina 1 mM A *** 1400 1200 *** 1000 *** *** ** 600 400 ** * ** 200 * 0 20 DOPAC (% respecto al basal) *** 800 40 60 80 100 120 140 160 180 Tiempo (min) B 180 160 140 120 100 80 60 40 20 0 a a *** 20 40 60 80 100 a ** * *** ** * ** ** b 180 120 140 160 * ** * HVA (% respecto al basal) Tiempo (min) 180 160 140 120 100 80 60 40 20 0 C * 20 40 60 80 100 * 120 ** a 140 * *a *a *a 160 180 Tiempo (min) Figura 4.8: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de dopamina (A), DOPAC (B) y HVA (C) en animales tratados con clorgilina (1 mM). La isatina y la clorgilina fueron perfundidas durante 60 minutos a partir del momento indicado por la flecha. Los datos se expresan como la media ± EEM (n= 4-11) de los valores basales considerados el 100%. Niveles de significación: *P< 0,05, **P<0,01, ***P<0,001, con respecto al basal y aP< 0,05, bP< 0,01, con respecto al grupo de isatina (10 mM). 146 RESULTADOS 4.4.2. Efecto de la isatina en animales tratados con selegilina La administración de selegilina (1 mM), a través de la sonda de microdiálisis, incrementó los niveles de dopamina hasta un 822,97 ± 259,03 %, respecto a los niveles basales (60 minutos después del comienzo de la administración de la selegilina). Además, produjo un descenso significativo sobre el DOPAC hasta un 44,1 ± 11,1 % con respecto al basal (80 minutos después del comienzo de la administración de la selegilina). La selegilina no produjo modificaciones significativas en los niveles de HVA. Cuando la isatina fue administrada juntamente con la selegilina los niveles de dopamina se incrementaron hasta un 1627,9 ± 544,3 %, respecto a los niveles basales (20 minutos después del comienzo de la administración de la isatina). Además, se produjo un descenso significativo en los niveles extracelulares de DOPAC hasta un 52,1 ± 17,1 %, con respecto al basal (80 minutos después del comienzo de la administración de la isatina). No se produjeron modificaciones significativas sobre los niveles extracelulares de HVA. Este incremento en los niveles de dopamina no mostró diferencias significativas con respecto al efecto de la administración de isatina sola. Por tanto, la selegilina no altera la liberación de dopamina inducida por isatina (Figura 4.9). 147 RESULTADOS Isatina 10 mM Isatina 10 mM + Selegilina 1 mM Selegilina 1 mM DA (% respecto al basal) A 2500 ** ** 2000 1500 1000 *** 500 ** *** ** *** ** *** ** ** 100 120 140 * ** ** ** 160 180 0 20 40 60 80 DOPAC (% respecto al basal) Tiempo (min) 180 160 140 120 100 80 60 40 20 0 B *** a *** * * 20 40 60 80 100 ** * 120 140 * ** 120 140 * * 160 *a a 180 HVA (% respecto al basal) Tiempo (min) 180 160 140 120 100 80 60 40 20 0 C 20 40 60 80 100 Tiempo (min) * 160 180 Figura 4.9: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de dopamina (A), DOPAC (B) y HVA (C) en animales tratados con selegilina (1 mM). La isatina y la selegilina fueron perfundidas durante 60 minutos a partir del momento indicado por la flecha. Los datos se expresan como la media ± EEM (n= 4-11) de los valores basales considerados el 100%. Niveles de significación: *P< 0,05, ** P<0,01, ***P<0,001, con respecto al basal y aP< 0,05, con respecto al grupo de isatina (10 mM). 148 RESULTADOS Para determinar si el pretratamiento con selegilina (1 mM) podría modificar el efecto de la isatina sobre la liberación de dopamina se administró durante 60 minutos selegilina previamente a la administración conjunta con isatina. La administración de selegilina durante una hora produjo un incremento significativo de los niveles de dopamina hasta un 649,6 ± 135,7 %, respecto a los niveles basales (60 minutos después del comienzo de la administración de la selegilina). La selegilina no produjo modificaciones en los niveles de los metabolitos de la dopamina. Los valores anteriores fueron considerados como basales para determinar el efecto de la isatina en animales tratados con selegilina. La administración conjunta de isatina con selegilina no produjo modificaciones significativas en los niveles de dopamina, con respecto a los niveles basales. Aunque se produjo un descenso significativo en los niveles extracelulares de DOPAC y HVA hasta un 33,5 ± 4,7 % y 49,8 ± 9,01 %, con respecto a los niveles basales respectivamente. Estos efectos se produjeron 80 y 100 minutos después del comienzo de la administración de la isatina, respectivamente para el DOPAC y el HVA. Los efectos sobre los metabolitos fueron significativamente diferentes a los de la administración de isatina sola. Las variaciones observadas en los niveles de dopamina fueron significativamente distintas a las producidas por la administración de isatina sola en el mismo tiempo, supuso un descenso del 79,99 % del efecto máximo de la isatina, lo que indica que la liberación de dopamina inducida por isatina es disminuida por el pretratamiento con selegilina (Figura 4.10). 149 RESULTADOS DA (% respecto al basal) Isatina 10 mM Isatina 10 mM + Selegilina 1 mM A *** 1400 1200 1000 800 600 400 200 0 *** ** *** ** ** b 20 40 60 80 *** b 100 120 140 160 180 200 220 240 DOPAC (% respecto al basal) Tiempo (min) 180 160 140 120 100 80 60 40 20 0 B *** *** ** *a **a ** 160 180 b 20 40 60 80 100 120 140 *a *b 200 220 240 ** * HVA (% respecto al basal) Tiempo (min) 180 160 140 120 100 80 60 40 20 0 C * *a 20 40 60 80 100 120 140 160 ** **a 180 200 **b 220 **a 240 Tiempo (min) Figura 4.10: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de dopamina (A), DOPAC (B) y HVA (C) en animales pretratados con selegilina (1 mM). La isatina fue perfundida durante 60 minutos a partir del momento indicado por la flecha. La perfusión de selegilina fue realizada durante 120 minutos, mostrado en la barra negra. Los datos se expresan como la media ± EEM (n= 4-11) de los valores basales considerados el 100%. Niveles de significación: *P< 0,05, **P<0,01, *** P<0,001, con respecto al basal y aP< 0,05, bP< 0,01, con respecto al grupo de isatina (10 mM). 150 RESULTADOS 4.5. EFECTOS DE LA COADMINISTRACIÓN DE ISATINA Y COMPUESTOS DE ACCIÓN ANTIPARKINSONIANA Los resultados que se muestran a continuación representan los efectos de diferentes compuestos con acción antiparkinsoniana sobre la liberación de dopamina inducida por isatina. La finalidad de estos experimentos fue proporcionar información adicional sobre los mecanismos de acción de la isatina. Como la isatina es un compuesto endógeno, se buscó determinar cómo pueden interactuar los diferentes compuestos con el efecto de la isatina sobre la liberación de dopamina y sus metabolitos. Los compuestos utilizados en esta serie de experimentos fueron: Inhibidores de la COMT: tropolona y dinitrocatecol. Antagonista de los receptores colinérgicos: atropina. Agonista dopaminérgico: ropinirol. Antivírico con acción inespecífica utilizado en la EP: amantadina. Precursor de la dopamina: L-DOPA. 151 RESULTADOS 4.5.1. Efecto de la isatina en animales tratados con tropolona y dinitrocatecol Para investigar el efecto de la inhibición de la COMT sobre la liberación in vivo de dopamina inducida por isatina se administró isatina juntamente con tropolona (1 mM) y dinitrocatecol (100 µM) en diferentes grupos experimentales. La administración de tropolona (1 mM) a través de la sonda de microdiálisis incrementó los niveles de dopamina y DOPAC hasta un 240,9 ± 63,3 % y 211,8 ± 21,8 %, respecto a los basales, respectivamente. El incremento máximo de la dopamina se produjo a los 20 minutos del inicio de la administración de tropolona y el del DOPAC a los 40 minutos. La tropolona no produjo modificaciones significativas sobre el HVA. Cuando la isatina fue administrada juntamente con la tropolona los niveles de dopamina se incrementaron hasta un 3038,0 ± 857,4 %, respecto a los niveles basales (20 minutos después del comienzo de la administración de la isatina). Además, se produjo un descenso significativo en los niveles extracelulares de DOPAC y HVA hasta un 73,4 ± 8,1 % y 61,1 ± 10,1 % con respecto a los niveles basales, respectivamente (80 minutos después del comienzo de la administración de la isatina). Los efectos sobre los metabolitos no son significativamente diferentes a los de la administración de la isatina sola. Estas variaciones en los niveles de dopamina fueron significativamente distintas a las producidas por la isatina sola, pues supuso un incremento de 3,7 veces del efecto de la isatina en el mismo tiempo y 2,5 veces del efecto máximo de la isatina, lo que indica que la liberación de dopamina inducida por isatina es incrementada por la tropolona (Figura 4.11). 152 RESULTADOS La administración de dinitrocatecol (100 µM), a través de la sonda de microdiálisis, incrementó los niveles de dopamina hasta un 480,2 ± 138,3 %, respecto a los basales (20 minutos después del comienzo de la administración de dinitrocatecol) y un descenso de hasta un 15,6 ± 2,7 % en los niveles del HVA al término de los experimentos, con respecto al basal. El dinitrocatecol no produjo modificaciones significativas sobre el DOPAC. Cuando la isatina fue administrada juntamente con el dinitrocatecol los niveles de dopamina se incrementaron hasta un 2492,7 ± 578,2 %, respecto a los basales (20 minutos después del comienzo de la administración de la isatina). Además, se produjo un descenso significativo en los niveles extracelulares de DOPAC y HVA hasta un 63,1 ± 12,7 % y 18,1 ± 1,7 %, con respecto al basal, respectivamente. Los efectos sobre el DOPAC no fueron significativamente diferentes a los de la administración de isatina sola, mientras que sobre el HVA se observó un descenso mayor comparado con el grupo de isatina sola. El máximo descenso en el DOPAC se observó a los 80 minutos del comienzo de la administración de isatina, mientras que el HVA presentó el descenso máximo en la última muestra de los experimentos. Las variaciones en los niveles de dopamina fueron significativamente distintas a las producidas por la isatina sola, lo que supuso un incremento de 3 veces del efecto de la isatina en el mismo tiempo y el doble del efecto máximo de la isatina, lo que indica que la liberación de dopamina inducida por isatina es incrementada por el dinitrocatecol (Figura 4.12). 153 RESULTADOS DA (% respecto al basal) Isatina 10 mM Isatina 10 mM + Tropolona 1 mM Tropolona 1 mM A ***b 4000 3500 3000 2500 2000 1500 1000 500 0 ** *** **a 20 40 60 80 * *** **a *** **a 100 120 *** 140 160 180 DOPAC (% respecto al basal) Tiempo (min) 250 B ** c *a 200 *c *c 150 100 * * ** 50 *** *** ** 100 120 140 0 20 40 60 80 160 180 HVA (% respecto al basal) Tiempo (min) 250 C 200 150 100 * * * 50 ** * * * 120 140 0 20 40 60 80 100 160 180 Tiempo (min) Figura 4.11: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de dopamina (A), DOPAC (B) y HVA (C) en animales tratados con tropolona (1 mM). La isatina y la tropolona fueron perfundidas durante 60 minutos a partir del momento indicado por la flecha. Los datos se expresan como la media ± EEM (n= 4-11) de los valores basales considerados el 100%. Niveles de significación: *P< 0,05, **P<0,01, ***P<0,001, con respecto al basal y aP< 0,05, bP< 0,01, cP< 0,001, con respecto al grupo de isatina (10 mM). 154 RESULTADOS DA (% respecto al basal) Isatina 10 mM Isatina 10 mM + DNC 100 µm A DNC 100 µM ***b 3000 2500 2000 1500 *** *** 1000 ** 500 * *** * **b *** 0 20 40 60 80 100 120 140 160 180 180 DOPAC (% respecto al basal) Tiempo (min) B 180 160 140 120 100 80 60 40 20 0 b a a * 20 40 60 80 ** ** *** *** 100 120 140 160 * ** * *a *b ** HVA (% respecto al basal) Tiempo (min) 180 160 140 120 100 80 60 40 20 0 C a b 20 40 60 80 100 *b 120 *c ** b **b ** c ** c 140 160 180 Tiempo (min) Figura 4.12: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de dopamina (A), DOPAC (B) y HVA (C) en animales tratados con dinitrocatecol (100 µM). La isatina y el dinitrocatecol fueron perfundidos durante 60 minutos a partir del momento indicado por la flecha. Los datos se expresan como la media ± EEM (n= 5-11) de los valores basales considerados el 100%. Niveles de significación: *P< 0,05, **P<0,01, ***P<0,001, con respecto al basal y aP< 0,05, bP< 0,005, cP< 0,001, con respecto al grupo de isatina (10 mM). 155 RESULTADOS 4.5.2. Efecto de la isatina en animales tratados con atropina Para comprobar el efecto de antagonistas de los receptores colinérgicos de la acetilcolina sobre el efecto de la isatina, se perfundió a través de la sonda de microdiálisis un antagonista de tipo muscarínico, la atropina. De este modo, también se evalúa la interacción de isatina con anticolinérgicos, que son fármacos utilizados en la EP. La administración intraestriatal de atropina (1 mM) durante una hora produjo un incremento máximo hasta un 186,6 ± 31,4 %, con respecto a los basales (20 minutos después del comienzo de la administración de la atropina). La atropina no produjo modificaciones significativas en los niveles de los metabolitos de la dopamina. Los valores anteriores fueron considerados como basales para determinar el efecto de la isatina en animales tratados con atropina. La administración conjunta de isatina (10 mM) y atropina, en animales tratados con este antagonista, produjo un incremento en los niveles extracelulares de dopamina hasta un 381,0 ± 144,6 %, con respecto a los basales (20 minutos después del comienzo de la administración de la isatina). Los niveles de DOPAC y HVA descendieron hasta un 26,5 ± 5,2 % y 46,7 ± 12,1 %, en relación al basal, respectivamente (80 minutos después del comienzo de la administración de la isatina). Este descenso fue significativamente menor al producido por la administración de isatina sola. Las variaciones observadas en los niveles de dopamina fueron significativamente distintas a las producidas por la isatina sola, ya que supuso un descenso de un 69,3 % del efecto máximo de la isatina. Este resultado indica que la acción de la isatina sobre la liberación de dopamina estriatal podría estar mediada, en parte, por la activación de receptores muscarínicos de acetilcolina en el núcleo estriado (Figura 4.13). 156 RESULTADOS 1400 1200 1000 800 600 400 200 0 HVA (% respecto al basal) DOPAC (% respecto al basal) DA (% respecto al basal) Isatina 10 mM Isatina 10 mM + Atropina 1 mM A *** *** *** ** ** 20 40 60 80 *** b * 100 120 140 a 160 180 200 *** *** ** 220 240 240 Tiempo (min) 180 160 140 120 100 80 60 40 20 0 B *** a *** b *** a 20 40 60 80 100 120 140 160 180 200 220 * ** * Tiempo (min) 180 160 140 120 100 80 60 40 20 0 C * *** b *** b **a 20 40 60 80 100 120 140 Tiempo (min) 160 180 200 220 **a 240 Figura 4.13: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de dopamina (A), DOPAC (B) y HVA (C) en animales tratados con atropina (1 mM). La isatina fue perfundida durante 60 minutos a partir del momento indicado por la flecha. La perfusión de atropina fue realizada durante 120 minutos, mostrado mediante la barra negra. Los datos se expresan como la media ± EEM (n= 511) de los valores basales considerados el 100%. Niveles de significación: *P< 0,05, ** P<0,01, ***P<0,001, con respecto al basal y aP< 0,05, bP< 0,01, con respecto al grupo de isatina (10 mM). 157 RESULTADOS 4.5.3. Efecto de la isatina en animales tratados con ropinirol Para investigar el efecto de agonistas de receptores dopaminérgicos sobre la liberación in vivo de dopamina inducida por isatina, esta se administró juntamente con ropinirol, agonista dopaminérgico con mayor afinidad sobre los receptores de tipo D3. La administración de ropinirol (5 mM) a través de la sonda de microdiálisis incrementó los niveles de dopamina hasta un 368,3 ± 2,8 %, respecto a los basales (20 minutos después del comienzo de la administración de ropinirol). Además, se produjo un incremento significativo en los niveles extracelulares de DOPAC y HVA hasta un 144,2 ± 9,1 % y 182,3 ± 19,1 %, con respecto al basal, respectivamente (60 minutos después del comienzo de la administración del ropinirol). Cuando la isatina fue administrada juntamente con el ropinirol los niveles de dopamina se incrementaron hasta un 857,3 ± 142,6 % respecto a los basales (40 minutos después del comienzo de la administración de la isatina). Además se produjo un descenso significativo en los niveles extracelulares de DOPAC y HVA hasta un 56,2 ± 9,8 % y 75,5 ± 9,2 %, con respecto al basal, respectivamente. El descenso provocado sobre los metabolitos no es significativamente diferente a los de la administración de isatina sola, estos descensos se observaron en la última muestra de los experimentos en el caso del DOPAC y en la penúltima en el caso del HVA. Las variaciones en los niveles de dopamina no fueron significativamente distintas a las producidas por la isatina sola, lo que indica que la liberación de dopamina inducida por isatina no es modificada por ropinirol (Figura 4.14). 158 RESULTADOS DA (% respecto al basal) Isatina 10 mM 1400 Isatina 10 mM + Ropinirol 5 mM A Ropinirol 5 mM *** 1200 *** 1000 *** 800 600 *** *** 400 *** ***b *** *** *a 200 * 0 20 40 60 80 100 120 140 160 180 DOPAC (% respecto al basal) Tiempo (min) B 200 150 * *c *c 100 *c 50 *** *** ** ** **b 100 120 140 160 180 b 0 20 40 60 80 HVA (% respecto al basal) Tiempo (min) 200 C *c *c b 150 * 100 ** * 50 * ** 0 20 40 60 80 100 120 140 160 180 Tiempo (min) Figura 4.14: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de dopamina (A), DOPAC (B) y HVA (C) en animales tratados con ropinirol (5 mM). La isatina y el ropinirol fueron perfundidos durante 60 minutos a partir del momento indicado por la flecha. Los datos se expresan como la media ± EEM (n= 4-11) de los valores basales considerados el 100%. Niveles de significación: *P< 0,05, **P<0,01, ***P<0,001, con respecto al basal y aP< 0,05, bP< 0,01, cP< 0,001, con respecto al grupo de isatina (10 mM). 159 RESULTADOS 4.5.4. Efecto de la isatina en animales tratados con amantadina Para investigar el efecto de la amantadina sobre la liberación in vivo de dopamina inducida por isatina se administró esta juntamente con amantadina, un compuesto antivírico utilizado clínicamente en el manejo de la EP. La administración de amantadina (5 mM), a través de la sonda de microdiálisis, incrementó los niveles de dopamina y HVA hasta un 1283,2 ± 386,2 % y 133,6 ± 7,1 %, con respecto a los basales, respectivamente. Dichos incrementos se produjeron a los 40 y 60 minutos del comienzo de la administración de amantadina. Además, se produjo un descenso significativo en los niveles extracelulares de DOPAC hasta un 41,7 ± 14,5 %, con respecto al basal (última muestra de la experimentación). Cuando la isatina fue administrada juntamente con la amantadina los niveles de dopamina se incrementaron hasta un 2992,9 ± 554,5 %, respecto a los niveles basales (20 minutos después del comienzo de la administración de isatina). Además, se produjo un descenso significativo en los niveles extracelulares de DOPAC y HVA hasta un 43,1 ± 7,7 % y 72,5 ± 7,6 %, con respecto al basal, respectivamente (80 minutos después del comienzo de la administración de la isatina). El descenso provocado sobre los metabolitos no fue significativamente diferente a los de la administración de isatina sola. Las variaciones en los niveles de dopamina fueron significativamente distintas a las producidas por la isatina sola, suponiendo un incremento de 3,6 veces del efecto de la isatina en el mismo tiempo y de 2,4 veces del efecto máximo de la isatina, lo que indica que la liberación de dopamina inducida por isatina es incrementada por la amantadina (Figura 4.15). 160 RESULTADOS DA (% respecto al basal) Isatina 10 mM 4000 3500 3000 2500 2000 1500 1000 500 0 Isatina 10 mM + Amantadina 5 mM A Amantadina 5 mM ***c ***b ** ** 20 40 60 ** ** *** *** 80 100 ** *** 120 140 160 180 DOPAC (% respecto al basal) Tiempo (min) 180 160 140 120 100 80 60 40 20 0 B *** *** a *** ** *** ** *b 160 180 ** 20 40 60 80 100 120 140 HVA (% respecto al basal) Tiempo (min) 180 160 140 120 100 80 60 40 20 0 C ** b * *b ** ** 20 40 60 80 100 120 140 * 160 180 Tiempo (min) Figura 4.15: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de dopamina (A), DOPAC (B) y HVA (C) en animales tratados con amantadina (5 mM). La isatina y la amantadina fueron perfundidas durante 60 minutos a partir del momento indicado por la flecha. Los datos se expresan como la media ± EEM (n= 4-11) de los valores basales considerados el 100%. Niveles de significación: * P< 0,05, **P<0,01, ***P<0,001, con respecto al basal y aP< 0,05, bP< 0,01, cP< 0,001, con respecto al grupo de isatina (10 mM). 161 RESULTADOS 4.5.5. Efecto de la isatina en animales tratados con L-DOPA Para investigar el efecto de la L-DOPA sobre la liberación in vivo de dopamina inducida por isatina se administró isatina juntamente con dicho compuesto. La L-DOPA es el compuesto precursor de la dopamina y es el principal agente terapéutico utilizado para el tratamiento de la EP. La administración de L-DOPA (25 µM), a través de la sonda de microdiálisis, incrementó los niveles de dopamina hasta un 2064,6 ± 139,1 %, con respecto a los basales (40 minutos después del comienzo de la administración de L-DOPA). Además, se produjo un incremento significativo en los niveles extracelulares de DOPAC y HVA hasta un 151,9 ± 5,6 % y 161,4 ± 21,9 %, con respecto al basal, respectivamente (60 minutos después del comienzo de la administración de L-DOPA). El incremento provocado sobre los metabolitos fue significativamente diferente al de la administración de isatina sola. Cuando la isatina fue administrada juntamente con la L-DOPA los niveles de dopamina se incrementaron hasta un 2584,9 ± 497,9 % respecto a los basales (40 minutos después del comienzo de la administración de isatina). Además, se produjo un incremento significativo en los niveles extracelulares de DOPAC hasta un 371,2 ± 96,3 % con respecto al basal (40 minutos después del comienzo de la administración de isatina). No se produjeron modificaciones significativas sobre el HVA. Las variaciones en los niveles de dopamina fueron significativamente distintas a las producidas por la isatina sola, lo que supuso un incremento de 2 veces del efecto máximo de la isatina, lo que indica que la liberación de dopamina inducida por isatina es incrementada por la L-DOPA (Figura 4.16). 162 RESULTADOS DA (% respecto al basal) Isatina 10 mM Isatina 10 mM + L-DOPA 25 µM A L-DOPA 25 µM ***b 3000 ***c 2500 ***b 2000 ***b 1500 ** 1000 ***c *** *** *** 500 *** 0 20 40 60 80 100 120 140 160 180 DOPAC (% respecto al basal) Tiempo (min) 600 B 500 *b *c 400 300 200 * ** b *b *a *b ** c b 100 0 20 40 60 80 *** *** ** 100 120 140 a 160 180 HVA (% respecto al basal) Tiempo (min) 180 160 140 120 100 80 60 40 20 0 *b C 20 a 40 60 80 100 b a a * ** * 120 140 160 180 Tiempo (min) Figura 4.16: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de dopamina (A), DOPAC (B) y HVA (C) en animales tratados con LDOPA (25 µM). La isatina y la L-DOPA fueron perfundidas durante 60 minutos a partir del momento indicado por la flecha. Los datos se expresan como la media ± EEM (n= 4-11) de los valores basales considerados el 100%. Niveles de significación: *P< 0,05, ** P<0,01, ***P<0,001, con respecto al basal y aP< 0,05, bP< 0,01, cP< 0,001, con respecto al grupo de isatina (10 mM). 163 RESULTADOS Para determinar el efecto de la administración sistémica de L-DOPA sobre el incremento de los niveles de dopamina inducidos por isatina se administró L-DOPA metil-éster (500 mg/kg i.p.). Previamente a la administración de L-DOPA se administró benserazida, un inhibidor de la DDC para evitar la metabolización periférica de la L-DOPA. La administración de benserazida (80 mg/kg i.p.) no produjo modificaciones en los niveles de la dopamina y sus metabolitos durante toda la administración. Tras 40 minutos de la administración de benserazida se administró LDOPA i.p. La L-DOPA fue incrementando ligeramente los niveles de dopamina a partir del minuto 120 de los experimentos, alcanzándose un máximo incremento aproximadamente en el minuto 260 de la experimentación. Los niveles de dopamina alcanzaron unos valores de 1786,6 ± 725,6 %, con respecto a los niveles basales. La isatina comenzó a administrarse por medio de la sonda de microdiálisis en el minuto 240. Se observó un incremento máximo de los niveles de dopamina en el minuto 260 hasta un 6171,7 ± 3248,4 %, con respecto a los basales. Las variaciones en los niveles de dopamina fueron significativamente distintas a las producidas por la isatina sola en el mismo tiempo, suponiendo un incremento de 7,4 veces del efecto de la isatina, lo que indica que la liberación de dopamina inducida por isatina es incrementada por la L-DOPA. La administración de L-DOPA i.p. provocó un incremento significativo de los niveles de DOPAC y HVA a partir de los 120 minutos de experimentación. Los valores máximos para el DOPAC y el HVA fueron: 1682,7 ± 230,2 % (minuto 320 de experimentación) y 1980,9 ± 421,5 % (minuto 340 de experimentación), con respecto al basal, respectivamente. La administración de isatina en animales pretratados con L-DOPA produjo un incremento significativo en los niveles de DOPAC y HVA. Los valores máximos tras la administración de isatina para el DOPAC y el HVA fueron: 1273,04 ± 461,4 % (minuto 280 de experimentación) y 1638,1 ± 91,6 % (minuto 360 de experimentación), con respecto al basal, respectivamente (Figura 4.17). 164 RESULTADOS 4000 3000 *a L-dopa ip 5000 Isatina 10 mM + L-DOPA 500 mg/kg ip Benserazida 80 mg/kg ip A Benserazida ip 6000 *** ** * * *** *** ** ** * *** ** 1000 0 20 3000 60 100 140 180 220 *a ***a ** 2000 ***a **a *a *** 260 *a * *** *** 300 340 Tiempo (min) B 1500 D 2000 AT L-DOPA ip 2500 Benserazida ip B L DOPAC (% respecto al basal) DA (% respecto al basal) Isatina 10 mM L-DOPA 500 mg/kg ip **b ***c ***c ***c ***c *** **b 1000 500 ** *** *b *b *b *b * ** * * *b *b *a 0 20 60 100 140 180 220 260 300 340 2500 2000 1500 L-DOPA ip 3000 Benserazida ip HVA (% respecto al basal) Tiempo (min) C ***c ** ***c * * 1000 * * 500 * 0 20 60 100 * 140 *** *** *** 180 *** 220 ***c ***c ***c **b ***c ***c ***c ***c***c *** 260 300 **b ***c 340 Tiempo (min) Figura 4.17: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de dopamina (A), DOPAC (B) y HVA (C) en animales tratados con LDOPA i.p (500 mg/kg) y benserazida i.p. (80 mg/kg). La benserazida fue administrada al inicio de la experimentación y la L-DOPA 40 minutos después. La isatina fue perfundida durante 60 minutos a partir del momento indicado por la flecha (minuto 240). Los datos se expresan como la media ± EEM (n= 5-11) de los valores basales considerados el 100%. Niveles de significación: *P< 0,05, **P<0,01, ***P<0,001, con respecto al basal y aP< 0,05, bP< 0,01, cP< 0,001, con respecto al grupo de isatina (10 mM). 165 RESULTADOS 4.6. MEDIACIÓN DE LOS RECEPTORES GLUTAMATÉRGICOS EN EL EFECTO DE LA ISATINA SOBRE LA LIBERACIÓN DE DOPAMINA El objetivo de estos experimentos fue determinar la participación de los receptores ionotrópicos glutamatérgicos de tipo NMDA en el efecto de la isatina sobre la liberación de dopamina en el núcleo estriado. Para ello se utilizaron dos antagonistas diferentes de los receptores NMDA: AP-5 (antagonista competitivo) y MK-801 (antagonista no competitivo). 166 RESULTADOS 4.6.1. Efecto de la isatina en animales tratados con AP-5 La administración intraestriatal de AP-5 (650 µM) durante una hora no produjo modificaciones significativas en los niveles de dopamina. Además, se observó un incremento significativo en los niveles extracelulares de DOPAC y HVA hasta un 129,9 ± 8,3 % y 131,9 ± 4,6 %, con respecto al basal, respectivamente (60 minutos después del comienzo de la administración de AP-5). Los valores anteriores fueron considerados como basales para determinar el efecto de la isatina en animales tratados con AP-5. La administración de isatina juntamente con AP-5 produjo un incremento significativo de los niveles de dopamina hasta un 550,7 ± 201,4 %, respecto a los basales (20 minutos después del comienzo de la administración de la isatina). Además, se produjo un descenso significativo en los niveles extracelulares de DOPAC y HVA hasta un 70,9 ± 12,6 % y 90,1 ± 20,4 %, en relación al basal, respectivamente (80 minutos después del comienzo de la administración de isatina). Las variaciones en los niveles de dopamina fueron significativamente distintas a las producidas por la isatina sola, supuso una reducción del 55,6 % del efecto máximo de la isatina, lo que indica que el tratamiento con AP-5 induce un descenso del efecto de la isatina sobre la liberación de dopamina (Figura 4.18). 167 RESULTADOS DOPAC (% respecto al basal) DA (% respecto al basal) Isatina 10 mM 1400 1200 1000 800 600 400 200 0 Isatina 10 mM + AP-5 650 µM A *** *** *** ** b ** a *** *** 20 40 60 80 100 120 140 160 180 200 220 *** *** ** *** *** 160 180 200 220 * * * * 240 Tiempo (min) 180 160 140 120 100 80 60 40 20 0 B * *** 20 40 60 80 100 120 140 ** 240 HVA (% respecto al basal) Tiempo (min) 180 160 140 120 100 80 60 40 20 0 C *** 20 40 60 80 100 120 140 160 * ** 180 200 * 220 240 Tiempo (min) Figura 4.18: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de dopamina (A), DOPAC (B) y HVA (C) en animales tratados con AP-5 (650 µm). La isatina fue perfundida durante 60 minutos a partir del momento indicado por la flecha. La perfusión de AP-5 fue realizada durante 120 minutos, mostrado mediante la barra negra. Los datos se expresan como la media ± EEM (n= 611) de los valores basales considerados el 100%. Niveles de significación: *P< 0,05, ** P<0,01, ***P<0,001, con respecto al basal y aP< 0,05, bP< 0,01, con respecto al grupo de isatina (10 mM). 168 RESULTADOS 4.6.2. Efecto de la isatina en animales tratados con MK-801 La administración intraestriatal de MK-801 (500 µM) durante una hora produjo una disminución significativa de los niveles de dopamina hasta un 59,4 ± 13,4 %, con respecto a los basales. No se produjeron modificaciones significativas sobre los niveles de los metabolitos. Los valores anteriores fueron considerados como basales para determinar el efecto de la isatina en animales tratados con MK-801. La administración de isatina juntamente con MK-801 produjo un incremento significativo en los niveles de dopamina hasta un 530,4 ± 160,0 %, respecto a los niveles basales (40 minutos después del comienzo de la administración de la isatina). Además se produjo un descenso significativo en los niveles extracelulares de DOPAC y HVA hasta un 75,6 ± 9,6 % y 95,6 ± 9,3%, con respecto a los basales, respectivamente (80 minutos después del comienzo de la administración de isatina). Estos descensos no difieren del efecto de la isatina sola en los niveles de los metabolitos en el mismo tiempo de administración. Las variaciones en los niveles de dopamina fueron significativamente distintas a las producidas por la isatina sola, suponiendo una reducción del 57,3 % del efecto máximo de la isatina, lo que indica que el tratamiento con MK-801 provoca una disminución del efecto de la isatina sobre la liberación de dopamina (Figura 4.19). 169 RESULTADOS DA (% respecto al basal) Isatina 10 mM 1400 Isatina 10 mM + MK-801 500 µM A *** 1200 *** 1000 800 *** *** b 600 400 *** 200 ** ** 0 20 40 60 80 100 120 *** * 140 160 180 200 220 240 DOPAC (% respecto al basal) Tiempo (min) 180 160 140 120 100 80 60 40 20 0 B b *a *** *** 20 40 60 80 100 120 140 160 * *** ** 180 200 220 240 HVA (% respecto al basal) Tiempo (min) 180 160 140 120 100 80 60 40 20 0 C c * 20 40 60 80 100 120 140 160 * ** 180 200 * 220 240 Tiempo (min) Figura 4.19: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de dopamina (A), DOPAC (B) y HVA (C) en animales tratados con MK-801 (500 µm). La isatina fue perfundida durante 60 minutos a partir del momento indicado por la flecha. La perfusión de MK-801 fue realizada durante 120 minutos, mostrado mediante la barra negra. Los datos se expresan como la media ± EEM (n= 611) de los valores basales considerados el 100%. Niveles de significación: *P< 0,05, ** P<0,01, ***P<0,001, con respecto al basal y aP< 0,05, bP< 0,01, cP< 0,001, con respecto al grupo de isatina (10 mM). 170 RESULTADOS 4.7. MEDIACIÓN DEL ÓXIDO NÍTRICO EN EL EFECTO DE LA ISATINA SOBRE LA LIBERACIÓN DE DOPAMINA El objetivo de estos experimentos fue comprobar si la producción de óxido nítrico por la NOS podría ejercer algún papel sobre los efectos de la isatina en los niveles extracelulares de la dopamina y sus metabolitos. La realización de estos grupos experimentales se justifica por el hecho de que los antagonistas glutamatérgicos NMDA modificaron el efecto de la isatina y porque la enzima NOS es sensible a la activación de estos receptores. Para ello se realizaron dos grupos experimentales con inhibidores de la NOS: L-NAME y 7-NI. 171 RESULTADOS 4.7.1. Efecto de la isatina en animales tratados con L-NAME La administración intraestriatal de L-NAME (100 µM) durante una hora no produjo modificaciones significativas en los niveles de dopamina y sus metabolitos. La administración de isatina juntamente con L-NAME produjo un incremento significativo de los niveles de dopamina hasta un 497,7 ± 194,03 %, respecto a los basales (60 minutos después del comienzo de la administración de isatina). Además, se produjo un descenso significativo en los niveles extracelulares de DOPAC y HVA hasta un 52,0 ± 16,7 % y 62,2 ± 7,4 %, en relación al basal, respectivamente. Estos descensos no difieren del efecto de la isatina sola en los niveles de los metabolitos en el mismo tiempo de administración. El máximo descenso del DOPAC se observó a los 80 minutos del comienzo de la administración de isatina, mientras que el HVA presentó el descenso máximo a los 60 minutos del comienzo de la administración de isatina. Los valores anteriores fueron considerados como basales para determinar el efecto de la isatina en animales tratados con L-NAME. Las variaciones en los niveles de dopamina fueron significativamente distintas a las producidas por la isatina sola, pues supuso una reducción del 59,9 % del efecto máximo de la isatina, lo que indica que el tratamiento con L-NAME provoca una disminución del efecto de la isatina sobre la liberación de dopamina (Figura 4.20). 172 RESULTADOS DA (% respecto al basal) Isatina 10 mM 1400 1200 1000 800 600 400 200 0 Isatina 10 mM + L-NAME 100 µM A *** *** *** ** b *** ** ** 20 40 60 80 100 120 140 160 180 200 *** *** ** 220 240 * **b 220 240 DOPAC (% respecto al basal) Tiempo (min) 180 160 140 120 100 80 60 40 20 0 B ** 20 40 60 80 100 120 140 *** ** 160 180 200 *** *** ** ** *** ** * 160 180 200 220 HVA (% respecto al basal) Tiempo (min) 180 160 140 120 100 80 60 40 20 0 C b 20 40 60 80 100 c 120 140 **b 240 Tiempo (min) Figura 4.20: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de dopamina (A), DOPAC (B) y HVA (C) en animales tratados con LNAME (100 µm). La isatina fue perfundida durante 60 minutos a partir del momento indicado por la flecha. La perfusión de L-NAME fue realizada durante 120 minutos, mostrado mediante la barra negra. Los datos se expresan como la media ± EEM (n= 811) de los valores basales considerados el 100%. Niveles de significación: *P< 0,05, ** P<0,01, ***P<0,001, con respecto al basal y bP< 0,01, cP< 0,001, con respecto al grupo de isatina (10 mM). 173 RESULTADOS 4.7.2. Efecto de la isatina en animales tratados con 7-NI La administración intraestriatal de 7-NI (100 µM) durante una hora no produjo modificaciones significativas sobre los niveles de dopamina y DOPAC. Los niveles de HVA se incrementaron hasta un 146,2 ± 12 %, con respecto al basal (60 minutos después del comienzo de la administración de 7-NI). Los valores anteriores fueron considerados como basales para determinar el efecto de la isatina en animales tratados con 7-NI. La administración de isatina juntamente con 7-NI produjo un incremento significativo en los niveles de dopamina hasta un 884,1 ± 263,2 %, respecto a los basales (20 minutos después del comienzo de la administración de isatina). Además, se produjo un descenso significativo en los niveles extracelulares de DOPAC y HVA hasta un 50,4 ± 8,5 % y 76,8 ± 10,9 %, en relación al basal, respectivamente. Estos descensos no difirieron del efecto de la isatina sola en los niveles de los metabolitos en el mismo tiempo de administración. El máximo descenso del DOPAC se observó a los 80 minutos del comienzo de la administración de isatina, mientras que el HVA presentó el descenso máximo a los 60 minutos. Las variaciones en los niveles de dopamina fueron significativamente distintas a las producidas por la isatina sola, ya que supuso una reducción del 28,7 % del efecto máximo de la isatina, lo que indica que el tratamiento con 7-NI induce un descenso del efecto de la isatina sobre la liberación de dopamina (Figura 4.21). 174 RESULTADOS DA (% respecto al basal) Isatina 10 mM 1400 1200 1000 800 600 400 200 0 Isatina 10 mM + 7-NI 100 µM A *** *** *** *** *** *** a *** 20 40 60 80 100 120 140 160 180 200 220 240 DOPAC (% respecto al basal) Tiempo (min) 180 160 140 120 100 80 60 40 20 0 B ** *** *** ** *** 20 40 60 80 100 120 140 *** *** *** 160 180 200 * ** 220 ** 240 HVA (% respecto al basal) Tiempo (min) 180 160 140 120 100 80 60 40 20 0 C * * * *** 20 40 60 80 100 120 140 160 *** 180 *** 200 * * 220 * 240 Tiempo (min) Figura 4.21: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de dopamina (A), DOPAC (B) y HVA (C) en animales tratados con 7NI (100 µm). La isatina fue perfundida durante 60 minutos a partir del momento indicado por la flecha. La perfusión de 7-NI fue realizada durante 120 minutos, mostrado mediante la barra negra. Los datos se expresan como la media ± EEM (n= 511) de los valores basales considerados el 100%. Niveles de significación: *P< 0,05, ** P<0,01, ***P<0,001, con respecto al basal y aP< 0,05, con respecto al grupo de isatina (10 mM). 175 RESULTADOS 4.8. EFECTO DE LA ISATINA SOBRE AMINOÁCIDOS NEUROTRANSMISORES EN EL NÚCLEO ESTRIADO En la Figura 4.22 se muestra un cromatograma representativo de patrones (A) en el que se pueden apreciar los picos correspondientes a los aminoácidos analizados: aspartato, glutamato, taurina, glicina. En la sección B se expone una superposición de cromatogramas de muestras de dializados: en azul se representa un cromatograma correspondiente a la administración de un medio Ringer (muestras basales), mientras que en magenta se representa la evolución de los cromatogramas anteriores tras la administración de 10 mM de isatina, apreciando las variaciones en los niveles de los aminoácidos. Los niveles extracelulares de los aminoácidos analizados fueron estables durante el período de experimentación en las ratas control que no fueron sometidas a ningún tipo de tratamiento (únicamente perfusión continua de medio Ringer). Los valores basales, expresados en ng/20 min, se muestran en la Tabla 4.2. Compuesto Valor basal ASP 1,8 ± 0,5 GLU TAU GLI 2,2 ± 0,5 0,3 ± 0,1 0,3 ± 0,1 (ng/ 20 min) Tabla 4.2: Valores basales (expresados en ng/20 min) para el aspartato (ASP), el glutamato (GLU), la taurina (TAU) y la glicina (GLI). 176 RESULTADOS A B Figura 4.22: A. Cromatograma representativo de patrones de los aminoácidos analizados por medio de HPLC con detección fluorimétrica según las condiciones descritas previamente. B. Superposición de cromatogramas de dializados de muestras experimentales: en azul se representa un cromatograma de muestra basal y en magenta un dializado tras administrar 10 mM de isatina. 177 RESULTADOS La perfusión intraestriatal de isatina (10 mM) durante una hora produjo un incremento significativo en los niveles extracelulares de aspartato hasta un 194,3 ± 29,6 %, con respecto a los basales. Este incremento se produjo tras 40 minutos de perfusión de isatina, recuperándose los valores basales 20 minutos después del término de la administración de la misma (Figura 4.23). ASPARTATO (% respecto al basal) Isatina 10 mM Ringer 300 250 ** 200 150 100 50 0 20 40 60 80 100 120 140 160 180 Tiempo (min) Figura 4.23: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de aspartato. La isatina fue perfundida durante 60 minutos a partir del momento indicado por la flecha. Los datos se expresan como la media ± EEM (n= 5) de los valores basales considerados el 100%. Niveles de significación: **P<0,01, con respecto al basal. 178 RESULTADOS La perfusión intraestriatal de isatina (10 mM) durante una hora produjo un incremento significativo sobre los niveles extracelulares de glutamato hasta un 461,02 ± 114,7 %, con respecto a los basales. Este incremento máximo se produjo tras 60 minutos de perfusión de isatina, recuperándose los valores basales 40 después del término de la administración de la misma (Figura 4.24). GLUTAMATO (% respecto al basal) Isatina 10 mM Ringer 800 700 *** ** 600 500 ** 400 ** 300 200 100 0 20 40 60 80 100 120 140 160 180 Tiempo (min) Figura 4.24: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de glutamato. La isatina fue perfundida durante 60 minutos a partir del momento indicado por la flecha. Los datos se expresan como la media ± EEM (n= 5) de los valores basales considerados el 100%. Niveles de significación: **P<0,01, *** P<0,001, con respecto al basal. 179 RESULTADOS La perfusión intraestriatal de isatina (10 mM) durante una hora produjo un incremento significativo sobre los niveles extracelulares de glicina de un 140,7 ± 16,3 %, con respecto a los basales. Este incremento máximo se produjo tras 40 minutos de perfusión de isatina, recuperándose los valores basales tras el incremento observado anteriormente (Figura 4.25). GLICINA (% respecto al basal) Isatina 10 mM Ringer 300 250 200 * 150 100 50 0 20 40 60 80 100 120 Tiempo (min) 140 160 180 Figura 4.25: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de glicina. La isatina fue perfundida durante 60 minutos a partir del momento indicado por la flecha. Los datos se expresan como la media ± EEM (n= 5) de los valores basales considerados el 100%. Niveles de significación: *P<0,05 con respecto al basal. 180 RESULTADOS La perfusión intraestriatal de isatina (10 mM) durante una hora no produjo modificaciones significativas en los niveles de taurina (Figura 4.26). TAURINA (% respecto al basal) Isatina 10 mM Ringer 300 250 200 150 100 50 0 20 40 60 80 100 120 140 160 180 Tiempo (min) Figura 4.26: Efecto de la perfusión intraestriatal de isatina (10 mM) sobre los niveles estriatales de taurina. La isatina fue perfundida durante 60 minutos a partir del momento indicado por la flecha. Los datos se expresan como la media ± EEM (n= 5) de los valores basales considerados el 100%. 181 RESULTADOS 182 5 DISCUSIÓN Efectos de la isatina sobre la neurotransmisión dopaminérgica en el núcleo estriado. Un estudio in vivo mediante microdiálisis cerebral. DISCUSIÓN En relación al objetivo general fijado en este trabajo, consistente en evaluar los efectos de la isatina sobre la neurotransmisión dopaminérgica en el núcleo estriado, se administraron diferentes concentraciones de isatina a través de la sonda de microdiálisis. La medición de la dopamina y sus metabolitos es una de las ventajas que presenta la microdiálisis. Sin embargo, la explicación y discusión de las variaciones de los niveles de los metabolitos puede resultar difícil. Una de las dificultades es que la concentración del DOPAC en dializado no refleja del todo los niveles reales. Así, en tejido se considera que el ratio dopamina/DOPAC es positivo, excepto en condiciones de inhibición de la MAO. En dializado este ratio se revierte, de este modo se observa una concentración 100 veces mayor a la de la dopamina (Arbuthnott et al. 1990a). Por este motivo, en nuestro registro cromatográfico incrementamos 10 veces la sensibilidad del cromatógrafo para el análisis de la dopamina. Igualmente, es necesario considerar algunas limitaciones metodológicas para la técnica de muestreo in vivo por microdiálisis. Una de las limitaciones que presenta es la resolución temporal de 20 minutos y una relación cuantitativa imponderable entre la concentración de las sustancias en el dializado y en la hendidura sináptica, lo que hace que el análisis o la extrapolación cuantitativa sea compleja (Arbuthnott et al. 1990a). Al mismo tiempo, es necesario considerar que la cantidad de dopamina y metabolitos obtenida en los dializados es aquella que se encuentra en el espacio extracelular, por tanto es aquella que se escapa de los diferentes procesos fisiológicos de inactivación como la recaptación, la metabolización y la difusión (Pani et al. 1990). Igualmente, algunos autores explican que el DOPAC, a diferencia de moléculas activas como 185 DISCUSIÓN la dopamina, pasa más rápido al espacio extracelular, por lo que el registro de sus variaciones puede ser más difícil (Westerink et al. 1988). Es necesario considerar con cautela las variaciones de los metabolitos como indicadores de actividad neuronal debido a los estados de sulfoconjugación y la acción de los transportadores de metabolitos. Aunque generalmente la tasa de conversión del neurotransmisor en sus metabolitos sea considerada un indicador de metabolismo, los niveles de metabolitos se pueden disociar funcionalmente de los niveles del neurotransmisor y los niveles recogidos en el espacio intersticial no necesariamente deben reflejar la actividad neuronal (Cumming et al. 1992). Además, Westerink et al. (1988) consideran que el DOPAC puede derivar parcialmente de tejidos neuronales distantes que no sean influenciados por los compuestos aplicados. Asimismo, estos autores apuntan a que solo el 50% del DOPAC basal formado se relaciona con la actividad neuronal. La concentración máxima de isatina utilizada en el presente estudio fue de 10 mM, aunque pueda parecer a priori una concentración elevada para la administración intraestriatal, es necesario tener en cuenta que no toda la isatina disuelta en el líquido de perfusión atraviesa la sonda de microdiálisis. En este trabajo de investigación, la tasa de perfusión de isatina fue aproximadamente del 1 %. Por tanto, la administración de una concentración 10 mM a nivel estriatal equivale a 100 µM. Así, considerando el flujo de la bomba de microdiálisis (1,5 µl/min), cada 20 minutos se administran in situ 0,43 µg de isatina. Igualmente, las diferentes concentraciones de isatina utilizadas no produjeron modificaciones comportamentales objetivables a simple vista. En los estudios en los que se determinó que la isatina produce efectos motores 186 DISCUSIÓN (de carácter beneficioso sobre la sintomatología motora en los animales parkinsonizados), ésta fue administrada a nivel sistémico y en modelos experimentales de Parkinson que, además, fueron sometidos a test motores específicos (Zhou et al. 2001; Ogata et al. 2003; Hamaue et al. 2004; Xu et al. 2006). En otros estudios se ha observado que la administración sistémica de 50-200 mg/kg de isatina no produjo alteraciones comportamentales (Hamaue et al. 1999a). Además, Pani et al. (1990) indican que los cambios in vivo en la concentración de dopamina inducidos por diferentes compuestos pueden afectar a los niveles extracelulares de dopamina, sin tener consecuencias comportamentales, ya que es posible que la dopamina no interactúe en el espacio sináptico hasta el punto de producir cambios comportamentales. Asimismo, Blaha et al. (1996) señalan que el incremento de dopamina producido únicamente por inhibición de la MAO no es suficiente para provocar alteraciones conductuales como pueden producir otros compuestos con efectos más complejos a nivel neuroquímico, como la anfetamina. Debido a que la mayoría de estudios acerca de los efectos de la isatina sobre neurotransmisión utilizan una administración sistémica no se puede establecer una comparación directa de los resultados de estos estudios con los obtenidos a través de la microdiálisis. Por otro lado, se puede comparar la concentración de isatina utilizada en este trabajo de investigación con las dosis utilizadas en otros estudios, donde la isatina fue administrada de forma sistémica en una dosis de 50250 mg/kg, realizándose varias administraciones en días contiguos. Bhattacharya et al. (1991c) han observado que dosis de 50-100 mg/kg de isatina, administradas intraperitonealmente 30 minutos antes de sacrificar al animal, se corresponden con una concentración de 9 mg/kg 187 DISCUSIÓN (equivalentes a 60 μM) en el cerebro de la rata. Por tanto, los resultados obtenidos con las dosis utilizadas en estudios previos son comparables con los obtenidos en esta investigación, considerando la tasa de perfusión del 1 % obtenida en esta investigación. Existen escasas referencias en las que se utiliza la administración intraestriatal de isatina, siendo las concentraciones utilizadas en la bibliografía disponible de 10 µM y 1 mM (Hamaue et al. 1999b). Para disolver la isatina en una concentración de 10 mM fue necesario utilizar DMSO (5 %). Como se puede observar en la Figura 4.2 la administración de DMSO (5 %) disuelto en Ringer no produjo modificaciones en los niveles de dopamina ni de sus metabolitos. Igualmente, en publicaciones previas, para disolver la isatina se ha utilizado DMSO (Zhou et al. 2001; Ogata et al. 2003; Hamaue et al. 2004), aunque en otros estudios también se utilizó glicolato de celulosa (Xu et al. 2006). 5.1. EFECTO DE LA PERFUSIÓN INTRAESTRIATAL DE ISATINA SOBRE LA LIBERACIÓN DE DOPAMINA En base a los resultados obtenidos, se puede afirmar que la administración i.e. de isatina produce un incremento significativo en los niveles extracelulares de dopamina acompañado de un descenso en los niveles de sus metabolitos (DOPAC y HVA). Además, este efecto es dependiente de la dosis administrada, puesto que el efecto máximo se produjo con la concentración de 10 mM, siendo significativamente menor con las concentraciones de 5 y 1 mM (Figura 4.2), lo que indica que la isatina administrada intraestriatalmente in vivo mediante microdiálisis induce un incremento de tipo dosis-dependiente de los niveles de dopamina. En este sentido, previamente se ha descrito que la inhibición 188 DISCUSIÓN de la MAO producida por la isatina era dependiente de concentración (Hamaue et al. 1992). En el caso de los metabolitos de la dopamina, únicamente la concentración 10 mM de isatina produjo un descenso significativo. Los resultados obtenidos en este trabajo de investigación concuerdan ampliamente con los descritos en publicaciones previas en los que la administración intraestriatal (Hamaue et al. 1999b) y sistémica (Hamaue et al. 1999b; Ogata et al. 2003; Hamaue et al. 2004; Minami et al. 2006; Xu et al. 2006) de isatina produjo un incremento de los niveles de dopamina en el núcleo estriado de ratas. Además, la administración oral de isatina se relacionó con un incremento de monoaminas en orina (Hamanue et al. 1996). El hecho de que la administración de isatina produjera un incremento significativo de los niveles de dopamina acompañado de un descenso de los niveles de DOPAC es congruente con la hipótesis de que la isatina actúa inhibiendo la MAO, principal enzima de la degradación de la dopamina. Por tanto, se sugiere que la dopamina de nueva síntesis en vez de ser degrada por acción de la MAO, sea liberada en el espacio extracelular haciendo que la concentración de sus principales metabolitos disminuya. En cambio, si los niveles de los metabolitos permanecieran inalterados se podría sugerir que la isatina presentaría otros mecanismos, como la inhibición de la recaptación de dopamina o el incremento de la excitabilidad neuronal (Rivett et al. 1982; Sharp et al. 1986; Lamensdorf et al. 1996; Zhou et al. 2001). Basándonos en los resultados obtenidos en nuestra investigación, podemos plantear la hipótesis de que la isatina, por medio de la inhibición de la MAO, produce un efecto más directo sobre el DOPAC que sobre el HVA. Este hecho se correlaciona con otros estudios de microdiálisis en el 189 DISCUSIÓN estriado, en los cuales se determinó que la administración de un inhibidor no selectivo de la MAO (pargilina) produjo un mayor descenso del DOPAC que del HVA, observándose que la disminución del HVA se produjo de forma más tardía que la del DOPAC (Sharp et al. 1986; Obata y Yamanaka 1995). Otros autores observaron que la administración i.p. de pargilina (75 mg/kg) produjo un incremento de los niveles estriatales de dopamina de 1,7 veces con respecto al basal. Este incremento de dopamina se acompañó de la desaparición de los niveles de DOPAC y HVA, que se ubicaron en el 5% de los niveles basales (Elverfors et al. 1997). Según estos autores, el incremento de los niveles de dopamina se debe posiblemente a que en esta dosis la pargilina provocaría una inhibición completa de ambas isoformas de la MAO. Resultados similares fueron encontrados por Wood et al. (1987), Blaha et al. (1996) y Pani et al. (1990), con incrementos en los niveles de dopamina y descenso de sus metabolitos tras la administración sistémica de pargilina en la misma dosis. Además, (Pani et al. 1990) consideran que es posible que la pargilina no solo inhiba la MAO neuronal, sino también la enzima glial que sería la responsable de la metabolización de la dopamina que se recupera en la microdiálisis. Igualmente, se ha constatado que la disminución de los niveles de DOPAC y HVA en cerebros de roedor inducida por la administración de pargilina se debe a una inhibición de ambas isoenzimas de la MAO. Sin embargo, los autores indican que es necesario tener en cuenta que existen múltiples factores que pueden provocar alteraciones en los metabolitos de la dopamina, ya que los niveles de los metabolitos vienen determinados por la síntesis de neurotransmisor, su metabolismo y la eliminación de los propios metabolitos (Cumming et al. 1992). 190 DISCUSIÓN Considerando las variaciones observadas sobre los niveles extracelulares de dopamina y sus metabolitos tanto con la administración de pargilina como con la isatina en nuestro caso, podríamos extrapolar los mecanismos descritos para la pargilina para explicar nuestros resultados. Por tanto, la isatina podría actuar inhibiendo tanto la MAO glial como la neuronal e inhibir ambas isoformas de la MAO, para producir los efectos observados en este trabajo de investigación. Además, en otros estudios se observó una acción protectora de la isatina ante una dosis letal de triptamina en animales pretratados con pargilina. No se conoce el mecanismo exacto, pero los autores sugieren que la isatina protege o enmascara la MAO ante la inactivación por la pargilina (Kastner y Muller 1981; Medvedev et al. 1996). No obstante, es necesario considerar que el incremento de dopamina observado tras la inhibición de la MAO es difícil de interpretar in vivo. Se ha descrito la presencia de un retrocontrol inhibitorio de la síntesis catecolaminégica como resultado del incremento de la dopamina en el núcleo estriado (Westerink et al. 1984), lo que puede llevar a resultados diferentes de los observados en el presente trabajo de investigación. Igualmente, estudios recientes con IMAOs-B indican que la dopamina no desaminada por acción de un IMAO podría actuar sobre receptores presinápticos, lo que reduciría la liberación de dopamina y provocaría que no se incrementasen los niveles de dopamina en el dializado (Aluf et al. 2013). Por otra parte, en estudios de cortes neuronales se ha sugerido que IMAOs, al producir un cúmulo de dopamina, podrían acabar produciendo una disminución de la síntesis de dopamina por medio de la inhibición de la TH derivada de dicha acumulación (Schoepp y Azzaro 1983). Estudios posteriores muestran que la administración crónica de selegilina inhibe la 191 DISCUSIÓN TH, por medio de la activación de receptores tanto pre como postsinápticos (Vrana et al. 1992; Lamensdorf y Finberg 1997). En nuestro caso, al tratarse de un estudio con tratamiento agudo y al no observarse una disminución conjunta de dopamina y metabolitos se ha descartado que la isatina produjera este efecto. En lo referente a los efectos de la isatina sobre la neurotransmisión dopaminérgica, Zhou et al. (2001) obtuvieron resultados contradictorios. Estos investigadores observaron que la administración de isatina (40-100 mg/kg i.p.) no produjo modificaciones en los niveles estriatales de dopamina en ratas parkinsonizadas con 6-OHDA, mientras que la pargilina (75 mg/kg i.p.) sí que incrementaba dichos niveles. Para justificar sus resultados estos autores indican que la dosis utilizada en estudios previos de isatina no era selectiva para la MAO-B, lo que provocó que otros autores obtuvieran modificaciones sobre la dopamina. Además, exponen que existe variabilidad de los diferentes modelos experimentales de la EP. También proponen la existencia de mecanismos de acción de la isatina independientes de la MAO. En apartados posteriores se discutirá más profusamente la forma en la que la isatina podría estar inhibiendo la MAO en nuestro paradigma experimental. Ya que las variaciones en los metabolitos de la dopamina (DOPAC y HVA) resultan relevantes en el estudio de la actividad MAO, en este apartado es necesario profundizar más en su discusión. En primer lugar, el DOPAC como principal metabolito de la degradación de la dopamina es considerado un buen indicador del metabolismo dopaminérgico (Westerink et al. 1984; Colzi et al. 1996; Elsworth y Roth 1997). Esta acción es llevada a cabo por la MAO en la membrana externa mitocondrial y el DOPAC es el principal producto de 192 DISCUSIÓN la oxidación de la dopamina de nueva síntesis. Además, el ratio DOPAC/dopamina es considerado el índice más fiable de utilización de dopamina (Garret y Soares da Silva 1990), mientras que en primates el HVA es considerado un mejor indicador del metabolismo dopaminérgico (Elsworth y Roth 1997). Se considera que tanto el DOPAC como el HVA son liberados del interior celular por medio de un mecanismo de transporte activo (Miyamoto et al. 1991; Miyamoto et al. 1993). Otros metabolitos de la dopamina, como el DOPAL, se caracterizan por ser inestables, reaccionar con facilidad con otras moléculas y son considerados un mal indicador de la liberación o metabolismo de dopamina (Colzi et al. 1996; Elverfors et al. 1997). Además, se considera que cuando se administran compuestos que liberan dopamina de nueva síntesis, el DOPAC disminuye debido a que la MAO intraneuronal carece de su principal sustrato. Por tanto, el DOPAC procede de un reservorio intraneuronal de dopamina de nueva síntesis (Zetterström et al. 1988), mientras que una disminución de los niveles de dopamina y DOPAC simultáneamente es un fuerte indicador de una disminución de la síntesis dopaminérgica (Leviel et al. 2012). La importancia del DOPAC en el metabolismo dopaminérgico también se pone en evidencia en estudios previos, en los cuales descartaron que los compuestos que administraron no produjeron una inhibición de la MAO, ya que no observaron modificaciones sobre los niveles de DOPAC. Por ello, la monitorización del DOPAC es útil como indicador de la acción de compuestos sobre esta enzima (Fairbrother et al. 1990). 193 DISCUSIÓN Aunque la concentración relativa de dopamina y sus metabolitos sea considerada una medición de la actividad dopaminérgica y de la utilización de este neurotransmisor, la relación entre los niveles de DOPAC y la liberación de dopamina es compleja. Es necesario considerar que una vez formados, los metabolitos ácidos, son eliminados mediante el transportador de metabolitos o por medio de conjugación (Westerink 1985; Wood et al. 1987; Cumming et al. 1992). Por otra parte, el DOPAC no debe ser únicamente concebido como marcador de la liberación de dopamina, ya que esta puede ser metabolizada previamente a la liberación, por ejemplo ante la acción de antagonistas dopaminérgicos (Soares da Silva 1987). En este trabajo de investigación se puede observar que el descenso de los niveles de DOPAC fue superior al de HVA, que además disminuye de forma más tardía. Esto puede ser debido a que la metabolización de la dopamina en el estriado es principalmente realizada por la MAO, que conlleva la producción de su metabolito DOPAC, mientras que la producción del HVA es derivada de la acción extracelular de la COMT (que metaboliza un menor porcentaje de la dopamina) y que requiere posterior metabolización por la MAO. Por tanto, se considera que el HVA deriva principalmente del DOPAC (Westerink 1985; Wood et al. 1987; Arbuthnott et al. 1990b). El origen del DOPAC recolectado en dializados es difícil de discutir. El DOPAC podría proceder de la dopamina liberada y posteriormente recaptada. Sin embargo, en estudios previos se observó que la administración de agentes liberadores de dopamina produce una disminución de los niveles de DOPAC y que la inhibición del DAT no reduce estos niveles. Esto ha llevado a sugerir que es posible que el DOPAC no se produzca tras la recaptación, sino que derive de la 194 DISCUSIÓN dopamina que es nuevamente sintetizada, en sustitución de la dopamina liberada. Si se asume que el DOPAC intraneuronal difunde al espacio extraneuronal tras la síntesis dopaminérgica, las variaciones de los niveles de este metabolito también podrían aportar información sobre la tasa de formación de dopamina. Este hecho se ha observado por la gran sensibilidad que presentan los niveles de DOPAC ante tratamientos como α-metilparatirosina, inhibidor de la síntesis dopaminérgica que provoca disminución de los niveles extracelulares de dopamina (Arbuthnott et al. 1990a). Por último, los mecanismos descritos por otros autores para el incremento de los niveles de dopamina por inhibición de la MAO son: la inhibición de la MAO previene la metabolización de la dopamina tras la liberación o puede incrementar el reservorio liberable de dopamina de nueva síntesis. Aunque algunos investigadores han indicado que los IMAOs, probablemente, actúen más sobre la dopamina recaptada que sobre la dopamina de nueva síntesis (Butcher et al. 1990). 5.2. CARACTERIZACIÓN IN VIVO DE LA LIBERACIÓN DE DOPAMINA ESTRIATAL ESTIMULADA POR ISATINA Como ya se ha indicado, existen antecedentes científicos que sugieren que la isatina podría actuar por medio de otros mecanismos neuroquímicos diferentes a la inhibición de la MAO (Yuwiler 1990; McIntyre y Norman 1990; Panova et al. 1997; Zhou et al. 2001) y se ha observado que otros inhibidores de la MAO presentaban diversos mecanismos de acción (Neusch et al. 1997; Olanow et al. 2009a; Boll et al. 2011; Hickey y Stacy 2011; Barbosa y Bossoni 2014). 195 DISCUSIÓN En la literatura científica no existen antecedentes que describan los posibles mecanismos neuroquímicos de la isatina sobre la neurotransmisión dopaminérgica. Igualmente, para otros compuestos que producen un descenso de los metabolitos dopaminérgicos se han propuesto mecanismos neuroquímicos diferentes a la inhibición de la MAO, como el bloqueo de la recaptación dopaminérgica y la liberación de dopamina de nueva síntesis (Nishijima et al. 1996). Este dato sugiere que un incremento de dopamina asociado a una disminución de sus metabolitos es indicativo de una inhibición de la MAO, pero no excluye otros mecanismos. Por otra parte, algunos autores sugieren que el bloqueo de la degradación de la dopamina no necesariamente implica la liberación de la misma. Así como la liberación de dopamina por la administración de un IMAO-B no necesariamente es producida por la acción de la inhibición enzimática. Además, en el mecanismo de acción de otros IMAO-B, algunos autores plantean que pueden estar involucrados otros elementos como la feniletilamina, que es un sustrato específico de MAO-B (Lauber y Waldmeier 1987; Youdim y Tipton 2002). Mediante la comparación de los datos obtenidos en esta investigación con los efectos de diferentes sustancias y medios de perfusión modificados, con acción conocida sobre la neurotransmisión dopaminérgica, se pueden caracterizar los mecanismos por los cuales la isatina incrementa los niveles de dopamina (Westerink et al. 1987; Westerink et al. 1989; Arbuthnott et al. 1990a; Arbuthnott et al. 1990b; Kannari et al. 2000). Utilizando previamente esta metodología en nuestro laboratorio se han caracterizado los mecanismos neuroquímicos de diversos compuestos sobre la neurotransmisión dopaminérgica in vivo (Faro et al. 2002; 196 DISCUSIÓN Campos et al. 2007; Vidal et al. 2007; Ferreira-Nunes et al. 2010; Faro et al. 2012b). En los estudios clásicos de microdiálisis se pueden observar dos tipos de liberación de dopamina (Westerink et al. 1989; Arbuthnott et al. 1990a): Uno de ellos es el clásico mecanismo exocitótico de liberación de dopamina asociado al potencial de acción. Este tipo de liberación se caracteriza por ser dependiente de Ca++ extracelular y TTX. Otros mecanismos de liberación son independientes de Ca++ extracelular y TTX. De este modo, la dopamina se puede liberar por medio de la acción inversa del transportador (como lo realiza la anfetamina), por toxicidad neuronal (como el MPP+, metabolito activo del MPTP) o por la activación de múltiples mecanismos (como el glutamato). Por tanto, existen dos mecanismos diferenciados de liberación de dopamina objetivable por medio de microdiálisis cerebral. Así, agentes liberadores pueden utilizar un mecanismo exocitótico (liberación fásica), inversión del transportador (liberación tónica) o ambos mecanismos (Arbuthnott et al. 1990a). Así como podemos determinar diferentes mecanismos de liberación, la dopamina en el terminal dopaminérgico puede provenir de diferentes reservorios o compartimentos, interactuando los diferentes compuestos y medios administrados de diferente modo con estos reservorios. De los tres reservorios que se conceptualizan, dos son vesiculares y uno citoplasmático (Arbuthnott et al. 1990a): 197 DISCUSIÓN El reservorio vesicular de largo almacenamiento contiene dopamina “inactiva” y parece no participar en la liberación. Se considera que la reserpina actúa sobre este compartimento. El compartimento citoplasmático, donde se encuentra la dopamina no empaquetada en vesículas o en forma libre, proporciona dopamina al mecanismo dependiente de transportador. Aquellos compuestos que liberan dopamina y son inhibidos por medio de nomifensina liberan dopamina de este reservorio. La elevada sensibilidad de la anfetamina tanto a la nomifensina como a α-metilparatirosina indican que este reservorio se genera tanto de dopamina de largo almacenamiento como del reservorio vesicular liberable, que está constituido por dopamina de nueva síntesis. Por último, del reservorio vesicular de dopamina de nueva síntesis (dopamina liberable) se libera dopamina por medio del proceso de despolarización. Este reservorio también puede ser repuesto con dopamina del reservorio de largo almacenamiento, sin embargo la reposición por medio de esta vía es lenta. Igualmente, tras la administración de reserpina, también se puede reponer dopamina para su liberación del reservorio de largo almacenamiento. Bajo este tratamiento, la liberación de dopamina se realiza por acción inversa del DAT. En caso de que la dopamina no sea liberada, puede ser transferida entre los diferentes reservorios o metabolizada por la MAO. En cambio si es liberada, por medio de la recaptación se podría rellenar el reservorio citoplasmático, donde la dopamina también puede ser metabolizada. En relación a la isatina y a los IMAO, se teoriza que bloqueando la vía degradativa por medio de la inhibición de la MAO debería incrementarse la liberación de dopamina por acción de todos los liberadores, tanto los 198 DISCUSIÓN que actúan por medio de transportador como los que actúan por liberación vesicular. Además, Kaakkola y Wurman (1992) consideran que la metabolización por la MAO-B adquiere mayor relevancia en el metabolismo de la dopamina cuando se inhibe la recaptación, se inhibe la MAO-A o se incrementa la liberación. En estudios previos se ha evidenciado que pequeñas modificaciones en la composición iónica (Ca++, Mg++, K+) en el líquido de perfusión de microdiálisis produce alteraciones significativas en los niveles basales de dopamina estriatal (Osborne et al. 1991). Los efectos observados con la perfusión de los medios modificados y los diferentes compuestos de forma aislada, para la caracterización de los mecanismos de isatina, concuerdan con los obtenidos en publicaciones previas, lo que confiere mayor validez a la metodología (Faro et al. 2002; Campos et al. 2007; Vidal et al. 2007; Ferreira-Nunes et al. 2010; Faro et al. 2012b). Para determinar el posible mecanismo de acción por el cual la isatina induce la liberación de dopamina estriatal se utilizó la concentración de 10 mM, ya que en el estudio de la dosis-respuesta únicamente esta concentración produjo un incremento significativo de los niveles de dopamina acompañado de un descenso de sus principales metabolitos, lo que resulta indicativo que en esta concentración podría actuar por medio de la inhibición de la MAO. 5.2.1. Administración de isatina en un medio Ringer sin Ca++ Previamente, otros autores han demostrado que la liberación de dopamina es altamente dependiente de la concentración de Ca++ en el líquido de perfusión (Westerink et al. 1987; Westerink et al. 1988; Osborne et al. 1991; Bergquist et al. 1998; Itoh et al. 1998). La liberación 199 DISCUSIÓN que se ve modificada por la eliminación del Ca++ en el medio de perfusión se considera que es de tipo vesicular (Arbuthnott et al. 1990a; Arbuthnott et al. 1990b; Osborne et al. 1991). En la Figura 4.3 se puede observar que la eliminación del Ca++ del medio de perfusión produjo una disminución del efecto máximo de la isatina del 90,4 %, lo que indica que la liberación de dopamina inducida por isatina es dependiente de Ca++. Con respecto a los metabolitos, no se observaron modificaciones significativas sobre los niveles de DOPAC, pero el HVA descendió significativamente con respecto a los niveles basales, sin observarse una recuperación de dichos niveles al final del experimento. En investigaciones previas se ha observado que la administración de un medio de perfusión libre de Ca++ produjo una disminución de los niveles basales de dopamina y de DOPAC hasta un 10-30 % y un 70 % de los valores basales, respectivamente (Santiago y Westerink 1990; Osborne et al. 1991; Gazzara y Andersen 1994; Olivier et al. 1995; Bergquist et al. 1998). Además, Olivier et al. (1995) sugieren que un medio libre de Ca++ también podría inhibir la síntesis de dopamina. Igualmente, no se produjo una eliminación total de los niveles de dopamina puesto que el medio de perfusión no presenta Ca++, pero no se elimina el Ca++ , tanto extracelular como intracelular, que existe en el tejido estriatal del animal de experimentación (Arbuthnott et al. 1990a). La disminución del efecto de la isatina sobre la dopamina podría explicarse debido a que la eliminación del Ca++ en el medio de perfusión puede provocar menos liberación por vía exocitótica o que se sintetice menos dopamina. En ambos casos, considerando que la isatina actúa principalmente por medio de la inhibición de la MAO, aunque se degrade 200 DISCUSIÓN menos dopamina, al no liberarse o al no sintetizarse no aumentará en el espacio extracelular, que es donde se monitorizan los niveles por medio de microdiálisis. 5.2.2. Efecto de la isatina en animales tratados con TTX La aplicación de TTX como bloqueante de canales de Na+ dependientes de voltaje se utilizó clásicamente para mostrar si el impulso nervioso está involucrado en la liberación estimulada por una sustancia. Esto permite clasificar la liberación estimulada de dopamina en dependiente de potencial de acción o independiente de potencial de acción. En general, se considera que cualquier compuesto que es sensible a la TTX es sensible al Ca++, ya que para la liberación exocitótica de las vesículas sinápticas se requiere de despolarización por medio de las corrientes de Na+ dependientes de voltaje, la apertura de los canales de Ca++ dependiente de voltaje y la entrada de este ión (Westerink et al. 1987; Westerink et al. 1989; Arbuthnott et al. 1990a; Santiago y Westerink 1990; Itoh et al. 1998). En investigaciones previas se ha observado que la administración de TTX (en rango µM) produce una disminución de los niveles basales de dopamina y de DOPAC hasta un 10 % y 80 %, respectivamente (Fairbrother et al. 1990; Santiago y Westerink 1990; Gazzara y Andersen 1994). En este trabajo de investigación, el tratamiento con TTX (10 µM) produjo una disminución significativa de los niveles de dopamina y DOPAC. En la Figura 4.4 se puede observar que la administración de isatina en animales tratados con esta toxina produjo una disminución del efecto máximo de la isatina sobre la liberación de dopamina del 83,5 %. 201 DISCUSIÓN Asimismo, la administración de TTX produjo un descenso significativo de los niveles de DOPAC, observándose que existió una tendencia al descenso después de la administración de isatina. En el caso del HVA se observó que la TTX potenció el efecto de la isatina sobre el descenso de este metabolito. Estos resultados indican que la liberación de dopamina por acción de isatina es dependiente de despolarización del terminal dopaminérgico, ya que el bloqueo de los canales de Na+ dependiente de voltaje por TTX impide la despolarización del terminal y con ello la liberación de dopamina, aunque se inhiba la principal vía degradativa de la misma. Estos resultados refuerzan los hallazgos en el grupo anterior consistentes en que la liberación de dopamina estimulada por isatina es de tipo vesicular, ya que la liberación es dependiente de Ca++ y de despolarización podemos considerar que se trata de una liberación de tipo fásico, donde se libera dopamina del reservorio vesicular liberable. Una hipótesis que podría explicar este efecto consistiría en que la isatina aumenta la dopamina en el reservorio citoplasmático por inhibición de MAO, esta dopamina puede ser transferida al reservorio vesicular liberable; por este motivo la disminución de Ca++ y la TTX bloquean su efecto. 5.2.3. Efecto de la isatina en animales tratados con reserpina La reserpina es un inhibidor del empaquetamiento de dopamina en las vesículas sinápticas, por tanto expone al neurotransmisor a la acción de la MAO en el citoplasma neuronal o a su liberación desde el reservorio citoplasmático (Raiteri et al. 1979; Heeringa y Abercrombie 1995). 202 DISCUSIÓN El pretratamiento i.p. con reserpina una hora antes del comienzo del muestreo con microdiálisis produjo un descenso significativo de los niveles extracelulares de dopamina y sus metabolitos. Como se observa en la Figura 4.5 el pretratamiento con reserpina produjo un descenso del 78,4 % del efecto máximo de la isatina y un descenso más pronunciado sobre los niveles de HVA con respecto al descenso producido por isatina sobre la liberación de dopamina, aunque el DOPAC también descendió significativamente. Estos datos corroboran la hipótesis de que la dopamina liberada por acción de la isatina es de tipo exocitótico y de origen vesicular. La acción de la reserpina consiste en inactivar el empaquetamiento vesicular de la dopamina por medio del bloqueo del transportador VMAT2, provocando que la liberación evocada bajo los efectos de la reserpina sea por medio del transportador y del reservorio citoplasmático. Cuando se administra reserpina los niveles de dopamina en dializado disminuyen, ya que la dopamina no se encuentra disponible para su liberación vesicular (Arbuthnott et al. 1990a). También es necesario señalar que la aplicación de reserpina en todos los animales produjo catatonia. En este caso no se apreció ninguna mejoría tras la administración intraestriatal de isatina, aunque tampoco se aplicó ninguna evaluación motriz específica como en estudios previos (Zhou et al. 2001; Hamaue et al. 2004; Xu et al. 2006) Además, mediante la técnica de microdiálisis se realiza una administración muy focalizada en la región que se implanta la sonda (Westerink et al. 1989). En estudios previos con isatina y reserpina, Xu et al. (2006) observaron que la administración de reserpina i.p. durante 4 días (4 administraciones de 0,2; 0,18; 0,15; 0,15 mg/kg) indujo un descenso de 203 DISCUSIÓN dopamina intraestriatal medidos por microdiálisis cerebral equivalente al 26-64% con respecto al control. La administración de isatina durante 4 días (100 mg/kg i.p por día) en ratas reserpinizadas indujo un aumento gradual de la dopamina hasta equipararse con el grupo control, al mismo tiempo que mejoraba la bradicinesia inducida por la reserpina. Del mismo modo, los niveles de DOPAC y HVA decrecían tras la administración de reserpina, pero después del tratamiento con isatina dichos niveles fueron similares al control. Igualmente, se ha observado un efecto similar con la administración de pargilina. En este caso la administración de reserpina subcutánea (5 mg/kg) produjo un descenso de los niveles dopaminérgicos estriatales hasta un 2 % con respecto al basal. Este descenso de los niveles de dopamina se acompañó de un incremento de los metabolitos. En estos casos, la administración i.p. de pargilina (75 mg/kg) 2 horas más tarde produjo una recuperación de los niveles de dopamina estriatal y un descenso de los niveles de metabolitos (Elverfors et al. 1997). En otros estudios, se ha observado, también, que debido a la inhibición de la liberación vesicular por acción de la reserpina, compuestos que incrementan la liberación de dopamina podrían inducir una liberación por medio del DAT (Fairbrother et al. 1990). Igualmente, los resultados obtenidos en este trabajo son similares a los obtenidos por Xu et al. (2006), donde la reserpina no produce una abolición total del efecto de la isatina sobre los niveles de la dopamina. Esto explicaría por qué la isatina, a pesar de inducir una liberación vesicular en condiciones normales, cuando los animales son pretratados con reserpina, podría existir cierta liberación por medio de la acción inversa del DAT. Aunque también es posible una liberación vesicular disminuida debido a un bloqueo no completo por acción de la reserpina. 204 DISCUSIÓN La reserpina es considerada el primer compuesto utilizado como modelo experimental de parkinsonismo en animales (Tieu 2011). Igualmente, debido a las alteraciones neuroquímicas y a las manifestaciones motrices que produce, se sigue utilizando actualmente para inducir modelos experimentales de la EP (Bezard y Przedborski 2011; Santos et al. 2013; Pinna y Morrelli 2014). Desde esta perspectiva, podemos considerar que la isatina produjo mejorías en las alteraciones neuroquímicas en el modelo experimental de la EP inducido por reserpina, ya que se consiguió incrementar los niveles disminuidos de dopamina producidos por la reserpina (incremento de 2,7 veces, con respecto al efecto de la reserpina). Partiendo de estos resultados coincidimos con otros investigadores que postulan a la isatina como un posible compuesto útil en el abordaje de la EP (Glover et al. 1988; Hamaue et al. 1999a; Ogata et al. 2003; Hamaue et al. 2004; Minami et al. 2006; Xu et al. 2006; Fang y Wang 2008; Buneeva et al. 2010). 5.2.4. Efecto de la isatina en animales tratados con nomifensina Para determinar la implicación del DAT en la liberación de dopamina inducida por isatina se utilizó la nomifensina. Este compuesto es un bloqueador del DAT y se utiliza para determinar si el bloqueo de este transportador está implicado en el incremento de los niveles extracelulares de dopamina (Raiteri et al. 1979; Arbuthnott et al. 1990a). Además, este grupo se justifica porque estudios previos en el núcleo estriado de ratas mostraron que la clorgilina inhibe la recaptación de dopamina, mientras que la pargilina no presenta ese efecto (Culver et al. 2002). Asimismo, en estudios con sinaptosomas se observó que tanto la clorgilina y selegilina, IMAO-A e IMAO-B respectivamente, pueden bloquear la recaptación de monoaminas. Sin embargo, el DAT fue el 205 DISCUSIÓN transportador que requirió mayor concentración de selegilina para su bloqueo, frente al noradrenérgico y serotonérgico (Lai et al. 1980). Por otra parte, se considera que en condiciones de incremento de síntesis de dopamina (por medio de la administración de L-DOPA) o de inhibición de su degradación (por inhibidores de la MAO), el mecanismo de liberación por medio del transportador adquiere mayor relevancia, ya que estas sustancias pueden activar la liberación de dopamina por medio del transportador (Raiteri et al. 1979). Nuestros resultados muestran que la administración i.e. de nomifensina (50 µM) e isatina (10 mM) de forma aislada produjo un incremento similar sobre los niveles de dopamina. La administración conjunta de ambos compuestos también produjo un incremento significativo en los niveles de dopamina que no difiere significativamente del efecto de cualquiera de las sustancias administradas de forma aislada (Figura 4.6). La administración de nomifensina también provocó un incremento significativo de los niveles de DOPAC, en la coadministración con isatina no se observaron modificaciones significativas sobre los niveles de este metabolito. En el caso del HVA no se produjeron modificaciones significativas con la administración de nomifensina, ni con la coadministración. La nomifensina, al igual que otros inhibidores de la recaptación de dopamina, tiene la capacidad de incrementar los niveles extracelulares de dopamina (Hurd y Ungerstedt 1989; Butcher et al. 1991; Kaakkola y Wurman 1992; Budygin et al. 2000). En relación a los metabolitos de la dopamina, se ha observado que la nomifensina tanto incrementó los niveles de DOPAC y HVA (Hurd y Ungerstedt 1989), que los disminuyó 206 DISCUSIÓN (Kaakkola y Wurman 1992), así como, no produjo alteraciones de los metabolitos (Butcher et al. 1991). Ya que no se observó diferencia significativa entre los efectos observados por la coadministración de isatina y nomifensina, se podría considerar que actúan por mecanismos similares. Es decir, al no existir un efecto aditivo, parece que el DAT puede estar implicado en el aumento de los niveles de dopamina por acción de la isatina. Como ya se ha indicado previamente, a nivel clínico un efecto dual que abarque la inhibición de la MAO y el bloqueo del DAT de forma simultánea es considerado beneficioso para la EP (Binda et al. 2011). Al igual que en este caso, en otras investigaciones se observó que la coadministración de selegilina y nomifensina mostró unos resultados similares a la administración de la nomifensina sola. Como la selegilina no modificó el efecto de la nomifensina sobre la dopamina, los autores sugieren que la MAO-B no está involucrada en la desaminación de dopamina seguida del bloqueo del transportador (Butcher et al. 1990). Mientras que Harsing et al. (1979) observaron que la selegilina producía una inhibición de la recaptación de dopamina estriatal. Sin embargo, en otros estudios, la nomifensina incrementó los niveles estriatales de dopamina en ratas pretratadas con pargilina i.p. (Blaha et al. 1996). Estos resultados discrepantes podrían ser explicados por diferencias metodológicas, ya que en este caso la pargilina fue administrada previamente, por ello la pargilina pudo estimular la liberación de dopamina y posteriormente la nomifensina pudo bloquear la recaptación de esa dopamina liberada. Por último, aunque está ampliamente constatada la implicación del DAT en la liberación de dopamina, puede resultar difícil determinar si el incremento de dopamina inducido por isatina fue producido por el bloqueo 207 DISCUSIÓN de la recaptación o por la facilitación de la liberación por medio de modo inverso del DAT. En definitiva, teniendo en cuenta los resultados obtenidos y la discrepancia observada en la bibliografía lo más oportuno resulta considerar que el DAT realiza un importante papel en la eliminación de dopamina liberada por isatina. 5.2.5. Administración de isatina en un medio Ringer con alta concentración de K+ En la literatura científica, la liberación de dopamina inducida por despolarización con alta concentración de K+, es uno de los métodos frecuentemente utilizados para estudiar la movilización de vesículas del almacenamiento vesicular de dopamina para su liberación exocitótica (Fairbrother et al. 1990; Ripley et al. 1997; Shui et al. 1998). De forma contraria, la reducción de K+ en el líquido de perfusión produce una disminución significativa de los niveles estriatales de dopamina, DOPAC y HVA. Esto se debe a una hiperpolarización del terminal neuronal (Osborne et al. 1991). La administración de isatina diluida en un medio Ringer con KCl 50 mM incrementó 2,8 veces el efecto máximo de la isatina. Si consideramos el efecto aislado de este medio modificado (incrementa 11,8 veces los niveles basales de dopamina) observamos claramente un efecto aditivo (Figura 4.7). Por tanto la isatina incrementa la liberación in vivo de dopamina estimulada por despolarización. La administración del medio con alta concentración de KCl no modificó el efecto de la isatina sobre los metabolitos de la dopamina. 208 DISCUSIÓN Estos resultados concuerdan con lo descrito por Fairbrother et al. (1990): la perfusión de un medio con concentraciones elevadas de K+ produce un incremento de dopamina de tipo dosis-dependiente. En concentraciones de K+ por encima de 60 mM se produce además un descenso de los niveles de DOPAC y HVA. Esta liberación es de tipo exocitótica, aunque ante la eliminación de esta vía de liberación también puede operar por medio del DAT. La estimulación por K+ se considera que libera dopamina de nueva síntesis. Los resultados obtenidos en este trabajo de investigación concuerdan con estudios previos. Harsing y Vizi (1984) observaron que tanto la selegilina como la clorgilina incrementaron la liberación de dopamina estimulada por alto K+ en estriado aislado de rata. En ambos casos, observaron que los IMAOs inhibieron la enzima aproximadamente el 90 %. Con respecto a los IMAOs, Butcher et al. (1988) observaron que la administración i.p. de pargilina (75 mg/kg) podría aumentar la disponibilidad de dopamina en el reservorio citoplasmático para poder ser liberada con mayor facilidad por otros compuestos que estimulan la liberación de dopamina. La isatina aumentaría los niveles de dopamina citoplasmática que está disponible para llenar el reservorio liberable, lo que facilitaría la reposición ante una estimulación continua o mantenida, como la provocada por K+. Como la isatina inhibe la principal vía degradativa, existe más dopamina disponible para su liberación. Igualmente, el descenso en los metabolitos de la dopamina se explicaría por el hecho de que la despolarización estimula la liberación vesicular, lo que impide que la dopamina se encuentre disponible para su conversión en DOPAC y HVA. 209 DISCUSIÓN Sin embargo, otros investigadores observaron que la administración de 60 mM de K+ produjo un incremento pronunciado de dopamina con un ligero descenso del DOPAC. Lo justifican indicando que los niveles de DOPAC no se relacionan directamente con la liberación estimulada de dopamina, sino que en condiciones de liberación inducida, los niveles de DOPAC podrían reflejar más las síntesis que la liberación dopaminérgica (Westerink et al. 1989). Esto justifica el hecho de que el medio con alto K+ no modifique el efecto de la isatina sobre los metabolitos. En conclusión, nuestros resultados concuerdan con estudios previos en los que la liberación estimulada por K+ es incrementada por IMAOs, como la clorgilina y la pargilina. Debido a que con la administración de pargilina se observó un mayor incremento que con clorgilina, se plantea que el aumento de liberación estimulada de dopamina es mayor cuando se inhiben ambas isoformas (Butcher et al. 1990). Por tanto, un incremento tan elevado de la dopamina al administrar isatina en un medio Ringer con alto K+ nos lleva a sugerir que se está produciendo una fuerte inhibición de la MAO. 5.2.6. Sumario de la caracterización de los posibles mecanismos neuroquímicos de la isatina Los resultados en su conjunto nos indican que la liberación in vivo de dopamina inducida por isatina depende del contenido vesicular. Dicho proceso de liberación es de tipo fásico por medio de exocitosis, dependiente de Ca++ y de la despolarización del terminal dopaminérgico. Aunque en nuestras condiciones de estudio también puede estar interviniendo el DAT o este puede realizar un cierto papel en el aclaramiento de la dopamina evocada por isatina. 210 DISCUSIÓN Los datos observados con alto K+ muestran que la administración de isatina en nuestro caso presenta un perfil neuroquímico más similar al de la pargilina que al de la selegilina, es decir, que está actuando por medio de una inhibición no selectiva. Esta observación corrobora lo expuesto en el apartado anterior. 5.3. MEDIACIÓN DE LAS ISOFORMAS DE LA MAO EN EL EFECTO DE LA ISATINA SOBRE LA LIBERACIÓN DE DOPAMINA En apartados anteriores, así como en la bibliografía (Panova et al. 1997; Zhou et al. 2001), se ha expuesto la posibilidad de que la isatina interactúe de forma no específica con las isoformas de la MAO, a pesar de que habitualmente se describa como un IMAO-B (Hamaue et al. 1999b; Binda et al. 2003; Buneeva et al. 2010; Manley et al. 2011). Para determinar la influencia de otros inhibidores de la MAO sobre el efecto de la isatina en la liberación de dopamina se administraron clorgilina y selegilina a través de la sonda de microdiálisis. La clorgilina es un inhibidor selectivo e irreversible de la isoforma A de la MAO, mientras que la selegilina es un inhibidor selectivo e irreversible de la isoforma B (Finberg 2014). Para seleccionar la concentración administrada intraestriatalmente de cada IMAO se realizó previamente un estudio de dosis-respuesta con cada compuesto. Finalmente, en ambos casos se seleccionó la concentración 1 mM, ya que fue la concentración más baja que produjo modificaciones significativas y claramente observables sobre los niveles de dopamina. Igualmente, se buscó que ambas concentraciones produjeran el mismo efecto para poder establecer una comparación sobre la modificación que pudieran provocar sobre el efecto de la isatina. 211 DISCUSIÓN La administración de clorgilina y selegilina incrementó significativamente los niveles de dopamina 8,9 y 8,2 veces, respectivamente. Tanto la coadministración de clorgilina, como la de selegilina, con isatina no produjeron modificaciones del efecto producido por la isatina sola. Estos resultados indican que en nuestras condiciones experimentales los inhibidores selectivos para cada isoforma no interfieren con el efecto de la isatina, al menos en las concentraciones utilizadas. Asimismo, un aspecto a tener en cuenta es que tanto la selegilina como la clorgilina son inhibidores selectivos para cada isoforma, pero en dosis elevadas se vuelven inespecíficos. Como se indicó en el apartado de mecanismos, la administración de un IMAO produce un incremento o potencia el efecto de compuestos liberadores de dopamina. Sin embargo, en nuestro caso la isatina no potenció la liberación de dopamina estimulada por la selegilina ni por la clorgilina, esto podría ser debido a que la isatina estaría compitiendo con los otros IMAOs por el mismo sustrato, es decir, la dopamina. En la misma línea, Panova et al. (1997) estudiaron in vitro e in vivo la interacción de isatina con inhibidores no selectivos de la MAO. Estos autores observaron que la administración de isatina a dosis de 80 mg/kg redujo la inhibición de un IMAO no selectivo sobre la MAO-B, pero no sobre la MAO-A. Igualmente, indican que el incremento de monoaminas observado en diversos laboratorios por la administración de isatina es posible que no involucre la inhibición de la MAO-A, como se suponía previamente. Otros autores sugirieron que la isatina, aunque se administre a dosis elevadas, podría interactuar de forma específica con la isoforma B, debido a los efectos comportamentales que produce (Panova et al. 1997). 212 DISCUSIÓN Además, en otros estudios se ha atribuido a la inhibición de la MAOB, por acción de la isatina, un incremento de los niveles de dopamina y una disminución del ratio DOPAC/dopamina incrementado por el VEJ (Hamaue et al. 2004). Lamensdorf et al. (1996) observaron que la administración sistémica de forma crónica de selegilina producía un incremento en los niveles de dopamina. Igualmente, Rogríguez-Gómez et al. (1997) observaron que la administración de selegilina durante tres semanas incrementó los niveles estriatales de dopamina en relación a su acción como IMAO, pero además observaron que la actividad de la TH se había incrementado. Estos datos en conjunto sugieren que la isatina produce una inhibición de la MAO-B, pero no resulta excluyente de que también produzca inhibición de la MAO-A. De hecho, los mismos efectos observados con clorgilina apuntan a una inhibición no selectiva. Así, una inhibición no selectiva de la MAO a altas dosis fue descrita previamente al observarse que la isatina aumentó los niveles de serotonina y noradrenalina, que son sustratos preferentes de la MAO-A. Sin embargo, al observar en algún caso que no existía modificaciones sobre el HIAA se consideró que pueden existir mecanismos alternativos hasta ahora no dilucidados, como el incremento de la excitabilidad de neuronas monoaminérgicas que produciría un incremento de los niveles de serotonina y noradrenalina (Medvedev et al. 1996). Igualmente, Butcher et al. (1990) observaron que la administración sistémica de selegilina en ratas, solo mostró alteraciones en la metabolización de la dopamina en una dosis en la cual también inhibía parcialmente la MAO-A. En este caso disminuyó los niveles de los metabolitos sin alterar la salida de dopamina, mientras que en dosis inferiores no modificó los niveles de DOPAC. Por otra parte, estos autores 213 DISCUSIÓN observaron que la clorgilina, en este caso, incrementó los niveles de dopamina y disminuyó los de sus metabolitos. Además, la pargilina modificó los mismos parámetros que la clorgilina, pero con un efecto mayor. Similarmente, Themann et al. (2002) observaron que la administración sistémica de una dosis elevada de selegilina de forma aguda y subcrónica produjo un incremento de los niveles de dopamina y un descenso del DOPAC. En ambos trabajos, los autores sugieren que para un incremento máximo o pronunciado en los niveles extracelulares de la dopamina es necesario un fuerte bloqueo de ambas isoformas de la MAO, ya que bajo condiciones de total inhibición de la MAO-A ejerce su acción la MAO-B (Butcher et al. 1990; Themann et al. 2002), por lo que al bloquear una isoforma, la otra puede asumir la carga metabolizadora de la misma. Igualmente, en estudios previos donde se utilizó clorgilina y selegilina para estudiar el metabolismo de la serotonina se observó que, aunque la serotonina es metabolizada principalmente por la MAO-A, cuando se administra clorgilina no se inhibe completamente su metabolización, solo se inhibe por completo cuando se administra la clorgilina junto con la selegilina. Esto refuerza la idea de que cuando una isoforma es inhibida actúa la otra (Green y Youdim 1975; Arbuthnott et al. 1990a). En primates la administración i.p. de selegilina produjo un incremento de los niveles de dopamina en diversos núcleos basales acompañada de una disminución de sus principales metabolitos. Por otra parte, la administración conjunta de selegilina y clorgilina produjo un incremento mayor de los niveles de dopamina con un descenso mayor de los metabolitos, lo que sugiere que en este caso el metabolismo es mayoritario por la isoforma B, pero no exclusivo (Lakshmana et al. 1998). 214 DISCUSIÓN Considerando alguna de estas aportaciones (Butcher et al. 1990; Lakshmana et al. 1998) y los datos de nuestro estudio, se deduce que es más factible que se produzca una fuerte inhibición de ambas isoformas de la MAO por acción de la isatina, ya que se observó un gran incremento de dopamina y un descenso de sus metabolitos. En este caso, la dopamina liberada tras la inhibición de la MAO-A resulta en una acumulación de dopamina que debe ser metabolizada y ante la inhibición de isoforma A también se puede encargar la isoforma B (Arbuthnott et al. 1990b). Por tanto, los resultados observados con la administración de isatina indican que en la concentración utilizada puede estar produciendo una inhibición no selectiva. Además, la coadministración de otro IMAO, que modifica los niveles dopaminérgicos en administración aislada, no incrementó los niveles de dopamina, lo que es indicativo de la fuerte inhibición que posiblemente produzca la isatina. Nuestra hipótesis inicial consistía en que la clorgilina y la selegilina producirían un efecto diferente sobre la dopamina liberada por isatina, ya que son inhibidores de isoenzimas diferentes e incluso pueden presentar efectos diferentes a la inhibición de la MAO. Como por medio de la coadministración no se observaron cambios en la liberación de dopamina inducida por isatina, se procedió a realizar un pretratamiento con selegilina para observar si se podía modificar el efecto de la isatina. Nuestros resultados muestran que el pretratamiento con la misma concentración de selegilina supuso una disminución significativa del efecto máximo de la isatina del 80 %. Además, se produjo un descenso más marcado de los niveles de DOPAC y HVA. 215 DISCUSIÓN Estos resultados indican que el pretratamiento con selegilina modifica el efecto de la isatina, mientras que la coadministración no produce variaciones significativas sobre los efectos de la misma. Por tanto, una inhibición enzimática previa limita el efecto de la isatina, lo que indica que puede existir competencia entre ambos inhibidores. Con respecto al pretratamiento de selegilina es necesario tener en cuenta los siguientes aspectos: al producirse un incremento previo con selegilina estos niveles son considerados basales, por lo que al comparar el efecto de la isatina con estos niveles parece una fuerte disminución, siendo realmente una limitación del efecto. Igualmente, la liberación de dopamina con el pretratamiento puede limitar la disponibilidad de dopamina con el tratamiento siguiente. Aunque en este caso consideramos que el incremento no es tan elevado como para agotar las reservas liberables. Por otra parte, investigaciones previas describen que los IMAOs reversibles podrían ser desplazados por la dopamina, en condiciones de incremento de la misma en el citosol. Mientras que los IMAOs irreversibles no son desplazados del sitio activo (Colzi et al. 1993). Por tanto, el efecto observado con el pretratamiento con selegilina, también podría ser explicado por el hecho de que la isatina es un IMAO reversible, por lo que la dopamina en niveles elevados desplazaría al compuesto de la enzima. Los resultados obtenidos con la administración de isatina y otros IMAOs pueden explicarse teniendo en cuenta los siguientes aspectos: 216 DISCUSIÓN La dopamina se considera un sustrato no selectivo para ambas isoformas. La metabolización de dopamina estriatal en ratas puede realizarse por ambas isoenzimas. En caso de inhibición de una enzima la otra puede metabolizar el sustrato, aunque no sea su preferente. A elevadas concentraciones, tanto la selegilina como la clorgilina pierden selectividad por la isoforma. En la concentración administrada, la isatina podría ser no selectiva: la ki para la MAO-B es de 3 µM y para la MAO-A es de 15 µM, la concentración que se administró in situ se estima en 100 µM. El incremento de dopamina por la administración de la isatina va provocar un incremento de la actividad MAO-B, independientemente del mecanismo que lo produzca. Por tanto, podemos concluir que la selegilina administrada en esta investigación no actuó de forma selectiva sobre la MAO-B o bien activó otros mecanismos. Esta misma observación se podría aplicar a los resultados obtenidos con la isatina. Estas observaciones concuerdan con lo descrito por Panova et al. (1997) y Zhou et al. (2001) de que es posible que la dosis administrada de isatina no sea selectiva. Esta misma conclusión podría ser extrapolada a los estudios previos de isatina (Hamaue et al. 1999b; Ogata et al. 2003; Hamaue et al. 2004; Xu et al. 2006; Minami et al. 2006). Aunque generalmente se referencia la isatina como IMAO-B, a nivel experimental los datos no se ajustan a la bibliografía general. 217 DISCUSIÓN 5.4. EFECTOS DE LA COADMINISTRACIÓN DE ISATINA Y COMPUESTOS DE ACCIÓN ANTIPARKINSONIANA SOBRE LA LIBERACIÓN DE DOPAMINA Estudios previos en ratas han evaluado la posible interacción de diversos compuestos de acción antiparkinsoniana para determinar la existencia de posibles sinergias (Skuza et al. 1994). Así, la realización de este grupo de experimentos nos permite realizar una aproximación neuroquímica al modo en que pueden interactuar compuestos de acción antiparkinsoniana con la isatina. Igualmente, será posible emitir alguna hipótesis sobre otros mecanismos de acción de la isatina. 5.4.1. Efecto de la isatina en animales tratados con tropolona y dinitrocatecol Para determinar el efecto de la inhibición de la COMT sobre el efecto de la isatina se coadministró esta con la tropolona y el dinitrocatecol. La tropolona es un ICOMT de primera generación que se caracteriza por realizar una inhibición de tipo reversible y no competitiva. El dinitrocatecol (OR-486) pertenece a los ICOMT de segunda generación, se caracteriza por presentar el nitrocatecol en su estructura química, al igual que otros elementos de su grupo como la entacapona y la tolcapona. Estos compuestos presentan mayor selectividad por la COMT que por otras enzimas y menos interacciones tóxicas (Nissinen 2010). Estudios recientes demuestran que polimorfismos en los genes de la COMT y de la MAO-B predisponen a los pacientes con la EP a sufrir complicaciones motoras, lo que lo pone en evidencia la importancia de ambas enzimas (Hao et al. 2014). 218 DISCUSIÓN Männistö y Kaakkola (1990) indican que previamente a la utilización en humanos, los ICOMT deben ser evaluados con otros compuestos que modifiquen la neurotransmisión dopaminérgica como los IMAO, lo que incrementa el interés por estudiar esta coadministración. Nuestros resultados muestran que la administración i.e. de tropolona aumentó significativamente los niveles de dopamina y DOPAC 2,4 y 2,1 veces, respectivamente (Figura 4.11). La administración i.e. de dinitrocatecol aumentó significativamente los niveles de dopamina 4,8 veces y disminuyó los niveles de HVA 6,4 veces (Figura 4.12). La coadministración de isatina con tropolona y dinitrocatecol produjo un incremento de los efectos de isatina de 3,7 y 3 veces, respectivamente. También se observó un descenso significativo tanto para el DOPAC como para el HVA. Esto indica que el efecto de isatina sobre neurotransmisión dopaminérgica estriatal es potenciada por ambos ICOMT. Los resultados observados concuerdan con estudios previos en los que la administración sistémica de tropolona (100 mg/kg) produjo un descenso significativo de los niveles de HVA y un incremento de los niveles estriatales de dopamina y DOPAC (Broch 1972). Otros investigadores también observaron que la administración de tropolona producía un ligero descenso de los niveles estriatales de HVA en ratones normales, mientras que casi suprimía su formación en ratones tratados previamente con compuestos que incrementaban este metabolito (Roffler-Tavlor et al. 1971). Otros estudios mediante la administración oral de tolcapona observaron un descenso significativo de los niveles estriatales de HVA y un incremento del DOPAC, sin modificaciones en los niveles de dopamina (Maj et al. 1990; Li et al. 1998; Budygin et al. 1999; Huotari et al. 1999). Otros estudios con nitecapona (OR-462) muestran que la 219 DISCUSIÓN administración conjunta de este compuesto con L-DOPA/carbidopa incrementa los niveles estriatales de dopamina y sus metabolitos, aunque la acción de la nitecapona se considera principalmente periférica (Lindén et al. 1988). En la misma línea, la coadministración oral LDOPA/benserazida con tolcapona, produce un incremento en los niveles estriatales de dopamina y sus metabolitos, observándose que reduce el influjo de HVA producido por L-DOPA/benserazida y se potencia el incremento de DOPAC (Napolitano et al. 2003). Por otro lado, se observó que la administración sistémica de Ro 410960 (ICOMT) no modifica los niveles de dopamina, produce un descenso de los niveles de HVA y un incremento del DOPAC, además potencia el efecto de la L-DOPA sobre los niveles de dopamina (Männistö y Kaakkola 1990). Estudios posteriores muestran los mismos resultados con la tolcapona (Acquas et al. 1992; Napolitano et al. 1995). Además, se considera que cuando la COMT es inhibida se produce un incremento compensatorio en los niveles extracelulares de DOPAC (Kaakkola y Wurman 1992), lo que explicaría las variaciones en los niveles de DOPAC producidos por la tropolona observadas en la literatura y en nuestro estudio. Igualmente, el descenso de los niveles de HVA estriatales es considerado un marcador de la inhibición central de la COMT (Nissinen 2010). También, es necesario tener en cuenta que el HVA estriatal proviene principalmente del DOPAC: aproximadamente el 60% del DOPAC se convierte en HVA, mientras que el 100% de la 3-MT es transformado en HVA (Westerink 1985). Por otra parte, Cumming et al. (1992) estudiaron los efectos de la administración conjunta de un IMAO y un ICOMT sobre los niveles de dopamina y sus metabolitos. La pargilina (i.p.) y la tolcapona (subcutánea) fueron administrados sistémicamente en unas concentraciones de 75 220 DISCUSIÓN mg/kg y 40 mg/kg, respectivamente. La administración de pargilina produjo un incremento de dopamina estriatal de 5,3 veces con respecto al basal, acompañada de una disminución exponencial de DOPAC y HVA. En cambio, la administración de tolcapona produjo un incremento de los niveles de DOPAC, disminución de los niveles de HVA y no produjo modificaciones de los niveles de dopamina. La coadministración de ambos inhibidores no alteró los niveles de dopamina, mientras que ambos metabolitos descendieron. Resultados similares fueron obtenidos por otros autores utilizando tropolona y pargilina (Dedek et al. 1979). Tanto para el DOPAC como para el HVA Cumming et al. (1992) indican que solo un pequeño porcentaje de los metabolitos es captado por la sonda en su forma libre, no conjugada o metilada. En lo referente al DOPAC se considera que este debe ser formado antes de la liberación de la dopamina nuevamente sintetizada o subsecuente a su recaptación. El estudio de estos autores indica que el DOPAC puede ser afectado por la inhibición de la COMT, mientras que el HVA es dependiente del DOPAC. Además, se debe tener en cuenta la ubicación de la COMT, ya que algunos autores sugieren una escasa presencia en las fibras dopaminérgicas. Según estos investigadores, la O-metilación no debe jugar un papel muy importante en la metabolización de la dopamina, por lo que la MAO realiza un papel más importante al incrementar los niveles de la dopamina (Cumming et al. 1992). Asimismo, la tendencia que se observó a incrementar la dopamina en los estudios descritos previamente tras administrar un ICOMT sugiere que una proporción de dopamina extracelular es metabolizada por la COMT siguiendo la ruta de la 3-MT. En nuestro caso, al aplicarse una dosis mayor y al ser un tratamiento in situ, se pudo observar un incremento de dopamina con los ICOMT. 221 DISCUSIÓN Por otra parte, otros estudios muestran resultados similares a los obtenidos en este trabajo, así la administración i.p. de tolcapona produjo una tendencia al aumento de la dopamina, un descenso significativo del HVA y un incremento del DOPAC, analizados en dializados estriatales. La entacapona por vía sistémica produjo las mismas modificaciones estriatales pero solo en la dosis más elevadas, ya que es un inhibidor principalmente periférico (Kaakkola y Wurman 1992). Sin embargo, en estos casos, la coadministración de selegilina con la tolcapona produjo variaciones en los niveles de la dopamina que no difirieron de las variaciones producidas por la tolcapona sola. Igualmente, en otros estudios la administración conjunta de nitecapona y clorgilina han mostrado un incremento de los niveles de dopamina acompañado de un descenso de ambos metabolitos (Männistö et al. 1990). De forma similar, Männistö y Tuomainen (1991) estudiando las modificaciones producidas por la coadministración de clorgilina y pargilina con diversos ICOMT en ratas tratadas con L-DOPA/carbidopa (administrando dichos compuestos por vía i.p) observaron que el Ro 410960 (ICOMT con actividad central) mostró una potenciación del efecto de la clorgilina, observándose un incremento mayor de dopamina y una disminución de HVA con respecto al grupo control. De acuerdo con los datos expuestos previamente (Kaakkola y Wurman 1992), se podrían explican los datos observados en el presente estudio del siguiente modo: cuando se administró isatina, la actividad de la COMT sobre el metabolismo dopaminérgico podría verse incrementado, por lo que su coadministración con tropolona y dinitrocatecol potenció los efectos de ambos sobre la dopamina y los metabolitos. 222 DISCUSIÓN Como conclusión de este apartado, se puede decir que la sinergia de isatina con ICOMT podría resultar beneficiosa, aunque sería necesario tener en cuenta las posibles interacciones negativas. 5.4.2. Efecto de la isatina en animales tratados con atropina En estudios previos se ha observado que los receptores muscarínicos de acetilcolina influencian la neurotransmisión dopaminérgica estriatal (Giorguieff et al. 1977; Raiteri et al. 1982) Además, Xu y Kato (1988) observaron que la administración intraestriatal de oxotremorina (agonista muscarínico) incrementa los niveles de DOPAC y HVA en dializado estriatal, especificando que en el estriado in vivo la mayoría de receptores muscarínicos indirectamente incrementan el turnover de dopamina por medio de la vía nigroestriatal. Previamente se ha establecido que la isatina inhibe la acetilcolinesterasa (Kumar et al. 1993). Sin embargo, otros investigadores han observado que la administración de isatina incrementa los niveles estriatales de acetilcolina, pero se considera que lo realiza por medio de un mecanismo independiente a la acetilcolinesterasa, ya que en algunas regiones cerebrales se incrementó la colina (metabolito de la acetilcolina) y la inhibición de acetilcolinesterasa fue solo del 5%, con dosis en las cuales se inhibe más del 90% de la MAO. Este incremento de acetilcolina se ha asociado al incremento de la dopamina que estimula receptores D2 y produce dicha liberación (Hamaue et al. 1999a; Hamaue et al. 1999b). Nuestros resultados muestran que el pretratamiento con atropina produce una disminución significativa del efecto producido por la isatina (descenso del 69,3 % del efecto máximo), lo que indica que el efecto de la isatina sobre la neurotransmisión dopaminérgica podría estar mediado, en parte, por la activación de receptores muscarínicos de acetilcolina (Figura 4.13). 223 DISCUSIÓN Anteriormente se ha descrito que la administración de antagonistas muscarínicos M1 produjo un descenso de los niveles estriatales de dopamina, mientras que los antagonistas M2 producen un incremento de tipo dosis-dependiente de dopamina, sin observarse alteraciones en los metabolitos. La administración de un agonista muscarínico no selectivo a dosis bajas produce descenso en los niveles de dopamina y una dosis elevada incrementa los niveles de neurotransmisor (Klippel et al. 1993). Puesto que la atropina es un antagonista M1, en nuestro estudio resulta lógico que el pretratamiento con atropina disminuyera el efecto de la isatina sobre los niveles de dopamina, por lo que a priori, la coadministración de ambos compuestos no resulta factible a nivel neuroquímico. Por otro lado, también se observó que la administración sistémica de dosis elevadas (10 mg/kg) de atropina no produjo modificaciones sobre los niveles estriatales dopamina y sus metabolitos. Igualmente, la administración de otros antagonistas muscarínicos tampoco produjo efectos sobre la neurotransmisión dopaminérgica estriatal (Damsma et al. 1988). Por este motivo, en base a sus resultados, los autores concluyen que los compuestos anticolinérgicos en la EP podrían actuar por otros mecanismos diferentes a la modulación de la actividad dopaminérgica estriatal produciendo beneficios sintomatológicos, aunque también es posible que modifiquen la actividad neuronal sin modificar los niveles extracelulares de dopamina. En este sentido, aunque la coadministración de isatina y atropina no mostrara un efecto sinérgico sobre los niveles estriatales de dopamina, no se debe descartar una interacción beneficiosa por medio de otros mecanismos, ya que los compuestos anticolinérgicos pueden mejorar la sintomatología parkinsoniana sin alterar los niveles de dopamina. 224 DISCUSIÓN 5.4.3. Efecto de la isatina en animales tratados con ropinirol El ropinirol es un agonista dopaminérgico no ergólico que presenta mayor afinidad por los receptores D3. La afinidad por este subtipo de receptores es unas 20 veces mayor que por otros subtipos de la familia D2 (Eden et al. 1991). Por otra parte, estudios previos han investigado la interacción de IMAOs con agonistas dopaminérgicos observando que los IMAOs podrían desplazar a los agonistas de su lugar de unión (Culver et al. 2002; Levant et al. 2002). En nuestro estudio la administración intraestriatal de ropinirol no modificó significativamente el efecto de la isatina sobre los niveles extracelulares de dopamina, aunque el ropinirol administrado de forma aislada incrementó los niveles de dopamina 3,7 veces (Figura 4.14). En estudios previos se observó que los agonistas dopaminérgicos incrementan los niveles de dopamina, aunque en bajas dosis pueden presentar un efecto bifásico y disminuir los niveles de la misma (Timmerman et al. 1989; Kurata y Shibata 1990). En trabajos anteriores se demostró que, en el núcleo estriado de rata, la selegilina potenciaba la respuesta neuronal a agonistas dopaminérgicos sin inhibir el metabolismo de la dopamina, por lo que pueden existir otros mecanismos de interacción diferentes que sean independientes al incremento de los niveles de dopamina (Paterson et al. 1991; Berry et al. 1994). Estos resultados se ajustan a los datos obtenidos en esta investigación, en los que el ropinirol no modificó el efecto de la isatina sobre la liberación de dopamina. Aunque no se observó un efecto sinérgico de ambos compuestos sobre el incremento de los niveles de dopamina, no se 225 DISCUSIÓN pueden desconsiderar una interacción positiva por medio de otros mecanismos. Asimismo, aunque el ropinirol no potenció el efecto de la isatina sobre los niveles estriatales de dopamina, es necesario considerar que los agonistas dopaminérgicos producen variaciones en los niveles de dopamina por medio de la estimulación de los autorreceptores del subtipo D3, mientras que el efecto sobre la motricidad sería por estimulación postsináptica sobre el subtipo D2 (Ozaki et al. 1989; Kuczenski et al. 1990; Santiago y Westerink 1991; Kehr et al. 2007). En esta línea, los datos obtenidos en nuestro grupo experimental indican que el efecto de la isatina no se ve modificado por la estimulación de receptores dopaminérgicos por la administración de un agonista dopaminérgico, aunque desconocemos las implicaciones positivas a nivel motriz en EP que dicha coadministración pueda producir. 5.4.4. Efecto de la isatina en animales tratados con amantadina La amantadina es un compuesto utilizado en la EP que presenta diversos mecanismos de acción: antagoniza los receptores NMDA de glutamato, facilita la liberación de dopamina y bloquea la recaptación de dopamina. Actualmente, el mecanismo de acción de este compuesto no se conoce por completo (Huang et al. 2014). La administración de amantadina por medio de la sonda de microdiálisis produjo un incremento significativo de los niveles de dopamina (12,8 veces en relación a los niveles basales). La coadministración de amantadina e isatina supuso un incremento de los niveles de dopamina 2,4 veces superior al efecto máximo de la isatina sola (Figura 4.15). 226 DISCUSIÓN En estudios previos se ha observado que la amantadina incrementa los niveles estriatales de dopamina en ratas, por medio de la inhibición de la recaptación de dopamina y del antagonismo NMDA (Mizoguchi et al. 1994; Danysz et al. 1997). Además, también se ha observado que incrementa la síntesis y la liberación de la dopamina estriatal (Scatton et al. 1970; Heikkila y Cohen 1972) y potencia el efecto de L-DOPA en ratas parkinsonizadas (Skuza et al. 1994; Arai et al. 2003). Nuestros resultados concuerdan con estudios previos de microdiálisis en los que se observó que la administración de amantadina incrementa los niveles extracelulares de dopamina, siendo dicho incremento dosisdependiente (Quack et al. 1995; Takahashi et al. 1996). Considerando la amantadina como un compuesto liberador de dopamina, en nuestro caso (como fue descrito en grupos experimentales previos) la isatina, por medio de la inhibición de la MAO, incrementaría los niveles de dopamina disponible para la liberación por acción de la amantadina. Aunque, considerando el conocimiento actual sobre la amantadina, no se puede establecer el mecanismo por el cual se incrementa la liberación de dopamina al coadministrarla con isatina. El incremento de dopamina observado al coadministrar la isatina y la amantadina sugieren que a nivel neuroquímico la sinergia de ambos compuestos puede resultar beneficiosa. 5.4.5. Efecto de la isatina en animales tratados con L-DOPA La administración intraestriatal de L-DOPA produjo un incremento significativo de los niveles de dopamina de 20,7 veces. La administración conjunta de L-DOPA e isatina produjo un incremento de los niveles de dopamina de 2 veces mayor que el producido por la isatina sola (Figura 4.16). Igualmente, la administración sistémica de L-DOPA (500 mg/kg 227 DISCUSIÓN i.p.), con pretratamiento con benserazida (80 mg/kg), incrementó 17,9 veces los niveles estriatales de dopamina. La administración i.e. de isatina, en el momento que la L-DOPA produjo un mayor incremento de dopamina, aumentó 7,4 veces el efecto de la isatina sola (Figura 4.17). Los resultados obtenidos en esta investigación están en consonancia con otros trabajos publicados anteriormente, en los cuales se observó un incremento de dopamina con la combinación de L-DOPA y un IMAO. En estudios previos, se observó que la administración sistémica de clorgilina produjo un incremento de dopamina estimulada por L-DOPA i.e. y una disminución del DOPAC y HVA, mientras que la administración de selegilina presentó pocos efectos sobre los niveles de dopamina. Los autores atribuyen este resultado a una actividad predominante de la MAO-A en ratas (Waldmeier et al. 1976; Buu y Angers 1987; Finberg et al. 1995). Por otro lado, Brannan et al. (1995) consideran que en estos animales la MAO-B adquiere mayor relevancia en la metabolización dopaminérgica cuando se administra L-DOPA exógena. Esto se debe a que los autores observaron que la selegilina solo incrementó los niveles de dopamina y disminuyó los metabolitos en ratas tratadas con L-DOPA, mientras que en ratas sin L-DOPA la selegilina no alteró los niveles de dopamina. Por otra parte, en ratas reserpinizadas la administración de L-DOPA exógena no produce incremento de dopamina, pero sí modifica los niveles de sus metabolitos (Wong et al. 1993; Kannari et al. 2000). Lo que indica que la dopamina liberada por L-DOPA procede del reservorio vesicular liberable y en caso de que el empaquetamiento vesicular no fuera posible, la dopamina formada quedaría expuesta a la metabolización por la MAO. Adachi et al. (2006) sugieren que la dosis de L-DOPA puede controlar la liberación estriatal de dopamina en ratas pretratadas de forma crónica 228 DISCUSIÓN sistémicamente con selegilina, lo que les ha llevado a sugerir que controlando la dosis de L-DOPA se puede conseguir una respuesta estable a la inhibición de la MAO-B. Watchtel y Abercrombie (1994) observaron que L-DOPA (50 mg/kg) no modificó los niveles de dopamina en estriado de ratas normales, pero sí en las ratas parkinsonizadas con 6-OHDA. Además, la administración de un IMAO-B en ratas pretratadas con esta dosis L-DOPA produjo un incremento de dopamina. A pesar de que en estudios previos la administración i.p. de L-DOPA en diferentes dosis, con pretratamiento con benserazida, produjo un incremento de los niveles de dopamina estriatal (Pani et al. 1990), en otras publicaciones se muestra que la administración de L-DOPA (50 mg/kg i.p.) en ratas normales produce inicialmente una disminución de los niveles estriatales de dopamina (Kannari et al. 2000). Esta disminución inicial de dopamina se considera que puede ser debida a mecanismos autorregulatorios dopaminérgicos, por medio de receptores presinápticos tipo D2. Esta disminución se acompañó de un incremento de los metabolitos, por lo que se hipotetiza que la dopamina nuevamente sintetizada a partir de la L-DOPA es metabolizada en el citoplasma. El incremento de dopamina se ve restringido puesto que la recaptación y la modulación de la liberación por D2 están operativos en animales no tratados, mientras que en animales con 6-OHDA la L-DOPA incrementa los niveles de dopamina (Kannari et al. 2000). Estudios previos indican que la administración de L-DOPA sistémica podría modificar los niveles de los metabolitos dopaminérgicos sin modificar los niveles de dopamina, en este caso se incrementan la síntesis y el metabolismo sin modificarse el estado basal de dopamina (Wong et al. 1993). 229 DISCUSIÓN En la misma línea, en experimentaciones previas la administración i.p. de L-DOPA produjo un pequeño incremento en los niveles de dopamina en dializado (Miller y Abercrombie 1999).En este caso la misma dosis en animales control el incremento de los niveles de dopamina fue de 1,3 veces, frente a las 50,7 veces observadas en animales con 6-OHDA que recibieron la misma dosis. Este efecto puede ser debido a que el estriado intacto es capaz de eliminar de forma muy eficiente la dopamina derivada de la L-DOPA externa. Por otra parte, en el estriado denervado el incremento podría derivar de una substancial contribución de la neuronas residuales y estar mediada por neuronas no dopaminérgicas. Antecedentes previos describen en ratas normales un sistema que regula los niveles de dopamina por medio de receptores y a través del metabolismo, lo que hacen que la concentración dopaminérgica se mantenga estable (Wong et al 1993; Miller y Abercrombie 1999; Kannari et al. 2000). Además, en animales intactos el incremento de dopamina extracelular derivada de L-DOPA es moderada debido a que existe un baja difusión de dopamina al espacio extracelular. Igualmente, la dopamina que se libera por la administración de L-DOPA no alcanza en gran medida la sonda de microdiálisis debido a la recaptación por el DAT (Miller y Abercrombie 1999). Todos estos datos explicarían por qué en el grupo experimental con LDOPA i. p. fue necesario utilizar una dosis elevada de L-DOPA y esperar 2 horas para observar un elevado incremento de los niveles de dopamina estriatal. Por otra parte, se puede constatar un buen efecto sinérgico con ambos compuestos. La L-DOPA incrementó los niveles estriatales de dopamina y sus metabolitos, la administración de isatina en ratas tratas con isatina 230 DISCUSIÓN potenció el efecto de L-DOPA sobre los niveles de dopamina y provocó una disminución de los niveles de los metabolitos. Además, como en grupos experimentales previamente discutidos, se puede sugerir la hipótesis de que la isatina actuó por medio de la inhibición de ambas isoformas de la MAO. Corroborando dicha hipótesis, Männistö y Kaakkola (1990) señalan que cuando se administra L-DOPA ante el bloqueo de una vía degradativa pueden surgir rutas metabólicas alternativas. Por tanto, la inhibición de una isoenzima provocaría la activación de la otra. También, Green et al. (1977) observaron que no se producían modificaciones en los niveles de dopamina estriatal en ratas por medio de L-DOPA i.p. hasta que no se producía una elevada inhibición de ambas isoformas de la MAO. Por tanto, si la isatina realizase una inhibición de una sola isoenzima actuaría la otra y los niveles de dopamina evocada serían menores. Igualmente, estudios previos indican que dosis no selectivas de selegilina mejoran la respuesta dopaminérgica a la L-DOPA en registros electrofisiológicos (Mercuri et al. 1998), por lo que se sugerimos que el abordaje clínico por dosis no selectivas de un I-MAOB, como en nuestro caso, podría ayudar a disminuir los requerimientos diarios de L-DOPA en pacientes, aunque se deben evaluar los posibles efectos secundarios de la inhibición de la MAO-A. 5.4.6. Sumario de la coadministración de isatina y compuestos de acción antiparkinsoniana En nuestro paradigma experimental todos los compuestos evaluados con acción antiparkinsoniana mostraron una buena respuesta neuroquímica al incrementar el efecto de la isatina sobre la liberación de dopamina, a excepción de la atropina y del ropinirol. 231 DISCUSIÓN De las coadministraciones realizadas destaca la realizada con el grupo de los ICOMT, ya que se observó un incremento de los niveles de dopamina y un descenso de ambos metabolitos. 5.5. MEDIACIÓN DE LOS RECEPTORES GLUTAMATÉRGICOS EN EL EFECTO DE LA ISATINA SOBRE LA LIBERACIÓN DE DOPAMINA La substancia negra y el núcleo estriado reciben proyecciones glutamatérgicas y se ha observado que la administración de agonistas glutamatérgicos incrementa la liberación de dopamina (Westerink et al. 1992; Keefe et al. 1992; Keefe et al. 1993; Opazo 2010). Igualmente, se considera que el glutamato regula la liberación espontánea y evocada de dopamina en el estriado (Kulagina et al. 2001; Borland y Michael 2004). En este efecto, se observó que los receptores ionotrópicos pueden modular la neurotransmisión dopaminérgica estriatal (Krebs et al. 1991; Zigmond et al. 1998; Borland y Michael 2004). En la EP se han descrito alteraciones en la interacción entre el glutamato y la dopamina en neuronas estriatales, que contribuyen a la aparición de síntomas motores. De este modo, la sensibilización de receptores NMDA y AMPA altera el input glutamatérgico cortical en el estriado y modifica el output GABAérgico, lo que altera la función motora. Por este motivo, antagonistas de los receptores NMDA son investigados como dianas farmacológicas en la EP y son utilizados actualmente para el control de las discinesias en esta patología (Danysz et al. 1997; Lange et al. 1997; Ko et al. 2014; Tronci et al. 2014). Este grupo de experimentos se realizó con la finalidad de evaluar la posible mediación de receptores NMDA en la liberación de dopamina 232 DISCUSIÓN inducida por isatina. Para ello se utilizó el antagonista competitivo AP-5 y el antagonista no competitivo MK-801. En ambos grupos experimentales el pretratamiento con antagonistas de receptores NMDA produjo un descenso significativo del efecto de la isatina sobre los niveles estriatales de dopamina. El AP-5 produjo un descenso del 55,6 % del efecto máximo de la isatina (Figura 4.18) y el descenso producido por el MK-801 fue del 57,3% (Figura 4.19). La disminución del efecto de la isatina producido por los antagonistas NMDA se puede explicar por el hecho de que estos compuestos podrían estar bloqueando un circuito liberador de dopamina dependiente de impulso, que es producido por glutamato. Como no se produce dicha liberación exocitótica por glutamato no se liberada la dopamina, aunque se inhiba la vía degradativa por la isatina (Moghaddan et al. 1994). Sin embargo, algunos estudios indican que la liberación de dopamina estimulada por glutamato es independiente de impulso (Krebs et al. 1991). Igualmente, Lonart y Zigmond (1991) indican que la liberación de dopamina mediada por glutamato podría producirse por acción inversa del DAT. Por tanto, aunque los niveles de dopamina citoplasmática se vieran incrementados por isatina al inhibir el impulso excitador por dicho antagonista no se produce liberación. Desce et al. (1994) observaron en sinaptosomas que el glutamato por medio de receptores NMDA podría inhibir la síntesis de dopamina y estimular su liberación. Por tanto, en animales pretratados con antagonistas de estos receptores, al administrar isatina se podría producir una disminución de la liberación, aunque no se vea afectada la síntesis. Igualmente, se ha observado que el MK-801 previene las alteraciones motrices inducidas por L-DOPA en ratas (Marin et al. 1996).Además, en 233 DISCUSIÓN ratas parkinsonizadas con 6-OHDA, el MK-801 potencia la liberación de dopamina por administración de L-DOPA (Arfani et al. 2014). Por otra parte, considerado el efecto observado con los antagonistas de los receptores NMDA y la eliminación del Ca++ del medio Ringer, una hipótesis sobre el mecanismo de acción de la isatina también podría ser que la liberación de dopamina evocada por isatina está influenciada por el influjo de Ca++ a través de los canales de Ca++ acoplados a receptores NMDA (Takahashi et al. 1996). Otro mecanismo que podría estar involucrado en este efecto del MK801, sería el bloqueo de los canales de Na+ dependientes de voltaje, efecto observado en otros estudios con veratridina (Sitges et al. 2000). Este resultado resultaría congruente con los datos obtenidos en el grupo de pretratamiento con TTX. Por otra parte, en estudios previos se observó que antagonistas NMDA, como el MK-801, podrían ejercer efectos neuroprotectores ante la excitotoxicidad neuronal. En este estudio un IMAO-B (la selegilina) presentó un efecto neuroprotector similar, aunque por medio de la regulación descendiente en cascada del receptor (Mytilineou et al. 1997). En esta línea, resultaría interesante investigar si la interacción de la isatina y los receptores NMDA podrían estar implicados en mecanismos neuroprotectores. Estos resultados indican que los receptores NMDA podrían participar en la liberación de dopamina estimulada por isatina. 234 DISCUSIÓN 5.6. MEDIACIÓN DEL ÓXIDO NÍTRICO EN EL EFECTO DE LA ISATINA SOBRE LA LIBERACIÓN DE DOPAMINA El NO, gas soluble inestable, es una molécula mensajera multifuncional cuya señalización interviene en diversas regiones del sistema nervioso y se considera un modulador de la actividad estriatal, así como del control motor y conductual (Del Bel et al. 2005; Vincent 2010). El NO activa la enzima guanilato ciclasa e incrementa los niveles de GMP, este GMP incrementado por el NO juega un importante papel en el ciclo del Ca++. La acción del NO requiere de la activación de receptores NMDA de glutamato (Crespi et al. 2004; Hoque et al. 2010). Los agonistas NMDA generan NO que difunde rápidamente por el tejido neural. Se ha observad que el NO produce un incremento de la liberación de dopamina estriatal (Hanbauer et al. 1992; Zhu y Luo 1992). Igualmente, estudios previos in vivo muestran que el NO facilita la liberación de dopamina por medio de un mecanismo dependiente de Ca++ (West y Galloway 1998; Rocchitta et al. 2004). Por otra parte, IMAO e I-NOS han sido estudiados previamente como posibles agentes neuroprotectores ante la generación de estrés oxidativo en la EP (Youdim y Lavie 1994). Por lo que en este grupo experimental podría acercarnos un poco más a la comprensión del efecto de ambos compuestos. Ya que se ha observado que la estimulación de receptores NMDA produce NO (Cheramy et al. 1998) y en los grupos experimentales previos se observó que los receptores NMDA podrían influenciar el efecto de la isatina sobre la neurotransmisión dopaminérgica, en este grupo experimental se pretendió determinar si el NO podría influenciar el efecto 235 DISCUSIÓN de la isatina sobre la neurotransmisión dopaminérgica. Para ello se utilizaron dos inhibidores de la NOS: L-NAME y 7-NI. El pretratamiento con L-NAME y 7-NI produjo una disminución del efecto máximo de la isatina sobre los niveles de dopamina del 59,9 % y 28,5 %, respectivamente (Figura 4.20 y 4.21). Por lo que el NO podría intervenir en la liberación de dopamina producida por isatina. Considerando los resultados en conjunto, la isatina podría actuar indirectamente sobre los receptores NMDA, lo que conllevaría a una activación de la NOS. A su vez, la activación de esta enzima sintética produciría el NO que ayudaría a la liberación de dopamina. La mayoría de los estudios concuerdan en que los compuestos que estimulan la síntesis de NO incrementan la liberación de dopamina. Sin embargo, el mecanismo por el cual lo realizan se desconoce (West et al. 2002). En otra línea, la interacción de la isatina y el NO podría producirse por medio de receptores dopaminérgicos tipo D1. Se ha observado que la liberación fásica de dopamina, como la que ha mostrado la isatina en este trabajo de investigación, puede activar los receptores D1 y provocar un incremento de los niveles de NO en el núcleo estriado (Sammut et al. 2006), mientras que la activación de receptores D2 produciría efectos opuestos (Sammut et al. 2007). Aunque se desconocen los mecanismos exactos por los cuales los receptores dopaminérgicos influencian la síntesis de NO, se ha evidenciado que la activación de los receptores D1 potencia las respuestas inducidas sobre las neuronas estriatales (Cepeda y Levine 1998). 236 DISCUSIÓN 5.7. EFECTO DE LA ISATINA SOBRE AMINOÁCIDOS NEUROTRANSMISORES EN EL NÚCLEO ESTRIADO El glutamato y el aspartato se consideran los principales neurotransmisores de las proyecciones corticales al estriado desde el área motora y premotora (Yamamoto y Davy 1992). La interacción del glutamato y dopamina en el estriado se considera relevante para el control farmacológico de los ganglios basales (Morales et al. 2013). Además, Castro et al. (1996) y Timmerman et al. (1998) indican que el incremento de dopamina podría regular la liberación de aminoácidos excitadores, así como, los aminoácidos excitadores podrían estimular la síntesis y liberación dopaminérgica. La administración intraestriatal de isatina produjo un ligero incremento en los niveles extracelulares de aspartato y glicina de 1,9 y 1,4 veces, con respecto al basal, respectivamente. El aminoácido neurotransmisor sobre el que se observó un mayor incremento por la perfusión de isatina fue el glutamato, que se incrementó 4,6 veces, con respecto a los niveles basales (Figuras 4.23-4.26). La poca influencia de la isatina sobre el aspartato se puede explicar por limitaciones metodológicas. El número de terminaciones dopaminérgicas que están en contacto con los terminales excitatorios es baja, por lo que es posible que eventos que acontecen en esas ubicaciones no ejerzan gran influencia sobre el líquido extracelular recogido por microdiálisis (Moghaddan et al. 1990). Asimismo, la concentración de aminoácidos observados en el núcleo estriado por microdiálisis es discutible debido a la elevada compartimentalización de dichos neurotransmisores (Timmerman y Westerink 1997). Además, Westerink et al. (1987) consideran que el 237 DISCUSIÓN contenido de aminoácidos en dializados estriatales podría derivar de procesos metabólicos y no provenir de la actividad neuronal. En relación al incremento observado en los niveles de glutamato, previamente Godukhin et al. (1984) observaron que la administración intraestriatal de dopamina, apomorfina y feniletilamina incrementa los niveles de glutamato en el estriado. Además, Yamamoto y Davy (1992) observaron que una perfusión con alto K+ a nivel estriatal produjo un incremento de glutamato, aspartato y taurina. Estos autores indican que la dopamina actuando sobre receptores D2 podría modificar la liberación de glutamato de los terminales corticoestriatales. En base a estos datos, podríamos considerar que la isatina por medio del incremento de dopamina y activación de receptores dopaminérgicos podría producir un incremento de glutamato en el núcleo estriado. Otro nexo que asocia el incremento en los niveles de glutamato y el efecto producido por la isatina sobre la dopamina estriatal lo proporcionan los resultados observados por Moghaddan et al. (1990). Estos investigadores observaron que la administración i.e. de glutamato puede provocar un incremento de la concentración extracelular de K+. Por tanto, en nuestro estudio, un aumento de las concentraciones de este ion producidas por el incremento de glutamato, podría incrementar la liberación de dopamina estimulada por isatina. Estos datos podrían corroborar los resultados obtenidos en grupos experimentales previos donde describimos que un Ringer con alta concentración de K+ incrementó significativamente el efecto de la isatina sobre la dopamina. Asimismo, teniendo en cuenta los grupos experimentales previos sobre el posible efecto de la isatina sobre los receptores NMDA y el NO, se ha observado in vivo que la estimulación de receptores NMDA y la consecuente producción de NO podrían incrementar los niveles de 238 DISCUSIÓN glutamato (Bustos et al. 1992; West et al. 2002). Igualmente, en trabajos anteriores se ha observado que la estimulación de receptores NMDA produce un incremento de los niveles estriatales de dopamina y glutamato, siendo precedente el incremento de la dopamina (Morari et al. 1993). Por tanto, la isatina podría estar activando o regulando los receptores NMDA ubicados en las terminaciones dopaminérgicas y estos a su vez podrían inducir la liberación de glutamato y aspartato. Adicionalmente, la activación de estos receptores NMDA podría activar la NOS incrementando los niveles de NO, que a su vez aumentaría los niveles de dopamina liberada por isatina. Otra hipótesis, para la explicación de nuestros resultados, consistiría en que la isatina incrementa directamente los niveles estriatales de glutamato. Este glutamato liberado por acción de la isatina podría actuar sobre los receptores NMDA lo que produciría un incremento de dopamina en el espacio extracelular. Reforzando esta hipótesis, se considera que son necesarias concentraciones elevadas de glutamato a nivel estriatal para incrementar los niveles de dopamina (Moghaddam et al. 1990; Lonart y Zigmond 1991) y esto se produciría por medio de la activación de receptores NMDA (Clow y Jhamandas 1989; Moghaddam et al. 1990). Además, se ha postulado que los aminoácidos liberados de las proyecciones corticoestriatales podrían estimular la síntesis dopaminérgica en condiciones en las cuales exista poca disponibilidad de dopamina (Castro et al. 1996). Igualmente, el glutamato también podría ejercer acción modulatoria en los eventos neurofisiológicos compensatorios que suceden en la pérdida neuronal en procesos neuropatológicos (Zigmond et al. 1998). Por lo que el incremento de los 239 DISCUSIÓN niveles estriatales de glutamato observado en nuestra investigación, por acción de la isatina, podría tener repercusiones beneficiosas sobre la EP. Sin embargo, es necesario tener precaución en la interpretación de estos resultados, ya que recientes estudios in vivo señalan que es posible la generación de excitotoxicidad en regiones distantes al estriado, provocada por el incremento de glutamato en este núcleo (Morales et al. 2013). 240 6 CONCLUSIONES Efectos de la isatina sobre la neurotransmisión dopaminérgica en el núcleo estriado. Un estudio in vivo mediante microdiálisis cerebral. CONCLUSIONES 1. La administración intraestriatal de isatina incrementa los niveles de dopamina y disminuye los niveles de sus metabolitos en el núcleo estriado de forma concentración-dependiente. 2. La liberación in vivo de dopamina estriatal estimulada por isatina es de tipo exocitótico, ya que es dependiente de despolarización de la membrana neuronal, de almacenamiento vesicular y de calcio extracelular. 3. La isatina aumenta la liberación de dopamina estimulada por despolarización con potasio. 4. La isatina, en la concentración utilizada, parece inhibir la MAO de forma no selectiva, ya que la coadministración de clorgilina o selegilina con isatina no modificó el efecto de ésta sobre la liberación de dopamina en el núcleo estriado. 5. Los compuestos con acción antiparkinsoniana que presentan mejor interacción neuroquímica con la isatina, considerando los incrementos en los niveles de dopamina son: inhibidores de la COMT, amantadina y L-DOPA. Además, destaca la coadministración de isatina con inhibidores de la COMT porque también disminuye los niveles de los metabolitos. 6. La administración intraestriatal de isatina potencia la liberación de dopamina estimulada por L-DOPA administrada sistémicamente en ratas. 243 CONCLUSIONES 7. La liberación de dopamina estimulada por isatina parece implicar la participación de receptores NMDA de glutamato, ya que el bloqueo de estos receptores afecta a la liberación de dopamina estimulada por isatina. 8. El óxido nítrico también puede influir en la liberación in vivo de dopamina inducida por isatina a través de la activación de receptores glutamatérgicos de tipo NMDA. Esto indica una implicación de la vía glutamatérgica y producción de óxido nítrico en los efectos de la isatina sobre la neurotransmisión dopaminérgica in vivo. 9. Además de la dopamina, la isatina parece actuar sobre otros sistemas neurotransmisores en el núcleo estriado, aumentando los niveles de aminoácidos neurotransmisores como el glutamato, aspartato y glicina. 244 7 REFERENCIAS BIBLIOGRÁFICAS Efectos de la isatina sobre la neurotransmisión dopaminérgica en el núcleo estriado. Un estudio in vivo mediante microdiálisis cerebral. REFERENCIAS BIBLIOGRÁFICAS Abasolo-Osinaga E, Abecia-Inchaurregui L, Fernández-Díaz E, Barcenilla-Laguna A, Bañares-Onraita T. Prevalencia y coste farmacológico de la enfermedad de Parkinson en España. Revista de neurología. 2006; 43(11): 641-5. Abel EL. Behavioral effects of isatin on open field activity and immobility in the forced swim test in rats. Physiol Behav. 1995; 57(3): 611- 13. Acquas E, Carboni E, Ree R, Prada M, Chiara G. Extracellular concentrations of dopamine and metabolites in the rat caudate after oral administration of a novel Catechol‐O‐Methyltransferase inhibitor ro 40–7592. J Neurochem. 1992;59(1):326-30. Adachi K, Miwa H, Kusumoto H, Shimazu S, Kondo T. Effects of subchronic treatment with selegiline on L-DOPA-induced increase in extracellular dopamine level in rat striatum. Journal of pharmacological sciences. 2006;101(4):286-92. Aluf Y, Vaya J, Khatib S, Loboda Y, Finberg JP. Selective inhibition of monoamine oxidase A or B reduces striatal oxidative stress in rats with partial depletion of the nigro-striatal dopaminergic pathway. Neuropharmacology. 2013;65:48-57. Arai A, Kannari K, Shen H, Maeda T, Suda T, Matsunaga M. Amantadine increases L-DOPA-derived extracellular dopamine in the striatum of 6-hydroxydopamine-lesioned rats. Brain Res. 2003;972(1):229-34. Arbelo JM, Malo R. Advances in drug therapy: Alternative treatments for the control of motor fluctuations and dyskinesias. En: Qayyum A., editor. Diagnosis and Treatment of Parkinson ’s disease. Croatia: In Tech; 2011:105- 16. Arbuthnott G, Fairbrother I, Butcher S. Dopamine release and metabolism in the rat striatum: An analysis by in vivo brain microdialysis. Pharmacol Ther. 1990a;48(3):281-93. Arbuthnott G, Fairbrother I, Butcher S. Brain microdialysis studies on the control of dopamine release and metabolism in vivo. J Neurosci Methods. 1990b;34(1):73-81. 247 REFERENCIAS BIBLIOGRÁFICAS Arfani A, Bentea E, Aourz N, Ampe B, De Deurwaerdère P, Van Eeckhaut A, et al. NMDA receptor antagonism potentiates the LDOPA-induced extracellular dopamine release in the subthalamic nucleus of hemi-parkinson rats. Neuropharmacology. 2014. Bahena-Trujillo R, Flores G, Arias-Montaño JA, de Puebla P. Dopamina: Síntesis, liberación y receptores en el sistema nervioso central. Rev Biomed. 2000; 11: 39-60. Baluja S, Bhalodia R, Bhatt M, Vekariya N, Gajera R. Solubility of a pharmacological intermediate drug isatin in different solvents at various temperatures. International Letters of Chemistry, Physics and Astronomy. 2013; 12: 36- 46. Bannon MJ. The dopamine transporter: Role in neurotoxicity and human disease. Toxicol Appl Pharmacol. 2005;204(3):355-60. Barbosa ER, Bossoni AS. Safinamida: Uma nova perspectiva para o tratamento da doença de parkinson (DP). Boletim Neuro Atual. 2014;5(6). Beaulieu JM, Gainetdinov RR. The physiology, signaling, and pharmacology of dopamine receptors. Pharmacol Rev. 2011; 63(1): 182-217. Bergquist F, Jonason J, Pileblad E, Nissbrandt H. Effects of local administration of L‐, N‐, and P/Q‐Type calcium channel blockers on spontaneous dopamine release in the striatum and the substantia nigra: A microdialysis study in rat. J Neurochem. 1998;70(4):1532-40. Berry M, Scarr E, Zhu M, Paterson I, Juorio A. The effects of administration of monoamine oxidase‐B inhibitors on rat striatal neurone responses to dopamine. Br J Pharmacol. 1994;113(4):115966. Bezard E, Przedborski S. A tale on animal models of parkinson's disease. Movement Disorders. 2011;26(6):993-1002. Bhattacharya S, Clow A, Przyborowska A, Halket J, Glover V, Sandler M. Effect of aromatic amino acids, pentylenetetrazole and yohimbine on isatin and tribulin activity in rat brain. Neurosci Lett. 1991a; 132(1): 44-6. 248 REFERENCIAS BIBLIOGRÁFICAS Bhattacharya S, Banerjee P, Vivette G, Sandler M. Augmentation of rat brain endogenous monoamine oxidase inhibitory activity (tribulin) by electroconvulsive shock. Neurosci Lett. 1991b;125(1):65-8. Bhattacharya SK, Mitra SK, Acharya SB. Anxiogenic activity of isatin, a putative biological factor, in rodents. J Psychopharmacol. 1991c; 5(3): 202-6. Bhattacharya SK, Chakrabarti A. Dose-related proconvulsant and anticonvulsant activity of isatin, a putative biological factor, in rats. Indian J Exp Biol. 1998; 36(1): 118-21. Bhrigu B, Pathak D, Siddiqui N, Alam M, Ahsan W. Search for biological active isatins: A short review. Int J P’ceutical Sci & Drug Research. 2010; 2(4): 229-35. Bicker J, Fortuna A, Alves G, Falcão A. Liquid chromatographic methods for the quantification of catecholamines and their metabolites in several biological samples - A review. Anal Chim Acta. 2013;768(1):12-34. Bidlingmeyer BA. Practical HPLC methodology and applications. 1st ed. New York: John Wiley and Sons; 1992. Binda C, Newton-Vinson P, Hubálek F, Edmondson DE, Mattevi A. Structure of human monoamine oxidase B, a drug target for the treatment of neurological disorders. Nature Structural & Molecular Biology. 2001; 9(1): 22-6. Binda C, Li M, Hubalek F, Restelli N, Edmondson DE, Mattevi A. Insights into the mode of inhibition of human mitochondrial monoamine oxidase B from high-resolution crystal structures. Proc Natl Acad Sci USA. 2003;100(17): 9750-5. Binda C, Wang J, Pisani L, Caccia C, Carotti A, Salvati P, et al. Structures of human monoamine oxidase B complexes with selective noncovalent inhibitors: Safinamide and coumarin analogs. J Med Chem. 2007; 50(23): 5848-52. Binda C, M Milczek E, Bonivento D, Wang J, Mattevi A, E Edmondson D. Lights and shadows on monoamine oxidase inhibition in neuroprotective pharmacological therapies. Current topics in medicinal chemistry. 2011;11(22):2788-96. 249 REFERENCIAS BIBLIOGRÁFICAS Bito L, Davson H, Levin E, Murray M, Snider N. The concentrations of free amino acids and other electrolytes in cerebrospinal fluid, in vivo dialysate of brain, and blood plasma of the dog*. J Neurochem. 1966;13(11):1057-67. Björklund A, Dunnett SB. Dopamine neuron systems in the brain: An update. Trends Neurosci. 2007; 30(5):194-202. Blackstone C. Infantile parkinsonism-dystonia: A "transportopathy". J Clin Invest. 2009;119(6):1455-8. Blaha C, Coury A, Phillips A. Does monoamine oxidase inhibition by pargyline increase extracellular dopamine concentrations in the striatum? Neuroscience. 1996;75(2):543-50. Blandini F, Nappi G, Tassorelli C, Martignoni E. Functional changes of the basal ganglia circuitry in parkinson's disease. Prog Neurobiol. 2000; 62(1): 63-88. Boll MC, Alcaraz-Zubeldia M, Rios C. Medical management of parkinson's disease: Focus on neuroprotection. Curr Neuropharmacol. 2011; 9(2): 350-9. Borland LM, Michael AC. Voltammetric study of the control of striatal dopamine release by glutamate. J Neurochem. 2004;91(1):220-9. Bortolato M, Chen K, Shih JC. Monoamine oxidase inactivation: From pathophysiology to therapeutics. Adv Drug Deliv Rev. 2008; 60(13): 1527-33. Bortolato M, Shih JC. Behavioral outcomes of monoamine oxidase deficiency: Preclinical and clinical evidence. Int Rev Neurobiol. 2011; 100: 13-42. Bourne JA. Intracerebral microdialysis: 30 years as a tool for the neuroscientist. Clin Exp Pharmacol Physiol. 2003;30(1-2):16-24. Braak H, Del Tredici K. Cortico-basal ganglia-cortical circuitry in parkinson's disease reconsidered. Exp Neurol. 2008; 212(1): 226-9. 250 dopamine REFERENCIAS BIBLIOGRÁFICAS Brannan T, Prikhojan A, Martinez-Tica J, Yahr M. In vivo comparison of the effects of inhibition of MAO-A versus MAO-B on striatal LDOPA and dopamine metabolism. Journal of Neural TransmissionParkinson's Disease and Dementia Section. 1995;10(2-3):79-89. Brewerton TD, Zealberg JJ, Lydiard RB, Glover V, Sandler M, Ballenger JC. CSF isatin is elevated in bulimia nervosa. Biol Psychiatry. 1995; 37(7): 481-3. Broch OJ. The in vivo effect of tropolone on dopamine metabolism and the Catechol‐O‐Methyl transferase activity in the striatum of the rat. Acta Pharmacol Toxicol. 1972;31(3):217-25. Budygin EA, Gainetdinov RR, Kilpatrick MR, Rayevsky KS, Männistö PT, Wightman RM. Effect of tolcapone, a catechol-Omethyltransferase inhibitor, on striatal dopaminergic transmission during blockade of dopamine uptake. Eur J Pharmacol. 1999;370(2):125-31. Budygin EA, Kilpatrick MR, Gainetdinov RR, Wightman RM. Correlation between behavior and extracellular dopamine levels in rat striatum: Comparison of microdialysis and fast-scan cyclic voltammetry. Neurosci Lett. 2000;281(1):9-12. Buneeva OA, Gnedenko OV, Medvedeva MV, Ivanov I, Glover V, Medvedev AE. Interaction of pyruvate kinase with isatin and deprenyl. Biomed Khim. 2007; 52(4): 413-8. Buneeva O, Gnedenko O, Zgoda V, Kopylov A, Glover V, Ivanov A, et al. Isatin‐binding proteins of rat and mouse brain: Proteomic identification and optical biosensor validation. Proteomics. 2010; 10(1): 23-37. Burguera JA, Cubo E. Amantadina. En: García PJ, Martínez JC. Guía oficial de práctica clínica en la enfermedad de Parkinson 2010. Barcelona: Sociedad Española de Neurología; 2009. p. 103-109. 251 REFERENCIAS BIBLIOGRÁFICAS Bustos G, Abarca J, Forray MI, Gysling K, Bradberry CW, Roth RH. Regulation of excitatory amino acid release by N-methyl-D-aspartate receptors in rat striatum: In vivo microdialysis studies. Brain Res. 1992;585(1):105-15. Butcher SP, Fairbrother IS, Kelly JS, Arbuthnott GW. Amphetamine‐ induced dopamine release in the rat striatum: An in vivo microdialysis study. J Neurochem. 1988;50(2):346-55. Butcher SP, Fairbrother IS, Kelly JS, Arbuthnott GW. Effects of selective monoamine oxidase inhibitors on the in vivo release and metabolism of dopamine in the rat striatum. J Neurochem. 1990; 55(3): 981-8. Butcher S, Liptrot J, Aburthnott G. Characterisation of methylphenidate and nomifensine induced dopamine release in rat striatum using in vivo brain microdialysis. Neurosci Lett. 1991;122(2):245-8. Buu NT, Angers M. Effects of different monoamine oxidase inhibitors on the metabolism of L-dopa in the rat brain. Biochem Pharmacol. 1987;36(10):1731-5. Calabresi P, Picconi B, Tozzi A, Di Filippo M. Dopamine-mediated regulation of corticostriatal synaptic plasticity. Trends Neurosci. 2007; 30(5): 211-9. Campos F, Durán R, Vidal L, Faro L, Alfonso M. In vivo neurochemical characterization of anatoxin-a evoked dopamine release from striatum. J Neural Transm. 2007;114(2):173-84. Campos F, Rellán S, Duran R, Gago A, Faro LF, Alfonso M. Evaluation of in vivo and in vitro recovery rate of anatoxin-a through the microdialysis probe. Toxicon. 2008;52(7):817-23. Cândido-Bacani PdM, Reis MBd, Serpeloni JM, Calvo TR, Vilegas W, Varanda EA, et al. Mutagenicity and genotoxicity of isatin in mammalian cells in vivo. Mutation Research/Genetic Toxicology and Environmental Mutagenesis. 2011; 719(1): 47-51. 252 REFERENCIAS BIBLIOGRÁFICAS Cane A, Tournaire M, Barritault D, Crumeyrolle-Arias M. The endogenous oxindoles 5-hydroxyoxindole and isatin are antiproliferative and proapoptotic. Biochem Biophys Res Commun. 2000; 276(1): 379-84. Castro SL, Sved AF, Zigmond MJ. Increased neostriatal tyrosine hydroxylation during stress: Role of extracellular dopamine and excitatory amino acids. J Neurochem. 1996;66(2):824-33. Castro A, Campos V. Inhibidores de la catecolortometiltransferasa I: entacapona. En: García PJ, Martínez JC. Guía oficial de práctica clínica en la enfermedad de Parkinson 2010. Barcelona: Sociedad Española de Neurología; 2009. p. 217-228. Cepeda C, Levine MS. Dopamine and N-methyl-D-aspartate receptor interactions in the neostriatum. Dev Neurosci. 1998;20(1):1-18. Chaurasia CS. In vivo microdialysis sampling: Theory and applications. Biomed Chromatogr. 1999;13(5):317-32. Chaurasia CS, Müller M, Bashaw ED, Benfeldt E, Bolinder J, Bullock R, et al. AAPS-FDA workshop white paper: Microdialysis principles, application, and regulatory perspectives report from the joint AAPSFDA workshop, november 4-5, 2005, nashville, TN. AAPS Journal. 2007;9(1). Chefer VI, Thompson AC, Zapata A, Shippenberg TS. Overview of brain microdialysis. Curr Protoc Neurosci. 2009(SUPPL. 47):7.1.17.1.28. Cheramy A, L'hirondel M, Godeheu G, Artaud F, Glowinski J. Direct and indirect presynaptic control of dopamine release by excitatory amino acids. Amino Acids. 1998;14(1-3):63-8. Chocholova L, Kolinova M. Effect of isatin (2,3-dioxoindoline) on audiogenic seizures in rats and its relationship to electrographic and behavioural phenomena. Physiol Bohemoslov. 1979; 28(6): 495-502. Chocholova L, Kolinova M. Effect of isatin (2,3 dioxoindoline) on physiological and pathological electrographic manifestations and vigilance. Physiol Bohemoslov. 1981; 30(2): 129-37. 253 REFERENCIAS BIBLIOGRÁFICAS Cianca RCC, Barbosa RD, Faro LRF, Adan LV, Gago-Martínez A, Pallares MA. Differential changes of neuroactive amino acids in samples obtained from discrete rat brain regions after systemic administration of saxitoxin. Neurochem Int. 2009;54(5-6):308-13. Clow A, Davidson J, Glover V, Halket J, Milton A, Sandler M, et al. Isatin and tribulin concentrations are increased in rabbit brain but not liver following pentylenetetrazole administration. Neurosci Lett. 1989; 107(1): 327-30. Clow DW, Jhamandas K. Characterization of L-glutamate action on the release of endogenous dopamine from the rat caudate-putamen. J Pharmacol Exp Ther. 1989;248(2):722-8. Colzi A, D'Agostini F, Cesura AM, Borroni E, Da Prada M. Monoamine oxidase-A inhibitors and dopamine metabolism in rat caudatus: Evidence that an increased cytosolic level of dopamine displaces reversible monoamine oxidase-A inhibitors in vivo. J Pharmacol Exp Ther. 1993;265(1):103-11. Colzi A, Musolino A, Iuliano A, Fornai F, Bonuccelli U, Corsini G. Identification and determination of 3, 4‐ Dihydroxyphenylacetaldehyde, the dopamine metabolite, in in vivo dialysate from rat striatum. J Neurochem. 1996;66(4):1510-7. Connolly BS, Lang AE. Pharmacological treatment of parkinson disease: A review. JAMA. 2014; 311(16): 1670-83. Crespi F, Rossetti ZL. Pulse of nitric oxide release in response to activation of N-methyl-D-aspartate receptors in the rat striatum: Rapid desensitization, inhibition by receptor antagonists, and potentiation by glycine. J Pharmacol Exp Ther. 2004 May;309(2):462-8. Crumeyrolle‐Arias M, Medvedev A, Cardona A, Barritault D, Glover V. In situ imaging of specific binding of [3H] isatin in rat brain. J Neurochem. 2003; 84(3) :618-20. Crumeyrolle‐Arias M, Buneeva O, Zgoda V, Kopylov A, Cardona A, Tournaire M, et al. Isatin binding proteins in rat brain: In situ imaging, quantitative characterization of specific [3H] isatin binding, and proteomic profiling. J Neurosci Res. 2009;87(12):2763-72. 254 REFERENCIAS BIBLIOGRÁFICAS Cubo E, Burguera JA. Anticolinérgicos. En: García PJ, Martínez JC. Guía oficial de práctica clínica en la enfermedad de Parkinson 2010. Barcelona: Sociedad Española de Neurología; 2009. p. 217-228. Culver K, Rosenfeld J, Szechtman H. Monoamine oxidase inhibitorinduced blockade of locomotor sensitization to quinpirole: Role of striatal dopamine uptake inhibition. Neuropharmacology. 2002;43(3):385-93. Cumming P, Brown E, Damsma G, Fibiger H. Formation and clearance of interstitial metabolites of dopamine and serotonin in the rat striatum: An in vivo microdialysis study. J Neurochem. 1992;59(5):1905-14. Damsma G, Westerink BH, de Vries JB, Horn AS. The effect of systemically applied cholinergic drugs on the striatal release of dopamine and its metabolites, as determined by automated brain dialysis in conscious rats. Neurosci Lett. 1988;89(3):349-54. Daneault J, Carignan B, Sadikot AF, Duval C. Are quantitative and clinical measures of bradykinesia related in advanced parkinson's disease? J Neurosci Methods. 2013;219(2):220-3. Danysz W, Parsons C, Kornhuber J, Schmidt W, Quack G. Aminoadamantanes as NMDA receptor antagonists and antiparkinsonian agents—preclinical studies. Neuroscience & Biobehavioral Reviews. 1997;21(4):455-68. Darvesh AS, Carroll RT, Geldenhuys WJ, Gudelsky GA, Klein J, Meshul CK, et al. In vivo brain microdialysis: Advances in neuropsychopharmacology and drug discovery. Expert Opin Drug Discov. 2011;6(2):109-27. Dedek J, Baumes R, Ten‐Duc N, Gomeni R, Korf J. Turnover of free and conjugated (sulphonyloxy) dihydroxyphenylacetic acid and homovanillic acid in rat striatum. J Neurochem. 1979;33(3):687-95. Del Bel E, Guimaraes F, Bermũdez-Echeverry M, Gomes M, Schiaveto-de-Souza A, Padovan-Neto F, et al. Role of nitric oxide on motor behavior. Cell Mol Neurobiol. 2005;25(2):371-92. 255 REFERENCIAS BIBLIOGRÁFICAS Delgado JM, De Feudis FV, Roth, RH, Ryugo DK, Mytruca BK. Dyalitrode for long term intracerebral perfusion in awake monkeys. Archf Int Pharmacodyn. 1972; 198: 9-21. DeLong MR, Wichmann T. Circuits and circuit disorders of the basal ganglia. Arch Neurol. 2007; 64(1): 20-4. Desce J, Godeheu G, Galli T, Glowinski J. Opposite presynaptic regulations by glutamate through NMDA receptors of dopamine synthesis and release in rat striatal synaptosomes. Brain Res. 1994;640(1):205-14. Di Monte DA, DeLanney LE, Irwin I, Royland JE, Chan P, Jakowec MW, et al. Monoamine oxidase-dependent metabolism of dopamine in the striatum and substantia nigra of L-DOPA-treated monkeys. Brain Res. 1996; 738(1): 53-9. Dorsey ER, Constantinescu R, Thompson JP, Biglan KM, Holloway RG, Kieburtz K, et al. Projected number of people with parkinson disease in the most populous nations, 2005 through 2030. Neurology. 2007; 68(5): 384-6. Doyle A, Pang F, Bristow M, Hucklebridge F, Evans P, Clow DA. Urinary cortisol and endogenous monoamine oxidase inhibitor (s), but not isatin, are raised in anticipation of stress and/or arousal in normal individuals. Stress Med. 1996; 12(1): 43-9. Durán R, Alfonso M, Arias B. Determination of biogenic amines in rat brain dialysates by high performance liquid chromatography. J Liq Chromatogr Relat Technol. 1998;21(18):2799-811. Eden R, Costall B, Domeney A, Gerrard P, Harvey C, Kelly M, et al. Preclinical pharmacology of ropinirole (SK&F 101468-A) a novel dopamine D2 agonist. Pharmacology Biochemistry and Behavior. 1991;38(1):147-54. Edmondson D. Structure activity studies of the substrate binding site in monoamine oxidase B. Biochimie. 1995;77(7):643-50. Edmondson DE, Binda C, Mattevi A. Structural insights into the mechanism of amine oxidation by monoamine oxidases A and B. Arch Biochem Biophys. 2007; 464(2): 269-76. 256 REFERENCIAS BIBLIOGRÁFICAS Eisenhofer G, Kopin IJ, Goldstein DS. Catecholamine metabolism: A contemporary view with implications for physiology and medicine. Pharmacol Rev. 2004;56(3): 331-49. Elsworth JD, Roth RH. Dopamine synthesis, uptake, metabolism, and receptors: Relevance to gene therapy of parkinson's disease. Exp Neurol. 1997;144(1):4-9. Elverfors A, Pileblad E, Lagerkvist S, Bergquist F, Jonason J, Nissbrandt H. 3‐Methoxytyramine formation following monoamine oxidase inhibition is a poor index of dendritic dopamine release in the substantia nigra. J Neurochem. 1997;69(4):1684-92. European Parkinson’s Disease Association (EPDA). European Parkinson's Disease Standards of Care Consensus Statement. Volume II. 2012. Factor SA. Current status of symptomatic medical therapy in Parkinson’s disease. Neurotherapeutics. 2008; 5(2): 164-80. Fairbrother IS, Arbuthnott GW, Kelly JS, Butcher SP. In vivo mechanisms underlying dopamine release from rat nigrostriatal terminals: II. studies using potassium and tyramine. J Neurochem. 1990;54(6):1844-51. Fang Z, Wang Y. Effect of isatin on the activities of antioxidase in PD model mice. China Pharmacy. 2008; 22: 007. Faro L, do Nascimento J, Alfonso M, Duran R. Mechanism of action of methylmercury on in vivo striatal dopamine release: Possible involvement of dopamine transporter. Neurochem Int. 2002;40(5):45565. Faro LRF, Alfonso M, Maues LA, Durán R. Role of ionotropic glutamatergic receptors and nitric oxide in the effects of flutriafol, a triazole fungicide, on the in vivo striatal dopamine release. J Toxicol Sci. 2012a;37(6). Faro L, Oliveira I, Durán R, Alfonso M. In vivo neurochemical characterization of clothianidin induced striatal dopamine release. Toxicology. 2012b;302(2):197-202. 257 REFERENCIAS BIBLIOGRÁFICAS Faro LR, Ferreira Nunes BV, Alfonso M, Ferreira VM, Durán R. Role of glutamate receptors and nitric oxide on the effects of glufosinate ammonium, an organophosphate pesticide, on in vivo dopamine release in rat striatum. Toxicology. 2013;311(3):154-61. Fedchenko V, Globa A, Kaloshin A, Kapitsa I, Nerobkova L, Val'dman E, et al. The effect of short-term administration of (-)-deprenyl and isatin on the expressions of some genes in the mouse brain cortex. Med Sci Monit. 2008; 14(12): 269-73. Fernández HH, Chen JJ. Monoamine Oxidase‐B inhibition in the treatment of parkinson's disease. Pharmacotherapy: The Journal of Human Pharmacology and Drug Therapy. 2007; 27:174-85. Fernández M, Gatto E. Halfon M. Bioquímica de los ganglios basales. En: Micheli F., editor. Enfermedad de Parkinson y trastornos relacionados. 2ª ed. Buenos Aires: Panamericana; 2006. p. 47-74. Fernandez HH. Updates in the medical management of parkinson disease. Cleve Clin J Med. 2012; 79(1): 28-35. Ferreira-Nunes BV, Durán R, Alfonso M, De Oliveira IM, Ferreira Faro LR. Evaluation of the effects and mechanisms of action of glufosinate, an organophosphate insecticide, on striatal dopamine release by using in vivo microdialysis in freely moving rats. Arch Toxicol. 2010;84(10):777-85. Finberg J, Wang J, Goldstein D, Kopin I, Bankiewicz K. Influence of selective inhibition of monoamine oxidase A or B on striatal metabolism of l‐DOPA in hemiparkinsonian rats. J Neurochem. 1995;65(3):1213-20. Finberg JP, Youdim MB. Pharmacological properties of the antiparkinson drug rasagiline; modification of endogenous brain amines, reserpine reversal, serotonergic and dopaminergic behaviours. Neuropharmacology. 2002;43(7):1110-8. Finberg JP. Update on the pharmacology of selective inhibitors of MAO-A and MAO-B: Focus on modulation of CNS monoamine neurotransmitter release. Pharmacol Ther. 2014: 133-52. 258 REFERENCIAS BIBLIOGRÁFICAS Fowler JS, Logan J, Volkow ND, Wang G. Translational neuroimaging: Positron emission tomography studies of monoamine oxidase. Molecular Imaging and Biology. 2005; 7(6): 377-87. Fritsch T, Smyth KA, Wallendal MS, Hyde T, Leo G, Geldmacher DS. Parkinson disease: Research update and clinical management. South Med J. 2012; 105(12): 650-6. Fukushima T, Usui N, Santa T, Imai K. Recent progress in derivatization methods for LC and CE analysis. J Pharm Biomed Anal. 2003;30(6):1655-87. García DS, González ML, Arribi MM, Corral JA, Díaz AA. Utilización de duodopa en el paciente con enfermedad de parkinson. Revista de neurología. 2012; 54(5): 69-76. García-Ramos R, López Valdés E, Ballesteros L, Jesús S, Mir P. Informe de la fundación del cerebro sobre el impacto social de la enfermedad de Parkinson en España. Neurología. 2013. Garrett M, Soares-da-Silva P. Role of type A and B monoamine oxidase on the formation of 3, 4-dihydroxyphenylacetic acid (DOPAC) in tissues from the brain of the rat. Neuropharmacology. 1990;29(10):875-9. Gazewood JD, Richards DR, Clebak K. Parkinson disease: An update. Am Fam Physician. 2013;87(4): 267-73. Gazzara RA, Andersen SL. Calcium dependency and tetrodotoxin sensitivity of neostriatal dopamine release in 5‐day‐old and adult rats as measured by in vivo microdialysis. J Neurochem. 1994;62(5):17419. Geha RM, Rebrin I, Chen K, Shih JC. Substrate and inhibitor specificities for human monoamine oxidase A and B are influenced by a single amino acid. J Biol Chem. 2001; 276(13): 9877-82. Gelb DJ, Oliver E, Gilman S. Diagnostic criteria for parkinson disease. Arch Neurol. 1999; 56(1): 33-9. 259 REFERENCIAS BIBLIOGRÁFICAS Giorguieff MF, Le Floc'h ML, Glowinski J, Besson MJ. Involvement of cholinergic presynaptic receptors of nicotinic and muscarinic types in the control of the spontaneous release of dopamine from striatal dopaminergic terminals in the rat. J Pharmacol Exp Ther. 1977;200(3):535-44. Globa A, Glover V, Medvedev A. Isatin causes a rapid accumulation of ATP in synaptosomes: Implication for stress and regulation of natriuretic peptide receptors. Biochemistry (Moscow) Supplement Series B: Biomedical Chemistry. 2008;2(4):432-4. Glover V, Reveley MA, Sandler M. A monoamine oxidase inhibitor in human urine. Biochemical pharmacology. 1980; 29(3): 467-470. Glover V, Halket J, Watkins P, Clow A, Goodwin B, Sandier M. Isatin: Identity with the purified endogenous monoamine oxidase inhibitor tribulin. J Neurochem. 1988; 51(2): 656-9. Glover V, Sandler M. Tribulin and isatin: An update. Monoamine oxidase: basic and clinical aspects. VSP, Utrecht. 1993:61-71. Glover V, Bhattacharya S, Chakrabarti A, Sandler M. The psychopharmacology of isatin: A brief review. Stress Health. 1998; 14(4): 225-9. Godukhin O, Zharikova A, Budantsev AY. Role of presynaptic dopamine receptors in regulation of the glutamatergic neurotransmission in rat neostriatum. Neuroscience. 1984;12(2):37783. Green A, Youdim M. Effects of monoamine oxidase inhibition by clorgyline, deprenil or tranylcypromine on 5‐hydroxytryptamine concentrations in rat brain and hyperactivity following subsequent tryptophan administration. Br J Pharmacol. 1975;55(3):415-22. Green A, Mitchell B, Tordoff AF, Youdim M. Evidence for dopamine deamination by both type A and type B monoamine oxidase in rat brain in vivo and for the degree of inhibition of enzyme necessary for increased functional activity of dopamine and 5‐hydroxytryptamine. Br J Pharmacol. 1977;60(3):343-9. 260 REFERENCIAS BIBLIOGRÁFICAS Halket J, Watkins P, Przyborowska A, Goodwin B, Clow A, Glover V, et al. Isatin (indole-2, 3-dione) in urine and tissues: Detection and determination by gas chromatography—mass spectrometry. Journal of Chromatography B: Biomedical Sciences and Applications. 1991 ;562(1): 279-87. Hamaue N, Minami M, Hirafuji M, Monma Y, Yamazaki N, Togashi H, et al. Significance of isatin, an endogenous MAO inhibitor, on blood pressure control and monoamine levels in rats. Biogenic amines. 1996;12(5):395-405. Hamaue N, Minami M, Hirafuji M, Terado M, Machida M, Yamazaki N, et al. Isatin, an endogenous MAO inhibitor, as a new biological modulator. CNS Drug Rev. 1999a; 5(4): 331-46. Hamaue N, Yamazaki N, Minami M, Endo T, Hirafuji M, Monma Y, et al. Effect of isatin, an endogenous MAO inhibitor, on acetylcholine and dopamine levels in the rat striatum. Biogenic amines. 1999b; 15(3): 367-77. Hamaue N, Yamazaki N, Terado M, Minami M, Ohno K, Ide H, et al. Urinary isatin concentrations in patients with parkinson's disease determined by a newly developed HPLC-UV method. Res Commun Mol Pathol Pharmacol. 2000; 108(1-2): 63-73. Hamaue N, Minami M, Terado M, Hirafuji M, Endo T, Machida M, et al. Comparative study of the effects of isatin, an endogenous MAOinhibitor, and selegiline on bradykinesia and dopamine levels in a rat model of Parkinson’s disease induced by the japanese encephalitis virus. Neurotoxicology. 2004; 25(1): 205-13. Han S. Chemiluminescence determination of indole derivatives in human body fluids and soil by flow injection analysis using potassium permanganate. Microchimica Acta. 2010; 168(1-2):169-75. Hanbauer I, Wink D, Osawa Y, Edelman GM, Gaily JA. Role of nitric oxide in NMDA-evoked release of [3H]-dopamine from striatal slices. Neuroreport. 1992;3(5):409-12. Hao H, Shao M, An J, Chen C, Feng X, Xie S, et al. Association of catechol-O-methyltransferase and monoamine oxidase B gene polymorphisms with motor complications in parkinson's disease in a chinese population. Parkinsonism Relat Disord. 2014. 261 REFERENCIAS BIBLIOGRÁFICAS Hardy J, Gwinn-Hardy K. Genetic classification of primary neurodegenerative disease. Science. 1998 Nov 6; 282(5391): 1075-9. Harsing LG,Jr, Magyar K, Tekes K, Vizi ES, Knoll J. Inhibition by deprenyl of dopamine uptake in rat striatum: A possible correlation between dopamine uptake and acetylcholine release inhibition. Pol J Pharmacol Pharm. 1979;31(4):297-307. Harsing L, Vizi E. Release of endogenous dopamine from rat isolated striatum: Effect of clorgyline and (l)− deprenyl. Br J Pharmacol. 1984;83(3):741-9. Harsing Jr L. Dopamine and the dopaminergic systems of the brain. In: Handbook of Neurochemistry and Molecular Neurobiology. Springer; 2008. p. 149-70. Heeringa MJ, Abercrombie ED. Biochemistry of somatodendritic dopamine release in substantia nigra: An in vivo comparison with striatal dopamine release. J Neurochem. 1995;65(1):192-200. Heikkila RE, Cohen G. Evaluation of amantadine as a releasing agent or uptake blocker for H3-dopamine in rat brain slices. Eur J Pharmacol. 1972;20(2):156-60. Herrero M, Barcia C, Navarro J. Functional anatomy of thalamus and basal ganglia. Child's nervous system. 2002; 18(8): 386-404. Hickey P, Stacy M. Available and emerging treatments for parkinson's disease: A review. Drug Des Devel Ther. 2011; 5: 241-54. Höcht C, Opezzo JAW, Taira CA. Applicability of reverse microdialysis in pharmacological and toxicological studies. J Pharmacol Toxicol Methods. 2007;55(1):3-15. Höcht C, Bertera FM, Taira CA. Application of reverse microdialysis in neuropharmacological studies. In: Microdialysis Techniques in Neuroscience. Springer; 2013. p. 43-61. Hoehn MM, Yahr MD. Parkinsonism: onset, progression and mortality. Neurology 1967; 17: 427–442. 262 REFERENCIAS BIBLIOGRÁFICAS Hoque KE, Indorkar RP, Sammut S, West AR. Impact of dopamine– glutamate interactions on striatal neuronal nitric oxide synthase activity. Psychopharmacology (Berl). 2010;207(4):571-81. Hota D, Acharya SB. Studies on peripheral actions of isatin. Indian J Exp Biol. 1994; 32(10): 710-7. Hou L, Ju C, Zhang J, Song J, Ge Y, Yue W. Antitumor effects of isatin on human neuroblastoma cell line (SH-SY5Y) and the related mechanism. Eur J Pharmacol. 2008;5 89(1): 27-31. Huang EY, Tsui P, Kuo T, Tsai J, Chou Y, Ma H, et al. Amantadine ameliorates dopamine-releasing deficits and behavioral deficits in rats after fluid percussion injury. PloS one. 2014;9(1):e86354. Huotari M, Gainetdinov R, Männistö PT. Microdialysis studies on the action of tolcapone on Pharmacologically‐Elevated extracellular dopamine levels in conscious rats. Pharmacol Toxicol. 1999;85(s1):233-8. Hurd YL, Ungerstedt U. In vivo neurochemical profile of dopamine uptake inhibitors and releasers in rat caudate-putamen. Eur J Pharmacol. 1989;166(2):251-60. Igosheva N, Matta S, Glover V. Effect of acute stress and gender on isatin in rat tissues and serum. Physiol Behav. 2004; 80(5): 665-8. Igosheva N, Lorz C, O’Conner E, Glover V, Mehmet H. Isatin, an endogenous monoamine oxidase inhibitor, triggers a dose-and timedependent switch from apoptosis to necrosis in human neuroblastoma cells. Neurochem Int. 2005; 47(3): 216-24. Itoh Y, Oka M, Ukai Y, Kimura K. A novel Na+/Ca+2 channel blocker NS-7 inhibits evoked but not spontaneous dopamine release from rat striatum, as measured by intracerebral microdialysis. Neurosci Lett. 1998;252(3):203-6. Iversen SD, Iversen LL. Dopamine: 50 years in perspective. Trends Neurosci. 2007; 30(5): 188-93. Jankovic J. Parkinson's disease: Clinical features and diagnosis. J Neurol Neurosurg Psychiatry. 2008; 79(4): 368-76. 263 REFERENCIAS BIBLIOGRÁFICAS Jarman J, Przyborowska A, Glover V, Halket J, Davies P, Rose FC, et al. Urinary output of endogenous monoamine oxidase inhibitor and isatin during acute migraine attacks. Journal of Neural Transmission/General Section JNT. 1991; 84(1-2): 129-34. Jenner P, Olanow CW. The pathogenesis of cell death in parkinson's disease. Neurology. 2006; 66(10 Suppl 4): 24-36. Jensen JB, Egsgaard H, Van Onckelen H, Jochimsen BU. Catabolism of indole-3-acetic acid and 4- and 5-chloroindole-3-acetic acid in bradyrhizobium japonicum. J Bacteriol. 1995; 177(20): 5762-6. Jin-Lian S, Lin H. Isa induces apoptosis of human neuroblastoma cell line sh-sy5y. Acta Academiae Medicinae Qingdao Universitatis. 2008; 4: 004. Kaakkola S, Wurtman R. Effects of COMT inhibitors on striatal dopamine metabolism: A microdialysis study. Brain Res. 1992;587(2):241-9. Kannari K, Tanaka H, Maeda T, Tomiyama M, Suda T, Matsunaga M. Reserpine pretreatment prevents increases in extracellular striatal dopamine following L‐DOPA administration in rats with nigrostriatal denervation. J Neurochem. 2000;74(1):263-9. Karger BL. HPLC: Early and recent perspectives. J Chem Educ. 1997;74(1):45-8. Kastner I, Muller M. Effects of 2,3-dioxoindoline on a behavioral syndrome after tryptamine in pargyline-treated mice. Pharmazie. 1981; 36(10):711. Katzenschlager R. Parkinson’s disease: Recent advances. J Neurol. 2014; 261(5): 1031-6. Keefe K, Zigmond M, Abercrombie E. Extracellular dopamine in striatum: Influence of nerve impulse activity in medial forebrain bundle and local glutamatergic input. Neuroscience. 1992;47(2):32532. 264 REFERENCIAS BIBLIOGRÁFICAS Keefe KA, Sved AF, Zigmond MJ, Abercrombie ED. Stress‐Induced dopamine release in the neostriatum: Evaluation of the role of action potentials in nigrostriatal dopamine neurons or local initiation by endogenous excitatory amino acids. J Neurochem. 1993;61(5):19431952. Kehr J, Hu X, Goiny M, Scheller D. Continuous delivery of rotigotine decreases extracellular dopamine suggesting continuous receptor stimulation. J Neural Transm. 2007;114(8):1027-31. Khan S-H, Shuaib A. The technique of intracerebral microdialysis. Methods. 2001;23(1):3-9. Kiss JP. Role of nitric oxide in the regulation of monoaminergic neurotransmission. Brain Res Bull. 2000;52(6):459-66. Klippel N, Sarre S, Ebinger G, Michotte Y. Effect of M1-and M2muscarinic drugs on striatal dopamine release and metabolism: An in vivo microdialysis study comparing normal and 6-hydroxydopaminelesioned rats. Brain Res. 1993;630(1):57-64. Ko WKD, Pioli E, Li Q, McGuire S, Dufour A, Sherer TB, et al. Combined fenobam and amantadine treatment promotes robust antidyskinetic effects in the 1‐methyl‐4‐phenyl‐1, 2, 3, 6‐ tetrahydropyridine (MPTP)‐lesioned primate model of parkinson's disease. Movement Disorders. 2014;29(6):772-9. Krebs M, Desce J, Kemel M, Gauchy C, Godeheu G, Cheramy A, et al. Glutamatergic control of dopamine release in the rat striatum: Evidence for presynaptic N‐methyl‐D‐aspartate receptors on dopaminergic nerve terminals. J Neurochem. 1991;56(1):81-5. Kuczenski R, Segal DS, Manley LD. Apomorphine does not alter Amphetamine‐Induced dopamine release measured in striatal dialysates. J Neurochem. 1990;54(5):1492-9. Kulagina N, Zigmond M, Michael A. Glutamate regulates the spontaneous and evoked release of dopamine in the rat striatum. Neuroscience. 2001;102(1):121-8. Kumar R, Bansal R, Mahmood A. Isatin, an inhibitor of acetylcholinesterase activity in rat brain. Biogenic amines. 1993;9(4):281-9. 265 REFERENCIAS BIBLIOGRÁFICAS Kurata K, Shibata R. Biphasic effect of locally applied apomorphine and 2, 3, 4, 5-tetrahydro-7, 8-dihydroxy-1-phenyl-1-H-3-benzazepine on the release of striatal dopamine investigated by means of brain dialysis. Neurosci Lett. 1990;117(3):264-8. Laatikainen LM, Sharp T, Harrison PJ, Tunbridge EM. Sexually dimorphic effects of catechol-O-methyltransferase (COMT) inhibition on dopamine metabolism in multiple brain regions. PloS one. 2013; 8(4): e61839. Lai JC, Leung TK, Guest JF, Lim L, Davison AN. The monoamine oxidase inhibitors clorgyline and L-deprenyl also affect the uptake of dopamine, noradrenaline and serotonin by rat brain synaptosomal preparations. Biochem Pharmacol. 1980;29(20):2763-7. Lakshmana MK, Rao BS, Dhingra NK, Ravikumar R, Sudha S, Meti B, et al. Role of monoamine oxidase type A and B on the dopamine metabolism in discrete regions of the primate brain. Neurochem Res. 1998;23(8):1031-7. Lamensdorf I, Youdim MB, Finberg JP. Effect of Long‐Term treatment with selective monoamine oxidase A and B inhibitors on dopamine release from rat striatum in vivo. J Neurochem. 1996;67(4):1532-9. Lamensdorf I, Finberg J. Reduced striatal tyrosine hydroxylase activity is not accompanied by change in responsiveness of dopaminergic receptors following chronic treatment with deprenyl. Neuropharmacology. 1997;36(10):1455-61. Lange KW, Kornhuber J, Riederer P. Dopamine/glutamate interactions in parkinson's disease. Neuroscience & Biobehavioral Reviews. 1997;21(4):393-400. Lauber J, Waldmeier P. Determination of 2-phenylethylamine in rat brain after MAO inhibitors, and in human CSF and urine by capillary GC and chemical ionization MS. J Neural Transm. 1984;60(3-4):24764. 266 REFERENCIAS BIBLIOGRÁFICAS Levant B, Moehlenkamp JD, Morgan KA, Leonard NL, Cheng CC. Modulation of [3H]quinpirole binding in brain by monoamine oxidase inhibitors: Evidence for a potential novel binding site. J Pharmacol Exp Ther. 1996;278(1):145-53. Leviel V, Gobert A, Olivier V, Dentresangle C, Hassoun W, Dzahini K. Normal and physio-pathological striatal dopamine homeostasis. Neuroscience–Dealing With Frontiers. InTech. 2012. Lewis SJ, Caldwell MA, Barker RA. Modern therapeutic approaches in Parkinson's disease. Expert reviews in molecular medicine. 2003; 5(10): 1-20. Li Y, Wirth T, Huotari M, Laitinen K, MacDonald E, Männistö PT. No change of brain extracellular catecholamine levels after acute Catechol-O-methyltransferase inhibition: A microdialysis study in anaesthetized rats. Eur J Pharmacol. 1998;356(2):127-37. Linden IB, Nissinen E, Etemadzadeh E, Kaakkola S, Mannisto P, Pohto P. Favorable effect of catechol-O-methyltransferase inhibition by OR-462 in experimental models of parkinson's disease. J Pharmacol Exp Ther. 1988;247(1):289-93. Lonart G, Zigmond MJ. High glutamate concentrations evoke Ca++independent dopamine release from striatal slices: A possible role of reverse dopamine transport. J Pharmacol Exp Ther. 1991;256(3):11328. López S, Arancibia R. Estrés oxidativo, metabolitos oxidados de dopamina y enfermedad de Parkinson. Rev Fac Med UNAM. 2008; 15(3): 104-7. López LJ, Linasazoro G. Inhibidores de la monoaminooxidasa. En: García PJ, Martínez JC. Guía oficial de práctica clínica en la enfermedad de Parkinson 2010. Barcelona: Sociedad Española de Neurología; 2009. p. 191-210. Ma J, Yoshimura M, Yamashita E, Nakagawa A, Ito A, Tsukihara T. Structure of rat monoamine oxidase A and its specific recognitions for substrates and inhibitors. J Mol Biol. 2004; 338(1): 103-14. 267 REFERENCIAS BIBLIOGRÁFICAS Machado de Oliveira I, Nunes BVF, Barbosa DR, Pallares AM, Faro LRF. Effects of the neonicotinoids thiametoxam and clothianidin on in vivo dopamine release in rat striatum. Toxicol Lett. 2010;192(3):2947. Maj J, Rogóż Z, Skuza G, Sowińska H, Superata J. Behavioural and neurochemical effects of ro 40-7592, a new COMT inhibitor with a potential therapeutic activity in parkinson's disease. Journal of Neural Transmission-Parkinson's Disease and Dementia Section. 1990;2(2):101-12. Manabe S, Gao Q, Yuan J, Takahashi T, Ueki A. Determination of isatin in urine and plasma by high-performance liquid chromatography. Journal of Chromatography B: Biomedical Sciences and Applications. 1997;691(1):197-202. Manley-King CI, Bergh JJ, Petzer JP. Inhibition of monoamine oxidase by selected C5-and C6-substituted isatin analogues. Bioorg Med Chem. 2011; 19(1): 261-74. Männistö P, Kaakkola S. Rationale for selective COMT inhibitors as adjuncts in the drug treatment of parkinson's disease. Pharmacol Toxicol. 1990;66(5):317-23. Männistö P, Tuomainen P, Toivonen M, Törnwall M, Kaakkola S. Effect of acute levodopa on brain catecholamines after selective MAO and COMT inhibition in male rats. Journal of Neural TransmissionParkinson's Disease and Dementia Section. 1990;2(1):31-43. Männistö PT, Tuomainen P. Effect of high single doses of levodopa and carbidopa on brain dopamine and its metabolites: Modulation by selective inhibitors of monoamine oxidase and/or catechol-Omethyltransferase in the male rat. Naunyn Schmiedebergs Arch Pharmacol. 1991;344(4):412-8. Marin C, Papa S, Engber TM, Bonastre M, Tolosa E, Chase T. MK801 prevents levodopa-induced motor response alterations in parkinsonian rats. Brain Res. 1996;736(1):202-5. Martínez JA, Mir P. Algoritmo de tratamiento de la enfermedad de Parkinson inicial. En: García PJ, Martínez JC. Guía oficial de práctica clínica en la enfermedad de Parkinson 2010. Barcelona: Sociedad Española de Neurología; 2009. p. 279-282. 268 REFERENCIAS BIBLIOGRÁFICAS Matheus ME, Violante FdA, Garden SJ, Pinto AC, Fernandes PD. Isatins inhibit cyclooxygenase-2 and inducible nitric oxide synthase in a mouse macrophage cell line. Eur J Pharmacol. 2007; 556(1): 200-6. Mathur G, Nain S. Recent advancement in synthesis of isatin as anticonvulsant agents: A review. Med chem. 2014; 4: 417-27. Mawatari K, Segawa M, Masatsuka R, Hanawa Y, Iinuma F, Watanabe M. Fluorimetric determination of isatin in human urine and serum by liquid chromatography postcolumn photoirradiation. Analyst. 2001; 126(1): 33-6. McIntyre I, Norman T. Serotonergic effects of isatin: An endogenous MAO inhibitor related to tribulin. Journal of Neural Transmission/General Section JNT. 1990;79(1-2):35-40. Medvedev AE, Clow A, Sandler M, Glover V. Isatin: A link between natriuretic peptides and monoamines? Biochem Pharmacol. 1996; 52(3): 385-91. Medvedev A, Abakumova OY, Podobed O, Tsvetkova T, Sandler M, Glover V. Effects of isatin on atrial natriuretic peptide-mediated accumulation of cGMP and guanylyl cyclase activity of PC12 cells. Life Sci. 2001; 69(15): 1783-90. Medvedev A, Bussygyna O, Pyatakova N, Glover V, Severina I. Effect of isatin on nitric oxide-stimulated soluble guanylate cyclase from human platelets. Biochem Pharmacol. 2002; 63(4): 763-6. Medvedev AE, Glover V. Tribulin and endogenous MAO-inhibitory regulation in vivo. Neurotoxicology. 2004; 25(1): 185-92. Medvedev A, Crumeyrolle-Arias M, Cardona A, Sandler M, Glover V. Natriuretic peptide interaction with [3H]isatin binding sites in rat brain. Brain Res. 2005;1042(2):119-24. Medvedev A, Buneeva O, Gnedenko O, Fedchenko V, Medvedeva M, Ivanov Y, et al. Isatin interaction with glyceraldehyde-3-phosphate dehydrogenase, a putative target of neuroprotective drugs: Partial agonism with deprenyl. In: Oxidative Stress and Neuroprotection. Springer; 2006. p: 97-103. 269 REFERENCIAS BIBLIOGRÁFICAS Medvedev A, Buneeva O, Glover V. Biological targets for isatin and its analogues: Implications for therapy. Biologics. 2007; 1(2): 151-62. Meiser J, Weindl D, Hiller K. Complexity of dopamine metabolism. Cell Communication and Signaling. 2013; 11(34): 1-18. Mendoza A, Duarte J. Inhibidores de la catecolortometiltransferasa II: tolcapona. En: García PJ, Martínez JC. Guía oficial de práctica clínica en la enfermedad de Parkinson 2010. Barcelona: Sociedad Española de Neurología; 2009. p. 217-228. Mercuri NB, Scarponi M, Federici M, Bonci A, Siniscalchi A, Bernardi G. Modification of levodopa responses by deprenyl (selegiline): An electrophysiological and behavioral study in the rat relevant to parkinson's disease. Ann Neurol. 1998;43(5):613-7. Meyer VR. The 1000 bar and 24 hour limits of one-dimensional HPLC - graphical representations. Anal Bioanal Chem. 2010;396(5):1633-40. Miller DW, Abercrombie ED. Role of High‐Affinity dopamine uptake and impulse activity in the appearance of extracellular dopamine in striatum after administration of exogenous L‐DOPA. J Neurochem. 1999;72(4):1516-22. Minami M, Hamaue N, Hirafuji M, Saito H, Hiroshige T, Ogata A, et al. Isatin, an endogenous MAO inhibitor, and a rat model of Parkinson’s disease induced by the japanese encephalitis virus. In: Oxidative Stress and Neuroprotection. Springer; 2006. p. 87-95. Missale C, Nash SR, Robinson SW, Jaber M, Caron MG. Dopamine receptors: From structure to function. Physiol Rev. 1998; 78(1): 189225. Miyamoto J, Uezu E, Terashima S. Active transport pumps of HVA and DOPAC in dopaminergic nerve terminals. Physiol Behav. 1991;49(1):141-7. Miyamoto J, Uezu E, Jiang P, Miyamoto AT. H+-ATPase and transport of DOPAC, HVA, and 5-HIAA in monoamine neurons. Physiol Behav. 1993;53(1):65-74. 270 REFERENCIAS BIBLIOGRÁFICAS Mizoguchi K, Yokoo H, Yoshida M, Tanaka T, Tanaka M. Amantadine increases the extracellular dopamine levels in the striatum by re-uptake inhibition and by N-methyl-D-aspartate antagonism. Brain Res. 1994;662(1):255-8. Moghaddam B, Gruen RJ, Roth RH, Bunney BS, Adams RN. Effect of l-glutamate on the release of striatal dopamine: In vivo dialysis and electrochemical studies. Brain Res. 1990;518(1):55-60. Moghaddam B, Bolinao ML. Glutamatergic antagonists attenuate ability of dopamine uptake blockers to increase extracellular levels of dopamine: Implications for tonic influence of glutamate on dopamine release. Synapse. 1994;18(4):337-42. Morales I, Sabate M, Rodriguez M. Striatal glutamate induces retrograde excitotoxicity and neuronal degeneration of intralaminar thalamic nuclei: Their potential relevance for parkinson's disease. Eur J Neurosci. 2013;38(1):2172-82. Morari M, O'Connor W, Ungerstedt U, Fuxe K. N‐methyl‐d‐Aspartic acid differentially regulates extracellular dopamine, GABA, and glutamate levels in the dorsolateral neostriatum of the Halothane‐ Anesthetized rat: An in vivo microdialysis study. J Neurochem. 1993;60(5):1884-93. Morley JE, Farr SA, Flood JF. Isatin inhibits food intake in mice. Eur J Pharmacol. 1996; 305(1): 23-9. Mulero P, Cortijo E, Llorente JM. Abordaje terapéutico de los síntomas no motores de la enfermedad de parkinson. Revista de neurología. 2012; 54(5):89-95. Müller M. Microdialysis. Br Med J. 2002;324(7337):588-91. Murata M. Zonisamide: A new drug for parkinson's disease. Drugs Today (Barc). 2010; 46(4): 251-8. Mytilineou C, Radcliffe P, Leonardi EK, Werner P, Olanow CW. l‐ Deprenyl protects mesencephalic dopamine neurons from glutamate Receptor‐Mediated toxicity in vitro. J Neurochem. 1997;68(1):33-9. 271 REFERENCIAS BIBLIOGRÁFICAS Napolitano A, Zürcher G, Da Prada M. Effects of tolcapone, a novel catechol-O-methyltransferase inhibitor, on striatal metabolism of LDOPA and dopamine in rats. Eur J Pharmacol. 1995;273(3):215-21. Napolitano A, Bellini G, Borroni E, Zürcher G, Bonuccelli U. Effects of peripheral and central catechol-O-methyltransferase inhibition on striatal extracellular levels of dopamine: A microdialysis study in freely moving rats. Parkinsonism Relat Disord. 2003;9(3):145-50. National Center for Biotechnology Information. PubChem Compound Database; CID=7054, Disponible en: https://pubchem.ncbi.nlm.nih.gov/summary/summary.cgi?cid=7054& loc=ec_rcs (consulta el 20 de agosto de 2014). Neusch C, Schnierle S, Moser A. Selegiline induces dopamine release through ATP-sensitive potassium channels in the rat caudate-putamen in vitro. Neurochem Int. 1997;31(2):307-11. Nicola SM, Surmeier DJ, Malenka RC. Dopaminergic modulation of neuronal excitability in the striatum and nucleus accumbens. Annu Rev Neurosci. 2000; 23(1): 185-215. Nicotra A, Pierucci F, Parvez H, Senatori O. Monoamine oxidase expression during development and aging. Neurotoxicology. 2004; 25(1): 155-65. Nishijima K, Kashiwa A, Hashimoto A, Iwama H, Umino A, Nishikawa T. Differential effects of phencyclidine and methamphetamine on dopamine metabolism in rat frontal cortex and striatum as revealed by in vivo dialysis. Synapse. 1996;22(4):304-12. Nissinen E. Basic aspects of catechol-O-methyltransferase and the clinical applications of its inhibitors. Academic Press; 2010. Novaroli L, Daina A, Favre E, Bravo J, Carotti A, Leonetti F, et al. Impact of species-dependent differences on screening, design, and development of MAO B inhibitors. J Med Chem. 2006; 49(21): 626472. Obata T, Yamanaka Y. Intracranial microdialysis of salicyclic acid to detect hydroxyl radical generation by monoamine oxidase inhibitor in the rat. Neurosci Lett. 1995;188(1):13-6. 272 REFERENCIAS BIBLIOGRÁFICAS Obeso JA, Rodríguez‐Oroz MC, Benitez‐Temino B, Blesa FJ, Guridi J, Marin C, et al. Functional organization of the basal ganglia: Therapeutic implications for parkinson's disease. Movement Disorders. 2008; 23(S3): 548-59. Oertel WH, Álvarez D, Eggert K. Inhibición de la COMT en la enfermedad de Parkinson. En: Micheli F., editor. Enfermedad de Parkinson y trastornos relacionados. 2ª ed. Buenos Aires: Panamericana; 2006. p. 265-276. Ogata A, Hamaue N, Terado M, Minami M, Nagashima K, Tashiro K. Isatin, an endogenous MAO inhibitor, improves bradykinesia and dopamine levels in a rat model of parkinson's disease induced by japanese encephalitis virus. J Neurol Sci. 2003; 206(1): 79-83. Olanow CW, Stern MB, Sethi K. The scientific and clinical basis for the treatment of parkinson disease (2009). Neurology. 2009a; 72(21 Suppl 4): 1-136. Olanow CW, Rascol O, Hauser R, Feigin PD, Jankovic J, Lang A, et al. A double-blind, delayed-start trial of rasagiline in parkinson's disease. N Engl J Med. 2009b; 361(13): 1268-78. Olanow CW, Schapira AH. Therapeutic prospects for parkinson disease. Ann Neurol. 2013; 74(3): 337-47. Olivier V, Guibert B, Leviel V. Direct in vivo comparison of two mechanisms releasing dopamine in the rat striatum. Brain Res. 1995;695(1):1-9. Opazo F, Schulz JB, Falkenburger BH. PKC links Gq‐coupled receptors to DAT‐mediated dopamine release. J Neurochem. 2010;114(2):587-96. Osborne P, O'Connor W, Ungerstedt U. Effect of varying the ionic concentration of a microdialysis perfusate on basal striatal dopamine levels in awake rats. J Neurochem. 1991;56(2):452-6. Ozaki N, Nakahara D, Miura H, Kasahara Y, Nagatsu T. Effects of apomorphine on in vivo release of dopamine and its metabolites in the prefrontal cortex and the striatum, studied by a microdialysis method. J Neurochem. 1989;53(6):1861-4. 273 REFERENCIAS BIBLIOGRÁFICAS Pagonabarraga J, Kulisevsky J. Tratamiento dopaminérgico en la enfermedad de parkinson:¿ qué puede ofrecer cada familia terapéutica? Revista de Neurología. 2014; 58(1): 25-34. Palit G, Kumar R, Patnaik G, Bhattacharya S. Behavioural effects of isatin, a putative biological factor, in rhesus monkeys. Biogenic amines. 1997; 13(2): 131-42. Pandey S, Chakrabarti A, Pandey L, Bhattacharya S. Plasma isatin is increased in maternal anxiety and obstetrical stress. Stress Health. 2002; 18(3): 133-9. Pandeya SN, Smitha S, Jyoti M, Sridhar SK. Biological activities of isatin and its derivatives. Acta Pharm. 2005; 55(1): 27-46. Pang F, Hucklebridge F, Forster G, Tan K, Clow A. The relationship between isatin and monoamine oxidase‐B inhibitory activity in urine. Stress Med. 1996; 12(1): 35-42. Pani L, Gessa GL, Carboni S, Portas CM, Rossetti ZL. Brain dialysis and dopamine: Does the extracellular concentration of dopamine reflect synaptic release? Eur J Pharmacol. 1990;180(1):85-90. Panova N, Zemskova M, Axenova L, Medvedev A. Does isatin interact with rat brain monoamine oxidases in vivo? Neurosci Lett. 1997;233(1):58-60. Parkinson J. An essay on the shaking palsy. J Neuropsychiatry Clin Neurosci. 2002; 14(2): 223-36. Pascual-Sedano B, Kulisevsky J. Inhibidores de la colinesterasa. En: García PJ, Martínez JC. Guía oficial de práctica clínica en la enfermedad de Parkinson 2010. Barcelona: Sociedad Española de Neurología; 2009. p. 217-228. Pataki I, Adamik Á, Telegdy G. Isatin (indole-2, 3-dione) inhibits natriuretic peptide-induced hyperthermia in rats☆. Peptides. 2000; 21(3): 373-7. Paterson IA, Juorio AV, Berry MD, Zhu MY. Inhibition of monoamine oxidase-B by (-)-deprenyl potentiates neuronal responses to dopamine agonists but does not inhibit dopamine catabolism in the rat striatum. J Pharmacol Exp Ther. 1991;258(3):1019-26. 274 REFERENCIAS BIBLIOGRÁFICAS Paxinos G, Watson C. The rat brain: In stereotaxic coordinates. 4th ed. New York: Academic Press, 1986. Perry M, Li Q, Kennedy RT. Review of recent advances in analytical techniques for the determination of neurotransmitters. Anal Chim Acta. 2009;653(1):1-22. Pinna A, Morelli M. A critical evaluation of behavioral rodent models of motor impairment used for screening of antiparkinsonian activity: The case of adenosine A2A receptor antagonists. Neurotoxicity research. 2014;25(4):392-401. Pivonello R, Ferone D, Lombardi G, Colao A, Lamberts SW, Hofland LJ. Novel insights in dopamine receptor physiology. Eur J Endocrinol. 2007; 156 Suppl 1: 13-21. Plock N, Kloft C. Microdialysis - theoretical background and recent implementation in applied life-sciences. Eur J Pharm Sci. 2005;25(1):1-24. Prins LH, Petzer JP, Malan SF. Inhibition of monoamine oxidase by indole and benzofuran derivatives. Eur J Med Chem. 2010; 45(10): 4458-66. Puy-Núñez AP, Cebrián-Pérez E. Tratamiento inicial de la enfermedad de parkinson clínicamente establecida. Revista de neurología. 2012; 54(5):9-14. Quack G, Hesselink M, Danysz W, Spanagel R. Microdialysis studies with amantadine and memantine on pharmacokinetics and effects on dopamine turnover. J Neural Transm Suppl. 1995;46:97-105. Raiteri M, Cerrito F, Cervoni AM, Levi G. Dopamine can be released by two mechanisms differentially affected by the dopamine transport inhibitor nomifensine. J Pharmacol Exp Ther. 1979;208(2):195-202. Raiteri M, Marchi M, Maura G. Presynaptic muscarinic receptors increase striatal dopamine release evoked by ‘quasiphysiological’depolarization. Eur J Pharmacol. 1982;83(1):127-9. Raj V. Review on CNS activity of isatin derivatives. Int. J. Curr. Pharmaceut. Res. 2012; 4:1-9. 275 REFERENCIAS BIBLIOGRÁFICAS Rao R, Reddy K, Mahendra K. Synthesis, characterization, antibacterial, antifungal and anthelmintic activities of a new 5nitroisatin schiff base and its metal complexes. Bulgarian Chemical Communications. 2014; 46(1): 11-7. Reinhoud NJ, Brouwer H-, Van Heerwaarden LM, Korte-Bouws GAH. Analysis of glutamate, GABA, noradrenaline, dopamine, serotonin, and metabolites using microbore UHPLC with electrochemical detection. ACS Chem Neurosci. 2013;4(5):888-94. Riederer P, Konradi C, Schay V, Kienzl E, Birkmayer G, Danielczyk W, et al. Localization of MAO-A and MAO-B in human brain: A step in understanding the therapeutic action of L-deprenyl. Adv Neurol. 1987; 45: 111-8. Riederer P, Gerlach M, Müller T, Reichmann H. Relating mode of action to clinical practice: Dopaminergic agents in parkinson's disease. Parkinsonism Relat Disord. 2007; 13(8): 466-79. Riederer P, Laux G. MAO-inhibitors in parkinson's disease. Experimental neurobiology. 2011; 20(1): 1-17. Ripley TL, Jaworski J, Randall PK, Gonzales RA. Repeated perfusion with elevated potassium in in vivo microdialysis--A method for detecting small changes in extracellular dopamine. J Neurosci Methods. 1997;78(1-2):7-14. Rivera MM, González MM. Tratamiento farmacológico de la demencia de la enfermedad de parkinson. Archivos de Medicina. 2007; 3(2): 1-10. Rivett AJ, Eddy BJ, Roth JA. Contribution of sulfate conjugation, deamination, and O‐Methylation to metabolism of dopamine and norepinephrine in human brain. J Neurochem. 1982;39(4):1009-16. Rocchitta G, Migheli R, Mura MP, Esposito G, Desole MS, Miele E, et al. Signalling pathways in the nitric oxide donor-induced dopamine release in the striatum of freely moving rats: Evidence that exogenous nitric oxide promotes Ca+2 entry through store-operated channels. Brain Res. 2004;1023(2):243-52. 276 REFERENCIAS BIBLIOGRÁFICAS Rodríguez MC, Obseso JA. Organización anatomofuncional y fisiopatológica de los ganglios basales: implicaciones terapéuticas. En: Micheli F., editor. Enfermedad de Parkinson y trastornos relacionados. 2ª ed. Buenos Aires: Panamericana; 2006. p. 75-84. Rodrıǵ uez-Gómez JA, Venero JL, Vizuete ML, Cano J, Machado A. Deprenyl induces the tyrosine hydroxylase enzyme in the rat dopaminergic nigrostriatal system. Mol Brain Res. 1997;46(1):31-8. Roffler‐Tarlov S, Sharman D, Tegerdine P. 3, 4‐ Dihydroxyphenylacetic acid and 4‐hydroxy‐3‐methoxyphenylacetic acid in the mouse striatum: A reflection of intra‐and extra‐neuronal metabolism of dopamine? Br J Pharmacol. 1971;42(3):343-51. Sammut S, Dec A, Mitchell D, Linardakis J, Ortiguela M, West AR. Phasic dopaminergic transmission increases NO efflux in the rat dorsal striatum via a neuronal NOS and a dopamine D1/5 receptor-dependent mechanism. Neuropsychopharmacology. 2006;31(3):493-505. Sammut S, Bray KE, West AR. Dopamine D2 receptor-dependent modulation of striatal NO synthase activity. Psychopharmacology (Berl). 2007;191(3):793-803. Sandier M, Przyborowska A, Halket J, Watkins P, Glover V, Coates ME. Urinary but not brain isatin levels are reduced in Germ‐Free rats. J Neurochem. 1991; 57(3): 1074-5. Santiago M, Westerink B. Characterization of the in vivo release of dopamine as recorded by different types of intracerebral microdialysis probes. Naunyn Schmiedebergs Arch Pharmacol. 1990;342(4):407-14. Santos JR, Cunha JA, Dierschnabel AL, Campêlo CL, Leão AH, Silva AF, et al. Cognitive, motor and tyrosine hydroxylase temporal impairment in a model of parkinsonism induced by reserpine. Behav Brain Res. 2013;253:68-77. Satyan KS, Rai A, Jaiswal AK, Acharya SB, Bhattacharya SK. Isatin, a putative anxiogenic endocoid, induces memory dysfunction in rats. Indian J Exp Biol. 1995; 33(8): 576-9. 277 REFERENCIAS BIBLIOGRÁFICAS Saura J, Bleuel Z, Ulrich J, Mendelowitsch A, Chen K, Shih J, et al. Molecular neuroanatomy of human monoamine oxidases A and B revealed by quantitative enzyme radioautography and in situ hybridization histochemistry. Neuroscience. 1996; 70(3): 755-74. Savica R, Rocca WA, Ahlskog JE. When does parkinson disease start? Arch Neurol. 2010;67(7):798-801. Scatton B, Cheramy A, Besson M, Glowinski J. Increased synthesis and release of dopamine in the striatum of the rat after amantadine treatment. Eur J Pharmacol. 1970;13(1):131-3. Schoepp DD, Azzaro AJ. Effects of intrastriatal kainic acid injection on [3H] dopamine metabolism in rat striatal slices: Evidence for postsynaptic glial cell metabolism by both the type A and B forms of monoamine oxidase. J Neurochem. 1983;40(5):1340-8. Schultz W. Multiple dopamine functions at different time courses. Annu Rev Neurosci. 2007; 30: 259-88. Scriabine A. XIVth World Congress of Pharmacology, San Francisco, CA, USA July-7–12, 2002 New Drugs for the Treatment of Central Nervous System Disorders. CNS Drug Rev. 2002; 8(4): 427-37. Semwal A, Yogeeswari P, Ragavendran JV, Sriram D, Stables J. Discovery of isatinimino derivatives as new leads for neuropathic pain treatment: An isomeric modification approach. Int J Drug Des Discov. 2010; 1: 169-87. Sesar A. Diagnóstico de la enfermedad de Parkinson y técnicas auxiliares. En: García PJ, Martínez JC. Guía oficial de práctica clínica en la enfermedad de Parkinson 2010. Barcelona: Sociedad Española de Neurología; 2009. p. 217-228. Severina I, Schegolev AY, Ponomarev G, Medvedev A. Inhibition of NO-dependent soluble human platelet guanylate cyclase by isatin. Biochemistry (Moscow) Supplement Series B: Biomedical Chemistry. 2011; 5(3): 263-7. Shah AJ, Crespi F, Heidbreder C. Amino acid neurotransmitters: Separation approaches and diagnostic value. J Chromatogr B Biomed Anal Technol Biomed Life Sc. 2002;781(1-2):151-63. 278 REFERENCIAS BIBLIOGRÁFICAS Shannon RJ, Carpenter KLH, Guilfoyle MR, Helmy A, Hutchinson PJ. Cerebral microdialysis in clinical studies of drugs: Pharmacokinetic applications. J Pharmacokinet Pharmacodyn. 2013;40(3):343-58. Sharp T, Zetterström T, Ungerstedt U. An in vivo study of dopamine release and metabolism in rat brain regions using intracerebral dialysis. J Neurochem. 1986;47(1):113-22. Shih JC, Chen K, Ridd MJ. Monoamine oxidase: From genes to behavior. Annu Rev Neurosci. 1999; 22: 197-217. Shui H, Peng Y, Tsai Y. Recovery of high potassium-evoked dopamine release after depolarization challenge in the striatum of young and old male rats. Neurosci Lett. 1998;257(1):1-4. Silva JF, Garden SJ, Pinto AC. The chemistry of isatins: A review from 1975 to 1999. Journal of the Brazilian Chemical Society. 2001; 12(3): 273-324. Sitges M, Nekrassov V, Guarneros A. Simultaneous action of MK-801 (dizclopine) on dopamine, glutamate, aspartate and GABA release from striatum isolated nerve endings. Brain Res. 2000;854(1):48-56. Skuza G, Rogoz Z, Quack G, Danysz W. Memantine, amantadine, and L-deprenyl potentiate the action of L-dopa in monoamine-depleted rats. Journal of Neural Transmission/General Section JNT. 1994;98(1):57-67. Snyder LR. Modern practice of liquid chromatography: Before and after 1971. J Chem Educ. 1997;74(1):37-44. Soares‐da‐Silva P. Does brain 3, 4‐dihydroxyphenylacetic acid reflect dopamine release? J Pharm Pharmacol. 1987;39(2):127-9. Solopova I, Selionov V, Zhvansky D, Ivanenko YP, Chernikova L. Investigation of muscle tone in patients with Parkinson’s disease in unloading conditions. Hum Physiol. 2014;40(2):125-31. Song J, Hou L, Ju C, Zhang J, Ge Y, Yue W. Isatin inhibits proliferation and induces apoptosis of SH-SY5Y neuroblastoma cells in vitro and in vivo. Eur J Pharmacol. 2013; 702(1): 235-41. 279 REFERENCIAS BIBLIOGRÁFICAS Sprenger F, Poewe W. Management of motor and non-motor symptoms in Parkinson’s disease. CNS drugs. 2013; 27(4): 259-72. Sternberg EJ, Alcalay RN, Levy OA, Louis ED. Postural and intention tremors: A detailed clinical study of essential tremor vs. Parkinson’s disease. Frontiers in neurology. 2013;4. Sumpter WC. The chemistry of isatin. Chem Rev. 1944; 34(3):393434. Tabernero C. Levodopa. En: García PJ, Martínez JC. Guía oficial de práctica clínica en la enfermedad de Parkinson 2010. Barcelona: Sociedad Española de Neurología; 2009. p. 217-228. Takahashi T, Yamashita H, Zhang Y, Nakamura S. Inhibitory effect of MK-801 on amantadine-induced dopamine release in the rat striatum. Brain Res Bull. 1996;41(6):363-7. Telegdy G, Adamik A, Glover V. The action of isatin (2, 3dioxoindole) an endogenous indole on brain natriuretic and C-type natriuretic peptide-induced facilitation of memory consolidation in passive-avoidance learning in rats. Brain Res Bull. 2000; 53(3): 36770. Themann C, Fischer DA, Gross S, Westermann R, Weihe E, Kuschinsky K, et al. Effect of repeated treatment with high doses of selegiline on behaviour, striatal dopaminergic transmission and tyrosine hydroxylase mRNA levels. Naunyn Schmiedebergs Arch Pharmacol. 2002;365(1):22-8. Thorpe LW, Westlund KN, Kochersperger LM, Abell CW, Denney RM. Immunocytochemical localization of monoamine oxidases A and B in human peripheral tissues and brain. J Histochem Cytochem. 1987; 35(1): 23-32. Tieu K. A guide to neurotoxic animal models of parkinson's disease. Cold Spring Harb Perspect Med. 2011;1(1):1-20. 280 REFERENCIAS BIBLIOGRÁFICAS Timmerman W, Dubocovich ML, Westerink BH, De Vries JB, Tepper PG, Horn AS. The enantiomers of the dopamine agonist N-0437: In vivo and in vitro effects on the release of striatal dopamine. Eur J Pharmacol. 1989;166(1):1-11. Timmerman W, Westerink BH. Brain microdialysis of GABA and glutamate: What does it signify? Synapse. 1997;27(3):242-61. Timmerman W, Westerhof F, van der Wal, Taliet IC, Westerink BH. Striatal dopamine-glutamate interactions reflected in substantia nigra reticulata firing. Neuroreport. 1998;9(17):3829-36. Tisdall MM, Smith M. Cerebral microdialysis: Research technique or clinical tool. Br J Anaesth. 2006;97(1):18-25. Tozawa Y, Ueki A, Manabe S, Matsushima K. Stress-induced increase in urinary isatin excretion in rats: Reversal by both dexamethasone and α-methyl-p-tyrosine. Biochem Pharmacol. 1998; 56(8): 1041-6. Tozawa Y, Ueki A, Shimosawa T, Fujita T. 5-HT2a/2c receptor agonistinduced increase in urinary isatin excretion in rats: Reversal by both diazepam and dexamethasone. Biochem Pharmacol. 1999; 58(8): 1329-34. Tronci E, Fidalgo C, Zianni E, Collu M, Stancampiano R, Morelli M, et al. Effect of memantine on L-DOPA-induced dyskinesia in the 6OHDA-lesioned rat model of Parkinson’s disease. Neuroscience. 2014;265:245-52. Tsai S, Yuan R. Medication management of parkinson's disease: Early versus advanced stages. Journal of Experimental & Clinical Medicine. 2012; 4(4): 209-14. Tsunoda M. Recent advances in methods for the analysis of catecholamines and their metabolites. Anal Bioanal Chem. 2006;386(3):506-14. Valldeoriola F, Yáñez R. Infusión intradaduodenal de levododopa en gel. En: García PJ, Martínez JC. Guía oficial de práctica clínica en la enfermedad de Parkinson 2010. Barcelona: Sociedad Española de Neurología; 2009. p. 267-274. 281 REFERENCIAS BIBLIOGRÁFICAS Vidal L, Alfonso M, Faro LF, Campos F, Cervantes R, Durán R. Evaluation of the effects and mechanisms of action of mercuric chloride on striatal dopamine release by using in vivo microdialysis in freely moving rats. Toxicology. 2007;236(1):42-9. Vincent SR. Nitric oxide neurons and neurotransmission. Prog Neurobiol. 2010;90(2):246-55. Vine K, Matesic L, Locke J, Ranson M, Skropeta D. Cytotoxic and anticancer activities of isatin and its derivatives: A comprehensive review from 2000-2008. Anti-Cancer Agents in Medicinal Chemistry (Formerly Current Medicinal Chemistry-Anti-Cancer Agents). 2009; 9(4): 397-414. Volkow ND, Fowler JS, Gatley SJ, Logan J, Wang GJ, Ding YS, et al. PET evaluation of the dopamine system of the human brain. J Nucl Med. 1996; 37(7): 1242-56. Vrana SL, Azzaro AJ, Vrana KE. Chronic selegiline administration transiently decreases tyrosine hydroxylase activity and mRNA in the rat nigrostriatal pathway. Mol Pharmacol. 1992 ;41(5):839-44. Wachtel SR, Abercrombie ED. L‐3, 4‐dihydroxyphenylalanine‐ induced dopamine release in the striatum of intact and 6‐ hydroxydopamine‐treated rats: Differential effects of monoamine oxidase A and B inhibitors. J Neurochem. 1994;63(1):108-17. Waldmeier P, Delini-Stula A, Maitre L. Preferential deamination of dopamine by an A type monoamine oxidase in rat brain. Naunyn Schmiedebergs Arch Pharmacol. 1976;292(1):9-14. Watson CJ, Venton BJ, Kennedy RT. In vivo measurements of neurotransmitters by microdialysis sampling. Anal Chem. 2006;78(5):1391-9. West A, Galloway M. Nitric oxide and potassium chloride-facilitated striatal dopamine efflux in vivo: Role of calcium-dependent release mechanisms. Neurochem Int. 1998;33(6):493-501. West AR, Galloway MP, Grace AA. Regulation of striatal dopamine neurotransmission by nitric oxide: Effector pathways and signaling mechanisms. Synapse. 2002;44(4):227-45. 282 REFERENCIAS BIBLIOGRÁFICAS Westerink BH, Bosker FJ, Wirix E. Formation and metabolism of dopamine in nine areas of the rat brain: Modifications by haloperidol. J Neurochem. 1984;42(5):1321-7. Westerink BH. Sequence and significance of dopamine metabolism in the rat brain. Neurochem Int. 1985;7(2):221-7. Westerink B, Damsma G, Rollema H, De Vries J, Horn A. Scope and limitations of in vivo brain dialysis: A comparison of its application to various neurotransmitter systems. Life Sci. 1987;41(15):1763-76. Westerink BHC, Hofsteede H, Damsma G, De Vries J. The significance of extracellular calcium for the release of dopamine, acetylcholine and amino acids in conscious rats, evaluated by brain microdialysis. Naunyn Schmiedebergs Arch Pharmacol. 1988;337(4):373-8. Westerink B, Hofsteede R, Tuntler J, Vries J. Use of calcium antagonism for the characterization of Drug‐Evoked dopamine release from the brain of conscious rats determined by microdialysis. J Neurochem. 1989;52(3):722-9. Westerink B, Santiago M, De Vries J. The release of dopamine from nerve terminals and dendrites of nigrostriatal neurons induced by excitatory amino acids in the conscious rat. Naunyn Schmiedebergs Arch Pharmacol. 1992;345(5):523-9. Wirdefeldt K, Adami H, Cole P, Trichopoulos D, Mandel J. Epidemiology and etiology of Parkinson’s disease: A review of the evidence. Eur J Epidemiol. 2011; 26(1): 1-58. Wong P, Teo W, Lee T. A microdialysis study on striatal dopamine, 5HT and metabolites in conscious rats after various treatments: Evidence for extravesicular release of dopamine. Neuroreport. 1993;5(1):53-6. Wood P, Kim H, Marien M. Intracerebral dialysis: Direct evidence for the utility of 3-MT measurements as an index of dopamine release. Life Sci. 1987;41(1):1-5. 283 REFERENCIAS BIBLIOGRÁFICAS Xu M, Kato T. Brain dialysis: Changes in the activities of dopamine neurons in rat striatum by perfusion of acetylcholine agonists under freely moving conditions. Neurochem Int. 1988;12(4):539-45. Xu H, Wang D, Zhang W, Zhu W, Yamamoto K, Jin L. Determination of isatin and monoamine neurotransmitters in rat brain with liquid chromatography using palladium hexacyanoferrate modified electrode. Anal Chim Acta. 2006; 577(2): 207-13. Yamamoto BK, Davy S. Dopaminergic modulation of glutamate release in striatum as measured by microdialysis. J Neurochem. 1992;58(5):1736-42. Youdim MB, Lavie L. Selective MAO-A and B inhibitors, radical scavengers and nitric oxide synthase inhibitors in parkinson's desease. Life Sci. 1994;55(25):2077-82. Youdim M, Tipton K. Rat striatal monoamine oxidase-B inhibition by l-deprenyl and rasagiline: Its relationship to 2-phenylethylamineinduced stereotypy and parkinson's disease. Parkinsonism Relat Disord. 2002;8(4):247-53. Youdim MB, Riederer PF. A review of the mechanisms and role of monoamine oxidase inhibitors in Parkinson’s disease. Neurology. 2004; 63(7 suppl 2): 32-5. Youdim MB, Bakhle Y. Monoamine oxidase: Isoforms and inhibitors in parkinson's disease and depressive illness. Br J Pharmacol. 2006; 147(S1) :287-96. Youdim MB, Edmondson D, Tipton KF. The therapeutic potential of monoamine oxidase inhibitors. Nature Reviews Neuroscience. 2006;7(4):295-309. Yuwiler A. The effect of isatin (tribulin) on metabolism of indoles in the rat brain and pineal: In vitro and in vivo studies. Neurochem Res. 1990;15(1):95-100. Zapata A, Chefer VI, Shippenberg TS, Denoroy L. Detection and quantification of neurotransmitters in dialysates. Curr Protoc Neurosci. 2009(SUPPL. 48):1-35. 284 REFERENCIAS BIBLIOGRÁFICAS Zetterström T, Sharp T, Collin A, Ungerstedt U. In vivo measurement of extracellular dopamine and DOPAC in rat striatum after various dopamine-releasing drugs implications for the origin of extracellular DOPAC. Eur J Pharmacol. 1988;148(3):327-34. Zhang F, Dong H, Yue W. Protective effects of isatin on H2O2damaged dopaminergic cells. Chinese Pharmacological Bulletin. 2011a; 8(13). Zhang J, Zhang F, Qiu Y, Yue W. Isatin decreases bax protein expression in the substantia nigra of a mouse model of parkinson's disease. Neural Regeneration Research. 2011b; 6(26). Zhou Y, Zhao Z, Xie J. Effects of isatin on rotational behavior and DA levels in caudate putamen in parkinsonian rats. Brain Res. 2001; 917(1): 127-32. Zhu X, Luo L. Effect of nitroprusside (nitric oxide) on endogenous dopamine release from rat striatal slices. J Neurochem. 1992;59(3):932-5. Zigmond M, Castro S, Keefe K, Abercrombie E, Sved A. Role of excitatory amino acids in the regulation of dopamine synthesis and release in the neostriatum. Amino Acids. 1998;14(1-3):57-62. 285 REFERENCIAS BIBLIOGRÁFICAS 286