PRIMER PRINCIPIO (segunda parte)
Anuncio

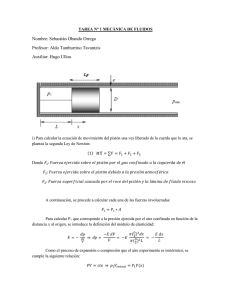
PRIMER PRINCIPIO DE LA TERMODINÁMICA (SEGUNDA PARTE) Roberto Laura (versión preliminar) Introducción. En las secciones anteriores presentamos el primer principio de la termodinámica, para un sistema físico con las siguientes características: a) está formado por un número muy grande de pequeñas partículas masivas (¿moléculas?) b) las partículas se mueven obedeciendo las leyes de la mecánica clásica. c) cada par de partículas interacciona con fuerzas débilmente atractivas a distancias grandes, y muy repulsivas a distancias cortas. Estas fuerzas son conservativas, de modo que hay una energía potencial asociada a cada interacción entre pares de partículas. d) sobre cada una de las partículas actúan también fuerzas externas. Obtuvimos entonces la siguiente expresión: ⎛1 2 ⎞ (1) Δ⎜ MVCM ⎟ + ΔU = W + Q , ⎝2 ⎠ donde M es la masa total del sistema, VCM es la velocidad de su centro de masa, U es la energía interna, W es el trabajo realizado sobre el sistema, y Q es el calor que entra al sistema. Destaquemos que la “deducción” del primer principio de la termodinámica que hemos desarrollado se ha basado exclusivamente en los conceptos de la mecánica clásica. No hemos tenido en cuenta en la deducción la presencia de los campos electromagnéticos, y tampoco hemos considerado la teoría cuántica, hoy considerada como la teoría fundamental, y de la que la mecánica clásica es solo una aproximación. Equivalente mecánico del calor. Experimento de Joule. En la presentación que hicimos del primer principio, el trabajo de las fuerzas externas sobre el sistema se consideró como la suma W + Q . El símbolo W designa al trabajo “ordenado” que puede escribirse como una fuerza por un desplazamiento macroscópico, tal como el que aparece cuando se desplaza un pistón en el cilindro de un motor. El símbolo Q representa al trabajo “desordenado”, tal como el que realizan las moléculas del metal de una pava al fuego sobre las moléculas del agua contenida en ella. Es evidente de estas definiciones de W y de Q , que se trata de cantidades que representan distintas formas de transferirle energía a un sistema, y que ambas cantidades pueden expresarse en unidades de energía, como el Joule ( J = N ⋅ m ). Pero antes del siglo ¿? se consideraba al calor como una sustancia (el calórico), que fluía de los cuerpos a temperatura elevada hacia los cuerpos a temperatura más baja. El calor tenía entonces su propia unidad, la caloría, que se definía como la cantidad de “sustancia calórico” que debía entregarse a un gramo de agua para que eleve un grado su temperatura. Fue Joule quien en ?? realizó experimentos para determinar el equivalente mecánico del calor, es decir para contabilizar cuanta energía debía entregarse a un gramo de agua de modo de producir el efecto de una caloría, es decir para elevar un grado su temperatura. El dispositivo experimental consiste en un recipiente aislado térmicamente, que contiene una masa m de agua. Como se ve en la figura, un eje vertical giratorio tiene paletas que están sumergidas en el agua. En su parte superior, el eje tiene un tambor en 1 el que está arrollada una cuerda. Esta cuerda, después de pasar por una polea, tiene atada en su otro extremo un bloque de masa M , sujeta a una altura H sobre el piso. Cuando se suelta el bloque, este desciende la altura H , haciendo girar las paletas dentro del agua. En este giro, las paletas hacen sobre el agua un trabajo W = MgH . Como las paredes del recipiente son buenos aislantes térmicos, podemos considerar que no ingresa calor al recipiente en el proceso ( Q = 0 ). Además, durante el proceso el centro de masa del agua no cambia de lugar. Teniendo todo esto en cuenta podemos usar la ecuación (1) para obtener la siguiente expresión para la variación de energía interna del agua ΔU = MgH En este proceso de entrega de trabajo al agua, esta experimenta un aumento de temperatura ΔT , que se puede medir en el termómetro que está sumergido en el agua. Como por definición, una caloría es la cantidad de calor para que un gramo de agua aumente un grado su temperatura, esta variación de energía interna se puede escribir también en la forma 1cal ΔU = ⋅ m ⋅ ΔT gr⋅º C Igualando las dos expresiones para la variación de energía interna obtenemos 1cal ⋅ m ⋅ ΔT = MgH . gr⋅º C De aquí deducimos que M ⋅H m 1cal = ⋅ 9,8 2 ⋅10 −3 kg ⋅º C m ⋅ ΔT s Las cantidades m , M , H y ΔT se pueden medir en el experimento, y se obtiene entonces 1cal = 4,18 J , (2) que es la expresión de la caloría en Joules, la unidad de energía del sistema internacional. Trabajo sobre un fluido. 2 Consideremos un fluido (líquido o gas), dentro de un recipiente como el que indica la figura. Se trata de un cilindro de paredes rígidas con un émbolo móvil. Supongamos que con una fuerza externa representada por el vector Fext , y aplicada sobre el émbolo, se produce un pequeño desplazamiento del mismo, representado por el vector Δl . El pequeño trabajo realizado sobre el fluido resulta entonces ΔW = F ext ⋅ Δl =| F ext | ⋅ | Δl | . Si con A designamos al área del émbolo en contacto con el fluido, podemos escribir | F ext | ΔW = ⋅ A | Δl |= − pext ⋅ ΔV . (1) A En la expresión anterior pext es la presión exterior, es decir la fuerza por unidad de área que el émbolo hace sobre el fluido, y ΔV es la variación del volumen ocupado por el fluido, cuando el émbolo se desplaza como indica la figura. El signo negativo corresponde ponerlo para que el trabajo externo resulte positivo cuando el volumen disminuye ( ΔW > 0 si ΔV < 0 ). Si la fuerza externa va cambiando a medida que se modifica el volumen ocupado por el fluido, podemos considerar ese proceso como una sucesión de pequeños cambios de volumen en que el trabajo se escribirá como en la ecuación (1). El trabajo total en el proceso será la suma de estos trabajos pequeños. Si se conoce como es la presión externa en función del volumen, el trabajo se puede obtener con la siguiente integral. V final W =− ∫p ext (proceso general) (V ) dV (3) Vinicial Esta última expresión depende de la presión exterior aplicada, y será válida para cualquier tipo de proceso que experimente el fluido, sea pasando por sucesivos estados de equilibrio o no (procesos reversibles o irreversibles). Si el proceso se realiza lentamente, de modo que el fluido pase por sucesivos estados de equilibrio, resultará que la presión externa se iguala en todo momento a la presión en el interior del fluido ( pext = p fluido ), y podemos escribir entonces V final W =− ∫p fluido (proceso reversible). (V ) dV Vinicial 3 (4) El primer principio para un proceso infinitesimal reversible de un fluido. La expresión (1) toma la siguiente forma especial para un proceso reversible infinitesimal ⎛1 2 ⎞ d ⎜ MVCM ⎟ + dU = δW + δQ . ⎝2 ⎠ En esta expresión la letra d indica el diferencial, o pequeño incremento de una función de estado del sistema. Así por ejemplo dU es el diferencial de la energía interna U , que es una función de estado, una propiedad del sistema termodinámico. En cambio, las cantidades δW y δQ no designan diferenciales. El sistema termodinámico no “contiene” calor Q ni trabajo W , o en otras palabras no hay ninguna propiedad termodinámica del sistema que podamos denominar Q ó W . Las cantidades δW y δQ se usan entonces para designar cantidades muy pequeñas de trabajo y de calor que ingresan al sistema. Si se trata de un fluido en un proceso infinitesimal reversible, hemos visto que δW = − pdV , de modo que podemos escribir ⎛1 2 ⎞ (5) d ⎜ MVCM ⎟ + dU = − pdV + δQ . ⎝2 ⎠ Calores específicos y molares. Para un sistema macroscópicamente en reposo ( VCM =0), la cantidad de calor que es necesario entregarle para que cada unidad de masa eleve un grado su temperatura, se denomina calor específico. Si el sistema tiene una masa M , y cuando recibe una cantidad de calor δQ aumenta su temperatura una cantidad dT , su calor específico se puede escribir en la siguiente forma δQ . (6) C esp = M ⋅ dT Para el caso particular de un fluido en reposo, la ecuación (5) permite escribir δQ = dU + pdV , y resulta entonces dU + pdV C esp = . (7) M ⋅ dT Que en el numerador de esta última expresión aparezcan dos diferenciales sumados es un indicio de que el calor específico dependerá de la forma en que se realice el proceso de entrega de calor al sistema. Hay dos casos especialmente importantes, que son cuando este proceso se realiza a volumen constante o a presión constante. Los correspondientes calores específicos los designaremos con CVesp y C pesp . Según la ecuación (7), para el caso a volumen constante resulta dV = 0 , y entonces 1 ⎛ ∂U ⎞ CVesp = (8) ⎜ ⎟ M ⎝ ∂T ⎠V En la expresión anterior (∂U / ∂T )V indica que se debe expresar la energía interna U en función de las dos variables termodinámicas V y T ( U = U (T , V ) ), y se debe hacer a esta función su derivada parcial respecto de la variable T . En lenguaje matemático, queremos decir que 4 ⎛ ∂U ⎞ ⎛ U (T + ΔT , V ) − U (T , V ) ⎞ ⎜ ⎟ ≡ lim ⎜ ⎟ ΔT ⎝ ∂T ⎠V ΔT →0⎝ ⎠ Usando también la ecuación (7) podemos encontrar una expresión para el calor específico cuando el proceso de calor se hace a presión constante 1 ⎛ dU + pdV ⎞ 1 ⎡⎛ ∂U ⎞ ⎛ ∂V ⎞ ⎤ (9) C pesp = ⎟ ⎥. ⎟ + p⎜ ⎟ = ⎜ ⎢⎜ M⎝ dT ⎝ ∂T ⎠ p ⎦⎥ ⎠ p M ⎣⎢⎝ ∂T ⎠ p Para calcular esta última expresión es necesario conocer como son la energía interna U y el volumen V en función de las variables temperatura y presión ( U = U (T , p) y V = V (T , p) ). En la ecuación anterior (∂U / ∂T ) p y (∂V / ∂T ) p designan a las siguientes derivadas parciales ⎛ U (T + ΔT , p) − U (T , p) ⎞ ⎛ ∂U ⎞ ⎟, ⎟ ≡ lim ⎜ ⎜ Δ T → 0 ΔT ⎠ ⎝ ⎝ ∂T ⎠ p ⎛ V (T + ΔT , p) − V (T , p) ⎞ ⎛ ∂V ⎞ ⎟. ⎟ ≡ lim ⎜ ⎜ Δ T → 0 ΔT ⎠ ⎝ ⎝ ∂T ⎠ p Otra cantidad importante que necesitaremos es el denominado calor molar, que es la cantidad de calor que es necesario entregar a un mol de una sustancia determinada para que aumente un grado su temperatura. Si al entregar una cantidad de calor δQ a n moles de una sustancia se obtiene un aumento de temperatura dT , el calor molar es δQ (10) C molar = n ⋅ dT Comparando las expresiones (6) y (10), vemos que la inversa del numero de moles n aparece en el calor molar, en vez de la inversa de la masa M que aparecía en el calor específico. Nos damos cuenta entonces que para obtener los calores molares a volumen constante y a presión constante, basta con que en las expresiones (8) y (9) reemplacemos la masa por el número de moles. Obtendremos entonces 1 ⎛ ∂U ⎞ (11) CVmolar = ⎜ ⎟ n ⎝ ∂T ⎠V 1 ⎡⎛ ∂U ⎞ ⎛ ∂V ⎞ ⎤ C pmolar = ⎢⎜ (12) ⎟ + p⎜ ⎟ ⎥. n ⎣⎢⎝ ∂T ⎠ p ⎝ ∂T ⎠ p ⎦⎥ Calores molares para el gas ideal. Las derivadas parciales que aparecen en las expresiones (11) y (12) de los calores molares para un fluido, se pueden calcular para el caso en que el fluido se comporte como un gas ideal. En ese caso disponemos de la ecuación de estado pV = nRT , y de la siguiente expresión para la energía interna l U = nRT , 2 donde l es aproximadamente 3 ó 5 según que el gas sea monoatómico o biatómico. De esta expresión para la energía interna resulta l ⎛ ∂U ⎞ ⎛ ∂U ⎞ ⎟ =⎜ ⎟ = nR , ⎜ ⎝ ∂T ⎠V ⎝ ∂T ⎠ p 2 y de la ecuación de estado, escrita en la forma V = nRT / p , se obtiene 5 nR ⎛ ∂V ⎞ . ⎜ ⎟ = p ⎝ ∂T ⎠ p Reemplazando estas derivadas parciales en las ecuaciones (11) y (12) resulta l ⎛l ⎞ (13) CVmolar = R, C pmolar = ⎜ + 1⎟ R . 2 ⎝2 ⎠ Este resultado es muy fuerte: nos dice que los calores molares de los gases a baja densidad dependen solamente del número de átomos que componen su molécula, y no de su composición. Así, de acuerdo a la teoría que hemos desarrollado en el curso, gases monoatómicos como el ¿???, ¿??, y el ¿??, con l = 3 , debieran tener los mismos CVmolar y C pmolar . También, gases biatómicos como el ¿?, ¿? y el ¿?, con l = 5 , debieran tener los mismos calores molares a presión y a volumen constantes. Es notable que estas predicciones teóricas se confirmen razonablemente bien cuando se determinan estas cantidades experimentalmente. De estas dos expresiones se obtienen también las relaciones C pmolar l + 2 molar molar C p − CV γ ≡ molar = = R, . (14) CV l Balance de energía en los procesos de un gas ideal. a) Proceso isobárico ( p = cte. ) Consideremos el caso en que un gas ideal está contenido en un cilindro como el de la figura, con un émbolo móvil en su parte superior. Se entrega lentamente cierta cantidad de calor Q al gas, mediante una fuente de calor en la base del cilindro, y se observa que el volumen del gas cambia desde un valor V0 al comenzar el proceso, hasta otro valor V1 al finalizar la entrega de calor. El émbolo está sometido a la carga constante de una pesa, y el proceso es muy lento, de modo que podemos suponer que durante el mismo la presión del gas se mantiene constante en un valor p = p0 . También hemos representado en la figura el proceso en un diagrama de p en función de V . El trabajo W realizado sobre el gas por el émbolo es V1 W = − ∫ p dV = − p0 (V1 − V0 ) . V0 Notemos que si el volumen aumenta el trabajo resulta negativo. El calor Q entregado al gas se puede escribir en la forma 6 1 T1 0 T0 Q = ∫ δQ = ∫ n C pmolar dT = n C pmolar (T1 − T0 ) = p ⎛pV pV ⎞ ⎛l ⎞ = n C pmolar ⎜ 0 1 − 0 0 ⎟ = C pmolar 0 (V1 − V0 ) = ⎜ + 1⎟ p0 (V1 − V0 ). nR ⎠ R ⎝2 ⎠ ⎝ nR Para la variación ΔU de energía interna obtenemos l ΔU = Q + W = p0 (V1 − V0 ) 2 b) Proceso isocórico ( V = cte. ) Consideremos ahora el gas contenido en un cilindro cerrado, como el que se indica en la figura siguiente, con un volumen V0 fijo. Se le entrega lentamente al gas una cantidad de calor Q . También se representa en la figura el proceso en un diagrama de p en función de V , donde se puede observar que la presión cambia desde un valor inicial p0 hasta un valor p1 . En este caso el trabajo W sobre el gas es cero porque no hay variación de volumen V1 V0 V0 V0 W = − ∫ p dV = − ∫ p dV = 0. El calor Q entregado al gas se obtiene de la siguiente forma 1 Q = ∫ δQ = 0 T1 ∫nC molar V dT = n C Vmolar (T1 − T0 ) = T0 pV ⎞ V l ⎛ pV = n C Vmolar ⎜ 1 0 − 0 0 ⎟ = C Vmolar 0 ( p1 − p 0 ) = V 0 ( p1 − p 0 ), nR ⎠ R 2 ⎝ nR y la variación de energía interna resulta l ΔU = Q + W = V0 ( p1 − p0 ) . 2 c) Proceso isotérmico ( T = cte. ) Consideremos ahora nuevamente al gas en un cilindro con un embolo movil, que se mueve lentamente de modo que el volumen cambie desde un valor V0 hasta otro valor V1 . El proceso se realiza manteniendo el gas en contacto térmico con un gran sistema con temperatura constante T0 , de modo que podemos considerar que gas tiene durante 7 todo el proceso la misma temperatura T0 . El proceso se ilustra en la figura siguiente, donde también se ha representado la evolución isotérmica del gas como una porción de la hipérbola p (V ) = nRT0 / V en un diagrama de p en función de V . El trabajo que hace el émbolo sobre el gas resulta V1 V1 ⎛V ⎞ 1 dV = − nRT0 ln⎜⎜ 1 ⎟⎟ V ⎝ V0 ⎠ V0 W = − ∫ p(V ) dV = − nRT0 ∫ V0 Destaquemos que si el volumen aumenta ( V1 > V0 ), la expresión anterior determina un trabajo negativo (que sale del gas), mientras que si el volumen disminuye ( V1 < V0 ), el gas recibe trabajo del émbolo, y W > 0 . Sabemos que para el gas ideal, la energía interna depende solamente de la temperatura ( U = nlRT / 2 = U (T ) ), de modo que la energía interna no cambia en este proceso isotérmico ΔU = 0 Usando los resultados obtenidos para W y ΔU , en la expresión del primer principio ΔU = Q + W , se obtiene también ⎛V ⎞ Q = −W = nRT0 ln⎜⎜ 1 ⎟⎟ ⎝ V0 ⎠ Si el volumen aumenta, vemos que Q > 0 (entra calor al gas desde el foco térmico). En cambio, si el volumen disminuye resulta Q < 0 . d) Proceso adiabático ( Q = 0 ) Consideraremos ahora el caso en que el gas está encerrado en un cilindro que tiene un émbolo móvil en su parte superior, para el caso en que. El émbolo se desplaza de modo que el volumen inicial del gas es V0 , y el volumen al final del proceso es V1 . Supondremos que las paredes del cilindro y el émbolo son muy malos conductores del calor, de modo que en este proceso no entra ni sale energía en forma de calor, es decir que Q = 0. En la figura siguiente se representa esquemáticamente este proceso. El rayado en las paredes del cilindro y en el émbolo designan su carácter adiabático. 8 Si intentamos calcular el trabajo que el émbolo hace sobre el gas debemos evaluar la V1 integral W = − ∫ p dV , y para ello debemos conocer como es la presión en función del V0 volumen durante el proceso adiabático. Veamos entonces como determinar p = p(V ) . Para un proceso infinitesimal reversible el primer principio de la termodinámica se escribe en la forma dU = δQ − pdV . Si el proceso es adiabático resulta δQ = 0 , y entonces dU = − pdV Por otro lado, si consideramos a la energía interna como función de las variables p y V ( U = U ( p,V ) ), resulta también ⎛ ∂U ⎞ ⎛ ∂U ⎞ ⎟⎟ dp + ⎜ dU = ⎜⎜ ⎟ dV ⎝ ∂V ⎠ p ⎝ ∂p ⎠V Igualando las dos últimas ecuaciones se obtiene ⎡⎛ ∂U ⎞ ⎤ ⎛ ∂U ⎞ ⎜⎜ ⎟⎟ dp + ⎢⎜ (15) ⎟ + p ⎥ dV = 0 ⎢⎣⎝ ∂V ⎠ p ⎥⎦ ⎝ ∂p ⎠V Esta última ecuación estable una relación que vincula una pequeña variación dp de la presión con la correspondiente pequeña variación del volumen dV , para una evolución adiabática infinitesimal. ¡Ya estamos más cerca de obtener la presión en función del volumen!. Para calcular las derivadas parciales en la última ecuación, necesitamos expresar la la energía interna del gas ideal como función de la presión y el volumen. Esto se logra reemplazando en U = nlRT / 2 la ecuación de estado pV = nRT . Se obtiene entonces l l U = nRT = pV = U ( p,V ) , 2 2 y las siguientes derivadas parciales ⎛ ∂U ⎞ l l ⎛ ∂U ⎞ ⎜⎜ ⎟⎟ = V , ⎟ = p. ⎜ ⎝ ∂V ⎠ p 2 ⎝ ∂p ⎠V 2 Con estas derivadas parciales reemplazadas en la ecuación (15) se obtiene 9 molar dp dV l + 2 Cp γ= = −γ , = molar . p V l CV Integrando esta última expresión entre el estado inicial ( p0 ,V0 ) y un estado ( p,V ) que pertenezca a la evolución adiabática se obtiene p ( p ,V ) ( p ,V ) V ⎛ p⎞ ⎛V ⎞ dp dV dp dV = −γ ∫ = −γ ∫ , , ln⎜⎜ ⎟⎟ = −γ ln⎜⎜ ⎟⎟ . ∫ ∫ p V p V ⎝ p0 ⎠ ⎝ V0 ⎠ p0 V ( p 0 ,V0 ) ( p 0 ,V0 ) De esta última ecuación resulta pV γ = p0V0γ = cte. ¡Por fin!, esta es la ecuación que buscábamos, y que relaciona la presión y el volumen para un gas ideal en una evolución adiabática. En la siguiente figura se representa el proceso adiabático en un diagrama de la presión en función del volumen Ahora podemos calcular el trabajo sobre el gas: V1 V1 1− γ 1 γ V W = − ∫ p(V ) dV = − p0V0 ∫ γ dV = − p0V0 V 1− γ V0 V0 γ V1 = V0 1 (pV − p V ). γ −1 1 1 0 0 La variación de energía interna resulta ΔU = W + Q = W = 10 1 ( p V − p0V0 ) . γ −1 1 1 El motor de cuatro tiempos. Los motores de autos, ómnibus y camiones son ejemplos de máquinas térmicas. La producción de movimiento en los motores comienza por el quemado de combustible en su interior. En los motores a nafta el quemado se produce en la cámara de combustión, que está formada por un cilindro con dos válvulas (una de admisión y otra de escape) y una bujía de encendido (los motores diesel no tienen bujía de encendido). La válvula de admisión permite la entrada de la mezcla de aire y combustible al cilindro, y la válvula de escape permite la salida de los gases resultantes de la combustión. El pistón se acopla por medio de la biela al cigüeñal. El cierre y la abertura de las válvulas es controlado externamente por un sistema acoplado al cigüeñal. 11 Como resultado de la combustión, hay un movimiento de vaivén del pistón. Debido al acoplamiento entre pistón, biela y cigüeñal, este movimiento de vaivén es convertido hacia fuera del motor en un movimiento de rotación. Veamos como funciona un motor de combustión interna. El proceso comienza cuando la mezcla de aire y aire y combustible entra al cilindro por la válvula de admisión. A medida que el pistón desciende, la mezcla es aspirada y llenando el volumen del cilindro. Durante esa parte del proceso la válvula de escape permanece cerrada, como se indica en la figura 2.4. Cuando el pistón vuelve a subir, debido a la inercia del cigüeñal, la mezcla queda confinada en un volumen cada vez menor, aumentando su presión y su temperatura. En esta parte del proceso las dos válvulas permanecen cerradas. La figura 2.5 muestra la compresión de la mezcla. En el punto de máxima compresión de la mezcla, la bujía produce una chispa que provoca una combustión muy rápida (explosión), produciendo un gran calentamiento de los gases resultantes, y un gran aumento de la presión en el interior del cilindro. Debido a la rapidez de la explosión y a la inercia del sistema, el descenso del pistón ocurre después de la explosión. Las válvulas siguen cerradas durante esta parte del proceso, en que el pistón desciende hasta ocupar la posición más baja. La figura 2.6 ilustra esta parte del proceso. 12 Finalmente, para el volumen máximo del cilindro, la válvula de escape se abre, y una parte de los gases es liberada muy rápidamente, debido a la baja presión exterior. A continuación, el pistón sube debido a la inercia del cigüeñal, eliminando el resto de los gases de combustión. Esta disminución de volumen del cilindro ocurre a presión constante. Esta parte del proceso se indica en la figura 2.7. 13 Después se cierra la válvula de escape, se abre la admisión y todo el proceso se repite. A continuación se resumen las distintas etapas de funcionamiento del motor, con los procesos involucrados, y se representa gráficamente las variaciones de presión y volumen. 1a. etapa: admisión de la mezcla Con la válvula de admisión abierta, aumenta el volumen la presión mientras la presión permanece prácticamente constante (A→B) 2a. etapa: compresión de la mezcla Mientras el volumen disminuye, la presión y la temperatura aumentan (B→C) 3a. etapa: explosión de la mezcla Al principio el volumen permanece prácticamente constante y la presión aumenta (C→D), después el volumen aumenta mientras la presión y la temperatura disminuyen (D→E). 14 4a. etapa: escape de los gases Se abre la válvula de escape y disminuye la presión a volumen constante (E→B), y después el volumen disminuye con presión prácticamente constante (B→A). Todos estos procesos pueden ser representados en el único diagrama presión-volumen dec la figura 2.8, para un ciclo completo del motor de combustión interna, que se denomina ciclo Otto. En este diagrama podemos identificar las distintas transformaciones que ocurren en un ciclo del motor. En el tramo A→B, la velocidad con que ingresa la mezcla es impuesta por la velocidad del pistón, haciendo que la presión permanezca constante. Por eso este proceso se denomina isobárico. En el tramo B→C, todo el trabajo que realiza el pistón se convierte en energía interna de la mezcla, con aumento de la presión y de la temperatura. Esto es una compresión 15 adiabática, o sea sin intercambio de calor con el exterior, ya que el proceso es muy rápido. En el tramo C→D ocurre la explosión, que por ser muy rápida no da tiempo suficiente para el movimiento del pistón, y por lo tanto, para la variación del volumen. La energía del combustible es entonces convertida en energía interna, con una gran elevación de la temperatura de los gases que resultan de la reacción. Entonces esa transformación puede considerarse isocórica. En el proceso D→E, la segunda parte de la etapa de explosión, el pistón desciende tan rápido que no hay tiempo para intercambiar calor. Por eso la expansión también se considera adiabática. En el proceso E→B, la abertura de la válvula de escape hace que ocurra una variación de masa y de presión de la mezcla, sin que haya tiempo para que el pistón cambie de posición, y por lo tanto de volumen. Esa descompresión puede considerarse isocórica. En el tramo B→A ocurre la expulsión de los productos de la explosión. La masa de gas contenido en el cilindro disminuye en la misma proporción en que lo hace el volumen, y el proceso puede considerarse isobárico. Los vehículos tienen en general varios cilindros con sus pistones conectados al mismo cigüeñal. La descripción que hemos hecho de las transformaciones que ocurren en un ciclo completo de un pistón, son solo aproximadas. El diagrama de las verdaderas variaciones de presión y de volumen en un motor presenta algunas diferencias respecto del análisis anterior. Así, la admisión no es perfectamente isobárica, porque el ingreso de la mezcla no acompaña exactamente el movimiento del pistón, lo que ocasiona una caída de la presión. La explosión tampoco es perfectamente isocórica, porque no es instantánea, y ocurre mientras el pistón se mueve. El escape isocórico no es tal, porque el pistón invierte rápidamente su velocidad y comienza a empujar los gases hacia fuera. El escape real tampoco es isobárico porque el pistón tiene una velocidad mayor que la de salida del gas. Para un ciclo completo de un motor real, el diagrama presión-volumen tiene la siguiente forma Trabajo realizado por el motor. Aunque haya cuatro etapas del funcionamiento en un ciclo del motor, solo en la tercera etapa el motor realiza trabajo, porque es cuando los gases resultantes de la explosión empujan el pistón En las otras tres etapas (admisión, compresión y escape), la continuidad del movimiento del pistón se da a través de un trabajo externo, debido a la inercia del conjunto al que 16 están acoplados los pistones con el cigüeñal. Además, la temperatura de los gases que salen por el escape durante la cuarta etapa es más alta que la temperatura antes de la explosión. Eso significa que parte del calor de combustión es eliminado en forma de energía interna de los gases, y también como flujo de calor desde el cuerpo del motor al ambiente. La parte restante del calor de combustión se convierte en energía de movimiento del pistón (realización de trabajo), cerrando de esta forma el balance energético. Considerando que en un ciclo de funcionamiento de un motor la energía del combustible es consumida totalmente, en parte realizando un trabajo, y en parte siendo transferida al medio exterior, podemos afirmar que ese motor, para realizar un nuevo ciclo, debe recibir una nueva cantidad de combustible (energía). Rendimiento. Un indicador importante de cómo funciona un motor es su rendimiento η , que se expresa como el cociente entre el trabajo neto W que es capaz de entregar y la cantidad de energía que consume Q: W η= Q Como el funcionamiento se repite en cada ciclo, basta con que consideremos el rendimiento en un ciclo. Vamos a tratar de calcular ese rendimiento para el ciclo ideal descripto anteriormente, en donde además supondremos que la mezcla en el cilindro se comporta como un gas ideal. Son muchas idealizaciones, así que no podemos esperar que nuestros cálculos nos provean de una expresión para el rendimiento muy confiable, pero esperamos que al menos nos de cierta información aproximada de los factores que influyen en el rendimiento de un motor. La energía Q que consume el motor en un ciclo es el calor generado por la explosión en el tramo C→D, en el que n moles de gas se expanden a volumen constante. Tenemos entonces que Q = n CV (TD − TC ) , donde CV es el calor molar a volumen constante del gas, mientras que TC y TD son las temperaturas del gas dentro del cilindro en los estados que se representan con los puntos C y D en el diagrama presión-volumen. Se pierde energía en el proceso E→B→A→B, en el que n moles de gas resultante de la combustión, a la temperatura TE, es reemplazado por la misma cantidad de moles de mezcla combustible proveniente del carburador, a la temperatura menor TB. La pérdida de energía es ΔU = n CV TE − n CV TB . Podemos escribir entonces ΔU Q − ΔU T −T η= =1− =1− E B . Q Q TD − TC B Recordemos que, en un proceso adiabático, la expresión TV γ −1 se mantiene constante. Los procesos B→C y D→E son adiabáticos, de modo que se cumplen las igualdades γ −1 γ −1 γ −1 γ −1 TBVmax = TCVmin , TEVmax = TDVmin , donde Vmax y Vmin son los volúmenes máximo y mínimo de gas que puede encerrar el pistón dentro del cilindro. El cociente r = Vmax Vmin se denomina relación de compresión del motor. De las últimas igualdades se obtiene entonces 17 TC = TB r γ −1 , TD = TE r γ −1 . Reemplazando ahora estas expresiones de TC y TD en la expresión del rendimiento η resulta 1 η = 1 − γ −1 . r Según esta última expresión, el rendimiento es siempre menor que uno, aun para este modelo idealizado. Si r=8 y γ=1,4 (el valor para el aire), el rendimiento teórico es 0,56, o sea el 56%. El rendimiento se puede aumentar aumentando r, pero esto también aumenta la temperatura al final de la compresión adiabática de la mezcla de aire y combustible. Si la temperatura es excesiva, la mezcla explota espontáneamente durante la compresión en lugar de quemarse después de ser encendida por la chispa de la bujía. Esto se denomina autoencendido, y causa un golpeteo que puede dañar el motor. La relación de compresión práctica máxima par la nafta de alto octano es de cerca de 10. Se pueden usar relaciones mayores con combustibles especiales. El ciclo Otto que hemos descripto, es un modelo muy idealizado: supone que la mezcla se comporta como un gas ideal, e ignora la fricción, turbulencia, perdidas de calor hacia las paredes del cilindro y muchos otros efectos que reducen aun más el rendimiento del motor. Otra fuente de ineficiencia es la combustión incompleta. El calor obtenido de la nafta es entonces menor que el calor de combustión total, y los gases del escape contribuyen a la contaminación del aire. Los rendimientos de los motores a nafta reales suelen ser del 20%. 18