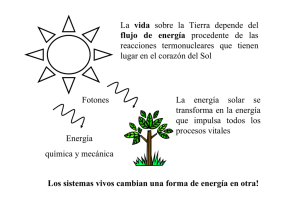
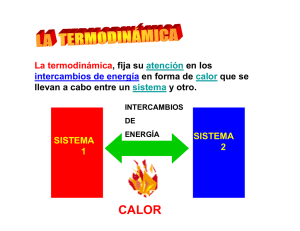
Energía en las reacciones químicas Todas las
Anuncio

Actividad para el estudiante Reactividad y equilibrio químico Energía en las reacciones químicas Nivel: 3.º Medio Subsector: Ciencias químicas Unidad temática: Reactividad y equilibrio químico Energía en las reacciones químicas Todas las reacciones químicas obedecen a dos leyes fundamentales: - Ley de conservación de la masa - Ley de conservación de la energía La estequiometría, el balance de reacciones químicas, relaciones ponderales entre reactivos y productos, son parte de la ley de conservación de la masa. En esta guía revisaremos aquellos cambios de la energía en una reacción química. Para realizar esta actividad debes recordar algunos conceptos, como: Existen funciones de trayectoria como el trabajo (W) empleado por una partícula en moverse desde un punto A hasta un punto B. Otro ejemplo de función de trayectoria es el calor de una reacción Q. Ambos dependen del proceso que ocurre durante el proceso de la reacción. Las variables termodinámicas que no dependen del proceso se llaman funciones de estado: dependen de las características del estado inicial y final del sistema en que se encuentran y no de la cantidad de energía que les costó llegar hasta dicho estado. Son funciones de estado la entalpía (H), la entropía (S) y la energía libre de Gibbs (G). Ambas, funciones de estado y trayectoria, son parámetros termodinámicos que varían en el transcurso de una reacción química. ¿Y qué es la termodinámica? La termodinámica es una ciencia que estudia los cambios energéticos ocurridos en procesos físicos o químicos. Los parámetros que estudiaremos en esta guía son: 1 Actividad para el estudiante Reactividad y equilibrio químico Energía en las reacciones químicas - La entalpía (H) - La entropía (S) - La energía libre de Gibbs (G) Repasa estos temas con ayuda de la ficha temática correspondiente a este tema (ficha n.º 17) u otros materiales bibliográficos como tu libro de clases. Actividades: Para la reacción: CO( g ) + H 2O( g ) ⎯ ⎯→ CO 2 ( g ) + H 2 ( g ) Y utilizando los siguientes datos: - Hº CO2 = -393,5 kJ/mol - Hº CO = -110,5 kJ/mol - Hº H2O= -241,8 kJ/mol a) Determina si la reacción es exotérmica o endotérmica. b) Determina si la reacción es espontánea o no, considerando que la ∆Sº de la reacción es -42 J/K y la expresión: ∆Gº=∆Hº-T∆Sº. Como observas en este ejercicio, la entropía es menor que cero, lo que indicaría que la reacción no es espontánea. Sin embargo, debes fijarte en el valor de energía libre de la reacción para saber qué es lo que ocurre realmente, debido a que la espontaneidad de la de ésta y, por tanto, la energía libre dependen también de la temperatura. Para este caso, observa el valor de energía libre a 25 ºC. c) Suponiendo que la entalpía y la entropía son independientes de la temperatura, calcula el valor de la energía libre a 800 ºC. Observa ahora el valor de la energía libre. ¿Es espontánea esta reacción a 800 ºC? 2 Actividad para el estudiante Reactividad y equilibrio químico Energía en las reacciones químicas Reflexiones acerca de las leyes de la termodinámica Repasa las leyes de la termodinámica, reflexiona sobre ellas y luego continúa esta actividad. 1) Imagina que tienes un fajo de billetes que trozas en pedacitos. Luego introduces estos pequeños trozos dentro de un recipiente cerrado y los agitas hasta que todos los trozos se mezclan y confunden. Imagina ahora que debes rearmar los billetes tal cual estaban en un comienzo. ¿Cuánto trabajo realizarás si trozaste en cuatro partes cada billete comparando con billetes trozados en cuatro partes? 2) Piensa en tu habitación. ¿Cuánto tiempo gastas en ordenarla, versus el tiempo que gastas en desordenarla? ¿Qué crees que te cuesta más: ordenarla o desordenarla? La entropía es la medida del desorden de un sistema. Se dice que todos los procesos espontáneos tienden a aumentar la entropía y con esto disminuye la energía y el trabajo que requiere el proceso. Por lo tanto, la diferencia de entropía entre el estado final e inicial de un proceso será positiva (mayor que cero) si el proceso es espontáneo, y negativa (menor que cero) si no lo es. En otras palabras, siempre intentamos hacer nuestra vida en contra de las leyes de la termodinámica: queremos enfriar aquello que está caliente y calentar aquello que está frío; queremos ordenar aquello que tiende al desorden y, por supuesto, queremos hacer las cosas con el menor esfuerzo posible. Para lograr todo esto nos gastamos en el camino enormes cantidades de energía. 3