NOV1006_REDVET - Veterinaria.org
Anuncio

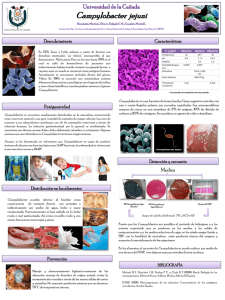
NOV1006_REDVET IMPLEMENTACION DE TECNICA TRADICIONAL DE DIAGNÓSTICO DE CAMPYLOBACTER JEJUNI EN DEPOSICIONES DE CANINOS JOVENES Introducción Los primeros aislamientos de Campylobacter jejuni fueron realizados en 1913 por McFadyen y Stockman. Se trata de a una bacteria Gram negativa, no esporulada, microaerofílica (6% O2 y 10-15% CO2) termófila (crecimiento óptimo a 42ºC) móvil con uno o dos flagelos polares, delgados, curvos o con forma de ?S? (0.2-0.8μm de ancho y 0.5-5 μm de largo) que coloniza la mucosa intestinal de muchos animales de sangre caliente. Algunos estudios señalan que hasta un 94.2% de los pollos, un 37.3% de los gatos y un 46.9% de los perros se encontrarían colonizados por Campylobacter jejuni (Workman et al., 2005). Considerado uno de los agentes patógenos zoonóticos más importante en países desarrollados debido entre otros factores, a su resistencia a la fagocitosis, ingresa al ser humano a través de los alimentos, principalmente productos avícolas (Fernández H et al., 2007). Sin embargo, también se estima que las mascotas cercanas al hombre (perros y gatos) pueden representar una importante fuente de transmisión, con el consiguiente riesgo que esto involucra. Objetivos El presente estudio tuvo como objetivo implementar una técnica tradicional de diagnóstico de Campylobacter spp para la detección de C. jejuni en deposiciones de caninos jóvenes (máximo 2 años) con y sin sintomatología clínica. Además de obtener datos estadísticos de portación de este agente en caninos, relacionándolo con sintomatología clínica (cuadro diarreico) versus caninos sin sintomatología clínica. Metodología Las muestras clínicas fueron obtenidas desde Clínicas Veterinarias del sector oriente de Santiago de Chile (Circulo Vet y Clínica Veterinaria VetLine) y criaderos de animales. Se recolectaron a través de torulado 59 muestras de materia fecal de caninos menores de 2 años: 31 procedentes de animales sanos y 28 con cuadro diarreico, con y sin sangre. En todos los casos no existió tratamiento antibiótico previo. Para el mantenimiento de las cepas, el transporte se realizó en Medio Cary Blair, siendo procesadas dentro de las primeras 6 horas. Posteriormente fueron teñidas con tinción Carbol Fucsina 1% para la observación de formas curvas o ?S? y tinción Gram para la observación microscópica exclusiva de muestras con sintomatología clínica. Para la detección de Campylobacter jejuni se utilizó Medio Skirrow adicionado de antibióticos (vancomicina, polimixina B, trimetropim y cefalotina). Todas las muestras fueron incubadas en microaerofilia (OXOID), O2 5%, CO2 10% y N2 85% a 42°C por 48 a 72 horas. Las colonias características fueron descritas como pequeñas (1-2 mm.) translúcidas a blanquecinas, con leve elevación, circulares alargadas, con bordes regulares. Para la identificación final de Campylobacter jejuni se realizaron pruebas bioquímicas tales como: Oxidasa, Catalasa e Hidrólisis de Hipurato. Resultados Tabla 1. Resultados de positividad a Campylobacter jejuni aislados desde muestras procedentes de caninos con y sin sintomatología clínica. Resultado Nº Muestras Total % (n=59) Campylobacter jejuni 9 15,3 Negativo 40 67,8 Sin crecimiento 10 16,9 Total 59 100 Campylobacter jejuni fue pesquisado en un 15,3% de las muestras totales. Su frecuencia en perros sanos y diarreicos fue de 16,1% y 14,3% respectivamente. No existiendo diferencia estadísticamente significativa (p>0.05). De 28 muestras fecales de perros diarreicos examinadas, en 9 (15,3%) se detectó Escherichia coli, y en 3 de ellas, además se identificó Campylobacter jejuni asociado a Escherichia coli (5,1%). Imagen 1. Desarrollo de colonias de Campylobacter jejuni en Medio Skirrow. Imagen 2. Campylobacter jejuni acompañado de flora contaminante, teñido con Carbol fucsina 1% (100x) Conclusiones Campylobacter jejuni fue aislado en iguales proporciones en cachorros, con y sin sintomatología clínica, por tanto, caninos sanos pueden ser portadores de Campylobacter jejuni durante sus primeros 2 años de vida. Resulta por tanto aconsejable, aumentar medidas de higiene y profilaxis especialmente en contactos estrechos entre estas mascotas y niños y/o inmunosuprimidos. Referencias Bibliográficas Díaz GC, Vizcaya DL, Velasco CJ. Evaluación de un medio de cultivo y la técnica de filtración para el aislamiento de Campylobacter sp. en un grupo de riesgo. Rev Fac Farm. 2003; 45(1):13-18. Fernández H, Vera F, Villanueva MP. Especies de Arcobacter y Campylobacter en aves y mamíferos del sur de Chile. Arch. Med. Vet. 2007; 39(2):163-165. Manual de la OIE sobre animales terrestres. Campylobacter jejuni y Campylobacter coli. Capítulo 2.10.8. 2004. Workman SN, Mathison GE, Lavoie MC. Pet dogs and chicken meat as reservoirs of Campylobacter spp. in Barbados. J Clin Microbiol. 2005; (43):2642-2650.