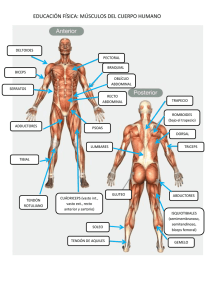
RUPTURA DE TENDON CALCANEO EN ATLETAS Dr. Dalton Ademar Salinas Sánchez INTRODUCCIÓN El tendón de Aquiles es el tendón más fuerte y más grande del cuerpo humano, y también es el que se rompe con más frecuencia. La rotura es más común en hombres, con una relación hombre/mujer de entre 10:1. Sin embargo, los hombres presentan mayor rigidez y fuerza máxima de ruptura que en mujeres, y también tienen un área de sección transversal mayor. Además, los tendones más jóvenes presentan una tensión de rotura por tracción significativamente mayor a pesar de tener una menor rigidez. La incidencia de roturas de AT ha aumentado considerablemente en la última década y suelen aparecer en personas sedentarias, que practican deporte ocasionalmente, sobre todo en la tercera o cuarta década de la vida. Por lo tanto, la mayoría de las roturas 44%-83%, ocurren durante actividades deportivas, y los cambios bioquímicos y biomecánicos relacionados con el envejecimiento pueden desempeñar un papel importante en la patogénesis de la lesión. Durante las actividades normales se producen varias interrupciones microscópicas en la sustancia tendinosa, mientras que las fibras se remodelan y se forma continuamente. Un tendón suele perder su configuración ondulada cuando se estira más del 2%. Cuando el tendón se estira más del 3% al 4% de su longitud normal, comienza a romperse y, cuando se estira más del 8%, se produce una rotura macroscópica. ANATOMÍA E HISTOLOGÍA El Tendón de Aquiles, está formado por las porciones tendinosas de los músculos gastrocnemio y sóleo. Además, el músculo plantar está presente en el 93% de las extremidades inferiores, situado medialmente, y distinto de éste. Las cabezas medial y lateral de los gastrocnemios se originan en los cóndilos femorales y su contribución al AT comienza como una aponeurosis amplia en los extremos inferiores de estos vientres musculares. El músculo sóleo se origina en la tibia y el peroné, y su contribución tendinosa al tendón de Aquiles es más corta y gruesa. La inserción del calcáneo está compuesta por una capa especializada de cartílago hialino y un área de hueso no cubierta por periostio. Una bolsa retro calcáneo se encuentra entre el tendón el calcáneo, mientras que una bolsa subcutánea se encuentra entre el tendón y la piel. La población celular del tendón está compuesta por tenocitos y tenoblastos en un 90% a 95%, mientras que las proteínas de colágeno y elastina representan el 70% y el 2% del peso seco de un tendón, respectivamente, y forman la mayor parte de la matriz extracelular (MEC). El colágeno tipo I es el más común y representa el 95% del colágeno del tendón. Mientras que los tenocitos de Tendón roto producen más colágeno tipo III. que es menos resistente y elástico a la fuerza de tracción. La sustancia fundamental que rodea el colágeno y los tenocitos está compuesta de glicoproteínas, glucosaminoglucanos y proteoglicanos. Los glucosaminoglicanos disminuyen con el envejecimiento, mientras que el colágeno aumenta y el ejercicio intenso aumenta la formación de colágeno tipo I en el tejido peritendinoso. El tendón está formado por fascículos bien organizados rodeados de endotenón. Estos fascículos están envueltos por una capa de tejido conectivo, el epitenón, en contacto directo con el endotenón. El epitenon, a su vez, está rodeado por el paratenon con una fina capa de líquido entremedio para permitir movimiento del tendón con una fricción reducida. Fibrillas de colágeno tipo I y tipo III, un revestimiento interno de células sinoviales y algunas fibrillas de elastina componen el paratenón, que está en contacto con la fascia crural que cubre la cara posterior del tendón.Además, el paratenón tiene 2 capas: una capa superficial llamada peritenón, que está conectada con la capa subyacente a través del mesotenon; y una capa más profunda, que rodea y está en contacto directo con el epitenón. La inervación sensorial del Tendon proviene de los nervios de los músculos de unión y de los nervios cutáneos, en particular del nervio sural. Además, el suministro de sangre AT está garantizado proximalmente por la unión musculotendinosa, a lo largo de su longitud por el tejido conectivo circundante y distalmente por la unión hueso- tendinoso. El sitio de rotura del AT suele estar entre 2 y 6 cm proximal a la inserción del tendón. La pobre vascularidad en el cuerpo principal del AT puede jugar un papel importante en la patogénesis de la rotura. Además, el flujo sanguíneo es mayor en las mujeres en comparación con los controles y disminuye con el envejecimiento. El ejercicio aumenta el flujo sanguíneo 4 veces en el tendón 5 cm proximal a la inserción, mientras que aumenta sólo 2,5 veces a 2 cm proximal a la inserción. CAUSAS Y PATOLOGÍA Se han desarrollado varias hipótesis para aclarar las causas de la rotura, pero no hay acuerdo en la literatura y los acontecimientos que llevaron a una ruptura del AT aún no están claros. Numerosos factores como disfunción gastrocnemio-sóleo, una unidad musculotendinosa en condiciones subóptimas, edad, sexo, cambios en el patrón de entrenamiento, mala técnica, lesiones previas, calzado, mala vascularización del tendón y degeneración frecuentemente se atribuyen a rupturas. Además, diversas condiciones patológicas, como enfermedades infecciosas, condiciones neurológicas, hipertiroidismo, insuficiencia renal, arteriosclerosis, condiciones inflamatorias y autoinmunes, hiperuricemia, anomalías del colágeno determinadas genéticamente, y alta concentración de lípidos séricos, puede estar asociado con rupturas de AT. Se proponen dos teorías principales sobre la causa de las rupturas de AT: la teoría degenerativa y la teoría mecánica. La teoría degenerativa. Afirma que la degeneración crónica del tendón conduce a una rotura sin que se apliquen cargas excesivas. La degeneración del tejido tendinoso puede deberse a numerosos factores como sobrecarga crónica o microtraumatismos, alteraciones fisiológicas del tendón y tratamientos farmacológicos. Los acontecimientos moleculares que conducen a la rotura del AT aún no están claros. En todos los AT operados dentro de las 24 horas posteriores a la lesión, detectamos marcados cambios degenerativos y alteración del colágeno. Además, varios investigadores observaron alteraciones degenerativas en la sustancia intratendinosa del AT en varios pacientes con rotura espontánea, en todos los sitios estudiados, y la mayoría de estas anomalías no tenían causa conocida. Varios investigadores han planteado la hipótesis de que las alteraciones en el flujo sanguíneo con la posterior hipoxia y alteración del metabolismo fueron factores importantes para el desarrollo de los cambios degenerativos del AT. También se demostro que los tenocitos de tendones rotos y tendinopáticos producían colágeno tipo III, que altera la arquitectura fisiológica del tejido, haciendo que el tejido sea menos resistente a altas cargas y fuerzas de tracción. Además, se observaron que la fibronectina, que normalmente se encuentra en las membranas basales, estaba presente en las superficies desgarradas de los AT rotos. La fibronectina está presente en forma soluble en el plasma y se une más fácilmente al colágeno desnaturalizado que al colágeno normal, lo que indica una desnaturalización del colágeno preexistente. Teoría Mecánica. El AT puede dañarse cuando se producen microtraumatismos frecuentes y repetitivos, sin dejar tiempo suficiente al tendón para su reparación incluso en tendones sanos y sin degeneración. Numerosos movimientos que ocurren en muchos deportes, y no sólo aquellos que requieren un impulso rápido, pueden ser responsables de estos sucesos. Un AT sano generalmente se rompe después de una tensión muscular violenta en presencia de una sinergia incompleta de las contracciones del músculo agonista, una acción ineficaz del músculo plantar que actúa como tensor del AT y una discrepancia en el cociente de espesor entre el músculo y el tendón, las contracciones musculares descoordinadas podrían causar la ruptura de un tendón que de otro modo sería normal, y los atletas que tienen un largo período de inactividad y regresan al entrenamiento demasiado pronto parecen presentar un mayor riesgo de una ruptura causada por este mecanismo. La actividad deportiva juega un papel importante papel en el desarrollo de problemas con el AT, especialmente cuando la sesión de entrenamiento se realiza incorrectamente. Además, el riesgo de rotura de la AT aumenta considerablemente durante los movimientos de inversión o eversión de la articulación subastragalina cuando se asocian con la aplicación de tensión oblicua. La lesión AT también puede ser el resultado de alteraciones estructurales o dinámicas en la mecánica normal de la parte inferior de la pierna, como sobrepronación funcional insuficiencia del gastrocnemio/ sóleo, sobreentrenamiento y microtraumatismos repetidos producidos por la carga excéntrica del músculo fatigado. En conclusión, la rotura completa del AT puede considerarse como consecuencia de múltiples microtraumatismos y microroturas que conducen al fallo del tendón tras alcanzar un punto crítico. Fármacos como los esteroides anabólicos y las fluoroquinolonas provocan displasia de las fibrillas de colágeno, lo que disminuye la resistencia a la tracción del tendón y aumenta el riesgo de rotura del AT. Los tendones normales y sanos no suelen resultar dañados por la inyección intratendinosa de esteroides, mientras que la administración de corticosteroides sistémica y local ha sido ampliamente implicada en la rotura del tendón. Sin embargo, numerosos estudios han demostrado que la inyección intratendinosa o peritendinosa de corticosteroides en un tendón lesionado puede precipitar una rotura. Además, las propiedades analgésicas de los corticosteroides pueden enmascarar o retrasar la aparición de los síntomas relacionados con el daño al tendón. inducir a los individuos a mantener sus altos niveles de actividad incluso cuando el tendón está dañado. Los corticosteroides también interfieren con la curación de los tendones, lo que provoca necrosis del colágeno. La consiguiente restauración de la fuerza del tendón es atribuible a la formación de una masa celular amorfa de colágeno y, por estas razones, se debe evitar la actividad física vigorosa durante al menos 2 semanas después de la inyección de corticosteroides cerca de un tendón. La administración de antibióticos fluoroquinolonas o ciprofloxacina se ha asociado con rotura del tendón. La pefloxacina, la ofloxacina, la levofloxacina, la norfloxacina y la ciprofloxacina son las fluoroquinolonas que se asocian con mayor frecuencia con trastornos de los tendones. Se han producido diversas pruebas de laboratorio sobre los efectos nocivos directos de las fluoroquinolonas sobre los tenocitos. MECANISMO DE RUPTURA Se pueden clasificar en 3 categorías principales: 53% ocurren durante la carga de peso con el antepié empujando y la rodilla en extensión. Las salidas de velocidad y los deportes de salto requieren con mayor frecuencia estos movimientos y esto explica la prevalencia de la rotura del AT izquierdo en personas diestras. 17% ocurren después de una dorsiflexión repentina e inesperada del tobillo, como resbalar en un agujero o caer una escalera. En el 10% de los pacientes, el tendón se rompió debido a una dorsiflexión violenta del pie en flexión plantar, como puede ocurrir después de una caída desde una altura DIAGNÓSTICO El diagnóstico de roturas, debe comenzar con una evaluación cuidadosa de la historia seguida de un examen físico. Sin embargo, entre el 20% y el 25% de las roturas de AT no son diagnosticadas por el primer médico que las examina, mientras que el diagnóstico clínico es inmediato en caso de roturas agudas del AT. Los pacientes con rotura de AT suelen referir antecedentes de dolor en la pierna afectada y la sensación de que, en el momento de la lesión, les habían dado una patada en la cara posterior de la parte inferior de la pierna. Además, son frecuentes la incapacidad para soportar peso y la debilidad o rigidez del tobillo afectado. Sin embargo, un pequeño número de pacientes aún pueden utilizar el flexor largo del dedo gordo, el flexor largo de los dedos, el tibial posterior y los tendones peroneos para realizar la flexión plantar del tobillo afectado. En el examen clínico, suele haber edema difuso y hematomas, a menos que la inflamación sea grave, se puede sentir un espacio palpable a lo largo del trayecto del tendón, con mayor frecuencia de 2 a 6 cm proximal a la inserción del tendón. La inspección y palpación deben ir seguidas de otras pruebas para confirmar el diagnóstico. La prueba de compresión de la pantorrilla de Thompson se realiza con el paciente boca abajo en la camilla de exploración y los tobillos fuera de la camilla, y el examinador aprieta la parte carnosa de la pantorrilla. Este procedimiento provoca la superposición del AT, produciendo flexión plantar del tobillo si el tendón está intacto. Los hallazgos clínicos en la pierna afectada después de esta prueba deben compararse con los de la pierna opuesta para excluir cualquier falso positivo que pueda ocurrir en presencia de un tendón plantar intacto. La prueba de Matles se realiza con el paciente boca abajo en la camilla de exploración. Se pide a los pacientes que flexionen las rodillas a 90 grados y, si el pie del lado afectado cae en posición neutra o en dorsiflexión, se diagnostica una rotura AT. La prueba de O'Brien consiste en la inserción de una aguja hipodérmica de calibre 25 a través de la piel de la pantorrilla, medial a la línea media y 10 cm proximal al borde superior del calcáneo, dentro de la sustancia del tendón. Luego se realiza una flexión plantar y una dorsiflexión alternativa del tobillo y si, en la dorsiflexión, la punta de la aguja se mueve distalmente, se presume que el tendón está intacto en la porción distal a la aguja. Si, durante la dorsiflexión, la punta de la aguja se mueve proximalmente o permanece quieta, se presume que hay una pérdida de continuidad entre la aguja y el sitio de inserción del tendón. La prueba de Copeland se realiza pidiendo al paciente que se acueste boca abajo con la rodilla flexionada a 90° y un manguito de esfigmomanómetro colocado alrededor de la mayor parte de la pantorrilla de la pierna afectada. Luego se infla el manguito a 100 mm Hg con el pie en flexión plantar. Luego se realiza la dorsiflexión del pie. Si la presión aumenta hasta aproximadamente 140 mm Hg, se supone que la unidad musculotendinosa está intacta. Se debe utilizar el lado opuesto para excluir una respuesta falsa positiva o con fines de comparación. EVALUACIÓN DE IMAGEN La ultrasonografía de alta resolución en tiempo real y la resonancia magnética son evaluaciones de imágenes más sensibles y menos invasivas. Sin embargo, la ecografía generalmente se considera el método de imagen primario para el diagnóstico de roturas de AT. Se pueden realizar radiografías laterales del tobillo para diagnosticar una rotura de AT. La pérdida de la configuración normal del triángulo de Kager, el espacio entre la cara anterior del AT, la cara posterior de la tibia y la cara superior del calcáneo, es patognomónica de rotura del AT. Arner encontraron que la deformación de los contornos del segmento distal del tendón resultante de la pérdida de tono eran los cambios radiográficos con mayor probabilidad de estar asociados con la rotura del AT. El signo de Toygar implica medir el ángulo de la curva de la superficie cutánea posterior que se ve en las radiografías simples, porque los extremos del tendón se desplazan hacia delante después de un desgarro completo. La cara posterior del triángulo de Kager luego se acerca a la cara anterior y el triángulo disminuye o desaparece. un angulo de 130-a 150-indica ruptura AT. La ecografía de la TA se considera el método de imagen primario para diagnosticar una rotura, aunque depende del operador. La posibilidad de realizar una evaluación dinámica y panorámica del TA mediante ultrasonografía lineal está influenciada por el tipo de transductor utilizado y el ángulo del haz de ultrasonido con respecto al tendón. Además, la ecografía se puede utilizar para evaluar la estructura del tendón después de cualquier tipo de reparación quirúrgica. A pesar de su corta distancia de enfoque, las sondas de alta frecuencia de 7,5 a 10 MHz proporcionan la mejor resolución. Para evitar artefactos durante la evaluación ecográfica del AT, la sonda debe ser manejada por examinadores expertos y sostenida en ángulo recto con respecto al tendón. Por lo tanto, los transductores lineales son más adecuados que los transductores sectoriales, que producen una oblicuidad excesiva del haz de ultrasonidos en los bordes. También puede ser necesario utilizar un espaciador de gel sintético o una almohadilla de separación, aumentando la definición de los ecos de la superficie y permitiendo un soporte adecuado. La apariencia ecográfica normal del AT es una imagen hipoecogénica en forma de cinta, contenida dentro de 2 bandas hiperecogénicas. Los fascículos tendinosos aparecen como bandas hipoecogénicas e hiperecogénicas alternas que son más compactas cuando el tendón está tenso y más separadas cuando está relajado. La presencia de un vacío acústico con bordes gruesos e irregulares es típica de la rotura del AT. El aspecto normal de la TA en la resonancia magnética es hipointenso en todas las secuencias de pulso. El triángulo de Kager, que parece hiperintenso debido a la presencia de grasa, está bien delineado por el AT. Las imágenes ponderadas en T1 y T2 en el plano sagital y en el plano axial se suelen utilizar para evaluar sospechas de roturas del AT, especialmente en casos de aumento de la intensidad de la señal intratendinosa. En las imágenes potenciadas en T1, la rotura AT aparece como una interrupción de la señal dentro del tendón, mientras que en las imágenes potenciadas en T2 la rotura se ve como un aumento generalizado en la intensidad de la señal. Además, en las imágenes potenciadas en T2, el edema y la hemorragia en el lugar de la rotura se ven como un área de alta intensidad de señal. TRATAMIENTO El tratamiento de la rotura aguda de AT se puede clasificar en términos generales en quirúrgico y no quirúrgico y generalmente depende de la preferencia del cirujano y del paciente. El manejo quirúrgico consiste en reparación abierta o percutánea, mientras que el manejo conservador consiste en inmovilización o aparatos ortopédicos funcionales. Hay más evidencia disponible para el uso de técnicas percutáneas que para la cirugía abierta, y también para el uso de la movilización temprana. El tratamiento quirúrgico ha sido el método de elección en las últimas dos décadas, especialmente en atletas y jóvenes y en casos de roturas tardías, mientras que en los no atletas se puede utilizar un tratamiento conservador y no quirúrgico. El tratamiento quirúrgico abierto de las roturas agudas de AT reduce significativamente el riesgo de nueva rotura en comparación con el tratamiento conservador, pero se asocia con un riesgo significativamente mayor de problemas de cicatrización de heridas que puede reducirse realizando una cirugía por vía percutánea. El objetivo del tratamiento de la rotura de AT es minimizar la morbilidad de la lesión, optimizar el rápido retorno a la función completa y prevenir complicaciones. Las complicaciones se pueden clasificar como mayores o menores según su impacto en las actividades de la vida diaria y se pueden dividir en 3 categorías: complicaciones de la herida, complicaciones generales; y re ruptura. La trombosis venosa profunda, la embolia pulmonar y la re ruptura son las complicaciones más graves y pueden afectar a los pacientes independientemente del tratamiento.89 MANEJO NO OPERATIVO El manejo conservador y la reparación percutánea pueden considerarse alternativas viables a la cirugía abierta, que es la más riesgosa y costosa de las tres opciones. La elección del tipo de manejo debe tener en cuenta la edad, ocupación y nivel de actividad deportiva de cada paciente. La inmovilización con un yeso debajo de la rodilla en posición de equino de gravedad durante 4 semanas seguida de una posición más neutral durante 4 semanas más se considera el protocolo no quirúrgico más común para el tratamiento de la rotura de AT. Después de este período, se aplica un yeso debajo de la rodilla con el pie plantígrado durante 2 semanas más, lo que permite soportar peso durante las últimas 2 semanas de este régimen de tratamiento. Después de 1 a 3 semanas de inmovilización, se han utilizado aparatos ortopédicos, férulas o zapatos con limitación de la dorsiflexión y aumento de la altura del talón para la rehabilitación funcional. Los informes sobre el tratamiento funcional temprano sugieren buenos resultados funcionales y bajas tasas de rerupción. En pacientes ancianos, mayores de 70 años, que presentan rotura crónica, se puede utilizar la fisioterapia sola. Estos pacientes suelen quejarse de debilidad en la flexión plantar y de una marcha extraña, pero suelen adaptarse bien a su discapacidad. Después de la inmovilización, se produce una profunda alteración de la morfología y fisiología muscular. Aparte del músculo gastrocnemio, que es un músculo biarticular capaz de moverse cuando se utiliza un yeso corto en la pierna, el músculo sóleo es particularmente susceptible a la inmovilización. Debido a la presencia de una alta proporción de fibras musculares tipo I en el sóleo humano, es particularmente susceptible a la atrofia si está inmovilizado. Los problemas causados por la inmovilización también pueden ocurrir después del manejo quirúrgico abierto, pero no en la misma medida que con el manejo no quirúrgico. La circunferencia de la pantorrilla disminuye considerablemente después del tratamiento no quirúrgico en comparación con el tratamiento quirúrgico. Además, después del tratamiento quirúrgico, no se observa ninguna diferencia significativa en la circunferencia de la pantorrilla en comparación con el tendón contralateral ileso. Sin embargo, los pacientes con reparaciones quirúrgicas abiertas pasan menos tiempo enyesados y con mayor frecuencia son atletas serios que cumplen bien con el manejo postoperatorio. La inmovilización con yeso, generalmente durante un período de 6 a 10 semanas, es la más utilizada y el resultado clínico es comparable con el manejo quirúrgico. MANEJO QUIRÚRGICO REPARACION PERCUTANEA A pesar del alto riesgo de problemas de heridas cutáneas, se asocian varias ventajas con la reparación quirúrgica abierta de roturas de AT, como la alineación correcta del tendón desgarrado, excelentes resultados funcionales con menos posibilidades de nueva rotura, fuerza superior y movilización activa temprana. REPARACION QUIRURGICA ABIERTA En los últimos años, la reparación quirúrgica abierta se consideró el estándar de oro para el tratamiento de las roturas de AT en individuos jóvenes y en forma. Además, los numerosos avances en las técnicas quirúrgicas, como en los protocolos de rehabilitación postoperatoria, han alentado a muchos cirujanos a favorecer la reparación directa del tendón, los excelentes resultados de la reparación quirúrgica en cuanto a las tasas de re rupción y la fuerza de los tendones, como el trofismo de la pantorrilla, pueden ayudar a muchos atletas a regresar a las actividades físicas previas a la lesión. Se pueden realizar diferentes técnicas operativas, que van desde una sutura de extremo a extremo con suturas, hasta reparaciones más complejas utilizando refuerzo fascial o injertos de tendón.implantes de tendones artificiales, materiales como compuestos absorbibles de polímero y fibra de carbono, andamios de xenoinjerto ECM, Malla Marlex y prótesis tendinosas de colágeno. Aumento primario de la reparación con el tendón plantar,un solo colgajo fascial central o 2 (1 medial, 1 lateral) de gastrocnemio, el tendón peroneo corto, el tendón grácil, el tendón hueso- rotuliano, el tendón del hueso-cuádriceps. Sin embargo, no hay evidencia de que, en las roturas agudas de AT, esto sea mejor que una reparación de extremo a extremo sin aumento. El plasma rico en plaquetas (PRP) también se ha utilizado solo para el tratamiento de la tendinopatía AT crónica, en asociación con reparación abierta en caso de roturas agudas de AT de PRP en rotura aguda de TA o en tendinopatía crónica de TA concluyeron que el PRP no es útil para el tratamiento de estos trastornos. MANEJO POST OPERATORIO Los pacientes pueden ser dados de alta 2 días después o la misma fecha de la operación. Un fisioterapeuta ortopédico debe indicarle al paciente que use muletas. A los pacientes se les permite soportar peso sobre la pierna operada según lo toleren. Además, es importante indicarle al paciente que mantenga la pierna afectada elevada el mayor tiempo posible para evitar la hinchazón. Los pacientes son seguidos de forma ambulatoria a intervalos de 2 semanas y el yeso se retira 6 semanas después de la operación. En caso de aplicación de yeso con el tobillo en equino, transcurrido este período se cambia, poniendo el tobillo en dorsiflexión progresivamente creciente, hasta plantígrado, después de 2 y 4 semanas. Luego se retira el yeso 6 semanas después de la operación. Después del período de inmovilización de 6 semanas, los pacientes deben soportar peso parcialmente y se permiten ejercicios graduales de estiramiento y fortalecimiento. No se recomienda soportar todo el peso antes de 8 a 10 semanas después de la cirugía. Durante el período en el yeso, se deben iniciar contracciones isométricas suaves del complejo gastrosóleo, especialmente después de que la carga de peso se haya vuelto cómoda. Después de retirar el yeso, los pacientes deben comenzar a movilizar el tobillo y, después de 2 semanas, se permite montar en bicicleta y nadar, continuando también con los ejercicios de movilización activa del tobillo. Los pacientes suelen reincorporarse a su actividad deportiva habitual a los 4 meses de la cirugía. En los deportistas, el tratamiento posoperatorio debe ser diferente del que se proporciona a los pacientes no deportistas. El tobillo debe inmovilizarse en posición de equino con una losa de yeso de París anterior debajo de la rodilla. Los pacientes suelen ser dados de alta el mismo día o al día siguiente de la operación. Se les permite tocar con los dedos del pie el peso que soporta la extremidad operada según lo toleren. También se aconseja mantener elevada la pierna operada el mayor tiempo posible, para reducir la hinchazón postoperatoria. Después de 48 a 72 horas, cuando la hinchazón postoperatoria debería reducirse significativamente, los pacientes son atendidos en la sala de yesos para cambiar la losa de yeso de París por una losa sintética anterior debajo de la rodilla con el tobillo en equino de gravedad. La losa se mantiene en su lugar mediante un vendaje elástico, que permite la flexión plantar del tobillo, mientras que la dorsiflexión está limitada por la pieza de la losa para el pie. A los pacientes se les permite soportar peso según lo toleren. La losa se cambia en la segunda semana postoperatoria para que el tobillo pueda dorsiflexionarse a neutral y la dorsiflexión se limita hasta la sexta semana, cuando se retira la losa. Cuando los atletas de alto nivel y bien motivados cumplen, generalmente pueden volver a entrenar entre 6 y 8 semanas después de retirar la losa anterior. La losa anterior se puede sustituir por una ortesis articulada, que es más cara que un simple yeso sintético pero se puede reutilizar. Además, el movimiento libre del tobillo después de la reparación de la TA proporcionado por un yeso que soporta el tendón rotuliano con un marco protector debajo del pie, que permite soportar peso inmediatamente después de la cirugía, también es seguro y se asocia con resultados clínicos satisfactorios.El nivel de actividad deportiva previo a la lesión suele alcanzarse 9 meses después de la cirugía. Las variables que generalmente se estudian después de la ruptura del AT son las complicaciones del tratamiento, la fuerza de los músculos de la pantorrilla, la satisfacción del paciente, la resistencia, la configuración del tendón, el impacto de la ruptura del AT en la ausencia del trabajo y el impacto en la participación deportiva. En general, se han utilizado mediciones de resultados utilizando sistemas de puntuación de 100 puntos. La principal limitación para su uso común ha sido que las puntuaciones incluyen pruebas de dinamometría, que no están ampliamente disponibles en la práctica clínica habitual. La puntuación de ruptura total del tendón puede ser una buena solución para resolver este problema. Es un instrumento informado por el paciente para medir el resultado después del tratamiento de la rotura total de AT. Es un instrumento autoadministrado con alta utilidad clínica y ha sido sugerido para medir el resultado, relacionado con los síntomas y la actividad física, después del tratamiento en pacientes con rotura total de AT. PARA LLEVAR A CASA En las últimas décadas, la incidencia de rotura de AT ha aumentado, mientras que la evidencia sobre el mejor manejo aún se debate y varias opciones aún son desafiantes. En pacientes ancianos o en unos pocos pacientes seleccionados, el tratamiento conservador y la movilización temprana logran resultados excelentes, pero la tasa de re ruptura asociada no es aceptable en individuos jóvenes. La cirugía abierta se asocia frecuentemente con un mayor riesgo de rotura superficial de la piel y problemas en las heridas, que pueden prevenirse realizando una reparación percutánea. La reparación percutánea, realizada con anestesia local y seguida de rehabilitación funcional temprana, es cada vez más común y puede considerarse en pacientes seleccionados. Sin embargo, diferentes investigadores proponen varias técnicas percutáneas y faltan ensayos apropiados que demuestren cuál de ellas es la mejor. BIBLIOGRAFIA Ames PR, Longo UG, Denaro V, et al. Problemas del tendón de Aquiles: no sólo una cuestión ortopédica. Disabil Rehabil 2008;30(20–22):1646–50. Maffulli N, Waterston SW, Squair J, et al. Incidencia cambiante de la rotura del tendón de Aquiles en Escocia: un estudio de 15 años. Clin J Sport Med 1999;9:157– 60. Longo UG, Rittweger J, Garau G, et al. No hay influencia de la edad, el sexo, el peso, la altura y el perfil de impacto en la tendinopatía de Aquiles en atletas de atletismo máster. Soy J Sports Med 2009;37:1400–5. Thermann H, Frerichs O, Biewener A, et al. Estudios biomecánicos de la rotura del tendón de Aquiles humano. Unfallchirurg 1995;98:570–5 [en alemán]. Jarvinen TA, Kannus P, Maffulli N, et al. Trastornos del tendón de Aquiles: etiología y epidemiología. Pie Tobillo Clin 2005;10:255–66.