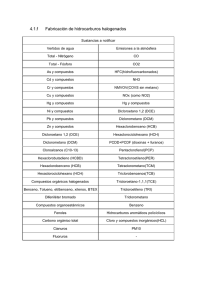
¶ E – 36-285-A-10 Anestésicos halogenados I. Odin, N. Nathan La clase terapéutica de los agentes halogenados utilizados en anestesia incluye agentes como el halotano y el enflurano, que han sido sustituidos por otros más recientes como el isoflurano, el desflurano y el sevoflurano, menos solubles en los tejidos y mejor tolerados por el sistema cardiovascular. Las diferencias farmacodinámicas existentes entre estos tres últimos agentes son pequeñas, y su toxicidad se puede considerar casi nula, incluso en el caso del sevoflurano, que al degradarse en presencia de las bases fuertes contenidas en la cal sodada da lugar a compuestos A. El sevoflurano y el desflurano, que son los agentes más recientes, se caracterizan por tener una cinética más rápida. A la hora de usarlos habrá que sopesar las ventajas clínicas que esto supone (rapidez de la inducción y del despertar, mayor facilidad de control) frente a un coste que, en la práctica, es cuatro veces superior al del isoflurano. Estos dos agentes se deben utilizar con prioridad en circuito cerrado y con flujos de gases frescos reducidos al máximo posible. Esta reducción de flujo de gases frescos no disminuye la facilidad de control de los agentes menos solubles, como el desflurano. No obstante, el empleo de cualquier agente halogenado, sea cual sea su coste, resulta mucho más económico que el de los agentes intravenosos, y además permite una recuperación más rápida o igual. El sevoflurano, menos acre y menos soluble, puede utilizarse tanto en el adulto como en el niño para la inducción con máscara. La inducción con máscara en el adulto ha despertado recientemente cierto interés, pero esta técnica provoca en determinados grupos de pacientes algunos efectos de tipo hemodinámico o de actividad cerebral epileptiforme que deben evaluarse mejor. © 2005 Elsevier SAS. Todos los derechos reservados. Palabras Clave: Halogenado; Liposolubilidad; Concentración alveolar; CAM; Bajo flujo de gas fresco; Hemodinámica; Barorreflejo; Respuesta ventilatoria Plan ¶ Introducción 1 ¶ Propiedades fisicoquímicas 2 ¶ Farmacocinética: consecuencias clínicas Generalidades Solubilidad y cinética comparadas de los agentes halogenados Consecuencia de las diferencias cinéticas entre agentes halogenados cuando se utiliza un circuito con bajo flujo de gas fresco Cinética y circuito cerrado Efecto de segundo gas y efecto concentración 3 3 ¶ Estabilidad en la cal sodada, metabolismo y toxicidad Degradación Metabolismo Toxicidad hepática Toxicidad renal Otras toxicidades 7 7 7 8 8 9 ¶ Mecanismo de acción 9 Anestesia-Reanimación 4 5 6 6 ¶ Efectos farmacodinámicos Efecto hipnótico y efecto sobre el electroencefalograma Efectos analgésicos Flujo sanguíneo cerebral, presión intracraneal y consumo de oxígeno cerebral Efectos respiratorios Efectos cardiocirculatorios Otros efectos 10 10 11 ¶ Utilización práctica Inducción Mantenimiento Despertar Coste y elección del agente halogenado 15 15 16 17 17 ¶ Conclusión 18 11 11 12 14 ■ Introducción En la clase de los agentes anestésicos por inhalación se encuentran el protóxido de nitrógeno (N2O) y el xenón, de 1 E – 36-285-A-10 ¶ Anestésicos halogenados estructura simple, y los agentes halogenados, de estructura más compleja. Los agentes halogenados son hidrocarburos cuyas moléculas se han sustituido en parte y en grados diversos por un átomo halógeno (bromo, cloro y flúor), de ahí su nombre. La naturaleza, el número y la posición de este halógeno condicionan las propiedades farmacocinéticas, los efectos y la toxicidad de dichos agentes. En su globalidad, los agentes halogenados y, sobre todo, los más recientes, se caracterizan por un alto índice terapéutico asociado a una toxicidad baja. Además de poder medir de forma continuada sus concentraciones alveolares, la inyección directa de estos agentes en ciertos circuitos de anestesia permite realizar una anestesia por inhalación con un objetivo de concentración medida y no calculada, como en el caso de los agentes intravenosos. Su rápida eliminación por vía respiratoria y la baja solubilidad de los agentes más recientes permite una adaptación rápida del nivel de anestesia durante el mantenimiento, así como una recuperación rápida y predecible, con independencia de la duración de la anestesia y de las características del paciente. Las primeras aplicaciones de vapores anestésicos se remontan a 1846, año en el que Morton utilizó éter con este fin (aunque esta sustancia no es un «halogenado» propiamente dicho). El mismo año se publicó el empleo del cloroformo [24]. Hay que esperar casi un siglo para la comercialización del metoxiflurano (1962), que no se utiliza desde hace muchos años por su toxicidad renal y, sobre todo, por su escasa facilidad de control, debida a su elevada liposolubilidad. El halotano, que empezó a usarse al final de la década de 1950, tampoco se utiliza hoy en día, debido a su toxicidad y sus efectos cardiovasculares negativos. El enflurano, comercializado en 1973, apenas se administra ya, por razones similares. Además, a causa de su olor acre, tampoco se puede emplear para la inducción. En la actualidad, el isoflurano, el desflurano y el sevoflurano son los tres agentes halogenados que se administran con mayor frecuencia. Figura 1. Estructura química de los agentes halogenados. A. Halotano. B. Enflurano. C. Isoflurano. D. Sevoflurano. E. Desflurano. átomo de bromo y otro de cloro, es más liposoluble que el isoflurano, que contiene un átomo de cloro y varios de flúor. Este último es más liposoluble que el sevoflurano y que el desflurano, que sólo contienen flúor. La solubilidad suele ser proporcional a la potencia anestésica (ley de Meyer-Overton), lo que sugiere un punto de acción hidrófobo y unitario para todos los agentes halogenados. Existen, sin embargo, excepciones a la ley de Meyer-Overton que están relacionadas con la existencia de isómeros (enflurano e isoflurano, por ejemplo), con la localización terminal de la halogenación (efecto convulsivante) o con la talla del esqueleto del hidrocarburo (ausencia de efecto por la talla). La liposolubilidad también condiciona la cinética (cf infra). La estructura fisicoquímica del halogenado condiciona igualmente las reglas para su administración. Así pues, los éteres metil-etil, como el isoflurano, el desflurano y el enflurano, son acres, de ahí que no se puedan administrar durante la inducción sin riesgo de irritación de las vías respiratorias. En cambio, el halotano (clase de los alcanos) y, sobre todo el sevoflurano (éter-isopropil), se pueden utilizar para la inducción en el niño y, recientemente, en el adulto, ya que son menos acres (Fig. 1). Por último, la temperatura de ebullición y la presión de vapor saturante, que difiere entre los halogenados, condicionan la calibración de los vaporizadores convencionales. El desflurano, con una presión de vapor saturante aproximada a la presión atmosférica y una temperatura de ebullición cercana a la temperatura ambiente, se debe administrar con un vaporizador ■ Propiedades fisicoquímicas Las propiedades fisicoquímicas de los agentes halogenados (Cuadro I) y su liposolubilidad (evaluada por el coeficiente de partición aceite/agua [Cuadro II]) dependen de la sustitución de un átomo de hidrógeno por uno de flúor y, sobre todo, por uno de bromo y, en menor grado, de cloro (Fig. 1). El halotano, que contiene un Cuadro I. Propiedades fisicoquímicas de los agentes anestésicos por inhalación. Peso molecular (da) Temperatura de ebullición (°C) PVS (20°C) A/G Halotano 197,381 50,2 243,97 224 Enflurano 184,491 56,5 171,97 96 Isoflurano 184,491 48,5 238,95 91 Sevoflurano 200,053 58,5 159,97 53 Desflurano 168,036 23,5 663,97 19 Protóxido de nitrógeno 44 -88,5 / 1,4 Da: Dalton; PVS: presión de vapor saturante; A/G: coeficiente de partición aceite/gas. Cuadro II. Coeficientes de partición de los agentes anestésicos por inhalación y porcentaje de metabolismo. Halotano Enflurano Isoflurano Desflurano Sevoflurano Protóxido de nitrógeno Sangre-gas 2,54 1,8 1,46 0,42 0,68 0,47 Sangre-cerebro 1,94 1,4 1,57 1,29 1,70 1,1 Sangre-músculo 3,38 1,7 2,92 2,02 3,13 1,2 Sangre-grasa 62 36 52 30 55 2,3 Metabolismo 20 % 2,4 a 8,5 % 0,2 % 0,02 % 2a5% 0% Coeficiente de partición 2 Anestesia-Reanimación Anestésicos halogenados ¶ E – 36-285-A-10 presurizado y con termostato (cf infra). Recientemente, un vaporizador concebido con mayor originalidad y específico de la máquina de anestesia Kion permite su administración sin tener que mantener constantes la presión y la temperatura en el vaporizador. Cada agente halogenado tiene su vaporizador de administración específico, para evitar dosificaciones excesivas o insuficientes. Estos agentes halogenados también se pueden inyectar directamente en ciertos circuitos. Los agentes halogenados se comercializan en forma líquida en frascos con tapones específicos para cada agente, a fin de evitar errores de llenado. Cada mililitro de gas líquido permite obtener una cantidad de agente en forma gaseosa que varía en función de su peso molecular y de su temperatura de ebullición. Para evaluar el coste de la anestesia, se pueden calcular fácilmente las cantidades de gas utilizadas a partir del flujo de gas fresco y de la concentración usada gracias a la conversión en mililitros de agente líquido. Así pues, 1 ml de sevoflurano líquido se transforma en 183 ml de gas, 1 ml de desflurano se convierte en 208 ml de gas y 1 ml de isoflurano en 194 ml de gas. ■ Farmacocinética: consecuencias clínicas Generalidades La farmacocinética de los agentes halogenados se puede comparar a un simple traspaso de un compartimento a otro del organismo. Al comienzo de la década de 1960, Mapleson diseñó un modelo en el que estos compartimentos estaban representados en forma de cisternas (Fig. 2). Una vez introducido el agente anestésico en el organismo por vía respiratoria, las concentraciones del mismo tienden a equilibrarse por su paso a través de los distintos compartimentos. Sea cual sea el compartimento considerado, el paso del anestésico dependerá de la diferencia de la presión parcial de gas entre los dos compartimentos (función de la concentración de gas), de la solubilidad del agente en dicho compartimento (efecto del coeficiente de partición) y del flujo sanguíneo del órgano. El agente halogenado pasa desde el compartimento alveolar hacia otros tres compartimentos de transferencia (Fig. 2). El primer compartimento, formado por el grupo de los órganos muy vascularizados, de pequeño volumen pero perfundidos con un flujo elevado, se satura rápidamente; este grupo incluye órganos diana para el efecto farmacológico buscado o no, como el corazón, el cerebro, los riñones y el hígado. El segundo compartimento comprende el grupo músculo-piel, comparable a una cisterna de mayor volumen aunque de menor perfusión. Este compartimento, que se satura con menor rapidez, constituye una zona de acumulación (almacenamiento) rápida del agente halogenado. Por último, en el tercer Boca Pulmones Ventilación . Músculos Vísceras compartimento, denominado «profundo», de gran volumen pero débilmente vascularizado, se encuentra el tejido adiposo. Esta esquematización permite describir el paso del agente halogenado a las distintas partes del cuerpo y comprender la secuencia de sus efectos clínicos. Así, el paso del agente anestésico del alvéolo al compartimento sanguíneo es proporcional a la diferencia de presión parcial a ambos lados del alvéolo, a la capacidad del agente para atravesar de forma pasiva las barreras celulares en función de su solubilidad (reflejada por el coeficiente de partición sangre-gas) y a la ventilación alveolar. Más tarde, el agente anestésico pasa primero del compartimento sanguíneo al compartimento de los órganos ricamente vascularizados (como el cerebro), después menos vascularizados (compartimento músculo-piel) y, por último, los débilmente vascularizados (como las grasas). Este modelo farmacocinético permite entender las variaciones del tiempo de inducción o de la duración de la anestesia según el contexto o el agente utilizado. Así pues, la inducción de la anestesia por vía inhalatoria es más rápida en el niño que en el adulto. Como la capacidad residual funcional es menor en los pulmones de los niños, la dilución del agente en el compartimento pulmonar está reducida, de ahí que el aumento de las concentraciones alveolares y la velocidad de adormecimiento sean más rápidos. Esta diferencia entre el adulto y el niño persiste incluso con los agentes menos liposolubles. El paso de la sangre al cerebro se produce en un lapso de tiempo cuantificado por una constante de transferencia, y se traduce en la clínica por una histéresis y, por tanto, un tiempo en el que el anestésico tarda en actuar de aproximadamente un minuto y medio, que no se puede reducir durante la inducción por vía inhalatoria o durante las adaptaciones terapéuticas. Pese a su gran volumen, el tejido graso sólo puede captar una pequeña cantidad de agente halogenado, pues se halla perfundido por un flujo sanguíneo que representa un porcentaje muy bajo del flujo cardíaco. Así pues, al contrario de lo ocurrido con los agentes administrados por vía intravenosa, la acumulación del agente anestésico en el tejido graso es baja en el caso del halotano o del enflurano, y mínima con el isoflurano, el desflurano y el sevoflurano; esto también sucede en los pacientes obesos, en quienes el tiempo de despertar y el consumo de anestésicos no están aumentados, o sólo un poco [71],incluso con los agentes más liposolubles, como el isoflurano. Las consecuencias para la evaluación de la profundidad de la anestesia son las siguientes: la concentración existente en el interior del alvéolo se equilibra de manera progresiva con las concentraciones sanguíneas y tisulares; las concentraciones del agente inhalado en los distintos compartimentos del organismo son, por tanto, proporcionales. La concentración en el cerebro, y también la profundidad de la anestesia, se evalúan de forma aproximada midiendo la concentración alveolar Boca Pulmones Ventilación Vísceras Músculos Tejido graso A Tejido graso B Figura 2. Analogía hidráulica de Mapleson. A. Agente anestésico poco soluble. B. Agente anestésico muy soluble. Anestesia-Reanimación 3 E – 36-285-A-10 ¶ Anestésicos halogenados de halogenado al final de la espiración. Esta evaluación sólo resulta válida en situación de equilibrio, es decir, durante la fase de mantenimiento de la anestesia, y no durante las fases de adormecimiento y despertar, o durante las variaciones rápidas de las concentraciones del agente halogenado por el fenómeno de histéresis (cf supra). Durante la inducción, o justo después de los ajustes terapéuticos, la elevación de las concentraciones alveolares es, efectivamente, más rápida que en el cerebro, y no refleja la profundidad de anestesia. La diferencia entre concentración alveolar y concentración arterial aumenta con la edad, cuando existe una afección respiratoria, y con la obesidad [54]. Es necesario tener en cuenta esta diferencia para el análisis clínico de la concentración al final de la espiración. La gran diferencia entre las concentraciones inspiratorias y espiratorias de agente halogenado refleja una falta de equilibrio relacionada con una captación persistente del anestésico por los distintos compartimentos del organismo. En caso de inducción con máscara, la existencia de un gradiente considerable entre estas dos concentraciones sugiere que la profundidad de anestesia no es estable, y que puede disminuir rápidamente al interrumpir la administración del halogenado, como ocurre, por ejemplo, durante la intubación. Solubilidad y cinética comparadas de los agentes halogenados Cuanto más soluble es un agente en un tejido, más tiende a solubilizarse y a distribuirse en los distintos tejidos del organismo y, por tanto, menos baja es su presión parcial de gas en el tejido en cuestión. Así pues, cuando se utilizan los agentes menos liposolubles, como el desflurano y el sevoflurano, el aumento de las presiones parciales alveolares es más rápido y más elevado que con los agentes más liposolubles, como el isoflurano, el enflurano y el halotano, ya que se disuelven con menor rapidez. El coeficiente de partición sangre-gas no es el único factor que condiciona la velocidad de adormecimiento. Los coeficientes de partición sangre-músculo y sangre-cerebro condicionan asimismo la velocidad y la estabilidad del adormecimiento. El tiempo de transferencia sangre-cerebro es más rápido con el desflurano, cuyo coeficiente de partición sangre-cerebro es el más bajo de todos los agentes halogenados (Cuadro II). De esta forma, los efectos cerebrales del desflurano, evaluados por el electroencefalograma (EEG), se logran antes que los del sevoflurano y los del isoflurano, cuyos coeficientes de partición sangre-cerebro son más elevados [13, 91]. Asimismo, la redistribución del agente hacia los compartimentos con flujo de perfusión elevado posiblemente condicione la velocidad de adormecimiento y la estabilidad de la anestesia durante la inducción, sobre todo con el sevoflurano, cuya solubilidad en el músculo es similar a la del isoflurano. Es posible, por tanto, que se haya sobrevalorado el papel de los coeficientes de partición, sobre todo el de sangregas, en la velocidad de adormecimiento. Así pues, la concentración inspiratoria y la técnica utilizada son dos factores igualmente esenciales para prever la velocidad de inducción. Aunque el coeficiente de partición sangregas del sevoflurano es 2,1 veces inferior al del isoflurano, la inducción con una concentración alveolar mínima (CAM) de sevoflurano de 3,6 no es dos veces más rápida que con 3,6 CAM de isoflurano, sino sólo una vez y media [141]. El efecto de la liposolubilidad es todavía menor con concentraciones bajas de halogenados. De ahí que con 1,7 CAM de sevoflurano la pérdida de conciencia se alcanza en una media de 121 segundos, mientras que con 1,7 CAM de isoflurano sólo se llega a los 145 segundos [161]. Por último, el tiempo que transcurre hasta la perdida de conciencia es el mismo con el 4 1 N2O Desflurano FA/FI 0,8 Sevoflurano Isoflurano 0,6 Halotano 0,4 0,2 0 0 5 10 15 20 25 30 minutos Figura 3. Cinética de los agentes anestésicos por inhalación administrados en circuito abierto a 0,5 CAM: evolución de su concentración alveolar (FA) en relación con la concentración inspiratoria (FI). halotano y con el sevoflurano cuando las concentraciones proporcionadas por el vaporizador se aumentan de forma progresiva [119]. Durante la inducción anestésica, el aumento de las concentraciones alveolares medidas por la relación entre la fracción alveolar de los gases (F A ) y la fracción inspiratoria (FI) describe una curva seudoexponencial. La pendiente de la curva se muestra más pronunciada con los gases menos liposolubles, y el valor de la seudomeseta, que refleja la captación de los gases en los distintos compartimentos, está más cerca de la unidad (Fig. 3) [157, 158]. En cambio, con los agentes menos liposolubles se observa de manera prolongada una diferencia considerable entre las concentraciones alveolar e inspiratoria, lo que se traduce en un cociente FA/FI más alejado de 1 en la fase de seudomeseta y que se debe a una captación continua del agente anestésico en los distintos compartimentos del organismo (principalmente el compartimento músculo-piel). En la inducción por inhalación, el compartimento músculo-piel constituye el principal lugar de almacenamiento del agente anestésico, ya que los anestésicos por inhalación son más solubles en estos tejidos que en la sangre (Cuadro II) y la perfusión sanguínea se muestra relativamente elevada. Así, cuanto más elevado es el coeficiente de partición sangre/músculo, mayores son la captación y el almacenamiento (Cuadro II). El grado de captación tisular y, por tanto, del almacenamiento de los agentes halogenados, se mide en la práctica clínica por la diferencia entre las concentraciones inspiratoria y de final de espiración. Esta acumulación del agente anestésico también se traduce en la clínica por un consumo más elevado de gas anestésico y por un tiempo de eliminación más largo, con un despertar comparativamente retrasado. En el momento del despertar, la disminución de las concentraciones de halogenados a nivel alveolar se mide por la disminución del cociente entre la concentración alveolar instantánea (FA) y la obtenida al interrumpir la administración del halogenado (FAO). Este cociente FA/FAO disminuye antes con los gases menos liposolubles (Fig. 4) [37]. Dicha disminución se puede acelerar con el metabolismo del agente cuando se utiliza halotano, cuyas curvas de decrecimiento son semejantes a las de agentes menos liposolubles, como el isoflurano [15]. La velocidad de eliminación del agente halogenado se puede evaluar por la semivida contextual de eliminación, como con los agentes intravenosos, y sobre todo por el tiempo que tardan las concentraciones alveolares iniciales en disminuir al 90% (Fig. 5) [10]. Cuando se calcula de dicha forma, para anestesias de más de 2 horas, este tiempo aumenta con la duración de administración del sevoflurano, pero no con la del desflurano o con la del N2 O [41] . Esto quizá se deba a que el coeficiente de partición sangre-músculo del sevoflurano es más elevado. En cualquier caso, las semividas contextuales de todos los agentes halogenados, incluidas las del halotano y el isoflurano, son muyinferiores a las de todos Anestesia-Reanimación Anestésicos halogenados ¶ E – 36-285-A-10 FA/FAO FA/FAO 10-3 1 10-4 Halotano 0,1 Isoflurano Halotano Sevoflurano 10-5 Isoflurano Sevoflurano Desflurano Desflurano 10-6 0,01 0 10 20 30 40 50 60 minutos 0 2 000 4 000 6 000 8 000 minutos Figura 4. Cinética de los agentes anestésicos por inhalación durante el despertar: evolución de la concentración alveolar (FA) de los agentes anestésicos por inhalación en relación con la concentración presente al interrumpir su administración (FAO). Halotano Desflurano Sevoflurano Isoflurano Enflurano 100 90 80 70 60 50 40 30 20 10 0 0 50 100 150 200 250 300 350 400 Duración de la anestesia (minutos) A 100 90 80 70 60 50 40 30 20 10 0 0 50 100 150 200 250 300 350 400 Duración de la anestesia (minutos) B 100 90 80 70 60 50 40 30 20 10 0 0 50 100 150 200 250 300 350 400 Duración de la anestesia (minutos) C Figura 5. Semivida contextual y tiempo de disminución del 90% de los agentes anestésicos por inhalación. A. Tiempo de semidisminución (minutos). B. Tiempo de disminución del 80% (minutos). C. Tiempo de disminución del 90% (minutos). los agentes hipnóticos intravenosos. El objetivo del médico es obtener, no una concentración reducida a la mitad, sino una concentración alveolar de despertar (CAM de despertar, cf infra) después de la eliminación del 70%, o incluso del 90% del agente halogenado, dependiendo de si se ha asociado un morfínico o no. El tiempo necesario para lograr esta concentración de recuperación depende también de la concentración alveolar que existe al final de la anestesia. Con anestesias de 1-2 horas, estos tiempos difieren poco entre los distintos agentes halogenados, con independencia de su solubilidad, pero a condición de que las concentraciones Anestesia-Reanimación Tiempo del despertar (minutos) Isoflurano Desflurano Sevoflurano Coeficiente de partición sangre/gas Figura 6. Influencia de la concentración alveolar (CAM) de los agentes halogenados y de la duración de su administración sobre el tiempo del despertar. alveolares medidas al final de la anestesia sean moderadas (0,8 CAM), pues el agente anestésico no se ha acumulado en el compartimento músculo-piel (Fig. 6) [41]. En cambio, la ventaja de los agentes menos solubles en el compartimento muscular es manifiesta para concentraciones elevadas durante el mantenimiento de la anestesia, ya que la acumulación es menor. Así, con el desflurano, el tiempo de despertar no depende ni de las concentraciones utilizadas ni de la duración de su administración. En cambio, después de administrar sevoflurano durante más de 120 minutos, los tiempos de recuperación de la anestesia dependen de la duración de la misma, y se acercan a los obtenidos tras la administración de isoflurano [42]. Consecuencia de las diferencias cinéticas entre agentes halogenados cuando se utiliza un circuito con bajo flujo de gas fresco La cinética de gases descrita con anterioridad sólo es aplicable en circuito abierto, donde la concentración de los gases inspirados iguala a la proporcionada por el vaporizador. Cuando se utiliza un circuito-filtro, la cinética de los gases depende además de tres factores suplementarios. La concentración inspiratoria varía asimismo con la concentración proporcionada por el 5 E – 36-285-A-10 ¶ Anestésicos halogenados Fv /FD 1,0 10* 5* 3* 2* 1* 0,5 0 0 5 10 Tiempo (minutos) Figura 7. Cinética de los agentes anestésicos por inhalación administrados con un circuito filtro: evolución del cociente concentración inspiratoria (FI) / concentración liberada por el vaporizador (FD). vaporizador (FD), pero también con el flujo de gas que barre el vaporizador, con el volumen del circuito y con la cantidad de gas reinhalada (reinhalación). Al principio de su uso, y sin estar conectado al paciente, el aumento de las concentraciones de los vapores anestésicos es más lento cuanto más elevado es el volumen del circuito y menor es el flujo de gas fresco. El tiempo necesario para lograr las concentraciones inspiratorias deseadas se puede evaluar por la constante de tiempo del circuito (cociente volumen del circuito/flujo de gas fresco). En la práctica, la concentración inspiratoria alcanza el 95% de la concentración proporcionada por el vaporizador al cabo de tres constantes de tiempo. Así, por ejemplo, para un circuito de un volumen medio de 4 l, FI será igual al 95% de la concentración marcada por el vaporizador al cabo de 3 minutos, cuando el flujo de gas fresco llega a 4 l/min, y pasado 1 minuto para un flujo de gas fresco de 12 l/min. Esta inercia tiene la ventaja de evitar la sobredosificación de agente anestésico, pero también el inconveniente de ralentizar las variaciones de las concentraciones inspiratorias y, por tanto, la velocidad para aligerar o profundizar la anestesia. Esta inercia también condiciona el tiempo de preparación del circuito cuando se pretende realizar una inducción con máscara con un circuito con reinhalación de bajo flujo de gas fresco. La reinhalación de los gases espirados es el tercer factor suplementario que influye en la cinética de los gases cuando se utiliza un circuito de bajo flujo de gas fresco. Así, debido a la captación alveolar, los gases espirados, más pobres en agentes anestésicos, se mezclan con el gas fresco y con los que permanecen en el circuito. Por tanto, las concentraciones espiratorias tienden a reducir las concentraciones inspiratorias, y más aún cuando los agentes son liposolubles y han sido captados por el organismo. De todo esto se desprende que la reinhalación es un fenómeno significativo que ha de tenerse en cuenta con los agentes más liposolubles. En cambio, con un agente como el sevoflurano y, sobre todo, como el desflurano, las consecuencias de la reinhalación son poco notables. La interacción entre el volumen del circuito, el flujo de gas fresco y la reinhalación se puede esquematizar de acuerdo con la evolución del cociente FI/FD. Éste se acerca a 1 más rápidamente cuanto más elevado es el flujo de gas fresco (Fig. 7) [39] y menor es la reinhalación (que a su vez depende de la liposolubilidad y del gasto cardíaco del paciente). A la hora de ajustar la terapéutica, el objetivo del médico consiste en obtener una determinada concentración alveolar, y no una concentración inspiratoria, evitando flujos de gas fresco demasiado elevados para limitar la contaminación y un coste suplementario. La evolución de los cocientes FD /F A en función del 6 tiempo permite ajustar de forma óptima la FD, concentración proporcionada por el vaporizador, en función de la concentración alveolar deseada. Este cociente varía con la liposolubilidad del agente y con el flujo de gas fresco (Fig. 8) [41]. Para un flujo de gas fresco de 1 l/min con un agente poco liposoluble, como el desflurano, este cociente se aproxima a 3. En este caso, se puede aumentar la concentración proporcionada tres veces el valor de la concentración alveolar deseada, ya que el valor máximo proporcionado por el vaporizador alcanza el 18%, es decir, aproximadamente tres veces la CAM. De esta forma, se puede alcanzar la concentración alveolar deseada en unos cuantos ciclos respiratorios. Esto no es posible con los agentes más liposolubles, como el isoflurano o el halotano, ya que el cociente FD/FA correspondiente es superior a diez, y se necesitaría que la concentración máxima proporcionada por el vaporizador fuese superior al 10%, algo imposible, pues su calibración máxima es del 5%. Cuando se utilizan halotano e isoflurano, es necesario aumentar el flujo de gas fresco para profundizar la anestesia con mayor rapidez. El cociente FD/FA se acerca de forma progresiva a una seudomeseta (y por tanto al equilibrio) de un modo más rápido y próximo a 1 cuanto menos liposoluble es el agente. Así pues, cuanto menos liposoluble es el agente, más rápida podrá ser la reducción del flujo de gas fresco y de la concentración proporcionada por el vaporizador. Cuando el mantenimiento de la anestesia se realiza con sevoflurano, y sobre todo con desflurano, se puede reducir rápidamente el flujo de gas fresco a valores correspondientes al consumo del paciente, a menudo inferiores a 1 l/min. Si las máquinas de anestesia disponen de rotámetros electrónicos, estos flujos se pueden reducir con gran precisión y a niveles muy bajos, sin riesgo de administrar una mezcla hipóxica. El ahorro permitido por el circuito-filtro es máximo con el desflurano y el sevoflurano, y la eficacia y rapidez de los ajustes terapéuticos se mantienen; la facilidad de control, por tanto, es superior a la obtenida con los agentes más liposolubles [9]. La reinhalación limita los efectos de la hiperventilación usada a veces para profundizar la anestesia. Como la reinhalación es menor, con los agentes menos liposolubles, la hiperventilación permite en teoría profundizar la anestesia pues los gases espirados son menos pobres en gases anestésicos. Cinética y circuito cerrado Por el momento, el Physioflex y, más recientemente, el Zeus son los únicos respiradores de circuito cerrado que permiten realizar una anestesia con un objetivo de concentración espiratoria o inspiratoria [108]. Cuando se pone en marcha, el anestesista regula, según las necesidades del paciente, la concentración inspiratoria del agente anestésico, o del final de espiración. Tanto las características del circuito como la inyección directa del agente anestésico en el interior del circuito permiten alcanzar casi de forma instantánea las concentraciones alveolares deseadas o las inspiratorias, sin tener que modificar el flujo de gas fresco ni depender de la reinhalación. En este caso, el empleo de agentes poco solubles sólo tiene la ventaja clínica de que se eliminan con mayor rapidez durante el despertar y, sobre todo, tras una anestesia larga. Efecto de segundo gas y efecto concentración El efecto de segundo gas se refiere a las modificaciones en la composición de una mezcla de gas en el alvéolo relacionadas con una mayor difusión de uno de los dos gases a nivel de la membrana alveolar. Por este efecto, el N2O, que es un gas muy difundible, pasa con mayor rapidez del alvéolo al compartimento sanguíneo Anestesia-Reanimación Anestésicos halogenados ¶ E – 36-285-A-10 FD/FA FGF = 1 l/min 3 FD/FA FGF = 3 l/min 2,2 Halotano Halotano 1,8 2 Isoflurano Figura 8. Variación en función del tiempo del cociente entre la concentración que debe liberar el vaporizador (FD) y el valor obtenido de concentración alveolar (FA) con los agentes anestésicos por inhalación utilizados en un circuito-filtro con flujos de gas fresco (FGF) de 1 l/min (A) y 3 l/min (B). Isoflurano 1,4 Sevoflurano Sevoflurano Desflurano 0 20 40 Desflurano 1,0 1 0 60 20 40 A cuando se le añade en una segunda fase a una mezcla de gas que contiene halotano o enflurano. Así pues, la concentración alveolar del halotano aumenta, y la velocidad de inducción de la anestesia se puede acelerar. Este efecto también se ha descrito con un gas menos soluble, como el desflurano. En cambio, el segundo efecto gas probablemente sea menos marcado con los agentes menos liposolubles, como el sevoflurano. Por ello, cuando se realiza la inducción con sevoflurano por vía inhalatoria, se añade N2O directamente a la mezcla de gas inhalado. Si se tiene en cuenta su mecanismo, el efecto segundo gas es en teoría más marcado para un gas más soluble (como el N2O) en presencia de un gas menos soluble (como el desflurano). Paradójicamente, se ha observado lo contrario [137]. El efecto concentración describe la influencia de la concentración inspiratoria del agente inhalado sobre el valor de su concentración alveolar y sobre la velocidad a la que se obtiene. El aumento de la concentración inspirada se traduce en una concentración alveolar más elevada que se logra con mayor rapidez. El valor de FA/FI alcanza, por tanto, un valor cercano a 1 con más rapidez. Este efecto concentración permite explicar por qué, a pesar de tener una liposolubilidad superior, las concentraciones alveolares de N 2 O aumentan con mayor rapidez que la del desflurano (Fig. 2). ■ Estabilidad en la cal sodada, metabolismo y toxicidad Los agentes halogenados son xenobióticos y, por tanto, pueden ser tóxicos. Sin embargo, esta toxicidad resulta significativa sobre todo con los agentes más antiguos, como el halotano y el enflurano. La toxicidad puede deberse al propio agente, pero en especial, a los productos resultantes de su degradación o metabolismo. Degradación Las bases fuertes, como el hidróxido de sodio y el hidróxido de potasio, contenidas en la cal sodada o en la cal baritada, degradan todos los agentes halogenados. Cuando el desflurano y, en menor grado, el enflurano y el isoflurano entran en contacto con la cal, se puede formar monóxido de carbono (CO). Esto se produce sobre todo cuando se utiliza cal baritada desecada, y mucho menos con la cal sodada, que contiene alrededor de un 15% de humedad [49]. Además de CO también se forma trifluorometano, que se absorbe por una luz infrarroja de la misma longitud de onda que el enflurano y se puede detectar con los analizadores de gases usados en la práctica clínica. Cuando el analizador de gas emplea varias longitudes de onda lumínica (analizador policromático), se puede afirmar que el circuito está contaminado por CO si el analizador indica la presencia de varios Anestesia-Reanimación 60 B gases halogenados o de enflurano [153]. Cuando el monitor utiliza sólo una longitud de onda lumínica, las concentraciones de agente halogenado medidas por el analizador son muy superiores a las que en realidad existen en el interior del circuito. En la práctica clínica habitual, la formación de CO sólo expone a unas pocas ppm sin consecuencias sobre la concentración de carboxihemoglobina. No obstante, se ha informado de casos de intoxicación por CO tras el uso de desflurano y cal baritada completamente desecada por un flujo de gas fresco mantenido durante todo el fin de semana. No se ha descrito ninguna intoxicación por CO con cal sodada, cuando el empleo ha sido el correcto. Los agentes halogenados no producen CO en presencia de gránulos de hidróxido de calcio que absorben el dióxido de carbono (CO2). Sus principales inconvenientes son un coste elevado y una menor absorción de CO2. Aunque la degradación del halotano y del sevoflurano por las bases fuertes de la cal sodada no produce CO, sí da lugar a la formación de dos compuestos similares que pertenecen a la clase de las olefinas: el compuesto BCDE, en el caso del halotano, y el compuesto A o fluorometil-2,2-difluoro-1(trifluorometil)vinil-éter, con el sevoflurano. Ambos productos carecen de actividad anestésica. Paralelamente, el sevoflurano hidrolizado puede producir ácido hidrofluórico y formaldehído, y más tarde metanol, que reacciona con el compuesto A y forma compuesto B. Si se compara con la del sevoflurano [40] , la degradación del halotano por la cal sodada es poco relevante (unas 60 veces inferior). La degradación del sevoflurano depende de su concentración en el circuito, así como de la temperatura y la hidratación de la cal. De modo experimental, y en presencia de CO2, un 10% del sevoflurano se degrada al cabo de 4 horas en un circuito cerrado que contenga cal húmeda. Pasadas 8 horas, ya se ha degradado el 20%. En condiciones clínicas normales, en las que la cal está hidratada al 15% (hidratación de la cal durante su primer uso) y la temperatura se acerca a 22 °C, un 4,5 vol% de sevoflurano con concentraciones iniciales de 4,58,8 vol% se degrada en 1 hora. En cambio, sólo un 0,35 vol% de desflurano se degrada cuando se administra a una concentración de 2,1 vol%. Al igual que la elevación de la temperatura de la cal 38-47 °C durante la anestesia provoca, en teoría, un aumento de la degradación del sevoflurano, este aumento se contrarresta con el incremento de la hidratación de la cal. Así, después de 2 horas de anestesia, la concentración de compuestos A y B disminuye en el circuito. Metabolismo El metabolismo de los agentes halogenados varía según el agente que se considere (Fig. 9). El halotano es el agente más metabolizado (20%) si se compara con el enflurano (3-8%), el sevoflurano (5%), el isoflurano (0,20,5%) y el desflurano (0,05%). La metabolización puede ser renal (en el caso del metoxiflurano y, probablemente, del enflurano) o hepática. El enflurano, el 7 E – 36-285-A-10 ¶ Anestésicos halogenados Halotano (20 %) Isoflurano (0,2 %) Desflurano (0,03 %) Enflurano (3-5 %) Sevoflurano Hígado - oxidación - Cit. P4502E1 TFA DFA HFIP Proteína hepática Inmunización No inmunización Figura 9. Porcentaje y vía metabólica simplificada de los agentes halogenados. TFA: ácido trifluoroacético; DFA: ácido difluoroacético; HFIP: hexafluoro-isopropanol. isoflurano, el desflurano y el sevoflurano se metabolizan sobre todo en el hígado, donde se someten a una desalquilación y a una deshalogenación por parte de los microsomas hepáticos, y se forman iones fluoruros (de bromo y cloro para el halotano) y un metabolito intermedio sin actividad hipnótica. Este metabolito es un hexafluoro-isopropanol (FIP) en el caso del sevoflurano, un ácido trifluoroacético en el del halotano, isoflurano y desflurano, y un ácido difluoroacético en el caso del enflurano. Las enzimas que participan en el metabolismo del metoxiflurano dependen del citocromo P450 3 E4 y del citocromo P450 2 E1 en el caso del sevoflurano. En el hombre, este último citocromo está presente de forma mayoritaria en los microsomas hepáticos y no renales, como ocurre en animales como la rata [66, 77, 79]. El HFIP sufre una glucuronización antes de ser excretado por la orina; los ácidos trifluoroacético y difluoroacético también se eliminan por vía urinaria, después de una reacción de conjugación que los hace hidrosolubles. La cantidad de metabolitos formados es proporcional al porcentaje metabolizado. La mayor parte de los fluoruros se fija al hueso, y una pequeña cantidad se elimina por el riñón. La concentración de fluoruros séricos puede sobrepasar valores de 50 µmoles/l sin toxicidad asociada, salvo en el caso del enflurano y del metoxiflurano, en el que estos valores reflejan una intensa desfluorinación renal. Las concentraciones plasmáticas medidas infravaloran las concentraciones intrarrenales de flúor; una concentración elevada de estas últimas puede explicar la toxicidad renal tubular del metoxiflurano. La actividad del citocromo 2E1, que varía según los pacientes, se halla incrementada en el obeso y en caso de esteatosis hepática, pero no aumenta con la administración de barbitúricos. Deben señalarse dos aspectos concretos del metabolismo de los halogenados. El halotano es el único agente en el que interviene una reacción de reducción en situación de hipoxia. Este metabolismo sería responsable de la toxicidad hepática del halotano (cf infra). Los productos resultantes de la degradación de los agentes halogenados no tienen un efecto hipnótico, pero también se someten a un metabolismo. El análisis de la producción y del metabolismo de estos productos es fundamental, debido a su toxicidad potencial. El compuesto A, procedente de la degradación del sevoflurano, es metabolizado en el hígado por una glutatiónS-transferasa, y luego por una dipeptidasa y una gamma glutamil transferasa; los compuestos así formados serán destoxificados por una betaliasa o una N-acetiltransferasa. El bloqueo diferencial de estas enzimas permite analizar las modificaciones biológicas asociadas a la administración del producto. El compuesto BCDE, procedente de la degradación del halotano, es metabolizado por vías similares a las del compuesto A [52]. Toxicidad hepática La toxicidad hepática de los agentes halogenados se debe a dos mecanismos. La toxicidad hepática de tipo II, de origen 8 inmunoalérgico, está relacionada con la producción de ácido trifluoroacético, producto del metabolismo del halotano, del isoflurano y del desflurano, y de ácido difluoroacético, procedente del metabolismo del enflurano. Estos derivados terminales del metabolismo se comportan como haptenos, que forman con las proteínas citosólicas hepáticas un neoantígeno frente al que el organismo fabrica inmunoglobulinas G dirigidas de forma específica contra los hepatocitos [131]. Cuanto más significativo es el metabolismo del agente halogenado, mayor es la cantidad de neoantígenos formados y más elevado es el riesgo de hepatitis citolítica [114]. Así pues, cuando se utiliza halotano que se metaboliza en un 20%, la incidencia se aproxima a 1/10.000 anestesias en el adulto. En el niño, la incidencia sería más baja, del orden de 1/200.000, aunque el metabolismo del halotano es igual en el adulto que en el niño [146]. Con los otros agentes halogenados, la frecuencia de esta hepatitis de tipo II es muy baja, y sólo se han publicado algunos casos aislados, más raros cuanto menor es el metabolismo del agente. Aunque resulta excepcional con los agentes empleados hoy en día, hay que pensar en este diagnóstico cuando, 3-5 días después de una anestesia, aparece una fiebre elevada con náuseas, vómitos, erupción cutánea e ictericia; esto ocurre sobre todo en mujeres obesas y/o tras anestesias repetidas. La evolución suele ser fatal si no se realiza un trasplante de hígado. El diagnóstico de certeza se basa en la biopsia hepática que revela una necrosis centrolobular y en la búsqueda en la sangre de inmunoglobulinas G antiproteínas citosólicas mediante un análisis de inmunoabsorción ligada a enzimas, cuya sensibilidad es tan sólo del 79% [95]. Debido al carácter cruzado de la inmunización, no se puede utilizar con posterioridad ningún agente halogenado, salvo quizás el sevoflurano, cuyo metabolito es un hexafluoro-isopropanol, en teoría no inmunizante. Con excepción del halotano, no se ha descrito ningún caso de toxicidad hepática directa no inmunoalérgica con los otros agentes halogenados, incluido el sevoflurano administrado con un bajo flujo de gas fresco [59]. Después de una anestesia con halotano, hasta un 12% de los pacientes puede presentar una citólisis hepática biológica. La elevación de la a glutatión S-transferasa, que es un marcador muy sensible de toxicidad hepática, y que se observa en el 35-50% de los pacientes tras una anestesia con halotano, podría reflejar una afectación subclínica de incidencia muy superior [162] . En realidad, esta toxicidad se puede manifestar clínicamente por una ictericia postoperatoria en 1/282-1/4.000 casos. Las lesiones hepáticas serían secundarias a una formación excesiva de radicales libres (producidos por la alternancia bajo flujo hepáticoreperfusión) no depurados por el glutatión, cuyos depósitos están disminuidos en el metabolismo anaerobio del halotano [111]. Por el momento, no se ha podido demostrar formalmente este mecanismo de toxicidad hepática con el halotano, pero podría explicar la razón por la que los otros halogenados no son tóxicos para el hígado, ya que su metabolismo es débil y en él no interviene una vía reductora en anaerobiosis. Además, no alteran el flujo de perfusión hepática. Toxicidad renal De los agentes halogenados comercializados en la actualidad, sólo el enflurano tiene una nefrotoxicidad demostrada. Después de una anestesia prolongada con enflurano, se puede producir una tubulopatía proximal, a pesar de niveles de flúor en sangre bajos. En la clínica, esta tubulopatía se manifiesta mediante una alteración de la concentración de la orina, que puede evolucionar hacia una insuficiencia renal aguda. Los pacientes tratados con isoniacida, denominados «acetiladores lentos», son más sensibles a la toxicidad del enflurano que los pacientes «acetiladores rápidos». Todavía no se ha podido explicar el mecanismo de toxicidad de dicho Anestesia-Reanimación Anestésicos halogenados ¶ E – 36-285-A-10 agente. El metabolismo intrarrenal del enflurano mediado por un citocromo P450, presente en el riñón en altas concentraciones, podría causar una toxicidad análoga a la del metoxiflurano. Así pues, esta tubulopatía sólo se observa tras una anestesia prolongada con enflurano, cuya eliminación relacionada con el metabolismo podría estar aumentada. El sevoflurano se elimina sobre todo por la vía respiratoria, y sólo una pequeña parte es metabolizada por un citocromo P4502E1 en el hígado, y no en el riñón, como ocurre en la rata [77]. Por tanto, aunque su metabolismo genera concentraciones sanguíneas de fluoruros que antes se consideraban tóxicas (50 mmoles/l), no se ha descrito ningún caso de tubulopatía tras el empleo de sevoflurano en circuito abierto. Cuando se utiliza un circuito que permite la reinhalación de los gases, se considera que el compuesto A procedente de la degradación del sevoflurano es el responsable de la tubulopatía grave observada en la rata [35] . En el hombre, varios autores han descrito alteraciones analíticas mínimas, como la elevación urinaria de b2 microglobulina, N-acetil glucosaminidasa, a y p glutatión transferasa y una glucosuria y una proteinuria que reflejan una afección tubular subclínica. Estas modificaciones analíticas son de escasa cuantía, y totalmente reversibles de manera espontánea en el curso de los 5 días siguientes a la anestesia. Además, no se asocian a una elevación de la urea ni de la creatinina séricas, y carecen de relevancia clínica. Persiste, sin embargo, una duda sobre la toxicidad potencial del compuesto A en determinadas situaciones clínicas de riesgo, como la insuficiencia renal o en caso de administración concomitante de otros productos nefrotóxicos. Se sigue ignorando el mecanismo de estas alteraciones analíticas, aunque sí se conoce la toxicidad de los derivados alcanos y alquenos procedentes de la degradación y del metabolismo del compuesto A (cf supra). El bloqueo del transporte aniónico de dichos derivados en el interior del túbulo renal con el probenecid neutraliza esta toxicidad en la rata e impide la aparición de la proteinuria y la excreción de la b2 microglobulina, que son marcadores de afección tubular en el hombre [61]. Estos derivados, tóxicos en la rata, han sido identificados en el hombre, pero la relación de metabolitos tóxicos/no tóxicos es menor en el hombre que en ese animal [78]. Así pues, estos derivados alcanos y alquenos son metabolizados por una b-liasa muy presente en el riñón de la rata, pero no en el hombre [80]. Estos elementos permitirían explicar la diferencia de toxicidad entre las especies. La mayor producción de compuesto A con la cal sodada seca justifica que no se desequen los circuitos con un flujo de gas fresco prolongado [49]. Hace poco, la supresión de las bases fuertes presentes en la cal, como el hidróxido de potasio y, sobre todo, la sosa, ha permitido reducir e incluso eliminar completamente la degradación de los halogenados en compuesto A en el caso del sevoflurano, en compuesto BCDE en el del halotano, y en monóxido de carbono con el desflurano, enflurano e isoflurano [102]. Con el uso de este tipo de cal se podría poner término a cualquier polémica relativa a los efectos tóxicos de los productos de degradación de los halogenados por la cal sodada. Sin embargo, su elevado coste y su menor capacidad para absorber el CO2 (50%) son inconvenientes que frenan su empleo, porque además no se ha demostrado la toxicidad de estos productos de degradación [58]. Además, aunque la toxicidad renal del compuesto A sigue siendo controvertida, en ninguna publicación (ni siquiera en las que confirman una toxicidad del compuesto A) se observan trastornos de la concentración de la orina ni alteraciones de la creatinina o de la urea en sangre [43]. Tampoco se ha podido demostrar una relación de causa-efecto. Por tanto, la presencia de estos marcadores de afección tubular Anestesia-Reanimación también podría deberse a la naturaleza de la intervención, a una hipotensión asociada o a una hipovolemia [34, 57]. La proteinuria, la glucosuria y la albuminuria son similares después de anestesias de 2 a más de 8 horas con sevoflurano, desflurano o propofol [34, 76]. Las modificaciones analíticas menores, que indicarían una afección tubular, no se acentúan cuando se administra Ketorolac [85]. Después de una cirugía asociada a una elevada incidencia de disfunción renal postoperatoria, como la cirugía cardíaca, las alteraciones de la función renal evaluadas por las variaciones de la creatininemia son similares cuando la anestesia se ha mantenido con propofol, isoflurano y sevoflurano [135]. Por último, pacientes con insuficiencia renal moderada han sido anestesiados con sevoflurano, y su función renal no se ha agravado. Esta última era similar a la observada en pacientes anestesiados con isoflurano [21, 22, 60]. Otras toxicidades Aunque los agentes halogenados pueden inducir anomalías cromosómicas o embrionarias en cultivos celulares o en modelos animales, estos modelos experimentales no tienen ninguna relevancia clínica. Esto explica que, hasta la fecha, no se haya podido demostrar ningún efecto teratógeno o mutágeno en mujeres embarazadas anestesiadas con agentes halogenados o que trabajen en quirófanos. ■ Mecanismo de acción Las técnicas médicas de diagnóstico por imagen, como la tomografía por emisión de positrones y la resonancia magnética, han demostrado que los agentes halogenados modifican la actividad metabólica cerebral de zonas específicas del cerebro como el tálamo y la formación reticular [2]. Estas observaciones sugieren que el efecto anestésico de los agentes halogenados se debe a una modificación del funcionamiento fisiológico de neuronas cerebrales de zonas específicas. Además de esta actividad cortical, los agentes halogenados también inhiben la actividad neuronal de la médula, bloqueando la transmisión sináptica de las vías somestésicas y motoras. El efecto hipnótico global de los agentes halogenados se debe al efecto combinado sobre las estructuras medulares y supramedulares. Así, la CAM de los halogenados está aumentada en el animal cuando su circulación medular ha sido aislada y ya no se encuentra sometida al efecto de los agentes anestésicos. A nivel de la neurona, los agentes halogenados inhiben in vitro la transmisión del impulso en la sinapsis y, con concentraciones más altas, la propagación axonal del impulso nervioso [68, 86]. Esta inhibición se traduce en una disminución en la liberación de catecolaminas, de glutamato [44] o, por el contrario, en un aumento de glutamato en ciertas poblaciones neuronales. Esto último podría explicar el efecto excitante o las convulsiones inducidas por determinados halogenados, como el enflurano. Los halogenados utilizados para la anestesia potencian el efecto inhibidor del ácido gamma-amino-butírico (GABA) sobre la frecuencia de descarga espontánea de las neuronas corticales [3] . En cambio, los agentes halogenados que carecen de efecto anestésico no tienen esta propiedad. Los agentes halogenados aumentan además la sensibilidad de los receptores del GABA frente a sus agonistas, y prolongan la desensibilización de dichos receptores [90]. Esta acción sobre los receptores del GABA se traduce en la clínica en una potenciación de los halogenados con las benzodiazepinas. También intervienen otros receptores; los agentes anestésicos halogenados desensibilizan el receptor nicotínico de la acetilcolina (receptor que pertenece a la misma familia que el receptor gabaérgico), al contrario de lo que ocurre con los agentes halogenados no anestésicos [121]. Asimismo, se observa un efecto similar en los receptores muscarínicos. Las neuronas 9 E – 36-285-A-10 ¶ Anestésicos halogenados gliales podrían intervenir de igual manera en el efecto hipnótico de los halogenados, como indica el incremento de captación de glutamato por los astrocitos [100] . Las modificaciones en el funcionamiento de las neuronas corticales y gliales, inducidas por los agentes halogenados, podrían estar relacionadas con las modificaciones del flujo de potasio (aumento de la conductancia iónica de sus canales, corriente de fuga) y/o con una hiperpolarización de la membrana [124, 125, 151] . Se han propuesto numerosas hipótesis para explicar los mecanismos de acción de los halogenados sobre la membrana. La relación existente entre liposolubilidad y potencia de un anestésico halogenado, conocida como ley de Meyer-Overton, sugería una acción directa de estos agentes sobre las membranas celulares. Esta hipótesis, que sugiere un punto de acción hidrófobo y unitario para los halogenados, es sin duda atractiva, pero adolece de numerosas excepciones. De lo contrario, ¿cómo se explica la diferencia de eficacia entre los distintos isómeros (enflurano e isoflurano), el efecto convulsivante inducido por la localización terminal de la halogenación, o la desaparición del efecto, debida al aumento del tamaño del esqueleto del hidrocarburo? Tampoco permite explicar el determinismo genético en la acción de los halogenados, origen de las diferencias entre las personas o ligadas al sexo. Aún se ignora el sitio de acción de los halogenados a nivel de la membrana. Varios puntos de acción, sobre todo proteicos, podrían explicar la acción anestésica de los agentes halogenados [101]. En la actualidad existen dos hipótesis predominantes. Al modificar la conformación de la doble capa lipídica, los agentes halogenados podrían alterar el funcionamiento de ciertos receptores de membrana de naturaleza proteica, como el de las lisofosfatidasas [16] y, por tanto, la transmisión transmembrana de la señal. La ausencia de efecto de la conformación estereoespecífica del agente halogenado contradice esta teoría [38] . Según otra hipótesis, la fijación directa intramembrana del agente sobre las proteínas (incluso en el interior) de los canales iónicos sería la responsable de la modificación en el funcionamiento del receptor del GABA o de la acetilcolina. clínico, como la CAM de despertar (igual a 0,3 CAM) o la que bloquea la respuesta hemodinámica a la intubación (CAM-BAR igual a 1,5 CAM). La CAM se reduce con el paso de los años y varía según la edad de los niños (Cuadro III). La CAM también está disminuida en caso de hipotermia y en la mujer embarazada [117] . Asimismo, la CAM se reduce cuando se añaden N2O y morfínicos. El efecto del N2O sobre la CAM es aditivo, por lo que se debe calcular la concentración alveolar eficaz en presencia de N2O para evitar una sobredosificación. Por encima de una concentración alveolar del 50%, se ha observado un efecto antagonista que justifica el que no se administren estas concentraciones de N2O. La asociación de morfínicos, por el contrario, tiene un efecto sinérgico dependiente de la dosis. Esta sinergia entre halogenado y morfínico permite reducir la concentración del anestésico, su coste y el riesgo de acumulación durante una anestesia equilibrada. Sin embargo, como los morfínicos no son hipnóticos, no se debe disminuir la concentración de final de espiración por debajo de un determinado umbral, debido al riesgo de memorización. Este umbral de concentración, que sólo se ha evaluado con el isoflurano, es de aproximadamente 0,6 CAM [33]. Los efectos sobre la actividad eléctrica del cerebro dependen de la concentración del agente halogenado. Así, con dosis crecientes de anestésicos volátiles, el ritmo a se sustituya de forma progresiva por ondas lentas d, y luego por fases de silencio eléctrico, que aparecen con una concentración de halotano del 4% y del 3% con el isoflurano. Estos datos electrofisiológicos pueden servir para medir la profundidad de anestesia, sobre todo con el índice biespectral (BIS). Sin embargo, la medida puede estar falseada porque el enflurano es epileptógeno a partir del 2,5% y durante la inducción con sevoflurano, en condiciones de hipocapnia o de hiperventilación, se han descrito casos de actividad punta-onda no disociables de los observados durante una crisis comicial (por encima de aproximadamente 2 CAM, cf infra) [144, 160] . Esta actividad se puede traducir en un aumento artificial de los valores del BIS. Además, el N 2 O no modifica el BIS, por lo que la evaluación de la profundidad de la anestesia con el BIS es discutible cuando los efectos del N2O se suman a los de los halogenados [23]. Por último, un aumento de las concentraciones de isoflurano puede traducirse en una elevación paradójica de los valores del BIS [29] . La capacidad para predecir el nivel de sedación o la reacción a la incisión quirúrgica mediante el BIS es menor cuando se administra sevoflurano que con el propofol [65, 83]. Estos datos explican el motivo por el que la indicación de la monitorización con el BIS de una anestesia con halogenados es limitada cuando se mide la concentración de fin de espiración. Sí se ha propuesto, en cambio, el empleo del BIS durante la inducción anestésica con halogenados, ya que en esta fase las concentraciones al final de la espiración no permiten calcular la concentración cerebral. Por desgracia, la ■ Efectos farmacodinámicos Efecto hipnótico y efecto sobre el electroencefalograma Los efectos hipnóticos de los agentes halogenados dependen de la dosis, y se miden por la CAM, que se define como la concentración alveolar con la que el 50% de los pacientes no se mueve en el momento de la incisión quirúrgica (Cuadro III). Más adaptada a los objetivos clínicos, la CAM95 representa la concentración con la que el 95% de los pacientes no se mueve en el momento de la incisión quirúrgica. La CAM95 llega a 1,2-1,3 CAM. Se han definido otras CAM, específicas de cada objetivo Cuadro III. Concentración alveolar mínima de los halogenados. a b Adulto + 60% protóxido de nitrógeno Recién nacido 0 meses.1 año Niño 1% 0,9% Halotano 0,75% 0,29% Enflurano 1,68% 0,6% / Isoflurano 1,15% 0,5% 1,6 1,87 1,6% 1, 05% Sevoflurano 2,05% 1% 3% 3% 2,6% 1,45% Desflurano 6% (7,25% a) 2,83% (4% a) 9,16% 10% 8% 5,17% Protóxido de nitrógeno 104% 2-2,5% Personas de edad avanzada 0,64% b 1,55% 18-3 años. edad >3 años. 10 Anestesia-Reanimación Anestésicos halogenados ¶ E – 36-285-A-10 medida del BIS no permite predecir la aparición de movimientos durante la inducción o la intubación. Sin embargo, gracias al uso del BIS, es posible reducir el consumo de agentes halogenados y el tiempo para el despertar [159]. Sin embargo, la reducción de este tiempo gracias al empleo del BIS bastaría para evitar el paso de los pacientes anestesiados con sevoflurano a una sala de recuperación [1]. La profundidad de la anestesia también se puede evaluar mediante el análisis de los potenciales evocados auditivos de latencia media, que son bloqueados por los agentes halogenados de forma dependiente de la dosis. Para evaluar el nivel de sedación o la reacción motora a la incisión quirúrgica, el análisis global del trazado permite obtener un índice menos fiable que la concentración de final de espiración [83]. La aparición de una actividad punta-onda cuando se administran sevoflurano y enflurano se observa con altas concentraciones. Con las concentraciones utilizadas durante el mantenimiento de la anestesia, Artru et al no encuentran evidencia de actividad punta-onda en pacientes de neurocirugía [6]. El isoflurano, el desflurano y el sevoflurano no se consideran proconvulsivantes cuando se usan para el mantenimiento de la anestesia. Los agentes halogenados, como el N2O, prolongan la latencia de los potenciales auditivos de latencia media de forma proporcional a su concentración. Los agentes halogenados, como el N2O, prolongan la latencia y disminuyen la amplitud de los potenciales evocados motores y somestésicos de latencia media, lo que limita su uso cuando es necesaria una monitorización medular en cirugía de la columna vertebral o de la médula. Por encima de 1 CAM, estos potenciales desaparecen. Este efecto medular, que refleja un efecto combinado de los halogenados a nivel espinal y cortical, se resuelve aquí. Además, permitiría explicar por qué la inmovilidad quirúrgica es mayor cuando se mantiene la anestesia con agentes halogenados que cuando se emplean anestésicos intravenosos. Efectos analgésicos Los halogenados no poseen efecto analgésico. Sin embargo, se aprovecha la potenciación existente entre anestésicos halogenados y morfínicos para obtener la inmovilidad quirúrgica (cf noción de CAM). Los agentes halogenados podrían controlar la integración del fenómeno doloroso, ya que tanto el sevoflurano como el halotano reducen el flujo sanguíneo cerebral evaluado mediante tomografía por emisión de positrones, en concreto a nivel del tálamo. Paradójicamente, los halogenados tendrían efectos antianalgésicos a una concentración de 0,1 CAM [163]. Flujo sanguíneo cerebral, presión intracraneal y consumo de oxígeno cerebral Los agentes halogenados aumentan de forma global el flujo sanguíneo cerebral por su efecto vasodilatador. Este efecto es más marcado con el halotano (× 2) y con el enflurano (× 1,5). En el adulto, la regulación del flujo sanguíneo cerebral en respuesta a las variaciones de PaCO2 se mantiene con el isoflurano, el desflurano y el sevoflurano hasta 2 CAM, pero no con el enflurano y el halotano utilizados en concentraciones clínicas [113]. Así pues, con una hiperventilación moderada y una presión arterial media estable, el flujo sanguíneo cerebral se mantiene con 1 CAM de estos agentes anestésicos [84] . En cambio, la autorregulación en respuesta a la hipercapnia se encuentra limitada, sobre todo en el niño, a partir de 1,5 CAM de desflurano [94] . Por tanto, el Anestesia-Reanimación umbral medio de hipercapnia a partir del cual la autorregulación del flujo sanguíneo cerebral está abolida se sitúa en un presión media de 56 mmHg [96] . En la inducción con máscara, la autorregulación se altera por las fuertes concentraciones de sevoflurano y por la hipercapnia secundaria a la hipoventilación, de ahí que esté totalmente contraindicada en pacientes que presenten una hipertensión intracraneal. En presencia de agentes halogenados como el isoflurano, la asociación de N2O aumenta el flujo sanguíneo cerebral de las personas sanas, así como el de pacientes operados de tumores cerebrales. Las consecuencias de este aumento suplementario de flujo sanguíneo cerebral, inducido por los halogenados y el N2O, son variables y dependen de la reserva de distensibilidad del tejido cerebral en el interior de la bóveda craneal. Si no hay una afección cerebral o una elevación de la presión intracraneal y la expansión cerebral es posible, la administración de N 2 O y de halogenados no tiene consecuencias sobre la presión intracraneal. En cambio, si existe una elevación previa de la presión intracraneal, el aumento del flujo sanguíneo cerebral inducido por la asociación N2O-halogenados puede acompañarse de una elevación de la presión intracraneal por encima de las reservas de distensibilidades. Todd et al han observado una elevación de la presión intracraneal superior a 24 mmHg en pacientes operados de tumores cerebrales y que recibieron una asociación de isoflurano-N2O [142]. Por todo ello, cuando no hay monitorización, y sobre todo en urgencias, la administración de agentes halogenados está formalmente contraindicada si existe una hipertensión intracraneal. Por el contrario, cuando no existe efecto masa en la TC, la administración de desflurano o de isoflurano no se acompaña de una elevación de la presión intracraneal en pacientes operados de tumores cerebrales supratentoriales [53]. Los agentes halogenados modifican la distribución del flujo sanguíneo cerebral por las distintas zonas del cerebro. Los estudios realizados con tomografía por emisión de positrones muestran una redistribución subcortical del flujo sanguíneo y una reducción del flujo en el tálamo, en las amígdalas cerebelosas y en el lóbulo parietal a 1 CAM de sevoflurano, y más tarde en el frontal a 2 CAM. El enflurano, con independencia de sus efectos sobre el flujo y el volumen sanguíneo cerebral, puede elevar la presión intracraneal por aumento del volumen del líquido cefalorraquídeo [7]. Este efecto, observado en principio con el desflurano, no se ha vuelto a observar recientemente en condiciones de hipocapnia moderada con y sin N2O asociado, por lo que este agente no se halla contraindicado en la cirugía de tumores cerebrales sin efecto de masa. Todos los agentes halogenados disminuyen los consumos cerebrales de oxígeno y de glucosa, al mismo tiempo que reducen la actividad eléctrica y, por dicha razón, se consideran neuroprotectores cerebrales [88, 99]. De modo experimental, este efecto neuroprotector ha sido demostrado por una recuperación más rápida de los depósitos intracelulares de adenosintrifosfato y por una menor extensión de las lesiones inducidas por la isquemia. En la práctica clínica, no se ha descrito este efecto neuroprotector. Efectos respiratorios Los agentes halogenados deprimen la respuesta ventilatoria a la hipoxia y a la hipercapnia con un efecto dependiente de la dosis. La respuesta a la hipoxia se altera a partir de 0,1 CAM de agente halogenado, y desaparece por encima de 1,1 CAM de halogenados. A causa de dicho efecto, está justificado mantener la oxigenoterapia durante los 30 minutos siguientes a una anestesia. La alteración de la respuesta ventilatoria a la 11 12 Isoflurano Sevoflurano Halotano Enflurano 20 15 * * * * * * 10 * * 5 * * * * * * * 0 -5 -10 0 1 2 3 4 5 0,9 CAM Variación de la presión arterial sistólica (mmHg) hipercapnia es más marcada con el desflurano y el enflurano, intermedia con el isoflurano, y menor con el sevoflurano y el halotano. En ventilación espontánea y sin morfínicos ni estimulación quirúrgica, la PaCO2 que refleja estos efectos alcanza una media de 50-55 mmHg para 1 CAM de isoflurano y de desflurano, 45 mmHg para 1 CAM de sevoflurano y de halotano y 60 mmHg para 1 CAM de enflurano [12]. Tales efectos disminuyen con la duración de la exposición y con la estimulación quirúrgica. Por encima de 1 CAM, el halotano tiene un efecto depresor menor que el sevoflurano, pero los pacientes que tienen una disminución de la ventilación minuto superior al 30% son menos numerosos cuando se administran 2 CAM de sevoflurano que cuando se administran 2 CAM de halotano. La alteración de la respuesta ventilatoria a la hipercapnia es más marcada en pacientes con EPOC o con insuficiencia respiratoria, pacientes que en su mayoría no pueden ser anestesiados en ventilación espontánea, porque además su umbral de apnea también es más elevado. Al actuar sobre los centros respiratorios, los agentes halogenados modifican la acción de los distintos músculos que intervienen en la respiración. La disminución de la fuerza contráctil del diafragma, menos marcada que la de los músculos intercostales, provoca una respiración paradójica. Esta última es más débil con el halotano y el sevoflurano que con los otros agentes anestésicos. Aunque la hipercapnia es similar bajo sevoflurano y halotano, la reducción más marcada de la ventilación minuto y de la frecuencia respiratoria con el sevoflurano hace pensar que este agente tiene un efecto diferente sobre los centros respiratorios en el lactante [12]. La obtención de un pico de flujo espiratorio más rápidamente con el sevoflurano podría explicar tales diferencias. La reducción de la capacidad residual funcional produce atelectasias e hipoxemia [31]. Con concentraciones bajas, la disminución del volumen corriente inducida por la alteración de la fuerza contráctil del diafragma se encuentra compensada por el aumento de la frecuencia respiratoria, pero, por encima de 1 CAM, el volumen minuto disminuye. La reducción del volumen pulmonar, secundaria a la disminución de la capacidad residual funcional, induce una elevación de las resistencias respiratorias y un aumento del trabajo respiratorio. Los pacientes que tienen un trabajo respiratorio de base elevado, como aquellos que padecen una enfermedad pulmonar obstructiva crónica (EPOC), una estenosis traqueal y los niños, toleran muy mal dichas alteraciones. Los agentes anestésicos halogenados son broncodilatadores. En el animal, en caso de broncoespasmo de origen inmunoalérgico, 1 CAM de sevoflurano o de halotano tiene los mismos efectos broncodilatadores. Cuando la broncoconstricción está inducida por la histamina, el halotano posee un efecto broncodilatador más marcado por una mayor inhibición de la entrada de calcio [62]. Por el contrario, otros autores observan un efecto broncodilatador menos marcado con el halotano que con el desflurano y el sevoflurano, cuando la broncoconstricción está inducida por el leucotrieno C4 [150]. Algunos autores consideran que el desflurano posee un efecto broncodilatador menos marcado que los otros agentes halogenados, posiblemente debido a su carácter irritante de las vías respiratorias. Este carácter irritante, mayor en los fumadores y dependiente de la dosis, no se traduce en una menor tolerancia de la mascarilla laríngea [56]. En la práctica clínica, no existe un argumento formal que favorezca el uso de un agente halogenado específico en el paciente asmático. En preparaciones in vitro de tejido pulmonar aislado, los agentes anestésicos por inhalación deprimen con efecto dependiente de la dosis la vasoconstricción pulmonar hipóxica. Este efecto no se observa ni en el animal ni en el hombre cuando se utilizan los tres agentes (isoflurano, desflurano, sevoflurano) en cirugía con exclusión pulmonar [74, 75, 147]. Variación de la frecuencia cardíaca (lpm) E – 36-285-A-10 ¶ Anestésicos halogenados 5 6 7 8 9 10 10 11 12 13 1415 1,8 CAM 2,7 CAM A 15 * 10 5 0 -5 -10 -15 * * * * * * * * * * * * * * * * * * * * * * * * -20 0 1 2 3 4 5 0,9 CAM 5 6 7 8 9 10 10 11 12 13 1415 1,8 CAM 2,7 CAM B Figura 10. Efecto de los agentes halogenados sobre la presión arterial media y sobre la frecuencia cardíaca a 0,9, 1,8 y 2,7 CAM (A, B). Efectos cardiocirculatorios Efectos generales Los agentes halogenados disminuyen la presión arterial, y este efecto es dependiente de la dosis. Esto se debe a un efecto vasodilatador periférico que es más marcado con el isoflurano y el sevoflurano que con el desflurano. La caída de la presión arterial observada con el halotano se debe a su efecto depresor miocárdico, ya que no es vasodilatador. Dicho efecto vasodilatador puede tener dos consecuencias, sobre todo ante concentraciones elevadas de halogenados: por una parte, la reducción de la poscarga del ventrículo izquierdo permite mantener el gasto cardíaco pese al efecto inótropo negativo de los halogenados; por otra, por encima de 1,5 CAM de sevoflurano y de isoflurano se produce una taquicardia reactiva secundaria a la respuesta barorrefleja, cuando ésta se halla conservada, sobre todo en el paciente joven. En cambio, esta taquicardia es menos marcada en los pacientes mayores, ya que la respuesta barorrefleja es menor a causa de la edad. Dicha taquicardia reactiva es más intensa con el isoflurano y el sevoflurano (Fig. 10) [112]. Bajo isoflurano, ésta puede atenuar los efectos de la hipotensión controlada. Durante la inducción con máscara mediante sevoflurano y sin adyuvante ni premedicación, esta taquicardia reactiva podría encontrarse asociada a la actividad cerebral punta-onda descrita por algunos autores, lo que puede constituir una contraindicación para los pacientes con riesgo coronario, aunque se ignora su incidencia real. La taquicardia reactiva observada con más de 1 CAM de desflurano se asocia a la estimulación simpática inducida por el efecto irritante de dicho éter sobre los bronquios [149]. Esta reacción, observada también con mayor frecuencia en el paciente joven, se inhibe con la administración de morfínicos, clonidina, b-bloqueante y N2O. No refleja una menor profundidad de anestesia, pero obliga a reducir las concentraciones proporcionadas por el vaporizador. Anestesia-Reanimación Anestésicos halogenados ¶ E – 36-285-A-10 Aparte de estas taquicardias reactivas, los halogenados disminuyen la frecuencia cardíaca a través de varios mecanismos: efecto batmótropo negativo directo de los halogenados sobre el nodo sinoauricular (origen de ritmos de escape de la unión, sobre todo con el halotano, el desflurano y el sevoflurano), efecto parasimpaticomimético (sobre todo durante la inducción con halotano en el niño, que justifica una premedicación parasimpaticolítica) [20], efecto simpaticolítico. Se han descrito bradicardias graves (incluso asistolia) durante la inducción con sevoflurano a altas concentraciones y morfínicos asociados de acción rápida (como el remifentanilo). Esto se puede explicar, no por un efecto más marcado sobre el tejido de conducción, sino por una sobredosis relacionada con la forma de administración (altas concentraciones de agente halogenado), por la sinergia entre opiáceos y halogenados sobre la frecuencia cardíaca, así como por la cinética rápida del agente halogenado y del morfínico [27]. Durante el mantenimiento de la anestesia con concentraciones más bajas de halogenados, la frecuencia cardíaca es más baja con el sevoflurano que con el isoflurano cuando se mantiene constante la presión arterial haciendo variar la concentración alveolar alrededor de 1 CAM [55]. Algunos autores observan una caída más significativa de la presión con el isoflurano que con el sevoflurano, a pesar de tener un efecto vasodilatador similar [126, 127, 140]. El efecto vasodilatador del desflurano es menos marcado que el del isoflurano. Aunque estas diferencias se han observado en condiciones específicas, los estudios clínicos multicéntricos realizados con halogenados asociados a morfínicos y a N 2 O no encuentran ninguna diferencia de presión arterial ni de frecuencia cardíaca en pacientes coronarios y/o hipertensos, en los que la anestesia se mantiene con isoflurano, sevoflurano o desflurano [14, 128, 132]. En el niño menor de 1 año, los efectos del sevoflurano sobre la presión arterial son menos marcados que los del halotano. No obstante, cuando se administra sevoflurano, la presión arterial media disminuye porque la frecuencia cardíaca basal, fisiológicamente más elevada, no puede aumentar [89]. Cuando existe una cardiopatía congénita en el niño, los episodios de hipotensión grave son dos veces más frecuentes con el halotano que con el sevoflurano, aunque se utilicen más medicamentos vasopresores [129]. Eso se debe a que el sevoflurano tiene un efecto depresor miocárdico menor, o incluso nulo, si se compara con el halotano (cf infra). Respuesta barorrefleja y sistema nervioso autónomo Los agentes halogenados deprimen la respuesta barorrefleja. La disminución de la pendiente de dicha respuesta y el desplazamiento de su umbral hacia presiones más bajas contribuyen a la mala tolerancia hemodinámica de los halogenados en pacientes en estado de choque. La alteración de la respuesta barorrefleja es mayor con el halotano y el enflurano que con el isoflurano, el desflurano y el sevoflurano. Tanto con el isoflurano como con el sevoflurano, la sensibilidad de la respuesta barorrefleja se reduce entre un 50-60%, y sólo se recupera pasados 120 minutos en presencia de hipertensión, y al cabo de 60 minutos en caso de hipotensión [105]. Los agentes halogenados disminuyen la actividad del sistema nervioso simpático durante el mantenimiento de la anestesia, y también cuando se aumentan de forma brusca las concentraciones de sevoflurano [103]. Sin embargo, el marcado aumento de la frecuencia cardíaca, observado en el adulto durante la inducción por inhalación con sevoflurano, se podría explicar por una activación del sistema simpático o por una disminución más intensa de la actividad del sistema parasimpático. Este efecto, también observado en el Anestesia-Reanimación niño, permite prescindir de la premedicación parasimpaticolítica, necesaria con el halotano [20]. Contractilidad y gasto cardíaco Los agentes halogenados tienen un efecto inótropo negativo directo sobre las fibras miocárdicas. La alteración de la contractilidad se debe a una disminución de la duración del potencial de acción de la fibra miocárdica secundaria a una reducción de un 25% de los flujos de calcio entrante y de potasio saliente [118]. Dicho efecto es más marcado con el halotano y con el enflurano que con el isoflurano, el desflurano y el sevoflurano, de efectos cardiovasculares similares. La disminución de la contractilidad se acompaña de una reducción del consumo de oxígeno por parte del miocardio. Con independencia de cualquier variación de frecuencia cardíaca, y a pesar de la disminución de la contractilidad, el flujo cardíaco se mantiene con isoflurano, desflurano y sevoflurano hasta 2 CAM gracias a la reducción de la poscarga secundaria al efecto vasodilatador. La elevación de la frecuencia cardíaca con concentraciones más elevadas contribuye al mantenimiento del flujo cardíaco. El mantenimiento de dicho flujo y de la función sistólica, cuando se administra desflurano, depende también del mantenimiento o de la activación del sistema simpático. Así pues, cuando se administra un b-bloqueante, la función sistólica se altera más con el desflurano que con el sevoflurano o el isoflurano. La función diastólica también se encuentra disminuida bajo halogenados, con independencia de la actividad del sistema nervioso autónomo; esto posiblemente suceda porque durante la relajación los halogenados ralentizan la recaptación del calcio por el retículo sarcoplásmico. La disminución de la función diastólica es algo más significativa con el desflurano que con el isoflurano y el sevoflurano, debido al menor efecto vasodilatador del primero. En el niño y en el recién nacido anestesiados con 1 y 1,5 CAM de sevoflurano, el índice cardíaco y la contractilidad del miocardio, evaluados por ecocardiografía, están conservados, a diferencia de lo que ocurre con el halotano [152]. Esta ventaja hemodinámica, más que el argumento farmacocinético, aconseja el uso del sevoflurano en tales casos. Automatismo, conducción, trastornos del ritmo El desflurano y el isoflurano disminuyen de forma similar el potencial de acción de las células automáticas del nodo auricular, pero menos que el halotano [120]. Los agentes halogenados pueden alterar la conducción intracardíaca. Este efecto es más marcado con el enflurano y con el halotano, y menor con los otros halogenados, con los que sólo aparece con concentraciones superiores a 2 CAM. El período refractario efectivo se encuentra disminuido con el desflurano, mientras que está alargado con el isoflurano [120]. El desflurano y el isoflurano tienen un efecto similar sobre el nodo auriculoventricular [120]. El halotano y, en menor medida, el enflurano, sensibilizan el miocardio al efecto proarritmógeno de la adrenalina. Este efecto, que provoca trastornos del ritmo ventricular, no se observa o es excepcional con el isoflurano, el desflurano y el sevoflurano. Cuando aparecen estas anomalías (que son excepcionales), hay que cambiar de técnica anestésica. Desde el punto de vista clínico, la incidencia de los trastornos del ritmo ventricular en pacientes coronarios sometidos a una anestesia «equilibrada o balanceada» es similar con los tres halogenados: isoflurano, desflurano o sevoflurano [128] . En el niño, la incidencia de los trastornos del ritmo es menor con el sevoflurano que con el halotano. Por tanto, en cirugía otorrinolaringológica, sólo uno de cada 22 niños desarrolla un ritmo nodal con sevoflurano, mientras que bajo halotano, 12 niños de un grupo de 18 presentan un ritmo nodal 13 E – 36-285-A-10 ¶ Anestésicos halogenados o extrasístoles ventriculares [67, 103] . Recientemente, Loeckinger et al han observado en lactantes menores de 6 meses un alargamiento del espacio QT durante la anestesia con sevoflurano [93]. Este alargamiento, responsable en potencia de trastornos paroxísticos del ritmo ventricular, justifica una vigilancia cardiovascular prolongada hasta su normalización. En la práctica, esta recomendación sólo tiene consecuencias clínicas en caso de alargamiento congénito del intervalo QT, o en lactantes portadores de una cardiopatía congénita. Una CAM de sevoflurano no tiene ningún efecto sobre el período refractario de las vías de conducción auriculoventricular, o de las vías accesorias, en caso de síndrome de WolfParkinson-White [134]. Con el enflurano, el alargamiento de la conducción se produce sobre todo en esta vía accesoria, y el intervalo de acoplamiento entre las dos vías no está modificado. Por tanto, el uso del enflurano sería más aconsejable en los pacientes que presentan un trastorno de conducción de este tipo. En cambio, con el isoflurano y con el halotano, el alargamiento del intervalo de acoplamiento puede favorecer la aparición de arritmia y una taquicardia por reentrada. Circulaciones coronaria y locales En un corazón aislado, los agentes halogenados provocan una vasodilatación de la circulación coronaria y un aumento del flujo coronario por incorporación de la reserva coronaria. Asimismo, en condiciones experimentales, el efecto vasodilatador predomina sobre la macrocirculación con el isoflurano, mientras que con el sevoflurano, la vasodilatación afecta también a la microcirculación. Al mismo tiempo, el consumo de oxígeno del miocardio disminuye, de ahí que los agentes halogenados tengan un efecto cardioprotector que se traduce en la reducción en la producción de lactatos, medida en el seno coronario. En la práctica, los riesgos de isquemia coronaria dependen asimismo de los efectos hemodinámicos generales, por lo que no se recomienda el uso de enflurano y de halotano en enfermos coronarios. Con el isoflurano se han descrito síndromes de robo coronario, debido a su efecto vasodilatador sobre la macrocirculación, pero sólo en enfermos que presentaban una afección coronaria tritroncular [106]. Aparte de esta circunstancia concreta, los efectos clínicos del isoflurano, el desflurano y el sevoflurano sobre la presión arterial y sobre el porcentaje de isquemia perioperatoria en los pacientes coronarios son similares [36]. Así, las variaciones hemodinámicas y los episodios perioperatorios de isquemia coronaria, en pacientes coronarios sometidos a una intervención de cualquier tipo, son de la misma intensidad y duración con los tres agentes anestésicos administrados para el mantenimiento de la anestesia. Si se compara con el etomidato, el sevoflurano al 8% asociado a 3 mg/kg de fentanilo permite la inducción de la anestesia en un tiempo y unas condiciones hemodinámicas y respiratorias similares en pacientes sometidos a cirugía cardíaca [30]. Los halogenados como el halotano, el isoflurano y el desflurano también podrían emplearse en cirugía cardíaca para «preacondicionar» el miocardio, a fin de mejorar el rendimiento miocárdico al interrumpir la circulación extracorpórea [97, 148]. En la reperfusión después de una isquemia coronaria en el perro, la recuperación de la función sistólica es más rápida con el sevoflurano que con el propofol cuando esta función se mide por la fracción de acortamiento de superficie [97] . Se han descrito observaciones similares con el desflurano y el isoflurano. Estudios realizados recientemente, pero con pocos casos, confirman una mejoría del rendimiento miocárdico después de cirugía coronaria cuando se utilizan halogenados como el sevoflurano y el desflurano durante toda la anestesia. Quedan por determinar el tipo y la concentración del agente más conveniente para esta indicación. 14 Se han estudiado poco los efectos de los agentes halogenados sobre el resto de circulaciones periféricas. Los halogenados alteran la reactividad de la arteria mesentérica a la noradrenalina y a la acetilcolina. Varios trabajos muestran una disminución del pH intramucoso tras la administración de halogenados como el sevoflurano y el isoflurano; esto podría deberse a una isquemia mesentérica cuyo origen no se ha podido establecer (efectos generales o locales del agente halogenado, efecto de la cirugía y de la hemorragia asociada) [130]. El isoflurano, el desflurano y el sevoflurano alteran poco o nada el flujo sanguíneo hepático, a diferencia de lo que se observa con el halotano [72, 115, 148]. Otros efectos Efectos sobre las fibras musculares Los agentes halogenados potencian los curares por un efecto directo sobre el músculo. El efecto del N 2 O asociado a estos bloqueantes neuromusculares es menor que el de los agentes halogenados. Esta potenciación varía con el tipo de halogenado y de curare utilizados. Con frecuencia, los resultados de los distintos estudios publicados son contradictorios. Esto ocurre, por ejemplo, con el rocuronio y el isoflurano, con los que algunos autores observan una potenciación del 60% y otros ninguna, mientras que la mayoría registran una potenciación de los curares más marcada con el isoflurano que con el halotano y el enflurano [133, 155, 156]. El desflurano y el sevoflurano potencian con más intensidad que el isoflurano la curarización inducida por el cisatracurio y el rocuronio [154-156]. La cinética de los gases, que es muy lenta en el compartimento muscular, podría explicar esta diferencia de resultados entre los halogenados y entre los estudios realizados con un mismo halogenado. Dicha potenciación se traduce en la disminución o el espaciamiento de las dosis administradas en bolos o en perfusión continua, necesarias para mantener constante un determinado nivel de relajación muscular. Esta reducción puede llegar al 40-50% con el isoflurano y el sevoflurano, sobre todo. Debido a la gran variabilidad de los resultados publicados, se recomienda adaptar las dosis en función de una monitorización estricta de la curarización. Asimismo, el aumento del tiempo de acción de los curares después de un bolo único, o al interrumpir la perfusión, varía mucho según las fuentes. Aquí también se debe monitorizar la curarización, para decidir si se tienen que reinyectar o no curares, o si hay que antagonizarlos al final de la intervención. Al final del acto quirúrgico, la neostigmina actúa al cabo de un tiempo dos veces superior en presencia de agentes halogenados, como el sevoflurano y el isoflurano [123]. Los agentes halogenados también contribuyen a la inmovilidad quirúrgica por depresión de la actividad de las neuronas motoras espinales [122]. Así, los halogenados limitan la aparición de movimientos durante la intervención, sobre todo en pacientes en los que hay que limitar la curarización, como es el caso de los que padecen una miastenia. Todos los agentes anestésicos halogenados pueden desencadenar una crisis de hipertermia maligna en pacientes considerados «HMS» (portadores del gen de la hipertermia maligna), y en los que padecen una miopatía como la central core disease o la enfermedad de Duchenne de Boulogne (así como un gran número de enfermedades musculares hereditarias). La crisis puede aparecer con retraso, como ocurrió en una anestesia con desflurano, en la que la crisis se manifestó a los 180 minutos [64]. En dichos pacientes están absolutamente contraindicados todos los agentes halogenados. Todos los agentes halogenados relajan la musculatura lisa uterina de forma proporcional a su concentración. Cuando la concentración es moderada (<2 CAM), este Anestesia-Reanimación Anestésicos halogenados ¶ E – 36-285-A-10 ■ Utilización práctica efecto es similar entre los distintos halogenados, incluido el sevoflurano. Las altas concentraciones obtenidas después de una inducción por inhalación pueden provocar un defecto en la retracción uterina que favorezca la hemorragia [108]. La relajación de la musculatura lisa del ojo y la reducción de la producción de humor acuoso intervienen en la disminución de la presión intraocular observada con todos los halogenados. Cuando se utiliza un 8% de sevoflurano para la inducción, es posible evitar el aumento de la presión intraocular debida a la intubación, asociando una pequeña dosis de morfínicos [32, 47]. Inducción Efectos eméticos Todos los agentes halogenados son eméticos. Después de administrar sevoflurano y desflurano, la incidencia de las náuseas y de los vómitos postoperatorios es mayor que cuando se utiliza propofol, que posee propiedades antieméticas, pero menor que con el isoflurano o el halotano, posiblemente por razones cinéticas [98]. El uso de halogenados incrementaría el riesgo de vómitos. Así, según un metaanálisis, la incidencia de los vómitos postoperatorios aumenta de un 20 a un 40% (la de las náuseas de un 9 a un 20%) cuando se utiliza sevoflurano para la inducción de la anestesia, si se compara con el propofol [69]. En cirugía ambulatoria, la incidencia de las náuseas y los vómitos postoperatorios es más frecuente 30 minutos después de una anestesia inducida y mantenida con sevoflurano que con propofol, pero esta diferencia desaparece al cabo de 90 minutos [28]. Cuando el agente halogenado se utiliza sólo para el mantenimiento de la anestesia, la incidencia de las náuseas y los vómitos es muy variable, y afecta al 10-67% de los pacientes [8, 73]. Si se compara con el propofol, la mayor incidencia de las náuseas y los vómitos tras la administración de agentes halogenados es transitoria, y desaparece pasadas 2-4 horas, ya que el efecto antiemético del propofol depende de la concentración [5]. En un estudio prospectivo con 1.180 pacientes, Apfel et al no observan ninguna diferencia en la incidencia de las náuseas y los vómitos con el isoflurano, el enflurano o el sevoflurano [5]. En dicho estudio, la incidencia de las náuseas y los vómitos precoces es proporcional a la duración de administración de los agentes volátiles. Los antieméticos como el droperidol, los inhibidores de la 5-hidroxitriptamina o los corticoides en dosis bajas, solos o asociados, permiten reducir un 50-98% la incidencia de este efecto secundario, que también depende del tipo de cirugía, del enfermo y de la administración de morfínicos. El bajo coste y la eficacia del droperidol permiten el uso en la práctica de agentes halogenados, solos o asociados al N2O, (aunque existan antecedentes eméticos postoperatorios), y no tener que utilizar propofol en esta indicación. Coagulación A diferencia del isoflurano, el halotano y el sevoflurano inhiben in vitro la agregación plaquetaria y la síntesis de tromboxano A 2 plaquetario. No se han demostrado ni valorado las consecuencias de este riesgo hemorrágico perioperatorio. Prueba de dosis, anestesia peridural y anestésicos halogenados Cuando se hace una anestesia locorregional bajo anestesia general con sevoflurano en el adulto o en el niño, el paso intravascular del anestésico local se detecta por la disminución de amplitud de la onda T. Así, una reducción del 25% de la onda T tiene una sensibilidad y especificidad mayores que la elevación de la frecuencia cardíaca o de la presión arterial [138, 139]. Anestesia-Reanimación .2 De todos los agentes halogenados, sólo el halotano y, en especial, el sevoflurano, pueden usarse durante la inducción en el adulto y en el niño. El desflurano está contraindicado como agente de inducción por su efecto irritante. El isoflurano tiene un efecto irritante menor que el desflurano, pero su tiempo de inducción es mayor, por lo que en la práctica clínica esta técnica es menos manejable. Así como la inducción con máscara se lleva realizando en el niño desde hace tiempo, en el adulto es una práctica reciente, que todavía se utiliza poco pero que, en la gran mayoría de los casos, permite una estabilidad hemodinámica y unas condiciones de intubación excelentes, manteniendo la ventilación espontánea. Esto representa una ventaja en caso de intubación difícil. La incidencia de las complicaciones respiratorias secundarias, observadas en la inducción por inhalación con sevoflurano, es igual que en caso de inducción intravenosa, y la mayoría de los autores observan una aceptación igual cuando se le pide al paciente que inspire una capacidad vital forzada de una mezcla que contiene un 50% de N 2 O y un 8% de sevoflurano. Esta técnica, denominada «de la capacidad vital», permite acelerar la pérdida de conciencia, que en este caso es de 20-60 segundos. Casi todos los anestesiólogos utilizan desde el momento de la inducción su circuito-filtro, lo que les permite reducir el consumo de agentes halogenados. De esta forma, el circuito que se encuentra saturado de halogenados se usa desde el momento de la inducción para el mantenimiento de la anestesia. Con este método se evita tener que saturar más tarde el espacio muerto del circuito, como ocurre tras una inducción intravenosa. Una válvula específica, la válvula SIBI, permite realizar la preoxigenación y la preparación del circuito sin utilizar el circuito accesorio. Esta válvula también reduce la contaminación del quirófano. Aunque esta técnica parece sencilla, requiere un aprendizaje mínimo, ya que el momento en el que se puede proceder a la intubación varía entre los pacientes (4-5 minutos) y, aparte del sentido clínico del operador, no existe por ahora ningún medio objetivo que determine cuándo es mejor intubar o insertar la mascarilla laríngea. El valor de la concentraciones teleespiratorias de halogenados no permite determinar este momento porque refleja mal las concentraciones cerebrales durante la inducción (cf supra). Las publicaciones que establecen las CAM de intubación o de inserción de mascarilla laríngea han sido efectuadas en condición estacionaria y, por tanto, no tienen relevancia clínica durante la intubación. El BIS tampoco permite predecir qué pacientes van a moverse o no durante la intubación. Tan sólo algunos criterios clínicos, a veces subjetivos, como el tiempo transcurrido desde el comienzo de la inducción, la posición centrada de las pupilas, una miosis (inconstante), y la relajación de la mandíbula, permiten fijar el momento adecuado para intubar al paciente. Se ha propuesto el uso de adyuvantes durante la inducción con máscara mediante sevoflurano, para mejorar o acortar los tiempos de pérdida de conciencia, de intubación o de inserción de máscara laríngea. El N2O añadido a la mezcla permite reducir el tiempo de intubación y la concentración alveolar teórica de intubación [104]. Cuando se asocia N2O al sevoflurano, se observa en el niño y, a veces en el adulto, una incidencia menor de episodios de excitación durante la inducción [20, 116]. También se puede proponer la asociación de morfínicos al sevoflurano para mejorar las condiciones de la inducción. Las concentraciones ideales de los morfínicos y el momento para su administración dependen del objetivo clínico. El objetivo teórico es reducir la CAM del halogenado y acelerar la velocidad 15 E – 36-285-A-10 ¶ Anestésicos halogenados . . . de inducción, pero conservando una estabilidad hemodinámica y una ventilación eficaz. La asociación de morfínicos no acelera el tiempo de pérdida de conciencia. Los morfínicos permiten disminuir a un 2%, aproximadamente, la CAM de intubación del sevoflurano, pero, de forma paralela, la acción sinérgica sobre la respiración de los opioides y de los agentes halogenados provoca episodios de apnea en algunos pacientes, incluso con concentraciones bajas de morfínicos [27]. Los morfínicos en pequeñas concentraciones tienen la ventaja de lograr una estabilidad hemodinámica superior y evitar la elevación de la frecuencia cardíaca inducida por la técnica o por la intubación [109]. Cuando las concentraciones de morfínicos son más elevadas, se observa en un 30% de los pacientes una caída de la presión arterial y de la frecuencia cardíaca, similar a la observada con la asociación propofol-alfentanilo [110]. También se han descrito casos de asistolia. Por último, la incidencia de apnea o incluso de cierre de la glotis con altas concentraciones de morfínicos hace que esta técnica difiera poco de la inducción por vía intravenosa, y el uso de un curare puede resultar necesario. En el adulto y en el niño, se han descrito durante la inducción anestésica, con un 8% de sevoflurano, modificaciones del EEG en forma de actividad punta-onda. Estas modificaciones aparecen sobre todo cuando la concentración al final de la espiración se eleva por encima de 2 CAM, en presencia de una hipocapnia espontánea o provocada por una hiperventilación intencionada; paradójicamente, serían menos frecuentes en presencia de N2O. Estas modificaciones eléctricas se pueden asociar a movimientos clónicos. En algunos casos, se han observado crisis tonicoclónicas generalizadas en pacientes predispuestos, e incluso han permitido diagnosticar un tumor cerebral latente. En los sujetos predispuestos, esta actividad no se limita a la zona epileptógena, lo que sugiere un riesgo de manifestación eléctrica paroxística también en pacientes sanos [63]. Por el momento, la incidencia de estas anomalías es mal conocida, sobre todo en el adulto. En un estudio prospectivo, Conreux et al las han observado en 2 niños de un grupo de 18, mientras que Constant et al no las han observado en ningún niño [19, 20]. El uso de una benzodiazepina en la premedicación podría explicar la discordancia entre ambos estudios. Además, no se ha podido establecer ninguna correlación entre esta actividad eléctrica paroxística y anomalías residuales durante la recuperación de la anestesia. Tales episodios de actividad eléctrica cerebral paroxística aparecen cuando aumentan la frecuencia cardíaca y la presión arterial, como ocurre durante las sismoterapias. Falta por establecer la relación de causa-efecto existente entre esta actividad eléctrica y la taquicardia (y también la crisis hipertensiva), observadas durante los 2 minutos siguientes al inicio de la inducción. Es evidente que esta técnica de inducción con máscara con un 8% de sevoflurano sólo se debe aplicar a los pacientes con antecedentes de epilepsia cuando la inducción por vía intravenosa no es posible. En este caso, para elevar el umbral epileptógeno, se aconseja administrar a estos pacientes una benzodiazepina en el preoperatorio. Por último, esta técnica no ha sido validada, por el momento, en el enfermo coronario o en el que presenta una insuficiencia cardíaca. Con la inducción con máscara, el coste de una anestesia, aunque sea de corta duración, es inferior al de una anestesia con propofol, siempre que haya un control estricto del flujo de gas fresco y de la duración de la preparación del circuito [50, 107]. Por tanto, después de la inducción con un circuito-filtro, y reduciendo el flujo de gas fresco a 1 l/min y cerrando el vaporizador, se logra una lenta disminución de las concentraciones espiratorias hasta la CAM en un tiempo medio de 20 minutos. Esta técnica, llamada de overcoasting, que limita la liberación de halogenado a la 16 fase de inducción, permite reducir de esta forma los costes de anestesias de corta duración. Así como se conocen las grandes ventajas de la inducción por inhalación en el niño, faltan por definir las indicaciones específicas de esta técnica en el adulto. Algunos autores destacan las ventajas de dicha técnica en caso de intubación difícil [26, 50]. Mantenimiento Hoy en día, el isoflurano, el desflurano y el sevoflurano se utilizan sobre todo para el mantenimiento de la anestesia tras una inducción intravenosa. Las diferencias farmacodinámicas entre estos tres agentes son pequeñas, de ahí que la elección dependa de sus diferencias farmacocinéticas contrarrestadas por su coste directo e indirecto (cf infra). El argumento cinético, muy utilizado para justificar el abandono del halotano y del isoflurano, deriva de una esquematización del simple análisis de los coeficientes de partición sangre-gas de los distintos agentes. La realidad es más compleja, y el tiempo necesario para obtener concentraciones alveolares adaptadas a la anestesia o al despertar depende de numerosos parámetros. Éstos se pueden modular para lograr efectos clínicos superponibles con los distintos agentes empleados en numerosas circunstancias (cf supra). Así, el coste directo de la anestesia se puede multiplicar por cuatro. El precio del mantenimiento y de una adaptación terapéutica puede alcanzar una suma elevada si la gestión de los gases frescos no es rigurosa o se utiliza un circuito sin reinhalación. Los efectos menores de la reinhalación justifican una gestión distinta de los ajustes terapéuticos según el agente. Con el isoflurano, sólo se puede conseguir un rápido aumento de las concentraciones de final de espiración elevando de forma simultánea la concentración liberada por el vaporizador y el flujo de gas fresco. Debido a la menor captación periférica del sevoflurano y, sobre todo, del desflurano [87], el aumento máximo de la concentración proporcionada por el vaporizador consigue una adaptación terapéutica rápida sin tener que aumentar el flujo de gas fresco. Además, este último se puede regular a valores muy bajos, inferiores a 1 l/min, suficientes para compensar el consumo del paciente y las fugas. El uso del N 2 O asociado a los halogenados sigue estando justificado por su efecto aditivo sobre la CAM de estos agentes. La asociación de un 50% de N 2 O permite reducir a la mitad el consumo de agentes halogenados y, por tanto, el coste de los más caros. La reducción del riesgo de memorización y del tiempo de recuperación de la anestesia con los agentes más solubles constituye una ventaja clínica innegable [45, 46]. Ningún agente halogenado posee la autorización sobre su puesta en el mercado específica para un determinado tipo de cirugía. En la práctica clínica, el isoflurano sigue estando indicado en la inmensa mayoría de los casos para el mantenimiento de la anestesia general equilibrada. Sin embargo, cuando se requieren concentraciones elevadas de halogenados, hay que tener en cuenta que el isoflurano se acumula, y ha de preverse un tiempo más largo de recuperación. Por tanto, el empleo de agentes poco solubles, como el desflurano o el sevoflurano, puede estar justificado cuando el anestesista debe realizar una hipotensión controlada. Además, la mayor facilidad de control de los agentes poco solubles permite adaptar antes el nivel de anestesia, y esta adaptación más rápida con el desflurano que con el isoflurano también permite utilizar menos hipotensores asociados [9]. Aunque no existe ningún estudio aleatorizado, es previsible que el control de las variaciones de la presión arterial sea menos rápido con el isoflurano, en la cirugía del feocromocitoma, o después de un estímulo nociceptivo en el paciente hipertenso. Asimismo, en la práctica, el aligeramiento de la anestesia necesario en caso de caída significativa de la presión se Anestesia-Reanimación Anestésicos halogenados ¶ E – 36-285-A-10 Desflurano Isoflurano 6 Sevoflurano Isoflurano 1,8 5 1,6 2,8 4 1,4 2,6 3 1,2 2,4 2 1,0 2,2 1 0 10 20 30 Tiempo 40 50 60 0,8 2,0 0 10 20 30 Tiempo Desflurano Sevoflurano 3,0 40 50 60 4 l min-1 2 l min-1 1 l min-1 0,2 l min-1 0 10 20 30 40 50 60 Tiempo Figura 11. Consumo relativo de desflurano, isoflurano y desflurano para flujos de gas fresco de 4,2, 1 y 0,2 l/min. consigue con menor rapidez en el caso del isoflurano. Por ello, y aunque siempre se puede utilizar, el isoflurano no está indicado por estos motivos en las situaciones siguientes: cirugía del feocromocitoma, hipotensión controlada, pacientes en los que son previsibles grandes modificaciones hemodinámicas, como los hipertensos, control de la repercusión hemodinámica en la cirugía que incluye pinzamientos vasculares carotídeo o aórtico. De esta forma, el desflurano usado para controlar las variaciones de presión arterial en la cirugía aórtica permite mantener una estabilidad hemodinámica [48] y un control rápido de las cifras tensionales. Mientras que el empleo de agentes poco liposolubles tiene escasas consecuencias sobre la duración de la estancia en sala de recuperación, las secuelas psicomotoras debidas a la persistencia de bajas concentraciones de halogenados recomiendan el uso de agentes menos solubles para la cirugía ambulatoria. Despertar El tiempo y la calidad de la recuperación de la anestesia dependen del agente anestésico seleccionado. En una anestesia de larga duración, el desflurano no se acumula, mientras que el sevoflurano, y sobre todo el isoflurano, tienden a acumularse de forma proporcional a la duración de la anestesia y a la concentración utilizada en el peroperatorio [41, 42]. Así pues, el tiempo de eliminación del desflurano y, por tanto, la recuperación de la anestesia, no dependen de la duración de la misma, al contrario de lo que ocurre con el isoflurano, y en menor medida con el sevoflurano. Con anestesias de alrededor de 3 horas en pacientes obesos, los efectos residuales menores del desflurano se traducen en una oxigenación mejor que después de administrar isoflurano [71]. En los pacientes de edad avanzada, la diferencia entre los tiempos de despertar con el isoflurano y el desflurano es de tan sólo 3-10 minutos, y no se observa ningún beneficio real sobre la función respiratoria, la duración de la estancia en sala de recuperación o las funciones superiores evaluadas por el Mini Mental Status Test [17, 70]. En las anestesias de corta duración, la diferencia entre los tres agentes es pequeña, y sin consecuencias clínicas, ya que en la mayoría de los estudios publicados la elección del agente no modifica la duración de la estancia en sala de recuperación. Por ello, parece lógico optar por el desflurano y descartar el isoflurano únicamente en el caso de anestesias de larga duración. Estos datos deben sopesarse, pues el tipo de morfínico y la premedicación, sobre todo con el midazolam en los niños, pueden influir más sobre el tiempo de despertar que la elección del agente anestésico por inhalación [145]. En resumen, la menor somnolencia y la recuperación más rápida de las funciones superiores con los agentes menos solubles, como el desflurano, constituyen una clara ventaja que permite, por ejemplo, recuperar más rápidamente una mejor autonomía en caso de anestesia ambulatoria, o para utilizar correctamente una bomba de autoadministración de morfina. En el niño se han descrito fenómenos de agitación grave tras una anestesia con desflurano, isoflurano y, sobre todo, sevoflurano. Después de una anestesia con Anestesia-Reanimación sevoflurano, el 30-80% de los niños puede verse afectado según la gravedad del fenómeno [25, 81, 143]. Estos mismos niños anestesiados con propofol no manifiestan ninguna agitación en el momento de despertar [143]. Comparado con el halotano, con el que sólo el 11,5% de los niños presenta agitación, el 40% de los que han recibido sevoflurano manifiesta dichos síntomas en el momento de despertar [4]. La incidencia de agitación en el momento de despertar después del uso de sevoflurano y de desflurano sería similar [18]. Estos fenómenos, más frecuentes cuanto más joven es el niño, se pueden atenuar con una premedicación con midazolam o con 2 mg/kg de clonidina [4, 81, 82]. Coste y elección del agente halogenado A la hora de elegir entre las distintas anestesias, el criterio principal que se tiene en cuenta es la diferencia de coste de los agentes halogenados. Aunque a escala individual la diferencia de coste no resulta significativa, sí lo es para todo un servicio de anestesia. Así, el mayor gasto farmacéutico en un servicio de anestesia es el destinado a los agentes halogenados [51]. Cuando el producto se administra con un circuito-filtro, la elevación del coste por mililitro no repercute de forma directa y proporcional sobre el coste de la anestesia, debido a las diferencias de CAM y de inhalación entre halogenados, así como de flujo de gas fresco. Por tanto, cuando se utiliza un circuito-filtro con un flujo de gas fresco de 1,8 l/min, el aumento medio del coste, comparado con el isoflurano, es de 3,3 para el sevoflurano y de 3,9 para el desflurano [136]. Si aplicamos las tarifas asignadas a un departamento de anestesia de un centro hospitalario universitario, estos consumos de gas corresponden a costes de 2,3 euros para el isoflurano, 7,5 euros para el sevoflurano y 9 euros para el desflurano, administrados durante 100-122 minutos. Este incremento del coste puede variar según las prácticas (sobre todo cuando se utiliza un flujo de gas fresco muy bajo). Así pues, en un circuito cerrado con un flujo de gas fresco de 0,2 l/min, los consumos de sevoflurano y de isoflurano son equivalentes, y el del desflurano es dos veces superior a los de isoflurano y sevoflurano (Fig. 11) [92]. Esto implica en teoría un coste suplementario cuatro veces superior al del isoflurano, y similar para los dos agentes más recientes. La reducción del coste, debida a la disminución de los flujos de gas fresco, es mucho mayor para los agentes menos solubles que para los más solubles [92]. Para un flujo de gas fresco de 1 l/min, la diferencia de consumo entre el sevoflurano y el isoflurano alcanza un coeficiente aproximado de 1,3; la del consumo entre desflurano e isoflurano es de 3; esto implica un coste suplementario de 5,4 para el sevoflurano y de 6 para el desflurano [92]. Dicha diferencia sólo se justifica si la conveniencia clínica es real. Esta última es subjetiva y no se encuentra cuantificada. La elección de un agente más caro se justifica, más que por las diferencias de los tiempos de recuperación o de estancia en sala de recuperación, por una mayor seguri- 17 E – 36-285-A-10 ¶ Anestésicos halogenados dad en su uso. Así, una menor ocupación de la sala de recuperación debida al empleo de agentes de cinética más rápida, como el desflurano, no puede influir en los gastos en personal (que debe ser fijo), pero sí aumenta la disponibilidad del personal asistente para ocuparse de los pacientes más graves [11]. Por último, la seguridad y la facilidad de control de la inducción con máscara constituyen argumentos de mayor peso que el coste a la hora de justificar el uso del sevoflurano en el niño. ■ Conclusión De todos los agentes halogenados disponibles, sólo el isoflurano, el sevoflurano y el desflurano merecen seguir formando parte del arsenal terapéutico en anestesia. En la práctica clínica habitual, las diferencias farmacodinámicas de estos tres agentes son mínimas. Comparados “ con el isoflurano, el desflurano y el sevoflurano se caracterizan sobre todo por una cinética más rápida, pero también son más caros. Por tanto, estos dos agentes deben utilizarse de forma preferente en circuito cerrado y con una gestión rigurosa de los flujos de gas fresco. Los agentes halogenados, sea cual sea su coste, siguen revelándose más económicos, y permiten casi siempre una recuperación más rápida que los agentes intravenosos cuando se utilizan para la inducción o para el mantenimiento de la anestesia. La mayor facilidad de control y, sobre todo, del desflurano (más que un despertar más rápido) hace que se usen más que el isoflurano. El sevoflurano, menos acre y menos soluble, puede emplearse para la inducción con máscara tanto en el adulto como en el niño. La inducción con máscara en el adulto es una práctica reciente, pero algunos efectos relacionados con la técnica han de evaluarse mejor en determinados grupos de pacientes. Puntos esenciales • La naturaleza, el número y la posición de los átomos de halógeno condicionan las propiedades farmacéuticas, los efectos y la toxicidad de los anestésicos halogenados. Las propiedades fisicoquímicas de los agentes halogenados y su liposolubilidad (evaluada por el coeficiente de partición aceite/agua) dependen de la sustitución de un átomo de hidrógeno por un átomo de flúor, pero sobre todo de bromo y, en menor medida, de cloro. • Una temperatura de ebullición y una presión de vapor saturante diferentes entre los halogenados condicionan la calibración de los vaporizadores convencionales. Así, cada agente halogenado sólo debe administrarse con su vaporizador específico, a fin de evitar el riesgo de dosificación excesiva o insuficiente. • En la práctica clínica, el grado de captación tisular y, por tanto, del almacenamiento de los agentes halogenados, se mide por la diferencia entre las concentraciones inspiratorias y espiratorias. • Cuando se utiliza un circuito-filtro, la cinética de los gases está influida por la concentración proporcionada por el vaporizador, por el flujo de gas que barre el vaporizador, por el volumen del circuito y por la cantidad de gas reinhalada. • El hidróxido de sodio y el hidróxido de potasio, bases fuertes contenidas en la cal sodada o en la cal baritada, degradan todos los agentes halogenados. La formación de monóxido de carbono se produce sobre todo cuando se utiliza cal baritada desecada. • El efecto hipnótico global de los agentes halogenados se debe al efecto simultáneo sobre las estructuras medulares y supramedulares. Los efectos hipnóticos de los agentes halogenados son dependientes de la dosis, y se cuantifican por la concentración alveolar mínima (CAM). • Los agentes halogenados aumentan el flujo sanguíneo cerebral por su efecto vasodilatador. Este efecto es más marcado en el caso del halotano (x 2) y del enflurano (x 1,5). El enflurano puede aumentar la presión intracraneal con independencia de sus efectos sobre el flujo y el volumen sanguíneo cerebral, por un aumento del volumen del líquido cefalorraquídeo. • Los agentes halogenados deprimen la respuesta ventilatoria frente a la hipoxia y a la hipercapnia de forma dependiente de la dosis. La respuesta a la hipoxia se altera a partir de una CAM de 0,1 de agente halogenado, y desaparece por encima de una CAM de halogenados de 1,1. • Los agentes halogenados reducen la presión arterial de forma dependiente de la dosis. Esto se debe a un efecto vasodilatador periférico, más marcado en el caso del isoflurano y del sevoflurano que en el del desflurano. Los agentes halogenados deprimen la respuesta barorrefleja, y esta alteración es mayor con el halotano y el enflurano que con el isoflurano, el desflurano y el sevoflurano. • Con el isoflurano, el efecto vasodilatador predominante sobre la macrocirculación es considerado responsable de síndromes de robo coronario, pero sólo en pacientes con una afección coronaria tritroncular. • El isoflurano, el desflurano y el sevoflurano alteran poco o nada el flujo sanguíneo hepático, contrariamente a lo observado con el halotano. • Los agentes halogenados potencian los curares mediante un efecto muscular directo. La potenciación de los curares varía según el agente halogenado y el tipo de curare utilizados. • Todos los agentes halogenados relajan la musculatura lisa uterina de manera proporcional a su concentración. Con una concentración moderada (<2 CAM), este efecto es similar entre los distintos halogenados. • La relajación de la musculatura lisa del ojo, junto con la reducción de síntesis de humor acuoso, contribuye a disminuir la presión intraocular observada con todos los halogenados. 18 Anestesia-Reanimación Anestésicos halogenados ¶ E – 36-285-A-10 ■ Bibliografìa [1] [2] [3] [4] [5] [6] [7] [8] [9] [10] [11] [12] [13] [14] [15] [16] [17] [18] [19] Ahmad S, Yilmaz M, Marcus RJ, Glisson S, Kinsella A. Impact of bispectral index monitoring on fast tracking of gynecologic patients undergoing laparoscopic surgery. Anesthesiology 2003;98:849-52. Alkire MT, Haier RJ, Fallon JH. Toward a unified theory of narcosis: brain imaging evidence for a thalamocortical switch as the neurophysiologic basis of anesthetic-induced unconsciousness. Conscious Cogn 2000;9:370-86. Antkowiak B. Different actions of general anesthetics on the firing patterns of neocortical neurons mediated by the GABA(A) receptor. Anesthesiology 1999;91:500-11. Aono J, Ueda W, Mamiya K, Takimoto E, Manabe M. Greater incidence of delirium during recovery from sevoflurane anesthesia in preschool boys. Anesthesiology 1997;87: 1298-300. Apfel CC, Kranke P, Katz MH, Goepfert C, Papenfuss T, Rauch S, et al. Volatile anaesthetics may be the main cause of early but not delayed postoperative vomiting: a randomized controlled trial of factorial design. Br J Anaesth 2002;88:65968. Artru AA. Relationship between cerebral blood volume and CSF pressure during anesthesia with halothane or enflurane in dogs. Anesthesiology 1983;58:533-9. Artru AA, Lam AM, Johnson JO, Sperry RJ. Intracranial pressure, middle cerebral artery flow velocity, and plasma inorganic fluoride concentrations in neurosurgical patients receiving sevoflurane or isoflurane. Anesth Analg 1997;85: 587-92. Ashworth J, Smith I. Comparison of desflurane with isoflurane or propofol in spontaneously breathing ambulatory patients. Anesth Analg 1998;87:312-8. Avramov MN, Griffin JD, White PF. The effect of fresh gas flow and anesthetic technique on the ability to control acute hemodynamic responses during surgery. Anesth Analg 1998; 87:666-70. Bailey JM. Context-sensitive half-times and other decrement times of inhaled anesthetics. Anesth Analg 1997;85:681-6. Beaussier M, Decorps A, Tilleul P, Megnigbeto A, Balladur P, Lienhart A. Desflurane improves the throughput of patients in the PACU. A cost-effectiveness comparison with isoflurane. Can J Anaesth 2002;49:339-46. Brown K, Aun C, Stocks J, Jackson E, Mackersie A, Hatch D. A comparison of the respiratory effects of sevoflurane and halothane in infants and young children. Anesthesiology 1998;89:86-92. Bruhn J, Ropcke H, Hoeft A. Approximate entropy as an electroencephalographic measure of anesthetic drug effect during desflurane anesthesia. Anesthesiology 2000;92: 715-26. Campbell C, Nahrwold ML, Miller DD. Clinical comparison of sevoflurane and isoflurane when administered with nitrous oxide for surgical procedures of intermediate duration. Can J Anaesth 1995;42:884-90. Carpenter RL, Eger 2nd EI, Johnson BH, Unadkat JD, Sheiner LB. Does the duration of anesthetic administration affect the pharmacokinetics or metabolism of inhaled anesthetics in humans? Anesth Analg 1987;66:1-8. Chan CK, Durieux ME. Differential inhibition of lysophosphatidate signaling by volatile anesthetics. Anesthesiology 1997;86:660-9. Chen X, Zhao M, White PF, Li S, Tang J, Wender RH, et al. The recovery of cognitive function after general anesthesia in elderly patients: a comparison of desflurane and sevoflurane. Anesth Analg 2001;93:1489-94. Cohen IT, Finkel JC, Hannallah RS, Hummer KA, Patel KM. The effect of fentanyl on the emergence characteristics after desflurane or sevoflurane anesthesia in children. Anesth Analg 2002;94:1178-81. Conreux F, Best O, Preckel MP, Lhopitault C, Beydon L, Pouplard F, et al. Effets électroencephalographiques du sévoflurane à l’induction chez le jeune enfant : étude prospective sur 20 cas. Ann Fr Anesth Reanim 2001;20: 438-45. Anestesia-Reanimación [20] Constant I, Dubois MC, Piat V, Moutard ML, McCue M, Murat I. Changes in electroencephalogram and autonomic cardiovascular activity during induction of anesthesia with sevoflurane compared with halothane in children. Anesthesiology 1999;91:1604-15. [21] Conzen PF, Kharasch ED, Czerner SF, Artru AA, Reichle FM, Michalowski P, et al. Low-flow sevoflurane compared with low-flow isoflurane anesthesia in patients with stable renal insufficiency. Anesthesiology 2002;97:578-84. [22] Conzen PF, Nuscheler M, MelotteA, Verhaegen M, Leupolt T, Van Aken H, et al. Renal function and serum fluoride concentrations in patients with stable renal insufficiency after anesthesia with sevoflurane or enflurane. Anesth Analg 1995; 81:569-75. [23] Coste C, Guignard B, Menigaux C, Chauvin M. Nitrous oxide prevents movement during orotracheal intubation without affecting BIS value. Anesth Analg 2000;91:130-5. [24] Cousin MT. Le cent-cinquantenaire du chloroforme. Un agent anesthésique plus merveilleux et terrible encore que l’éther. Ann Fr Anesth Reanim 1997;16:1037-44. [25] Cravero J, Surgenor S, Whalen K. Emergence agitation in paediatric patients after sevoflurane anaesthesia and no surgery: a comparison with halothane. Paediatr Anaesth 2000;10:419-24. [26] CrosAM, Chopin F, Lopez C, Kays C. Induction anesthésique avec le sévoflurane chez le patient adulte avec des signes prédictifs d’une intubation difficile. Ann Fr Anesth Reanim 2002;21:249-55. [27] Dahan A, Nieuwenhuijs D, Olofsen E, Sarton E, Romberg R, Teppema L. Response surface modeling of alfentanilsevoflurane interaction on cardiorespiratory control and bispectral index. Anesthesiology 2001;94:982-91. [28] Dashfield AK, Birt DJ, Thurlow J, Kestin IG, Langton JA. Recovery characteristics using single-breath 8% sevoflurane or propofol for induction of anaesthesia in day-case arthroscopy patients. Anaesthesia 1998;53:1062-6. [29] Detsch O, Schneider G, Kochs E, Hapfelmeier G, Werner C. Increasing isoflurane concentration may cause paradoxical increases in the EEG bispectral index in surgical patients. Br J Anaesth 2000;84:33-7. [30] Djaiani GN, Hall J, Pugh S, Peaston RT. Vital capacity inhalation induction with sevoflurane: an alternative to standard intravenous induction for patients undergoing cardiac surgery. J Cardiothorac Vasc Anesth 2001;15:169-74. [31] Don HF, Wahba WM, Craig DB.Airway closure, gas trapping, and the functional residual capacity during anesthesia. Anesthesiology 1972;36:533-9. [32] Duman A, Ogun CO, Okesli S. The effect on intraocular pressure of tracheal intubation or laryngeal mask insertion during sevoflurane anaesthesia in children without the use of muscle relaxants. Paediatr Anaesth 2001;11:421-4. [33] Dwyer R, Bennett HL, Eger 2nd EI, Peterson N. Isoflurane anesthesia prevents unconscious learning. Anesth Analg 1992;75:107-12. [34] Ebert TJ, Arain SR. Renal responses to low-flow desflurane, sevoflurane, and propofol in patients. Anesthesiology 2000; 93:1401-6. [35] Ebert TJ, Frink 2nd EJ, Kharasch ED.Absence of biochemical evidence for renal and hepatic dysfunction after 8 hours of 1.25 minimum alveolar concentration sevoflurane anesthesia in volunteers. Anesthesiology 1998;88:601-10. [36] Ebert TJ, Kharasch ED, Rooke GA, Shroff A, Muzi M. Myocardial ischemia and adverse cardiac outcomes in cardiac patients undergoing noncardiac surgery with sevoflurane and isoflurane. Sevoflurane Ischemia Study Group. Anesth Analg 1997;85:993-9. [37] Eger 2nd EI. Desflurane animal and human pharmacology: aspects of kinetics, safety, and MAC. Anesth Analg 1992;75: S3-S7. [38] Eger 2nd EI, Halsey MJ, Koblin DD, Laster MJ, Ionescu P, Konigsberger K, et al. The convulsant and anesthetic properties of cis-trans isomers of 1,2-dichlorohexafluorocyclobutane and 1,2-dichloroethylene. Anesth Analg 2001;93:922-7. [39] Eger 2nd EI, Ionescu P, Koblin DD, Weiskopf RB. Compound A: solubility in saline and olive oil; destruction by blood. Anesth Analg 1996;83:849-53. 19 E – 36-285-A-10 ¶ Anestésicos halogenados [40] Eger 2nd EI, Ionescu P, Laster MJ, Gong D, Weiskopf RB, Kerschmann RL. Quantitative differences in the production and toxicity of CF2= BrCl versus CH2F-O-C(= CF2)(CF3) (compound A): the safety of halothane does not indicate the safety of sevoflurane. Anesth Analg 1997;85:1164-70. [41] Eger 2nd EI, Johnson BH. Rates of awakening from anesthesia with I-653, halothane, isoflurane, and sevoflurane: a test of the effect of anesthetic concentration and duration in rats. Anesth Analg 1987;66:977-82. [42] Eger 2nd EI, Gong D, Koblin DD, Bowland T, Ionescu P, Laster MJ, et al. The effect of anesthetic duration on kinetic and recovery characteristics of desflurane versus sevoflurane, and on the kinetic charasteristics of compound A in volunteers. Anesth Analg 1998;86:414-21. [43] Eger 2nd EI, Koblin DD, Bowland T, Ionescu P, Laster MJ, Fang Z, et al. Nephrotoxicity of sevoflurane versus desflurane anesthesia in volunteers. Anesth Analg 1997;84:160-8. [44] Eilers H, Kindler CH, Bickler PE. Different effects of volatile anesthetics and polyhalogenated alkanes on depolarizationevoked glutamate release in rat cortical brain slices. Anesth Analg 1999;88:1168-74. [45] Einarsson S, Bengtsson A, Stenqvist O, Bengtson JP. Emergence from isoflurane/N2O or isoflurane anaesthesia. Acta Anaesthesiol Scand 1997;41:1292-9. [46] Einarsson SG, Cerne A, Bengtsson A, Stenqvist O, Bengtson JP. Respiration during emergence from anaesthesia with desflurane/N2O vs. desflurane/air for gynaecological laparoscopy. Acta Anaesthesiol Scand 1998;42:1192-8. [47] Eltzschig HK, Darsow R, Schroeder TH, Hettesheimer H, Guggenberger H. Effect of tracheal intubation or laryngeal mask airway insertion on intraocular pressure using balanced anesthesia with sevoflurane and remifentanil. J Clin Anesth 2001;13:264-7. [48] Eyraud D, Benmalek F, Teugels K, Bertrand M, Mouren S, Coriat P. Does desflurane alter left ventricular function when used to control surgical stimulation during aortic surgery? Acta Anaesthesiol Scand 1999;43:737-43. [49] Fang ZX, Eger 2nd EI. Factors affecting the concentration of compound A resulting from the degradation of sevoflurane by soda lime and Baralyme in a standard anesthetic circuit. Anesth Analg 1995;81:564-8. [50] Favier JC, Da Conceicao M, Genco G, Bidallier I, Fassassi M, Steiner T, et al. Intubation fibroscopique sous sévoflurane chez l’adulte avec un masque facial endoscopique en cas d’intubation difficile. Ann Fr Anesth Reanim 2003;22:96-102. [51] Feiss P, Demontoux MH, Colin D. Anesthetic gas and vapor saving with minimal flow anesthesia. Acta Anaesthesiol Belg 1990;41:249-51. [52] Finkelstein MB, Baggs RB, Anders MW. Nephrotoxicity of the glutathione and cysteine conjugates of 2-bromo-2-chloro1,1-difluoroethene. J Pharmacol Exp Ther 1992;261: 1248-52. [53] Fraga M, Rama-Maceiras P, Rodino S, Aymerich H, Pose P, Belda J. The effects of isoflurane and desflurane on intracranial pressure, cerebral perfusion pressure, and cerebral arteriovenous oxygen content difference in normocapnic patients with supratentorial brain tumors. Anesthesiology 2003;98:1085-90. [54] Frei FJ, Zbinden AM, Thomson DA, Rieder HU. Is the endtidal partial pressure of isoflurane a good predictor of its arterial partial pressure? Br J Anaesth 1991;66:331-9. [55] Frink EJ, Morgan SE, Coetzee A, Conzen PF, Brown BR. The effects of sevoflurane, halothane, enflurane, and isoflurane on hepatic blood flow and oxygenation in chronically instrumented greyhound dogs. Anesthesiology 1992;76: 85-90. [56] Goff MJ, Arain SR, Ficke DJ, Uhrich TD, Ebert TJ. Absence of bronchodilation during desflurane anesthesia: a comparison to sevoflurane and thiopental. Anesthesiology 2000;93:404-8. [57] Hara T, Fukusaki M, Nakamura T, Sumikawa K. Renal function in patients during and after hypotensive anesthesia with sevoflurane. J Clin Anesth 1998;10:539-45. [58] Higuchi H, Adachi Y, Arimura S, Kanno M, Satoh T. The carbon dioxide absorption capacity of Amsorb is half that of soda lime. Anesth Analg 2001;93:221-5. 20 [59] Higuchi H, Adachi Y, Wada H, Kanno M, Satoh T. Comparison of plasma alpha glutathione S-transferase concentrations during and after low-flow sevoflurane or isoflurane anaesthesia. Acta Anaesthesiol Scand 2001;45: 1226-9. [60] Higuchi H, Adachi Y, Wada H, Kanno M, Satoh T. The effects of low-flow sevoflurane and isoflurane anesthesia on renal function in patients with stable moderate renal insufficiency. Anesth Analg 2001;92:650-5. [61] Higuchi H, Wada H, Usui Y, Goto K, Kanno M, Satoh T. Effects of probenecid on renal function in surgical patients anesthetized with low-flow sevoflurane. Anesthesiology 2001;94:21-31. [62] Hirshman CA, Edelstein G, Peetz S, Wayne R, Downes H. Mechanism of action of inhalational anesthesia on airways. Anesthesiology 1982;56:107-11. [63] Hisada K, Morioka T, Fukui K, Nishio S, Kuruma T, Irita K, et al. Effects of sevoflurane and isoflurane on electrocorticographic activities in patients with temporal lobe epilepsy. J Neurosurg Anesthesiol 2001;13:333-7. [64] Hoenemann CW, Halene-Holtgraeve TB, Booke M, Hinder F, Daudel F, Reich A, et al. Delayed onset of malignant hyperthermia in desflurane anesthesia. Anesth Analg 2003;96: 165-7. [65] Ibrahim AE, Taraday JK, Kharasch ED. Bispectral index monitoring during sedation with sevoflurane, midazolam, and propofol. Anesthesiology 2001;95:1151-9. [66] Iyer RA, Anders MW. Cysteine conjugate beta-lyasedependent biotransformation of the cysteine S-conjugates of the sevoflurane degradation product compound A in human, nonhuman primate, and rat kidney cytosol and mitochondria. Anesthesiology 1996;85:1454-61. [67] Johannesson GP, Floren M, Lindahl SG. Sevoflurane for ENTsurgery in children. A comparison with halothane. Acta Anaesthesiol Scand 1995;39:546-50. [68] Jones MV, Harrison NL. Effects of volatile anesthetics on the kinetics of inhibitory postsynaptic currents in cultured rat hippocampal neurons. J Neurophysiol 1993;70:1339-49. [69] Joo HS, Perks WJ. Sevoflurane versus propofol for anesthetic induction: a meta-analysis. Anesth Analg 2000;91:213-9. [70] Juvin P, Servin F, Giraud O, Desmonts JM. Emergence of elderly patients from prolonged desflurane, isoflurane, or propofol anesthesia. Anesth Analg 1997;85:647-51. [71] Juvin P, Vadam C, Malek L, Dupont H, Marmuse JP, Desmonts JM. Postoperative recovery after desflurane, propofol, or isoflurane anesthesia among morbidly obese patients: a prospective, randomized study. Anesth Analg 2000; 91:714-9. [72] Kanaya N, Nakayama M, Fujita S, Namiki A. Comparison of the effects of sevoflurane, isoflurane and halothane on indocyanine green clearance. Br J Anaesth 1995;74:164-7. [73] Karlsen KL, Persson E, Wennberg E, Stenqvist O. Anaesthesia, recovery and postoperative nausea and vomiting after breast surgery. A comparison between desflurane, sevoflurane and isoflurane anaesthesia. Acta Anaesthesiol Scand 2000;44:489-93. [74] Karzai W, Haberstroh J, Priebe HJ. The effects of increasing concentrations of desflurane on systemic oxygenation during one-lung ventilation in pigs. Anesth Analg 1999;89:215-7. [75] Kerbaul F, Bellezza M, Guidon C, Roussel L, Imbert M, Carpentier JP, et al. Effects of sevoflurane on hypoxic pulmonary vasoconstriction in anaesthetized piglets. Br J Anaesth 2000;85:440-5. [76] Kharasch ED, Frink Jr. EJ, Artru A, Michalowski P, Rooke GA, Nogami W. Long-duration low-flow sevoflurane and isoflurane effects on postoperative renal and hepatic function. Anesth Analg 2001;93:1511-20. [77] Kharasch ED, Hankins DC, Thummel KE. Human kidney methoxyflurane and sevoflurane metabolism. Intrarenal fluoride production as a possible mechanism of methoxyflurane nephrotoxicity. Anesthesiology 1995;82: 689-99. [78] Kharasch ED, Jubert C. Compound A uptake and metabolism to mercapturic acids and 3,3,3-trifluoro-2fluoromethoxypropanoic acid during low-flow sevoflurane anesthesia: biomarkers for exposure, risk assessment, and interspecies comparison. Anesthesiology 1999;91:1267-78. Anestesia-Reanimación Anestésicos halogenados ¶ E – 36-285-A-10 [79] Kharasch ED, Thummel KE. Identification of cytochrome P450 2E1 as the predominant enzyme catalyzing human liver microsomal defluorination of sevoflurane, isoflurane, and methoxyflurane. Anesthesiology 1993;79:795-807. [80] Kharasch ED, Thorning D, Garton K, Hankins DC, Kilty CG. Role of renal cysteine conjugate beta-lyase in the mechanism of compound A nephrotoxicity in rats. Anesthesiology 1997; 86:160-71. [81] Kulka PJ, Bressem M, Tryba M. Clonidine prevents sevoflurane-induced agitation in children. Anesth Analg 2001; 93:335-8. [82] Kulka PJ, Bressem M, Wiebalck A, Tryba M. Prophylaxe des ″Postsevoflurandelirs″ mit Midazolam. Anaesthesist 2001; 50:401-5. [83] Kurita T, Doi M, Katoh T, Sano H, Sato S, Mantzaridis H, et al. Auditory evoked potential index predicts the depth of sedation and movement in response to skin incision during sevoflurane anesthesia. Anesthesiology 2001;95:364-70. [84] Kuroda Y, Murakami M, Tsuruta J, Murakawa T, Sakabe T. Blood flow velocity of middle cerebral artery during prolonged anesthesia with halothane, isoflurane, and sevoflurane in humans. Anesthesiology 1997;87:527-32. [85] Laisalmi M, Eriksson H, Koivusalo AM, Pere P, Rosenberg P, Lindgren L. Ketorolac is not nephrotoxic in connection with sevoflurane anesthesia in patients undergoing breast surgery. Anesth Analg 2001;92:1058-63. [86] Larsen M, Grondahl TO, Haugstad TS, Langmoen IA. The effect of the volatile anesthetic isoflurane on Ca(2+) dependent glutamate release from rat cerebral cortex. Brain Res 1994;663:335-7. [87] Lee DJ, Robinson DL, Soni N. Efficiency of a circle system for short surgical cases: comparison of desflurane with isoflurane. Br J Anaesth 1996;76:780-2. [88] Lenz C, Frietsch T, Futterer C, Rebel A, Van Ackern K, Kuschinsky W, et al. Local coupling of cerebral blood flow to cerebral glucose metabolism during inhalational anesthesia in rats: desflurane versus isoflurane. Anesthesiology 1999;91: 1720-3. [89] Lerman J, Sikich N, Kleinman S, Yentis S. The pharmacology of sevoflurane in infants and children. Anesthesiology 1994; 80:814-24. [90] Li X, Pearce RA. Effects of halothane on GABA(A) receptor kinetics: evidence for slowed agonist unbinding. J Neurosci 2000;20:899-907. [91] Lockhart SH, Cohen Y, Yasuda N, Freire B, Taheri S, Litt L, et al. Cerebral uptake and elimination of desflurane, isoflurane, and halothane from rabbit brain: an in vivo NMR study. Anesthesiology 1991;74:575-80. [92] Lockwood GG, White DC. Measuring the costs of inhaled anaesthetics. Br J Anaesth 2001;87:559-63. [93] Loeckinger A, Kleinsasser A, Maier S, Furtner B, Keller C, Kuehbacher G, et al. Sustained prolongation of the QTc interval after anesthesia with sevoflurane in infants during the first 6 months of life. Anesthesiology 2003;98:639-42. [94] Luginbuehl IA, Karsli C, Bissonnette B. Cerebrovascular reactivity to carbon dioxide is preserved during hypocapnia in children anesthetized with 1.0 MAC, but not with 1.5 MAC desflurane. Can J Anaesth 2003;50:166-71. [95] Martin JL, Kenna JG, Pohl LR. Antibody assays for the detection of patients sensitized to halothane. Anesth Analg 1990;70:154-9. [96] McCulloch TJ, Visco E, Lam AM. Graded hypercapnia and cerebral autoregulation during sevoflurane or propofol anesthesia. Anesthesiology 2000;93:1205-9. [97] Meissner A, Weber TP, Van Aken H, Zbieranek K, Rolf N. Recovery from myocardial stunning is faster with desflurane compared with propofol in chronically instrumented dogs. Anesth Analg 2000;91:1333-8. Anestesia-Reanimación [98] Meretoja OA, Taivainen T, Raiha L, Korpela R, Wirtavuori K. Sevoflurane-nitrous oxide or halothane-nitrous oxide for paediatric bronchoscopy and gastroscopy. Br J Anaesth 1996; 76:767-71. [99] Mielck F, Stephan H, Buhre W, Weyland A, Sonntag H. Effects of 1 MAC desflurane on cerebral metabolism, blood flow and carbon dioxide reactivity in humans. Br J Anaesth 1998;81:155-60. [100] Miyazaki H, Nakamura Y, Arai T, Kataoka K. Increase of glutamate uptake in astrocytes: a possible mechanism of action of volatile anesthetics. Anesthesiology 1997;86: 1359-66. [101] Morgan PG, Sedensky M, Meneely PM. Multiple sites of action of volatile anesthetics in Caenorhabditis elegans. Proc Natl Acad Sci USA 1990;87:2965-9. [102] Murray JM, Renfrew CW, Bedi A, McCrystal CB, Jones DS, Fee JP. Amsorb: a new carbon dioxide absorbent for use in anesthetic breathing systems. Anesthesiology 1999;91: 1342-8. [103] Muzi M, Ebert TJ. A comparison of baroreflex sensitivity during isoflurane and desflurane anesthesia in humans. Anesthesiology 1995;82:919-25. [104] Muzi M, Robinson BJ, Ebert TJ, O’Brien TJ. Induction of anesthesia and tracheal intubation with sevoflurane in adults. Anesthesiology 1996;85:536-43. [105] Nagasaki G, Tanaka M, Nishikawa T. The recovery profile of baroreflex control of heart rate after isoflurane or sevoflurane anesthesia in humans. Anesth Analg 2001;93:1127-31. [106] Nakamura K, Toda H, Hatano Y, Mori K. Comparison of the direct effects of sevoflurane, isoflurane and halothane on isolated canine coronary arteries. Can J Anaesth 1993;40: 257-61. [107] Nathan N, Peyclit A, Lahrimi A, Feiss P. Comparison of sevoflurane and propofol for ambulatory anaesthesia in gynaecological surgery. Can J Anaesth 1998;45:1148-50. [108] Nathan N, Sperandio M, Erdmann W, Westerkamp B, Van Dijk G, Scherpereel P, et al. Le PhysioFlex® : un ventilateur de circuit fermé autorégulé d’anesthésie par inhalation à objectif de concentration. Ann Fr Anesth Reanim 1997;16: 534-40. [109] Nathan N, Vandroux D, Benrhaiem M, Marquet P, Preux PM, Feiss P. Low alfentanil concentrations improve hemodynamic and intubating conditions during induction with sevoflurane. Can J Anaesth 2004;51:382-7. [110] Nathan N, Vial G, Benrhaiem M, Peyclit A, Feiss P. Induction with propofol target-concentration infusion vs 8% sevoflurane inhalation and alfentanil in hypertensive patients. Anaesthesia 2001;56:251-7. [111] Nielsen VG, Tan S, Kirk KA, Baird MS, McCammon AT, Samuelson PN, et al. Halothane and xanthine oxidase increase hepatocellular enzyme release and circulating lactate after ischemia-reperfusion in rabbits. Anesthesiology 1997;87: 908-17. [112] Nishiyama T, Aibiki M, Hanaoka K. Haemodynamic and catecholamine changes during rapid sevoflurane induction with tidal volume breathing. Can J Anaesth 1997;44:1066-70. [113] Nishiyama T, Sugai N, Hanaoka K. Cerebrovascular CO2 reactivity in elderly and younger adult patients during sevoflurane anaesthesia. Can J Anaesth 1997;44:160-4. [114] Njoku D, Laster MJ, Gong DH, Eger EI, Reed GF, Martin JL. Biotransformation of halothane, enflurane, isoflurane, and desflurane to trifluoroacetylated liver proteins: association between protein acylation and hepatic injury. Anesth Analg 1997;84:173-8. [115] O’Riordan J, O’Beirne HA, Young Y, Bellamy MC. Effects of desflurane and isoflurane on splanchnic microcirculation during major surgery. Br J Anaesth 1997;78:95-6. [116] O’Shea H, Moultrie S, Drummond GB. Influence of nitrous oxide on induction of anaesthesia with sevoflurane. Br J Anaesth 2001;87:286-8. [117] Palahniuk RJ, Shnider SM, Eger EI. Pregnancy decreases the requirement for inhaled anesthetic agents. Anesthesiology 1974;41:82-3. 21 E – 36-285-A-10 ¶ Anestésicos halogenados [118] Park WK, Pancrazio JJ, Suh CK, Lynch C. Myocardial depressant effects of sevoflurane. Mechanical and electrophysiologic actions in vitro. Anesthesiology 1996;84: 1166-76. [119] Piat V, Dubois MC, Johanet S, Murat I. Induction and recovery characteristics and hemodynamic responses to sevoflurane and halothane in children. Anesth Analg 1994;79:840-4. [120] Raatikainen MJ, Trankina MF, Morey TE, Dennis DM. Effects of volatile anesthetics on atrial and AV nodal electrophysiological properties in guinea pig isolated perfused heart. Anesthesiology 1998;89:434-42. [121] Raines DE.Anesthetic and nonanesthetic halogenated volatile compounds have dissimilar activities on nicotinic acetylcholine receptor desensitization kinetics. Anesthesiology 1996;84:663-71. [122] Rampil IJ, King BS. Volatile anesthetics depress spinal motor neurons. Anesthesiology 1996;85:129-34. [123] Reid JE, Breslin DS, Mirakhur RK, Hayes AH. Neostigmine antagonism of rocuronium block during anesthesia with sevoflurane, isoflurane or propofol. Can J Anaesth 2001;48: 351-5. [124] Ries CR, Puil E. Ionic mechanism of isoflurane’s actions on thalamocortical neurons. J Neurophysiol 1999;81:1802-9. [125] Ries CR, Puil E. Mechanism of anesthesia revealed by shunting actions of isoflurane on thalamocortical neurons. J Neurophysiol 1999;81:1795-801. [126] Rodig G, Keyl C, Wiesner G, Philipp A, Hobbhahn J. Effects of sevoflurane and isoflurane on systemic vascular resistance: use of cardiopulmonary bypass as a study model. Br J Anaesth 1996;76:9-12. [127] Rodig G, Wild K, Behr R, Hobbhahn J. Effects of desflurane and isoflurane on systemic vascular resistance during hypothermic cardiopulmonary bypass. J Cardiothorac Vasc Anesth 1997;11:54-7. [128] Rooke GA, Ebert T, Muzi M, Kharasch ED. The hemodynamic and renal effects of sevoflurane and isoflurane in patients with coronary artery disease and chronic hypertension. Sevoflurane Ischemia Study Group. Anesth Analg 1996;82:1159-65. [129] Russell IA, Miller HW, Gregory G, Balea MC, Cassorla L, DeSilva A, et al. The safety and efficacy of sevoflurane anesthesia in infants and children with congenital heart disease. Anesth Analg 2001;92:1152-8. [130] Sato K, Kawamura T, Wakusawa R. Hepatic blood flow and function in elderly patients undergoing laparoscopic cholecystectomy. Anesth Analg 2000;90:1198-202. [131] Satoh H, Fukuda Y, Anderson DK, Ferrans VJ, Gillette JR, Pohl LR. Immunological studies on the mechanism of halothane-induced hepatotoxicity: immunohistochemical evidence of trifluoroacetylated hepatocytes. J Pharmacol Exp Ther 1985;233:857-62. [132] Searle NR, Martineau RJ, Conzen P, Al-Hasani A, Mark L, Ebert T, et al. Comparison of sevoflurane/fentanyl and isoflurane/fentanyl during elective coronary artery bypass surgery. Sevoflurane Venture Group. Can J Anaesth 1996;43: 890-9. [133] Shanks CA, Fragen RJ, Ling D. Continuous intravenous infusion of rocuronium (ORG 9426) in patients receiving balanced, enflurane, or isoflurane anesthesia. Anesthesiology 1993;78:649-51. [134] Sharpe MD, Cuillerier DJ, Lee JK, Basta M, Krahn AD, Klein GJ, et al. Sevoflurane has no effect on sinoatrial node function or on normal atrioventricular and accessory pathway conduction in Wolff-Parkinson-White syndrome during alfentanil/midazolam anesthesia. Anesthesiology 1999;90: 60-5. [135] Story DA, Poustie S, Liu G, McNicol PL. Changes in plasma creatinine concentration after cardiac anesthesia with isoflurane, propofol, or sevoflurane: a randomized clinical trial. Anesthesiology 2001;95:842-8. [136] Suttner S, Boldt J, Schmidt C, Piper S, Kumle B. Cost analysis of target-controlled infusion-based anesthesia compared with standard anesthesia regimens. Anesth Analg 1999;88:77-82. [137] Taheri S, Eger 2nd EI. A demonstration of the concentration and second gas effects in humans anesthetized with nitrous oxide and desflurane. Anesth Analg 1999;89:774-80. 22 [138] Tanaka M, Goyagi T, Kimura T, Nishikawa T. The efficacy of hemodynamic and T wave criteria for detecting intravascular injection of epinephrine test doses in anesthetized adults: a dose-response study. Anesth Analg 2000;91:1196-202. [139] Tanaka M, Kimura T, Goyagi T, Ogasawara K, Nitta R, Nishikawa T. Evaluating hemodynamic and T wave criteria of simulated intravascular test doses using bupivacaine or isoproterenol in anesthetized children. Anesth Analg 2000;91: 567-72. [140] Tanaka S, Tsuchida H, Nakabayashi K, Seki S, Namiki A. The effects of sevoflurane, isoflurane, halothane, and enflurane on hemodynamic responses during an inhaled induction of anesthesia via a mask in humans. Anesth Analg 1996;82: 821-6. [141] Ti LK, Pua HL, Lee TL. Single vital capacity inhalational anaesthetic induction in adults--isoflurane vs sevoflurane. Can J Anaesth 1998;45:949-53. [142] Todd MM, Warner DS, Sokoll MD, Maktabi MA, Hindman BJ, Scamman FL, et al. A prospective, comparative trial of three anesthetics for elective supratentorial craniotomy. Propofol/fentanyl, isoflurane/nitrous oxide, and fentanyl/nitrous oxide. Anesthesiology 1993;78:1005-20. [143] Uezono S, Goto T, Terui K, Ichinose F, Ishguro Y, Nakata Y, et al. Emergence agitation after sevoflurane versus propofol in pediatric patients. Anesth Analg 2000;91:563-6. [144] Vakkuri A, Jantti V, Sarkela M, Lindgren L, Korttila K, YliHankala A. Epileptiform EEG during sevoflurane mask induction: effect of delaying the onset of hyperventilation. Acta Anaesthesiol Scand 2000;44:713-9. [145] Valley RD, Freid EB, Bailey AG, Kopp VJ, Georges LS, Fletcher J, et al. Tracheal extubation of deeply anesthetized pediatric patients: a comparison of desflurane and sevoflurane. Anesth Analg 2003;96:1320-4. [146] Walton B. Halothane hepatitis in children. Anaesthesia 1986; 41:575-8. [147] Wang JY, Russell GN, Page RD, Jackson M, Pennefather SH. Comparison of the effects of sevoflurane and isoflurane on arterial oxygenation during one lung ventilation. Br J Anaesth 1998;81:850-3. [148] Warltier DC, al-Wathiqui MH, Kampine JP, Schmeling WT. Recovery of contractile function of stunned myocardium in chronically instrumented dogs is enhanced by halothane or isoflurane. Anesthesiology 1988;69:552-65. [149] Weiskopf RB, Moore MA, Eger 2nd EI, Noorani M, McKay L, Chortkoff B, et al. Rapid increase in desflurane concentration is associated with greater transient cardiovascular stimulation than with rapid increase in isoflurane concentration in humans. Anesthesiology 1994;80: 1035-45. [150] Wiklund CU, Lindsten U, Lim S, Lindahl SG. Interactions of volatile anesthetics with cholinergic, tachykinin, and leukotriene mechanisms in isolated Guinea pig bronchial smooth muscle. Anesth Analg 2002;95:1650-5. [151] Winegar BD, Owen DF, Yost CS, Forsayeth JR, Mayeri E. Volatile general anesthetics produce hyperpolarization of aplysia neurons by activation of a discrete population of baseline potassium channels. Anesthesiology 1996;85:889900. [152] Wodey E, Pladys P, Copin C, Lucas MM, Chaumont A, Carre P, et al. Comparative hemodynamic depression of sevoflurane versus halothane in infants: an echocardiographic study. Anesthesiology 1997;87:795-800. [153] Woehlck HJ, Dunning MB, Kulier AH, Sasse FJ, Nithipataikom K, Henry DW. The response of anesthetic agent monitors to trifluoromethane warns of the presence of carbon monoxide from anesthetic breakdown. J Clin Monit 1997;13:149-55. [154] Wright PM, Hart P, Lau M, Brown R, Sharma ML, Gruenke L, et al. The magnitude and time course of vecuronium potentiation by desflurane versus isoflurane. Anesthesiology 1995;82:404-11. [155] Wulf H, Kahl M, Ledowski T. Augmentation of the neuromuscular blocking effects of cisatracurium during desflurane, sevoflurane, isoflurane or total i.v. anaesthesia. Br J Anaesth 1998;80:308-12. Anestesia-Reanimación Anestésicos halogenados ¶ E – 36-285-A-10 [156] Wulf H, Ledowski T, Linstedt U, Proppe D, Sitzlack D. Neuromuscular blocking effects of rocuronium during desflurane, isoflurane, and sevoflurane anaesthesia. Can J Anaesth 1998;45:526-32. [157] Yasuda N, Lockhart SH, Eger 2nd EI, Weiskopf RB, Johnson BH, Freire BA, et al. Kinetics of desflurane, isoflurane, and halothane in humans. Anesthesiology 1991;74: 489-98. [158] Yasuda N, Lockhart SH, Eger 2nd EI, Weiskopf RB, Liu J, Laster M, et al. Comparison of kinetics of sevoflurane and isoflurane in humans. Anesth Analg 1991;72:316-24. [159] Yli-Hankala A, Vakkuri A, Annila P, Korttila K. EEG bispectral index monitoring in sevoflurane or propofol anaesthesia: analysis of direct costs and immediate recovery. Acta Anaesthesiol Scand 1999;43:545-9. [160] Yli-Hankala A, Vakkuri A, Sarkela M, Lindgren L, Korttila K, Jantti V. Epileptiform electroencephalogram during mask induction of anesthesia with sevoflurane. Anesthesiology 1999;91:1596-603. [161] Yurino M, Kimura H. Vital capacity breath technique for rapid anaesthetic induction: comparison of sevoflurane and isoflurane. Anaesthesia 1992;47:946-9. [162] Zaric D, Larsen SF, Jacobsen E, Olesen KH, Ranek L. Halothane hepatitis in a prospective study of postoperative complications. Acta Anaesthesiol Scand 1986;30:529-32. [163] Zhang Y, Eger 2nd EI, Dutton RC, Sonner JM. Inhaled anesthetics have hyperalgesic effects at 0.1 minimum alveolar anesthetic concentration. Anesth Analg 2000;91:462-6. I. Odin, Interne des Hôpitaux. N. Nathan, Professeur des Universités ([email protected]). Département d’anesthésie-réanimation chirurgicale, Centre hospitalier universitaire Dupuytren, 2, avenue Martin-Luther-King, 87042 Limoges, France. Cualquier referencia a este artículo debe incluir la mención del artículo original: Odin I., Nathan N. Anestésicos halogenados. EMC (Elsevier SAS, Paris), Anestesia-Reanimación, 36-285-A-10, 2005. Disponible en www.emc-consulte.com (sitio en francés) Título del artículo: Anesthésiques halogénés Algoritmos Anestesia-Reanimación Illustraciones complementarias Vídeos / Animaciones Aspectos legales Información al paciente Informaciones complementarias Autoevaluación 23
Anuncio
Documentos relacionados
Descargar
Anuncio
Añadir este documento a la recogida (s)
Puede agregar este documento a su colección de estudio (s)
Iniciar sesión Disponible sólo para usuarios autorizadosAñadir a este documento guardado
Puede agregar este documento a su lista guardada
Iniciar sesión Disponible sólo para usuarios autorizados