Nueva ventana:NTP 606: Exposición laboral a gases anestésicos (pdf, 640 Kbytes)
Anuncio
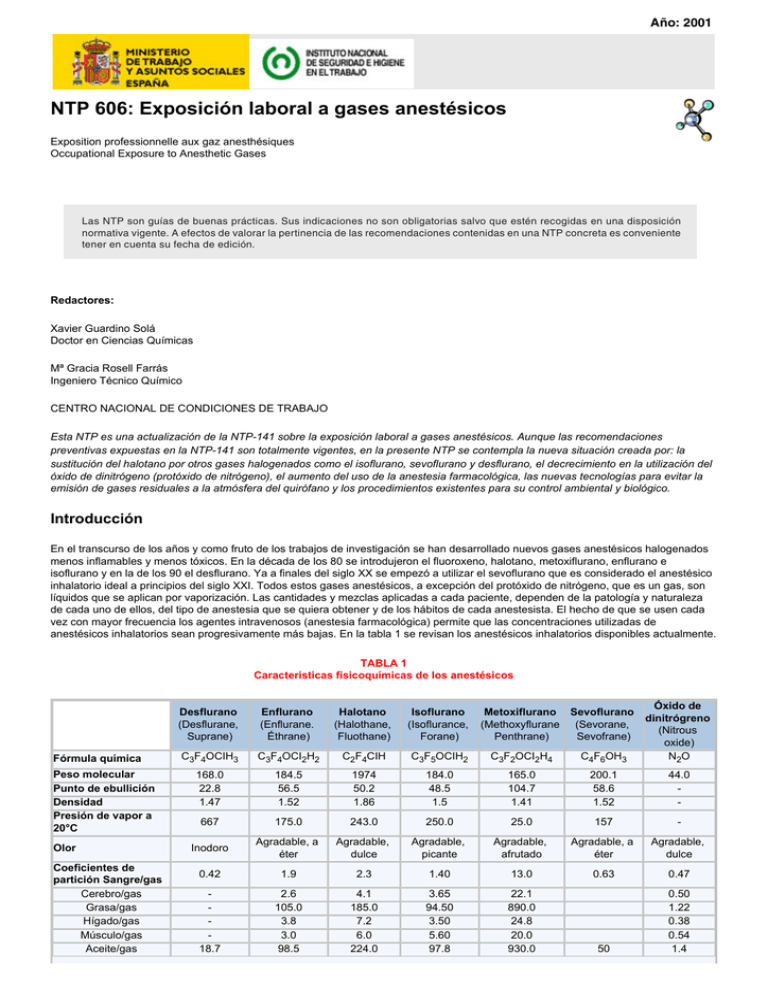
Año: 2001 NTP 606: Exposición laboral a gases anestésicos Exposition professionnelle aux gaz anesthésiques Occupational Exposure to Anesthetic Gases Las NTP son guías de buenas prácticas. Sus indicaciones no son obligatorias salvo que estén recogidas en una disposición normativa vigente. A efectos de valorar la pertinencia de las recomendaciones contenidas en una NTP concreta es conveniente tener en cuenta su fecha de edición. Redactores: Xavier Guardino Solá Doctor en Ciencias Químicas Mª Gracia Rosell Farrás Ingeniero Técnico Químico CENTRO NACIONAL DE CONDICIONES DE TRABAJO Esta NTP es una actualización de la NTP-141 sobre la exposición laboral a gases anestésicos. Aunque las recomendaciones preventivas expuestas en la NTP-141 son totalmente vigentes, en la presente NTP se contempla la nueva situación creada por: la sustitución del halotano por otros gases halogenados como el isoflurano, sevoflurano y desflurano, el decrecimiento en la utilización del óxido de dinitrógeno (protóxido de nitrógeno), el aumento del uso de la anestesia farmacológica, las nuevas tecnologías para evitar la emisión de gases residuales a la atmósfera del quirófano y los procedimientos existentes para su control ambiental y biológico. Introducción En el transcurso de los años y como fruto de los trabajos de investigación se han desarrollado nuevos gases anestésicos halogenados menos inflamables y menos tóxicos. En la década de los 80 se introdujeron el fluoroxeno, halotano, metoxiflurano, enflurano e isoflurano y en la de los 90 el desflurano. Ya a finales del siglo XX se empezó a utilizar el sevoflurano que es considerado el anestésico inhalatorio ideal a principios del siglo XXI. Todos estos gases anestésicos, a excepción del protóxido de nitrógeno, que es un gas, son líquidos que se aplican por vaporización. Las cantidades y mezclas aplicadas a cada paciente, dependen de la patología y naturaleza de cada uno de ellos, del tipo de anestesia que se quiera obtener y de los hábitos de cada anestesista. El hecho de que se usen cada vez con mayor frecuencia los agentes intravenosos (anestesia farmacológica) permite que las concentraciones utilizadas de anestésicos inhalatorios sean progresivamente más bajas. En la tabla 1 se revisan los anestésicos inhalatorios disponibles actualmente. TABLA 1 Características fisicoquímicas de los anestésicos Fórmula química Peso molecular Punto de ebullición Densidad Presión de vapor a 20°C Olor Coeficientes de partición Sangre/gas Cerebro/gas Grasa/gas Hígado/gas Músculo/gas Aceite/gas Desflurano (Desflurane, Suprane) Enflurano (Enflurane. Éthrane) Halotano (Halothane, Fluothane) Isoflurano (Isoflurance, Forane) C3F4OCIH3 C3F4OCI2H2 C2F4CIH C3F5OCIH2 C3F2OCI2H4 C4F6OH3 Óxido de dinitrógreno (Nitrous oxide) N2 O 168.0 22.8 1.47 184.5 56.5 1.52 1974 50.2 1.86 184.0 48.5 1.5 165.0 104.7 1.41 200.1 58.6 1.52 44.0 - 667 175.0 243.0 250.0 25.0 157 - Inodoro Agradable, a éter Agradable, dulce Agradable, picante Agradable, afrutado Agradable, a éter Agradable, dulce 0.42 1.9 2.3 1.40 13.0 0.63 0.47 18.7 2.6 105.0 3.8 3.0 98.5 4.1 185.0 7.2 6.0 224.0 3.65 94.50 3.50 5.60 97.8 22.1 890.0 24.8 20.0 930.0 50 0.50 1.22 0.38 0.54 1.4 Metoxiflurano Sevoflurano (Methoxyflurane (Sevorane, Penthrane) Sevofrane) Agua/gas Goma/gas Metabolización (%) 0.23 0.02 0.8 74.0 2.4 0.7 120.0 15-20 0.61 0.62 0.20 4.5 630.0 50.0 0.36 14 3 0.47 1.2 - Efectos sobre la salud La toxicidad aguda de los gases halogenados como el cloroformo, halotano y enflurano está bien documentada. Exposiciones a altas concentraciones de estos gases, tales como las requeridas para la inducción de la anestesia causan lesiones en el hígado y daños en el sistema renal. Los estudios con animales refuerzan la evidencia de los efectos adversos sobre el hígado y el riñón como consecuencia de la exposición a estos gases. Los nuevos gases anestésicos introducidos después de 1977 son considerados menos tóxicos que los primeros (más "seguros"), aunque se han descrito en la bibliografía leves y pasajeras lesiones asociadas con exposiciones agudas a isoflurano, sevoflurano y desflurano a unos niveles de concentración requeridos para la anestesia (de 1000 a 10000 ppm, dependiendo del gas). Raras veces se dan lesiones o necrosis hepáticas. En las tablas 2 y 3 se resumen los datos toxicológicos disponibles. TABLA 2 Efectos en exposiciones agudas Vías de entrada N2O Excitación Vértigo Somnolencia Descoordinación A concentración > 50% produce anestesia clínica A altas concentraciones pueden causar asfixia y muerte por falta de oxigeno Inhalación Contacto con la piel, mucosas y ojos Líquido puede causar congelación grave Anestésicos halogenados Confusión Vértigo Nauseas Somnolencia Sequedad Enrojecimiento TABLA 3 Efectos en exposiciones subagudas o crónicas Efectos demostrados en humanos por exposición a bajas concentraciones (trazas) de gases anestésicos Generales Trastornos de percepción, cognoscitivos y de habilidad motora Sobre el hígado Cambios funcionales Sobre el riñón En general no son nefrotóxicos Toxicidad para la reproducción No está suficientemente demostrada Carcinogenicidad No está demostrada Valores límite Valores límite ambientales Los Limites de Exposición Profesional para Agentes Químicos adoptados por el INSHT para el período 2001/2002 asignan los valores límite ambientales para exposición diaria (VLAD-ED) que se indican en la tabla 4. Sin embargo, debe tenerse en cuenta que los valores para el halotano y enflurano están probablemente tomados de los TLV de la American Conference of Governmental Industrial Hygienists (ACGIH, USA) y en la documentación de los mismos se indica que el del halotano está fijado por comparación con la toxicidad y los valores asignados al tricloroetileno (clasificado como cancerígeno de categoría 2 en la UE) y cloroformo. El TLV para el enflurano se ha fijado asumiendo que es un anestésico más seguro que el halotano y que no se conocen efectos adversos a concentraciones subanestésicas. TABLA 4 Valores límite ambientales para gases anestésicos VLA-ED ppm mg/m3 N2O 50 92 Enflurano 75 Halotano 50 Isoflurano 50 575 410 383 En 1977 el National Institute for Occupational Safety and Health (NIOSH), estableció para los agentes anestésicos como cloroformo, tricloroetileno, halotano, metoxiflurano, fluoroxeno y enflurano un valor límite recomendado (REL) de 2 ppm como valor techo durante 60 min. El isoflurano, desflurano y sevoflurano, fueron incluidos posteriormente, en esta recomendación. Estos valores REL propuestos por NIOSH estaban basados en la más baja concentración capaz de ser detectada utilizando los procedimientos descritos para la toma de muestra y análisis, y son aplicables a cualquier agente anestésico halogenado cuando se utiliza solo. Esta estrategia derivada de los valores REL para los gases anestésicos es debido a que NIOSH reconoce que pueden ocurrir efectos adversos en trabajadores expuestos, pero, que los datos que se tienen sobre exposición a estos gases en humanos y animales son insuficientes para establecer un valor límite seguro. Los gases anestésicos halogenados no suelen aplicarse solos, sino que muchas veces se suministran con el óxido de dinitrógeno. Estudios de control ambiental llevados a cabo en quirófanos por el NIOSH y por el INSHT, han demostrado que cuando los gases halogenados son suministrados junto con el óxido de dinitrógeno en las proporciones habituales en anestesia, a concentraciones ambientales del óxido de nitrógeno por debajo de las 25 ppm, las concentraciones de los gases halogenados que le acompañan se mantienen siempre por debajo de las 0,5 ppm. No están establecidos hasta el momento valores REL (NIOSH) para el sevoflurano, desflurano e isoflurano y ni la Occupational Safety and Health Administration (OSHA) ni la ACGIH tienen valores límite para estos compuestos (PEL y TLV, respectivamente) hasta el momento. En el ámbito hospitalario se usan de manera extensiva los criterios establecidos por su momento por el NIOSH. Propuestas de valores límite biológicos Los indicadores biológicos de la exposición a agentes anestésicos estudiados hasta el momento no presentan una especificidad y sensibilidad suficientes para que sean operativos. El INSHT y la ACGIH no tienen asignados VLB ni BEI para ningún agente anestésico. Sin embargo, existen estudios para poder llegar a establecer VLB relacionados con los VLA. En la tabla 5 se indican los procesos de metabolización y eliminación de estos gases y en las tablas 6 y 7 un resumen de los diferentes valores propuestos existentes. TABLA 5 Eliminación y metabolización de los agentes anestésicos Agente anestésico Eliminación aire espirado Metabolización Metabolitos en orina Óxido de dinitrógeno < 90 % Halotano 60-80% 5% en Hígado Ácido trifluoroacético Enflurano 80% 2,5 % en Hígado Difluorometoxidifluoroacéticolón fluor Isoflurano > 70 % 0,2% Ácido trifluoroacéticolón fluor Desflurano 0,02% Ácido trifluoroacético Sevoflurano 3% Hexafluoroisopropano TABLA 6 Concentración (•g/I) en orina de óxido de dinitrógeno a distintas concentraciones ambientales según diversos autores (8) AUTORES Nun et al. (1981) Sonander et al. (1983) Imbriani et al. (1988) Trevisan et al. (1990) Franco et al. (1992) Buratti et al. (1993) INSHT (1993) Concentración de N2O en aire, ppm 25 50 13 27 21 70 100 200 191 66 19 27 39 55 192 55 46 55 79 159 TABLA 7 Anestésicos halogenados Anestésico Halotano Isoflurano Indicador biológico Valor propuesto Momento del muestreo Exposición ambiental de referencia Aire exhalado 0,05 ppm Durante la exposición 5 ppm Orina 0,25 mg/g creatinina Final de la jornada laboral --Ácido trifluoroacético en sangre 2,5 mg/l Final de la semana laboral --Orina 3,3 •g/I Después de 4 h 2 ppm Control ambiental Lectura directa Halotano, isoflurano, sevoflurano, desflurano y N2O pueden determinarse mediante monitores de lectura directa. Un ejemplo es el analizador de aire portátil MIRAN→ que determina estos gases anestésicos dentro de unos márgenes de trabajo que van de 0 a 100 ppm y con un límite de detección (LOD) entre 0,3 y 0,7 ppm. La OSHA (USA) también recomienda la utilización de este sistema de medida. Captación activa El método OSHA 103, ver la tabla 8 está validado para la determinación en aire de Isoflurano, enflurano y halotano y el OSHA 106, ver la tabla 9, para el desflurano. El sevoflurano no tiene método validado pero los datos sobre la información de toma de muestra de productos químicos editada por OSHA toma la muestra y sigue las pautas de análisis del método 106. TABLA 8 Determinación de gases anestésicos halogenados en aire. Método de captación activa Isoflurano, Enflurano y Halotano Método Validado OSHA 103 Tubos adsorbentes Anasorb 747 (140/70 mg por sección) Tubos adsorbentes Anasorb CSM (150/75 mg por sección) Volumen máx. 12 l Caudal máx. 0,05 I/min Captación Desorción Ambos tubos con SZC Análisis por Cromatografia de gases CG/ FID Columna Capilar Stabilwax DB de 60 m, 0,32 mm DI, 1,0 •m espesor H2: 1,2 ml/min Gas portador Condiciones de análisis Detector FID Temperaturas Límite de detección Margen de trabajo H2: 30 ml/min; Aire: 350 ml/min Columna: 60 °C Inyector y detector: 250 y 300 °C 377 ppb de 0,3 ppm a 150 ppm TABLA 9 Determinación de gases anestésicos halogenados en aire. Adaptación del método OSHA 106 ( Desflurano / Sevoflurano *) Método Validado OSHA 106 Tubos adsorbentes Anasorb 747 (140/70 mg por sección) Volumen máx. 31 Caudal máx. 0,05 I/min Tolueno / S2C (**) Captación Desorción Análisis por Condiciones de análisis Límite de detección Margen de trabajo (*) Sin información sobre su validación Cromatografia de gases CG/ FID Columna Capilar sílice fundida SPB-1 de 60 m, 0,32 mm DI, 4 mm de espesor Gas portador He: 2,7 ml/min Detector FID h1:30 ml/min; Aire: 350 ml/min Columna: 60 °C Temperaturas Inyector y detector: 250 y 300°°-C 33 ppb de 0,03 ppm a 150 ppm (**) Se trata de una modificación comprobada del método validado; implica la utilización de una columna DB-Wax de 60 m, 0,53 mm Di y 1 mm de espesor de capa. Captación pasiva (por difusión) Una determinación de isoflurano está descrita en el método aceptado por el INSHT MTA/MA-027/A95. "Determinación de isoflurano en aire - método de captación con muestreadores pasivos por difusión - desorción térmica/ cromatografía de gases". Ver la tabla 10 La captación pasiva y posterior análisis de las muestras siguiendo los procedimientos descritos en los métodos OSHA 103 y 106 se puede llevar a cabo con los monitores pasivos SKC-575-002. Ver la tabla 11. TABLA 10 Determinación de isoflurano en aire. Captación por difusión/desorción térmicalcromatografia de gases Método Captación Desorción Análisis por Isoflurano Aceptado MTA7MA-027/A95 Tubos de acero inoxidable de 89 mm de longitud y 6,4 mm de diámetro, rellenos con 150 mg de Chromosorb 106 Velocidad de muestreo (SR): 3,42 ng/ppm.min Térmica Cromatografia de gases CG/ FID Columna Capilar FFAP de 25 m, 0,2 mm DI Gas portador N2: 68,9 kPa (10 psi) Condiciones de análisis Detector FID H2: 30 ml/min; Aire: 350 ml/min Temperaturas Columna: 90º C Detector: 200º C Límite de detección Margen de trabajo 2 ng de 1,3 ppm a 26,5 ppm TABLA 11 Determinación de gases anestésicos halogenados mediante captación pasiva Isoflurano / Desflurano / Sevoflurano Monitores SKC 575-002 Anasorb747 13,7 Isoflurano Velocidad de captación SR (ml/min) 14,8 Desflurano 13,1 Sevoflurano Tiempo de muestreo mínimo 15 min / máximo 8 horas con S2C 6 tolueno Desorción Captación Análisis por Cromatografia de gases CG/ FID Control biológico Como ya se ha comentado en el apartado 3, en el momento de redacción de esta NTP, no se hay establecidos valores VLB ni BEI para los compuestos objeto del presente estudio. Sin embargo, se resumen los métodos propuestos. Determinación de isoflurano en aire exhalado La captación de vapores de isoflurano en el aire exhalado se realiza mediante un sistema de muestreo que permite la selección de la fracción final del aire exhalado reteniéndose los vapores presentes en un tubo adsorbente relleno de Chromosorb 106 para su posterior análisis mediante desorción térmica y cromatografia de gases. Este procedimiento de análisis está descrito por el método aceptado por el INSHT MTA/MB-021/A92. (Tabla 12) TABLA 12 Isoflurano. Control biológico de la exposición (VLB) Método Captación Desorción Análisis por Isoflurano en aire exhalado Aceptado MTA/MB-021/A92. Instrumento de recogida del aire exhalado descrito en el método/ Tubos de Chromosorb 106 (150 mg de 20/40 mallas). Térmica Cromatografia de gases CG/ FID Columna Capilar FFAP de 25 m, 0,2 mm DI Gas portador N2: 68,9 kPa (10 psi) Condiciones de análisis Detector FID H2 :30 ml/min; Aire: 350 ml/min Columna: 70 °C Detector: 200 °C de 0.6 ppm a 3.28 ppm Temperaturas Margen de trabajo Determinación de óxido de dinitrógeno en orina Se toman las muestras antes y después de la exposición y se analizan por cromatografía de gases mediante la técnica del espacio de cabeza. Este procedimiento de análisis está descrito en el método propuesto por el INSHT MTA/118(1)/P00. (Tabla 13) TABLA 13 N2O. Control biológico de la exposición N2O en orina Método Toma de muestra Tratamiento de la muestra Análisis por Condiciones de análisis Margen de trabajo Medidas preventivas Propuesto MTA/118(1)/P00. Antes y después de la jornada laboral 10 ml de orina se calientan a 37 °C (2h) / Se analiza el espacio de cabeza Cromatografía de gases CG/ FI D Columna Capilar PoraPLOT Q de 27,5 m, 0,32 mm DI, 10 •m a 60 °C He: 7,5 psi Gas portador Auxiliar: N2 55 ml/min Detector: ECD a 250 °C De 0.4 •g/I a 500 •g/I Las recomendaciones contenidas en la tabla 9 de la NTP 141 siguen siendo totalmente válidas y aplicables hoy en día, aunque debe tenerse en cuenta la evolución que ha tenido lugar, tanto en los anestésicos utilizados, como en las prácticas de anestesia. A lo expuesto allí, habría que añadir las siguientes recomendaciones y comentarios. ● ● ● ● ● Utilización de sistemas anticontaminación. La utilización de sistemas de eliminación de gases residuales es la medida preventiva más eficaz, ya que elimina el contaminante de manera localizada en el momento de su generación. Sistemas alternativos de aspiración. En aquellos casos en los que no es posible conectar el sistema de eliminación de gases anestésicos que lleva la máquina de anestesia, como por ejemplo los quirófanos de pediatría y ORL, existen mascarillas de doble capa y otros sistemas alternativos de extracción localizada. (Ver figuras 1 y 2). Garantizar una ventilación general suficiente. La ventilación general del quirófano debe estar perfectamente dimensionada para asegurar la eliminación de la contaminación residual, mantener unas condiciones termohigrométricas determinadas (regulables a voluntad de los ocupantes) y garantizar su permanente sobrepresión. Establecer un plan de mantenimiento preventivo. Es importante incluir el control periódico de las instalaciones en el plan de mantenimiento preventivo del hospital. No descuidar la formación e información del personal. Especialmente en lo que se refiere a prácticas de trabajo seguro, revisión de medidas de seguridad y reducción al máximo de la generación de concentraciones de gases anestésicos residuales. FIGURA 1 Sistema de doble máscara FIGURA 2 Máscara ajustable Bibliografía 1. ACGIH Threshold Limit Values and Biological Exposure Indices for 2002 ACGIH, Cincinnati, Oh, USA, 2002. 2. CCE. Anestésicos por vía inhalatoria. En Biological indicators for the assessment of human exposure to industrial 3. 4. 5. 6. 7. 8. chemicals. EUR 12174 EN. Bruselas - Luxemburgo, 1989. Versión española de la Generalitat Valenciana. Conselleria de Sanitat. Direcció General de Salut Pública. Valencia 1997. GUARDINO, X., ROSELL, M.G. Exposure monitoring to anaesthetic gases. En Occupational Health for Health Care Workers, Hagberg, Hofmann, Westlander, Editores, ICOH, ECOMED, Landsberg, RFA, 1993, update 1995. Pag. 212. INSHT Límites de exposición profesional para Agentes químicos en España 2001-2002. Madrid, 2001. INSHT Métodos de toma de muestra y análisis http//www.mtas.es/insht/information/otros/mtm. htm NIOSH NIOSH Manual of Analytical Methods http//www.cdc.gov/niosh/nmam/nmampub. html OSHA OSHA Analytical methods http//www.osha.gov/dts/sltc/methods/index.html ROSELL, M.G. ET AL. Determination of dinitrogen oxide in urine as control to anaesthetic exposure. En Occupational Health for Health Care Workers, Hagberg, Hofmann, Westlander, Editores, ICOH, ECOMED, Landsberg, RFA, 1993, update 1995. Pag. 221 © INSHT


