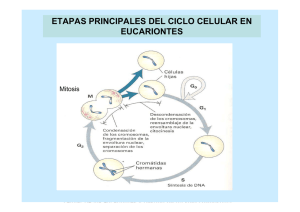
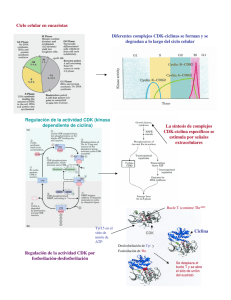
CICLO CELULAR Burke & Ellenberger, Nature Rev. MCB 2002 El ciclo celular consiste en la repetición de una secuencia de eventos o fases: G1, S, G2 y M El período comprendido por las fases G1, S y G2 se conoce como interfase y es en el cual la célula adquiere el estado para distribuir el material genético y citoplasmático, que ocurre durante la mitosis. S G1 Las células pueden detener el ciclo celular temporalmente (quiescencia), o permanentemente (p. ej. neuronas y células del cristalino) en un estado dentro de la fase G1 denominado G0. G2 M Existe un límite en la capacidad proliferativa de las células (“Hayflick limit”). El arresto permanente del ciclo celular inducido por el acortamiento telomérico se denomina senecencia replicativa. En levaduras se demostró que el ciclo celular es regulado por factores externos que promueven el crecimiento Si el ciclo celular ocurriera en tiempos prefijados e invariables, y no estuviera coordinado con el crecimiento de la célula (panel A), se esperaría que en ausencia o restricción de nutrientes el tamaño de las células disminuyera en cada división. Sin embargo, esto no se observa, las células mantienen su tamaño a lo largo de las generaciones (panel B) debido a su capacidad de modular la duración del ciclo celular. Esto revela que los procesos de crecimiento y división celular están acoplados. La restricción de nutrientes o factores de crecimiento inducen el arresto del ciclo celular en G1. Alberts et al., BMC 2002 En los organismos pluricelulares la proliferación celular es un proceso estrictamente regulado En epitelios, las células madre (stem cells) permanecen en un estado de quiescencia en G0 (a, en rojo). La ruptura del epitelio estimula la proliferación de las células madre (b, en verde). Las células nuevas se diferencian en diversos tipos celulares y reparan el daño (c), restaurando un nuevo estado estacionario del epitelio (a). Los daños permanentes o crónicos de los epitelios promueven la activación persistente de las células madre y aumentan la probabilidad de aparicióon de mutaciones oncogénicas que auto-perpetuen la proliferación y la formación de tumores (d y e). b d,e Beachy et al., Nature 2004 Diversas señales extracelulares regulan la proliferación y apoptosis en los tejidos. Hormonas (ej. prolactina), factores paracrinos (ej. HGF, Wnt, TGFβ, etc) y la matriz extracelular controlan la proliferación y diferenciación en la glándula mamaria durante la pubertad, embarazo y la lactancia. Cuando la lactancia finaliza, el epitelio alveolar involuciona por apoptosis de las células secretoras. El TGFb, p.ej, inhibe tubulogénesis y promueve la apoptosis. La prolactina es una hormona que activa la vía de JAKSTATs. Las STATs inducen la transcripción del gen de b-caseína, una de las principales proteínas de la leche. Secciones de glándula mamaria de ratones en el período de lactancia. En marrón se visualiza la expresión de TGFb. A: normal; B y C: animal donde se previene la succión. Las flechas en C indican células apoptóticas. A B prolactina, Wnts, EGF, HGF, etc C oxitocina Las células madre poseen un potencial replicativo ilimitado y son una fuente de renovación celular en los tejidos adultos Skin epithelium stem cells Paneth cells transit amplyfing cells Goblet cells enteroendocrine cells enterocyte Las células madre (stem cells) localizadas en el epitelio se dividen y originan células de tránsito que mientras se desplazan lateralmente se dividen activamente y amplifican la población. En la epidermis, cuando llegan a la base de las papilas, estas células se disocian del estrato basal, y migran hacia estratos superficiales a la vez que se diferencian en diferentes células. En el epitelio intestinal, las células de tránsito se diferencian durante su desplazamiento hacia el ápice de las vellosidades. El nivel de proliferación celular de un tejido puede estudiarse determinando la incorporación de BrdU La capacidad replicativa de las células epiteliales epidérmicas correlaciona directamente con la expresión de b1 integrinas. control knock out del gen de β1 La bromodeoxiuridina (BrdU) es un análogo de timina que se incorpora en el DNA cuando las células entran en fase S. En la figura se muestran secciones de folículos pilosos de ratones control (A) y knock out (B) para b1-integrinas teñidos con anti-BrdU. Note que los folículos normales presentan mayor cantidad de núcleos marcados (puntos en marrón) que los del ratón deficiente en beta 1 integrinas (asteriscos y flechas en B). La incorporación de 3H-timidina y la citometría de flujo son otras técnicas experimentales para evaluar la proliferación celular La incorporación de 3H-timidina ocurre en las células que están en fase S (flecha). (A) Autoradiografía. La determinación de la radioactividad incorporada permite cuantificar las células en estado proliferativo (B). A Microscopía de una sección de epitelio B control concentración (B).Células estimuladas a dividirse con insulina fueron incubadas en presencia de un péptido inhibidor de la MAPK Erk o un péptido control. Observe que la incorporación de 3H-timidina disminuye con la ccion del péptido inhibidor. insulin IR Grb10 Erk Ciclinas D péptido inhibidor La citometría de flujo revela el contenido de DNA de una población celular y permite calcular el porcentaje de células en fase G1, S y G2/M. PRINCIPIOS GENERALES DEL CICLO CELULAR unidireccionalidad (secuencia temporal unívoca de eventos encadenados) adaptabilidad (ajustable a las condiciones ambientales) robustez (mantiene la fidelidad del proceso aun en condiciones variables) Mecanismos de control o “checkpoints” monitorean las condiciones requeridas para la transición de una fase a la siguiente Mecanismos irreversibles, de “switch”, o de “todo o nada” controlan 3 transiciones críticas del ciclo: 1- G1/S ( duplicación del ADN) 2- G2/M (formación del huso mitótico) 3- Metafase-Anafase (distribución de los cromosomas) Complejos heterodiméricos formados por quinasas y ciclinas controlan los principales eventos moleculares de cada fase Whi5 Lodish et al., MBC 2004 Los niveles de expresión de las diferentes ciclinas varían de manera periódica durante el ciclo celular Experimentos pioneros con embriones de erizos de mar y almejas permitieron identificar las ciclinas mitóticas Durante el desarrollo embrionario temprano de estos organismos las células se dividen sincrónica y rápidamente alternando fases de S y M. El análisis en geles de poliacrilamida de extractos proteicos de embriones, preparados a distintos tiempos, revela variaciones cíclicas en los niveles de ciclinas mitóticas (ciclinas B), con un pico máximo al comenzar cada mitosis que correlaciona con la máxima actividad de MPF. ciclina B ribonucleótido reductasa La desaparición de las ciclinas al finalizar la mitosis ocurre por su degradación en proteosomas. Adaptado de Hunt et al, JCB 1992 Los complejos de ubiquitinación SCF y APC regulan transiciones entre fases del ciclo activating subunit Ubi ligase El complejo APC se activa por fosforilación y por la unión de los cofactores Cdc20 y Cdh1 durante la mitosis. Cdc20 y Cdh1 además determinan la especificidad de los substratos. APC reconoce motivos específicos (degrones) en las ciclinas de las fases S y M. degrón Ubi ligase En contraste, el complejo SCF esta siempre activo y la regulación ocurre a nivel de los substratos. SCF reconoce a los substratos solo cuando son fosforilados en secuencias específicas (fosfodegrones). APC: Anaphase Promoting Complex SCF: Skp1/Cullin/F-box protein) Alberts et al., BMC 2008 SCF y APC, promueven la degradación de ciclinas e inhibidores del ciclo celular inhibidores de G1 S (ej. p21, p27, Sic1 y ciclinas de G1 y G1/S son degradadas por SCF) inhibidores de metafase anafase (ej. Wee es degradada via SCF; securina es degrada por APC-Cdc20) inhibidores de anafase telofase/citokinesis (ej. ciclinas mitóticas (B) son degradadas por APC-Cdh1) ciclinas de G1/S APC: Anaphase Promoting Complex SCF: Skp1/Cullin/F-box protein) Reed, NRMCB 2003 Las Cdks se activan transitoriamente y promueven transiciones y el desarrollo de fases del ciclo. Mientras que los niveles de expresion de las ciclinas oscilan durante el ciclo celular, los niveles de Cdk son relativamente constantes. La expresión de ciclinas es regulada a nivel transcripcional y posttraducción. Al final de la mitosis las ciclinas son degradadas en proteosomas. Activity of CDKs SCF activity La actividad de CDK-ciclinas y APC/C se regulan mutuamente Cdk es una Ser/Thr quinasa que depende de la unión a una ciclina para activarse (a) La Cdk no unida a ciclina está autoinhibida por un bucle flexible (T-loop=activation loop) y una hélice alfa que bloquean el acceso del substrato al sitio activo unido al ATP. (b) La unión de la ciclina a la Cdk induce cambios conformacionales que exponen el sitio activo al solvente y permite la unión del substrato. Las ciclinas cumplen dos funciones básicas: 1) activan las Cdks 2) determinan la especificidad por los substratos Lodish et al., MBC 2004 La fosforilación de Cdk constituye otro nivel de regulación de su actividad La kinasa CAK fosforila la treonina 160 en el bucle flexible (T-loop) del dominio catalítico de Cdk1 y Cdk2 lo cual incrementa su afinidad por el substrato y potencia ~ 150 veces su actividad. (CAK) Cdk-Activating Kinasa Lodish et al., MBC 2016 La fosforilación de sitios inhibidores bloquea la actividad de los complejos Cdk/ciclinas Antes de comenzar la mitosis, las Cdk1 es fosforilada en un sitio activador (Thr160) por la kinasa CAK, y en uno o dos sitios inhibidores (Thr14, Tyr15) por la kinasa Wee1. En este estado la Cdk tiene muy baja afinidad por el substrato y es inactiva. Al final de la fase G2, Cdk1 es activada por la fosfatasa dual Cdc25 que remueve el fosfato del sitio inhibidor. Un mecanismo similar regula a Cdk2. s MPF (Mitosis Promoting Factor) = Cdk1-ciclinas B CAK: Cdk-Activating Kinase Otro mecanismo que regula negativamentge la actividad de Cdks es la expresión de inhibidores CKI: Cdk Kinase Inhibitors Cdk4/6 Los inhibidores (CKI) se unen a la Cdk o al complejo CDK-ciclina y emplean diversos mecanismos para inhibir la actividad de la Cdk: ej. bloqueo del acceso del dominio catalítico al substrato, cambios estructurales del sitio activo de la Cdk, bloqueo de la interacción con la ciclina, etc. Hay inhibidores que actúan sobre diferentes Cdks (ej. p16, p21, p27, p57, Sic1) y otros que son específicos (ej. p16/INK4a inhibe Cdk4 y 6 en G1). Alberts et al., BMC 2002 Las Cdk integran señalización de varias vías (“inputs”), que regulan de manera positiva y negativa la actividad. Cdk Los complejos Cdk-ciclinas fosforilan proteínas que controlan eventos específicos de las fases del ciclo celular. Por ej. durante la fase M, Cdk1-ciclinas M fosforilan substratos requeridos para la condensación de la cromatina, ruptura de la membrana nuclear, ensamble del huso mitótico, etc. Alberts et al, MBC 2015 EXPERIMENTOS QUE PERMITIERON IDENTIFICAR REGULADORES CLAVES DEL CICLO CELULAR Experimentos de fusión de células revelaron la existencia de factores difusibles que controlan el ciclo celular Experimentos que revelan la actividad de las Cdk de fase S Experimento que revela la actividad de las Cdks de fase M El citoplasma de células en fase S induce a núcleos en G1 (A) y no de G2 (B) a iniciar la replicación del DNA. (C) El núcleo en G2 no se modifica y el núcleo de G1 entra en fase S de acuerdo a su propio ritmo. La fusión de una célula en fase M con otra en fase G1 induce eventos en el núcleo de G1 característicos de las primeras fases de la mitosis. Experimentos en Xenopus permitieron aislar un factor que promueve la maduración de ovocitos (MPF, Maturation Promoting Factor) El MPF identificado en Xenopus es el equivalente molecular al complejo de CDK-ciclinas M La microinyección del citoplasma de huevos maduros en ovocitos arrestados en G2 induce la mitosis y la maduración a huevo sin necesidad de progesterona (b). El factor fue aislado y se denominó “Maturation Promoting Factor” o MPF. Cuando el MPF es inyectado en células somáticas en interfase promueve la mitosis (c). release from the ovary (ovulation) Huevo arrestado en meiosis II Ovocito arrestado en G2 bajos niveles de actividad MPF altos niveles de actividad MPF mitosis (b) microinyección de citoplasma (c) microinyección de MPF mitosis mitosis Ovocito arrested en G2 célula en interfase Lodish et al, MBC2004 La actividad del MPF es máxima durante la profase y metafase de cada división Perfil de actividad del MPF durante la maduración de oocitos de Xenopus, la fertilización y las etapas iniciales del desarrollo embrionario. huevo ovocito ↑Wee1, ↓Cdc25, ↓Wee1, ↑Cdc25, cytostatic factor APC primer arresto ↑Ca 2+ ↑APC segundo arresto tiempo Lodish et al, MBC2004 Los factores que controlan el ciclo celular pueden identificarse mediante el análisis genético en levaduras La levadura S. cerevisiae (budding yeast) es unicelular, tienen un genoma relativamente pequeño, tiempo de duplicación corto (~90 min) y posee un estado de reproducción haploide. Los genes cuyas mutaciones arrestan el ciclo celular se denominan “cell division cycle” genes o cdc genes. Solo las mutaciones condicionales permiten la propagación de las células. Cdc gene mutant Las mutaciones sensibles a la temperatura resultan típicamente de cambios “missense” (cambio de aminoácido). Usualmente mantienen la función normal de la proteína a una temperatura baja o permisiva. En esta condición las células se pueden propagar. El fenotipo de la mutación se manifiesta restringiendo el crecimiento de la levadura a una cierta temperatura denominada no permisiva o restrictiva. Estudios genéticos en S. pombe permitieron identificar la única Cdk de estas levaduras: Cdc2 Las células de S. pombe se dividen por fisión del citoplasma (A). Las mutantes recesivas para el gen cdc2 (cdc2-) no se dividen y se alargan (B). En contraste, mutantes de ganancia de función (cdcD, dominantes) entran prematuramente a la mitosis, sin crecer lo suficiente (C). A cepa salvaje, tamaño normal cdc2+ B mutante recesiva cdc2- C mutante dominante Sergio Moreno cdc2D Cdc2 de S. pombe es equivalente a Cdc28 de S. cerevisiae Lodish et al, MBC2004 Estudios genéticos en S. pombe también permitieron identificar genes reguladores de la actividad de Cdc2: Wee1 y Cdc25 Fenotipos mutantes en S. pombe modelo de interpretación de los resultados (cdc2-ciclB) inhibidor activador Lodish et al, MBC2004 Modelo de acción de los principales reguladores de la actividad del MPF en S. pombe Estudios genéticos permitieron identificar 4 proteínas reguladoras de Cdc2: la ciclina mitótica Cdc13, equivalente a la ciclina B de vertebrados; la quinasa Wee1, que fosforila el sitio inhibidor (Y15) en Cdc2; la kinasa CAK, que fosforila el sitio activador T161; y la fosfatasa Cdc25, que defosforila Y15 y activa el complejo Cdc2-Cdc13 . (Cdc13) defosforilación del sitio inhibidor (Cdc2) sitio inhibidor sitio activador * La treonina Thr161 de Cdc2 es homóloga a la Thr160 de la Cdk1 de vertebrados. Lodish et al, MBC2004 EVENTOS DE LA FASE G1 - Reconocimiento del origen de replicación (OR). Los complejos ORC se unen a los ORs y marcan los sitios de inicio de la duplicación del ADN. - Licenciamiento del origen. Los adaptadores Cdc6 y Cdt1 son requeridos para reclutar la helicasa Mcm al complejo ORC, formando el complejo de prereplicación que habilita al origen a iniciar la duplicación del ADN. Este proceso solo ocurre en G1 y es bloqueado en el resto de las fases. - Expresión de ciclinas de fase G1 - Expresión de ciclinas G1/S - Inhibición de los complejos Cdk-S El complejo de pre-replicación se ensambla en el origen y en G1, una sola vez por ciclo ORC es un complejo hexamérico que se asocia al OR. Posteriormente los factores Cdc6 y Cdt1 se unen al ORC y reclutan a la helicasa Mcm formando el complejo de pre-replicación o pre-RC que habilita o “licencia” a los OR para iniciar la duplicación en la fase S. Dos mecanismos inhiben el licenciamiento en el resto de las fase: 1) Geminina es un inhibidor de Cdt1 que bloquea el reclutamiento de Mcm; 2) los complejos Cdk-M y Cdk-S fosforilan e inactivan a Cdc6 y Cdt1. Al final de la mitosis y al comienzo de la fase G1, el complejo APC/Cdh1 degrada a Cdk-M y Cdk-S y a la proteína geminina permitiendo el ensamble del pre-RC. Complejos Cdk-M, Geminina Cdt1 ↑APC/Cdh1 Cdt1 Mcm OR: Origin of Replication ORC: Origin Recognition Complex (formado por 6 proteínas, ORC1-6). Mcm: Mini chromosome maintenance (formado por 7 proteínas, Mcm1-7). Cdc6 Lodish et al, MBC 2004; Sclafani & Holzen, ARG 2007 La expresión de ciclinas D es regulada por una red compleja de factores de transcripción Lasa ciclinas D son las principales ciclinas de G1 en vertebrados. Diversos factores extracelulares activan vías de señalización que regulan la expresión/función de factores de transcripción que interaccionan con el promotor. del gen de ciclina D. Klein & Assoian, JCS 2008 La vía ras MAPK induce la expresión de factores de transcripción que luego inducen la expresión de la ciclina D ej. c-fos gene En respuesta a la estimulación de la vía de ras-Erk ocurre la expresión de una primera oleada de genes denominados de expresión temprana, que incluyen a los factores de transcripción c-fosc-Jun y ATF. Estos regulan la expresión de genes de expresión tardía, como por ej. ciclina D. ej. cyclin D ej. c-fos y c-jun genes ERK TCF c-Fos↑ ECM integrins JNK c-Jun↑ cdk inhibitors c-Jun/c-Fos (AP-1) ciclina D ↑Cdk 4/6 TRANSICIÓN G1 S Esta transición requiere de la inactivación de inhibidores de Cdk-ciclinas de fase G1/S y pasaje del punto “Start” o “Restriction point” Cdk-ciclinas de fase S Sic1 Whi5 p21/p27 rb Cdc28-Ciclinas B5/6 en S. cerevisiae Cdk2-ciclinas E/A en vertebrados Cdc28-Clb5/6 (S. cerevisiae) SBF (S. cerevisiae) Cdk2-E/A (vertebrados) E2Fs ciclinas E (vertebrados) Mecanismos de retroalimentacion positiva promueven una transición abrupta de G1 S De estudios realizados en S. cerevisiae Whi5 es un represor transcripcional que inhibe a los factores de transcripción SBF. SBF induce la transcripción de ciclinas de G1/S. Los complejos Cdk-G1 fosforilan e inactivan Whi5. Sic1 es un inhibidor de complejos Cdk-S. La fosforilación de Sic1 en 9 sitios por complejos Cdk-G1 es necesaria para ser reconocidos y ubiquitinados por el complejo SCF, y posteriormente degradados en proteosomas. Como consecuencia, los complejos de Cdk-ciclinas S acumulados durante G1 se desbloquean abruptamente y simultaneamente disparan la masiva duplicación del DNA. La transición abrupta de G1 S depende de mecanismos de retroalimentacion positiva o doble negativa Red de circuitos que regulan la transición G1S en levaduras. Las ciclinas de G1 son resistentes a la degradación mediada por el complejo APC-Cdh1, el cual es activo en G1. SBF: Swi4-Swi6 cell cycle box Binding Factor La síntesis de ciclinas D en vertebrados activa un mecanismo de feedback positivo que promueve la transición G1S Las células estimuladas con factores de crecimiento progresan en G1 hasta superar un estado o punto de no retorno o “restriction point”, a partir del cual adquieren la capacidad para duplicar el DNA, y a partir del cual ya no son necesarias la ciclinas D. G1 Experimento que muestra el requerimiento de ciclinas D para inducir la fase S. Células fueron estimuladas con factores mitogénicos. A distintos tiempos post-estímulo, fueron microinyectadas con anti-ciclina D (barras rojas) o con IgG control (barras celestes) e incubadas con bromodeoxiuridina (BrdU) para detectar las células que están en la fase S. Note que el anti-ciclina D bloquea la fase S cuando es inyectado antes de las 14 h pero pierde su efecto para las 16 h, indicando que el sitio de no retorno ya se superó. La transición abrupta de G1 S en vertebrados depende de mecanismos de retroalimentacion positiva o doble negativa Rb es funcionalmente equivalente a Whi5 de levaduras. Rb inhibe a los factores de transcripción E2Fs por dos mecanismos diferentes: 1) interacción directa y bloqueo estérico de los factores E2Fs, 2) reclutamiento de la histona deacetilasa HDAC al promotor de E2F inhibiendo su transcripción. Cdk4/6-ciclinas D de G1 fosforilan e inactivan Rb, permitiendo pasar el punto de no retorno, en el cual se activan mecanismos de retroalimentación positivos y doble negativos que aseguran la expresión y activación de los factores E2Fs, y las ciclinas A y E. /A retroalimentación positiva p27 gen activo HDAC función inhibida, promotor inactivo Punto de restricción superado (independiente de ciclinas D) HDAC Mid G1 Las ciclinas D son resistentes a la degradación mediada por el complejo APC-Cdh1, el cual es activo en G1. Late G1 Los factores de transcripción E2F promueven la expresión de genes involucrados en la fase S, como ciclinas A y E. También estimulan su propia expresión. EVENTOS DE FASE S Activación de complejos Cdk-S Activación de OR y duplicación del ADN Inactivación de factores de licenciamiento - Apertura del ADN. Las quinasas de fase S, CDK y DDK, activan la helicasa Mcm y comienza el desenrrollamiento del ADN. Este proceso solo ocurre en fase S. - Copia del ADN. Ensamble del replisoma. (2, 3) La fase S se dispara cuando Cdk-ciclinas S y la kinasa (DDK) fosforilan componentes del pre-RC, evento necesario para reclutar el factor iniciador Cdc45. Los complejos Cdk-S activos fosforilan e inactivan a Cdh1, causando la inhibición de APC/Cdh1. Esto permite la acumulación de Geminina. Fosforilación Geminin Activación (3) Cdc45 activa la helicasa Mcm y recluta el replisoma, formandose la burbuja de replicación. La fosforilación de Cdt1 y Cdc6 por Cdk-S induce su disociación del complejo. Geminina se asocia Cdt1 y lo inhibe por el resto del ciclo. (3, 4) Cdc45 recluta proteínas del replisoma (polimerasas, primasas, ligasas, topoisomerasas, etc) y las proteínas Rpa que protegen las hebras simples del DNA de la degradación por nucleasas. Cdk-S y Cdk-M fosforilan a los factores de iniciación Cdc6 y Cdt1 impidiendo su re-asociación al ORC. Cdc6 y Cdt1 fosforilados son ubiquitinados por SCF y degradados o exportados al citoplasma. Cdt1 es además inhibido por Geminina. Estos mecanismos redundantes aseguran que cada origen de replicación dispare la síntesis del DNA una sola vez por ciclo. La degradación de las ciclinas S/M y Geminina por APCCdh1 al final de la mitosis y la actividad de fosfatasas durante G1, permiten que los factores de iniciación de la replicación ensamblen un nuevo pre-RC en el siguiente ciclo. DDK: Dbf4-Dependent Kinase Replisoma y duplicación bidireccional del ADN microscopía electrónica E. coli tiene un solo OR para duplicar el ADN (replicón). Los cromosomas eucariotas tienen varios ORC/replicones, aproximadamente unos 300 en la levadura S. cerevisiae. Lodish et al, MBC2004; Leman & Noguchi, Genes 2013 El replisoma constituye un complejo de proteínas asociado a las horquillas de replicación. Formado por polimerasas (, , ), adaptadores (RFC, PCNA, GINS) y diferentes enzimas y reguladores (GINS, Cdc45, primasas, etc). Las cromátides duplicadas se mantienen unidas por complejos proteicos denominados cohesinas Las cohesinas son complejos formados por 4 proteínas principales, dos subunidades, Smc1 y 3, pertenecen a la familia de proteínas SMC (Structural Maintenance of Chromosomes), se asocian por los extremos formando una estructura con forma de abrazadera que envuelve las dos cromátides. Las proteínas Scc1 y 3 cierran y estabilizan la estructura. Scc1 y 3 son degradadas por APC-Cdc20 al comienzo a la Anafase. cohesinas (bisagra) Anafase Alberts et al, MBC 2015 TRANSICIÓN DE LA FASE G2 M Activación de complejos Cdk-M Cdc28-Ciclinas B1-4 (S. cerevisiae) Cdk1-ciclina B (vertebrados) Cdc25 activa complejos Cdk-M al final de G2 y dispara la mitosis La fosfatasa Cdc25 es activada por las quinasas Polo y Cdk-M generando un circuito de retroalimentación positivo. Cdk-M además fosforila e inhibe a la quinasa inhibidora Wee1 (circuito de retroalimentación doble negativo). Como consecuencia al final de G2 se produce un aumento abrupto de la actividad de Cdk-M. ciclina M CAK Tyr incrementa expresión en G2, activación ↑Polo kinase Thr (stress signaling) p38 Cdk1 ~ Cdc28 ~ Cdc2 P ↑Polo kinase inhibición, ubiquitinación y degradación en proteosoma ATM, ATR, chk1 & 2 MPF activo DNA no replicado y/o dañado Retroalimentación positiva y doble negativa asegura la amplificación de la actividad de los complejos Cdk-M EVENTOS CONTROLADOS POR CDK-M EN MITOSIS fosforilación de laminas desensamble de la lámina nuclear eventos nucleares fosforilación de nucleoporinas desensamble de poros nucleares fosforilación de proteínas de anclaje de la cromatina a la membrana desestabilización de la envoltura nuclear y de la cromatina fosforilación de condensinas empaquetamiento de la cromatina Cdk-M eventos citoplasmáticos fosforilación de MAPs incremento del dinamismo de los MTs fosforilación de proteínas del RE y Golgi inhibición del tráfico y fragmentación del Golgi y RE. Fosforilación de las laminas y ruptura de la envoltura nuclear Los complejos Cdk-M fosforilan las laminas A, B y C evento que conduce a la depolimerización de los filamentos intermedios y al desensamble de la lámina nuclear. La lamina B fosforilada permanece anclada a la membrana nuclear interna por un ácido graso. La fosforilación de nucleoporinas provocan el desensamble parcial de los poros nucleares. microscopía de barrido de la lámina nuclear Cdk-M MPF Activación de condensinas y empaquetamiento de la cromatina complejo de condensinas Las condensinas son complejos multi-proteicos que se asocian al DNA e inducen su empaquetamiento dependiente de hidrólisis de ATP. Esta función es promovida por la fosforilación de Cdk-M. Modelo de empaquetamiento de la cromátide Los complejos de condensinas/cohesinas se unen a regiones específicas del DNA denominadas SARs/MARs (scaffold/matrix-attachment regions). Alberts et al 6th Ed Modelo de condensación de la cromatina fibra de 11 nm (hilera de nucleosomas) fibra de cromatina de 30 nm en un cromosoma de metafase (~2 mm de largo) la doble hebra del DNA (~1,5 cm de largo) se empaqueta por un factor de ~7.500 Visualización de condensinas en cromosomas en metafase En estas imágenes de fluorescencia los cromosomas estan teñidos con anticuerpos contra condensinas (rojo) y el DNA esta teñido con Hoescht (azul) Cdk-M promueve el incremento en el dinamismo de los microtúbulos de metafase Cdk-M fosforila catastrofinas y otras MAPs efecto que incrementa la inestabilidad dinámica de los microtúbulos. La vida media de microtúbulos de interfase es ~ 5-10 min y disminuye a < 1 min en mitosis. Las catastrofinas se unen a los extremos (+) de los microtúbulos provocando la disociación de monómeros e incrementando la frecuencia de catástrofes (transición de elongación acortamiento). El Cdk-M y otras quinasas, ej Polo y Aurora, fosforilan componentes de centrosomas y kinesinas, promoviendo el ensamble del aparato mitótico La estructura y dinámica del aparato mitótico depende de la actividad coordinada y combinatorial de diferentes motores. Alberts et al 6th Ed Cdk-M regula varios aspectos de mitosis: 1) duplicación y separación de centrosomas, 2) posicionamiento y alineamiento del huso, 3) condensación y cohesión de los cromosomas, 4) orientación y función de los cinetocoros, 5) elongación del huso y ensamble de la zona media en anafase. 3 4 1 5 Enserink & Kolodner, Cell Division 2010 2 El tráfico anterógrado vesicular es inhibido durante la mitosis Fragmentación del Golgi durante la mitosis y su re-ensamble al final de la misma. Se visualiza la distribución de GFP-GalNac-T2, una glicosil transferasa del Golgi. El complejo Cdk-M fosforila e inactiva a proteínas que estabilizan las cisternas del Golgi, promoviendo la desintegración del RE y Golgi. Magnus et al MBC2004, Yeong, BioEssays 2013 TRANSICIÓN DE METAFASE ANAFASE Fosforilación y activación de APC por complejos Cdk-M Unión del cofactor Cdc20 a APC Degradación de securinas y ciclinas mitóticas. APC ubiquitina y promueve la degradación de proteínas que inhiben la transición Metafase/Anafase y también eventos de telofase y citoquinesis Cdk1-cicl B (vertebrados) inactivo Anafase tardía fosforilación Cdh1 activo (securinas) Metafase/Anafase Cdc20 La destrucción de securina y cohesinas es requerida para iniciar la anafase Las proteínas Scc1 y 3 cierran el anillo formado por las proteínas Smc sobre las cromátides duplicadas. Scc1 y 3 son substratos de la proteasa separasa. Separasa es inhibida en fases previas a la anafase por la proteína securina. La activación de APC-Cdc20 promueve la ubiquitinación y degradación de securina en proteosomas. La separasa activa degrada Scc1/3, permitiendo la separación de las cromátides en la Anafase. APC-Cdc20 también inicia la degradación de ciclinas S y M. proteosoma Scc3 Scc1 Smc3 Smc1 Anafase cromátides duplicadas La destrucción total del MPF es requerida para finalizar la mitosis En la fase G1, la fosforilación de Cdh1 por Cdk-ciclinas G1/S inhibe su unión a APC y permite la acumulación de las ciclinas S y M. En la anafase tardía la fosfatasa Cdc14 defosforila Cdh1, y permite su unión al complejo APC. La unión del cofactor Cdh1 a APC es requerida para la ubiquitinación y degradación masiva de las ciclinas mitóticas, de fase S, Polo kinase, etc. Secuencia reconocida por APC en las ciclinas mitóticas Esta secuencia no está presente en las ciclinas de G1 y G1/S, por lo tanto no son blanco de APC-Cdh1. Cdh1: Cdc20 homology-1. Fosforilado en G1 por Cdk-ciclinas G1/S. Lodish et al, MBC2004 La inactivación del MPF permite la descondensación de los cromosomas y la reformación del núcleo La inactivación del MPF permite la activación de miosina y el desarrollo de la citoquinesis La acción de fosfatasas es requerida para la inactivación de Cdk-M y la inducción de la citoquinesis Durante interfase y mitosis temprana Cdc14 es una fosfatasa retenida inactiva en el nucleólo. Al final de la anafase Cdc14 es liberada y defosforila al cofactor Cdh1, permitiendo su unión y activación de APC. normal nucleolo kinasas (Cdc15) Cdc14 Cdc14 Cdh-APC La fosfatasa Cdc14 defosforila substratos necesarios para la formación de un complejo multiproteico en la zona media, que estabiliza microtúbulos polares antiparalelos (en verde), y que marca el sitio donde ocurrirá la citoquinesis. mutante de cdc14 PRC1, kinesins Cdk-M citoquinesis Cdc14 PRC1, kinesin MTs del huso intermedio PRC1: Protein Regulator of Cytokinesis, es una MAP que se une a microtúbulos anti-paralelos polares y estabiliza la zona media. Secuencia de eventos durante la citoquinesis en células animales (a) Extremos (+) de microtúbulos anti-paralelos polares se superponen en la zona ecuatorial del huso mitótico y son estabilizados por Kinesins (KIF4) y PRC1. Un complejo multiproteico define la zona media donde se ensamblará el anillo contráctil. El complejo recluta activadores de RhoA a la membrana. (b) RhoA activa forminas y dirige el ensamble de un anillo de actina y miosina contráctil. (c) Anillina y otras proteínas “scaffold” anclan el complejo contráctil a filamentos proteicos de septinas asociados a la membrana. (d) (e) La fusión de las membranas en el sitio de escisión requiere del ensamble de filamentos de proteínas ESCRT en las zonas flanqueantes al cuerpo medio. La escisión de las membranas requiere de hidrólisis de ATP. PRC1: Protein Regulator of Cytokinesis, PRC une a microtúbulos polares antiparalelos. ESCRT: Endosomal Sorting Complexes Required for Transport Forminas RhoA RhoK myosin midbody Green et al Annu Rev Cell Dev Biol 2012 REGULADORES POSITIVOS Y NEGATIVOS DEL CICLO CELULAR EN CÉLULAS DE MAMÍFEROS Una red compleja de interacciones funcionales opera en G1 y determina el arresto o progreso de las células hacia la fase S ECM TGFβ β-catenin p16 Tcf cytokines STATs Johnson & Skotheim, 2013 En vertebrados, 2 familias de inhibidores bloquean Cdks y arrestan el ciclo Cdk2-E integrinas p53 (-) (+) *cumplen una función similar al inhibidor Sic1 en S. cerevisiae SCF-ubiquitina - p21CIP * - CIP/KIP - p27KIP1 - p57KIP2 Cdk2-E/A TGF-b caderinas otro grupo de inhibidores de Cdks: - INK4 (p16) Cdk4/6-ciclinas D Proteínas reguladoras del ciclo celular Alberts et al., BMC 2008 Proteínas reguladoras del ciclo celular Protein kinases and protein phosphatases that modify Cdks Cdk-activating phosphorylates an activating site in Cdks kinase (CAK) Wee1 kinase phosphorylates inhibitory sites in Cdks; primarily involved in controlling entry into mitosis Cdc25 removes inhibitory phosphates from Cdks; three family members phosphatase (Cdc25A, B, C) in mammals; Cdc25C is the activator of Cdk1 at the onset of mitosis Cdk inhibitory proteins (CKIs) Sic1 (budding suppresses Cdk activity in G1 ; phosphorylation by Cdk1 triggers its yeast) destruction p27 (mammals) suppresses G1/S-Cdk and S-Cdk activities in G1; helps cells to withdraw from cell cycle when they terminally differentiate; phosphorylation by Cdk2 triggers its ubiquitylation by SCF p21 (mammals) suppresses G1/S-Cdk and S-Cdk activities following DNA damage in G1; transcriptionally activated by p53 p16 (mammals) suppresses G1-Cdk activity in G1; frequently inactivated in cancer Ubiquitin ligases and their activators SCF catalyzes ubiquitylation of regulatory proteins involved in G 1 control, including CKIs (Sic1 in budding yeast, p27 in mammals); phosphorylation of target protein usually required for this activity APC catalyzes ubiquitylation of regulatory proteins involved primarily in exit from mitosis, including Securin and M-cyclins; regulated by association with activating subunits Cdc20 APC-activating subunit in all cells; triggers initial activation of APC at metaphase-to- anaphase transition; stimulated by M-Cdk activity Hct1/Cdh1 maintains APC activity after anaphase and throughout G1; inhibited by Cdk activity Whi5. Yeast transcriptional repressor that binds and inhibits the yeast transcription factor SBF. SBF and MBF. Yeast transcription factors that induces the transcription of G1/S cyclins (Cln 1 y 2). Rb. Mammal Retinoblastoma protein binds to and inhibits E2F transcription factors. Functionally equivalent to Whi5. Gene regulatory proteins E2F promotes transcription of genes required for G1/S progression, including genes encoding G1/S cyclins, S-cyclins, and proteins required for DNA synthesis; stimulated when G1-Cdk phosphorylates Rb in response to extracellular mitogens p53 promotes transcription of genes that induce cell cycle arrest (especially p21) or apoptosis in response to DNA damage or other cell stress; regulated by association with Mdm2, which promotes p53 degradation Resumen de eventos en S. cerevisiae La nomenclatura corresponde mayormente a reguladores identificados en levaduras (S.cerevisiae) temprana G1 S tardía APC inactivo G2 anafase telofase activación fosforilado e inactivo APC activo fosforilación Cdh1 Wee fosforilación Whi5 SBF, ↑transcripción Cdc28-Cln3 ↑transcripción M CAK Cdc28-Cln1 Cdc28-Cln2 Cdc28-Clb1 Cdc28-Clb2 activas proteólisis Cdc20 Cdh1 Cdc25 fosforilación proteólisis SCF Sic1 inactivación Cdc28-Clb5 Cdc28-Clb6 inhibidor de inactivas la fase S Sic1 ensamblaje de complejos de pre-replicación Cdc28-Clb3 Cdc28-Clb4 activas Cdc28-Clb5 Cdc28-Clb6 activas inhibidor de la anafase Cdc7=DDK4 kinasa síntesis del DNA complejos activos inhibición del ensamblaje de nuevos complejos de pre-replicación Whi5 es un represor transcripcional; SBF es un factor de transcrición Cdc28-Clb1 Cdc28-Clb2 Cdc28-Clb3 Cdc28-Clb4 Cdc28-Clb5 Cdc28-Clb6 Nomenclatura comparada y eventos críticos S. cerevisiae vertebrados ciclina Cdk ciclina Cdk función mid G1 Cln 3 Cdc28 D (1-4) Cdk4/6 ↑E2F, ↑SBF, ↓Whi5, ↓Rb G1/S Cln 1, 2 Cdc28 E Cdk2 ↓APC, ↓Sic1, ↓Cdh1 S B 3-6 Cdc28 A Cdk2 ↑replicación del DNA M B 1-4 Cdc28 B Cdk1 ↑APC, ↑huso mitótico, ↑división nuclear MPF ~ Cdc28-Clb ~ Cdc2-Cdc13 ~ Cdk1- cicl B Xenopus S. cerevisiae S. pombe vertebrados CONTROL O "CHECKPOINTS" EN EL CICLO CELULAR señal sensor mediador o transductor efector Sistema de respuesta al ADN dañado (DNA Damage Response, DDR, system) ATM: Ataxia Telangiectasia Mutated ATR: ATM-Rad3-Related Chk1/2: Checkpoint 1/2 Lodish et al Mecanismos de control o "checkpoints" aseguran la correcta duplicación, integridad y distribución del DNA a las células hijas ATM: Ataxia Telangiectasia Mutated ATR: ATM-Rad3-Related Chk1/2: Checkpoint 1/2 (fosfatasa) ATM y ATR son quinasas relacionadas a PI3K; ATM sensa cortes de la doble hélice, ATR sensa alteraciones que generan cadenas simples (ej. horquillas de replicación detenidas). ATM/ATR fosforilan y activan a las Ser/Thr kinasas Chk1 y 2. (fosfatasa) Mecanismos de sensado y respuesta relacionados con alteraciones en la molécula de ADN Sensores: PARP sensan cortes del DNA y marcan el daño mediante la síntesis de cadenas de poly-ADP-ribosa sobre histonas próximas al daño. El complejo MRN luego recluta y activa ATM. Sensors Transducers Effectors Maréchal & Zou, CSHPB2013 p53 es un efector clave de la respuesta al daño del ADN “DNA Damage Response o DDR” En condiciones normales, p53 es una proteína inestable, ubiquitinada por la ubiquitina ligasa Mdm2 y degradada en proteosomas. El daño del DNA activa quinasas (ATM, ATR, Chk) que fosforilan a p53 y provocan su disociación de Mdm2. De esta manera, p53 se acumula y activa la transcripción de CKIs y factores de reparación del DNA. Mecanismos transcripcionales y modificaciones post-traducción inducen el arresto del ciclo y la apoptosis daño del DNA sensores & transductores activación P de quinasas Chk1 y Chk2 p53 P inhibición de la actividad; degradación en proteosoma P Cdc25 Cdk1 Cdk2 p21CIP estabilización de p53 Cdk4/6 Rb E2F ↑ proteínas proapoptóticas: Bax, receptores de Fas, etc G2/M G1/S Una red de proteínas controla el anclaje de los microtúbulos polares al cinetocoro: control “checkpoint” de metafase prometafase, baja tensión Bub y Mad2 activados en el cinetocoro sensors Bub, Mad Cdc20 active Mad Bub mediador Cdc20 Mad Bub efector APC securina inactive El anclaje de los MTs a los cinetocoros de los cromosomas duplicados genera tensión en los cinetocoros. La actividad de quinasas como Aurora-B en cinetocoros no ocupados o con baja tensión 1) reclutan y activan proteínas de control que secuestran al cofactor Cdc20, y 2) desestabilizan la unión de microtúbulos. De este modo, Cdc20 no puede activar a APC. La ocupación de los cinetocoros por los microtúbulos y la generación de tensión bloquean la activación de Mad/Bub, y Cdc20 puede activar a APC. APC-Cdc20 ubiquitina al inhibidor de la anafase y dispara la anafase. MAD: Mitotic Arrest Deficient BUB: Budding Uninhibited by Benzimidazole Mussachio & Salmon NRNCB 2007 La tensión en los cinetocoros controla el anclaje de los MTs al cinetocoro “checkpoint” de metafase La correcta segregación de cromosomas en anafase depende de mecanismos que detectan anclajes aberrantes de los microtúbulos del huso al cinetocoro. La tensión generada por dichos anclajes es detectada por la quinasa Aurora-B, localizada en la placa interior del cinetocoro. Tensión insuficiente en el cinetocoro promueve la fosforilación e inactivación de componentes externos del cinetocoro que anclan a los microtúbulos (ej. el complejo Ncd80), facilitando la disociación de los extremos (+) de los MTs. En condiciones de tensión normal, la ineficiente fosforilación de los substratos del cinetocoro externo incrementa su afinidad por los extremos de los MTs y promueve un anclaje fuerte de los MTs a los cinetocoros. Proteínas “scaffold” del cinetocoro reclutan a los componentes de señalización Bub y Mad en condiciones de baja tensión. Alberts et al 6th Ed