Cinética Enzimática: Teoría de Michaelis-Menten y Eficiencia
Anuncio

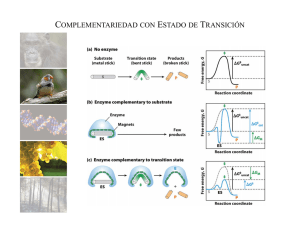
Enzimas Las cinética enzimática es importante para entender el mecanismo de acción de las enzimas Enzimas Cinética de una reacción enzimática Enzimas Condiciones de velocidad inicial En los primeros instantes de la reacción se cumple que: - La formación de producto es despreciable con respecto a la concentración de sustrato - La concentración de sustrato se mantiene constante E+S k1 k-1 ES k2 k-2 E+P Enzimas Teoría de Michaelis-Menten Leonor Michaelis y Maude Menten Esta teoría asume que: - Existe la formación de un complejo Enzima-Sustrato (ES) - El equilibrio entre el complejo ES y la enzima libre es rápido (k1 y k-1 ) - La hidrólisis del complejo ES para formar el producto (k2) es más lenta que: 1) La formación del complejo ES (k1) 2) La hidrólisis del complejo ES para reformar E y S libre (k-1) E+S k1 k-1 ES k2 k-2 E+P Enzimas Gráfico de velocidad inicial en función de la concentración de sustrato Enzimas La cantidad de enzima total limita la velocidad de reacción - La concentración de enzima total debe ser constante para las distintas concentraciones de sustrato - La concentración de enzima debe ser mucho menor que la concentración de sustrato - La concentración de sustrato se mantiene constante - La velocidad máxima se alcanza cuando la enzima está saturada con el sustrato Enzimas La constante Michaeliana representa una concentración de sustrato v0 = vmax [S] Km+[S] si, v0 = ½ vmax, Km = [S] Enzimas Dependencia de la velocidad inicial con la concentración de sustrato En un mecanismo en dos pasos, k2 es el limitante Vmax = k2[E]total A baja concentración de sustrato, la velocidad es proporcional a la concentración (1º orden). A altas concentraciones de sustrato la velocidad es constante (orden 0) Enzimas Método gráfico: doble recíproco de Lineweaver-Burk Enzimas La constante Michaeliana representa afinidad enzima-sustrato E+S k1 k-1 ES k2 E+P Km = k2 + k-1 k1 si, k2 << k-1, Km representa la constante de disociación del complejo ES Km = k-1 k1 = Kd Enzimas Constante Km para algunas enzimas Enzimas Algunas reacciones enzimáticas tiene más de dos pasos En un mecanismo en dos pasos, k2 es el limitante Vmax = k2[E]total E+S k1 k-1 ES k2 k-2 EP k3 E+P luego, Vmax = kcat[ET] Para reacciones en múltiples pasos, kcat corresponde a la constante de velocidad del paso limitante (en este ejemplo k3) kcat (s-1) también se define como NÚMERO DE RECAMBIO Equivale al número de moléculas de sustrato convertido en producto por unidad de tiempo cuando la enzima está saturada con el sustrato Enzimas Número de recambio para algunas enzimas Enzimas La eficiencia catalítica nos permite comparar distintas enzimas para [S] << Km v0 = kcat[ET][S] kM El cociente kcat/Km es una estimación de la eficiencia de la enzima El límite superior para kcat/Km es el límite de difusión, rapidez a la cual E y S difunden juntos (108-109 M-1 s-1) Enzimas Efecto del pH sobre la actividad enzimática Enzimas El pH óptimo de las enzimas está relacionado a su función Enzimas La temperatura también influye en la actividad de las enzimas