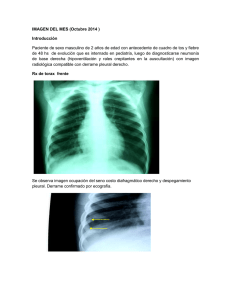
manos frecuente. Sin embargo, en pacientes que ya están infectados, se debe prevenir el contagio de otros pacientes con aislamiento por gotitas. También llamada gripe. Corresponde a una infección respiratoria de etiología viral, causada por los virus influenza. De este virus existen dos serotipos (A y B) que poseen dos antígenos importantes (H y N) de gran variabilidad genética. Las epidemias estacionales son causadas por los virus influenza A y B; desde 1968, la mayoría de las epidemias de gripe estacional se han debido al virus H3N2 (un virus de influenza A). Los virus influenza se pueden diseminar a través de: gotitas aerosolizadas, contacto interpersonal y contacto con elementos contaminados. Así, son grupo de riesgo las personas que son: - Niños < 5 años (especialmente niños < 2 años). Adultos > 65 años. Pacientes con enfermedades crónicas (p. ej., DM, ERC, insuficiencia hepática). Mujeres embarazadas. Pacientes inmunodeprimidos. La morbimortalidad en estos pacientes puede ser secundaria a la exacerbación de la enfermedad aguda, el desarrollo de síndrome de dificultad respiratoria aguda, neumonía primaria por gripe o neumonía bacteriana secundaria. Clínicamente, se presenta con fiebre > 38,5 °C (axilar), tos, mialgias, odinofagia, cefalea, rinorrea. Pudieran aparecer síntomas gastrointestinales como náuseas, vómitos o dolor abdominal. Después de 2 – 3 días los síntomas agudos desaparecen rápidamente, aunque algunos síntomas pueden llegar a durar semanas (autolimitado). Su diagnóstico es clínico. El tratamiento, generalmente, es sintomático con reposo, paracetamol o ibuprofeno e hidratación. En caso de pacientes pertenecientes a un grupo de riesgo se puede utilizar un antiviral como el oseltamivir. Su prevención, para todos los pacientes, se debe realizar con vacunación anual para grupos de riesgo y lavado de Infección causada por el virus hanta, el cual se transmite a los humanos a través de los roedores (vector, ratón de cola larga). En nuestro país, se encuentran en la zona centro y sur, especialmente, en el sector rural. Clínicamente, se caracteriza por un síndrome pulmonar que comienza como una gripe inespecífica con fiebre aguda, mialgia, cefalea y síntomas gastrointestinales. Entre 2 – 15 días más tarde aparece un edema pulmonar no cardiogénica e hipotensión. Su diagnóstico confirmatorio se puede hacer con PCR o con IgM para hantavirus. Además, se presentan alteraciones en el hemograma (hemoconcentración, trombocitopenia y linfocitosis atípica) y en los ELP (hiponatremia). El tratamiento es con soporte ventilatorio escalonado (naricera → mascarilla → mascarilla de recirculación → ventilación mecánica → ECMO) y ATB profilácticos según el caso. Infección viral aguda de las vías respiratorias inferiores. Su etiología es el virus respiratorio sincicial (primera causa de NAC en pacientes < 3 años). El virus se propaga desde las vías respiratorias superiores a los bronquios de mediano y pequeño calibre y a los bronquiolos, y provoca necrosis epitelial y desencadena una respuesta inflamatoria. El edema y la exudación causan obstrucción parcial, que es más pronunciada durante la espiración e induce atrapamiento aéreo. Su clínica y su tratamiento varía según su presentación: 1. No obstructiva: es similar a un resfriado común, presentándose con fiebre, rinorrea, tos y Respiratorio | 1 examen pulmonar normal. Su tratamiento es sintomático con suero fisiológico tópico para la coriza y antihistamínicos en algunos casos. 2. Obstructiva: se presenta como un síndrome bronquial agudo con fiebre, rinorrea, tos y examen pulmonar anormal (sibilancias, taquipnea, cianosis y uso de musculatura accesoria). Su tratamiento es sintomática asociada a broncodilatadores. Se puede dividir en dos presentaciones típicas: 1. Síndrome bronquial obstructivo (SBO) agudo: episodio respiratorio en pacientes ≤ 2 años. 2. SBO recurrente: episodio respiratorio en pacientes ≤ 2 años que presentan ≥ 3 cuadros en un año de SBO agudo. Su evaluación clínica se hace con el Score de Tal: En base a esta evaluación se realiza el manejo: - - - Score de Tal ≤ 5: Tratamiento en domicilio. Salbutamol cada 4 – 6 hrs con aerocámara x 5 – 7 días y control en sala IRA SOS. Score de Tal 6 – 10: Kinesioterapia y hospitalización abreviada (1 hr) que incluye: o Salbutamol: 3 nebulizaciones cada 20 min o 2 puff cada 10 min x 5 veces. o O2 en caso de que la SatO2 sea ≤ 93%. Score de Tal > 10: Hospitalización. En caso de SBO recurrente se deben utilizar β2-agonistas SOS y corticoides inhalados de forma horaria. Corresponde a la tos que dura > 8 semanas, la cual puede ser seca o productiva. Sus etiologías son variadas: - Descarga nasal posterior (rinitis) Asma bronquial Reflujo gastroesofágico atípico Tabaquismo EPOC Uso de IECAs Su estudio va a ser dirigido según la sospecha clínica desprendida de la historia clínica y el examen físico. Sin embargo, siempre se debe evaluar la presencia de síntomas de alarma: tabaquismo crónico, baja de peso, edad avanzada, fiebre, acropaquías. Respecto a su tratamiento, si presenta síntomas de alarma, se debe iniciar con una radiografía de tórax y luego seguir con un TAC de tórax con contraste (en caso de neoplasia). Por otro lado, si no se presentan síntomas de alarma, se debe eliminar los posibles orígenes como el tabaquismo, uso de IECAS, asma o RGE. Prueba diagnóstica que nos ayuda al conocimiento de la ventilación pulmonar. En ella se miden los flujos y volúmenes respiratorios útiles para el diagnóstico y seguimiento de algunas patologías respiratorias. Generalmente, tras una inspiración máxima se pide al paciente que expulse todo el aire que sea capaz en el menor tiempo posible. Aporta entre otros los siguientes flujos y volúmenes: 1. Capacidad vital forzada (CVF): volumen espirado durante una espiración lo más forzada y completa posible a partir de una inspiración máxima. 2. Volumen máximo espirado en el primer segundo de una espiración forzada (VEF1): es el volumen que se expulsa en el primer segundo de una espiración forzada. 3. Relación VEF1/CVF: indica el porcentaje del volumen total espirado que se expulsa en el primer segundo. Respiratorio | 2 Se realiza fundamentalmente para el diagnóstico diferencial entre asma y EPOC. Ambas patologías presentan un patrón obstructivo, sin embargo, las podemos diferenciar en el grado de reversibilidad del flujo aéreo (asma: reversible). Se administrará salbutamol (400 microgramos, 4 disparos en cartucho presurizado), bromuro de ipratropio o terbutalina con cámara de inhalación y se esperará entre 15 – 30 min para determinar el VEF1. Un aumento de 200 ml y 12% del valor absoluto del VEF1, determinará que la prueba broncodilatadora es positiva. En caso de obstrucción (VEF1/CVF < 0,7) no reversible en pacientes de riesgo podemos asumir el diagnóstico de EPOC. Según los resultados de la espirometría, existen diferentes patrones clasificables en: Va a presentar una CVF < 80% y un VEF1 normal o < 80%, por ende, se mantiene la relación VEF1/CVF > 70%. Espirometría VEF1/CVF ≥ 70% VEF1/CVF < 70% VEF1 y CVF ≥ 80% CVF < 80% CVF ≥ 80% CVF < 80% Normal Restrictivo Obstructivo Mixto Va a presentar una CVF normal y un VEF1 disminuido, por ende, la relación VEF1/CVF es < 0,7 En este caso, se debe hacer una test de broncodilatación, la cual permite valorar el grado de reversibilidad de la obstrucción del flujo aéreo. Sus indicaciones son: sospecha de asma, obtención de patrón obstructivo por primera vez, determinar grado de discapacidad y evaluación preoperatoria. Es una enfermedad frecuente, prevenible y tratable, que se caracteriza por síntomas respiratorios y una limitación del flujo aéreo persistentes, que se deben a anomalías de las vías respiratorias o alveolares causadas generalmente por una exposición importante a partículas o agentes nocivos. Fisiopatológicamente, se compone de dos entidades: 1. Bronquitis crónica: tos productiva la mayoría de los días de la semana durante al menos 3 meses de duración total en 2 años sucesivos. Se asocia a obstrucción del flujo de aire. Su diagnóstico es clínico. 2. Enfisema: Es la destrucción del parénquima pulmonar que aumenta la tendencia al colapso de la vía aérea. Es la responsable de la hiperinsuflación que, asociada a la limitación del Respiratorio | 3 flujo aéreo, genera atrapamiento de aire. Su diagnóstico es anatomo-patológico. Respecto a las causas, alrededor del mundo, su etiología más frecuente es el tabaquismo. Por otro lado, también se puede producir por exposición a biomasa (producción de carbón, cocina o estufa a leña, etc.). El síntoma principal es tos crónica con o sin expectoración mucosa, disnea (al inicio de esfuerzo y progresivamente se presenta en reposo). Estos síntomas suelen ser constantes durante el día y entre días (a diferencia del asma). El examen físico puede ser variado, pero a modo general se va a presentar con torax en tonel, espiración prolongada, percusión hipersonora, MAV disminuido, campos pulmonares ampliados, sibilancias y roncus. 1. Espirometría: patrón obstructivo (VEF1/CVF < 70%) sin reversibilidad post prueba de broncodilatador (cambio en VEF1 < 12% y < 200 ml). Se puede clasificar en grados de severidad: a. Leve: VEF1 ≥ 80%. b. Moderada: 50% ≥ VEF1 < 80%. c. Grave: 30% ≥ VEF1 < 50%. d. Muy grave: VEF1 < 30%. 2. Radiografía de torax: descenso y aplanamiento de las cúpulas diafragmáticas, aumento del diámetro anteroposterior del tórax, de la transparencia pulmonar y del espacio aéreo retroesternal. 3. Oximetría de pulso y gasometría arterial: en la insuficiencia respiratoria se observa disminución de la SaO2 (< 90%), hipoxemia (PaO2 < 60 mm Hg), seguida de hipercapnia (PaCO2 >50 mmHg) y acidosis respiratoria (pH <7,35). 1. Suspender tabaquismo o fuente de biomasa. 2. Broncodilatadores de acción corta: a. β2 agonistas: salbutamol 1 puff cada hora por 2 – 3 días y luego cada 2 – 4 hrs según respuesta. b. Anticolinérgicos: bromuro de ipratropio. Se indica cuando existe contraindicación de β2 agonistas. 3. Broncodilatadores de acción prolongada: se dan de forma horaria. β2 agonistas (salmeterol), anticolinérgicos (tiotriopio). 4. Corticoides inhalados. Se debe dejar con oxígeno domiciliario en caso de insuficiencia respiratoria, es decir, PaO2 < 55 mmHg o < 60 mmHg con comorbilidades (p. ej., hipertensión pulmonar, cor pulmonare, poliglobulia). Corresponde a la descompensación del EPOC, siendo su causa más frecuente las infecciones respiratorias de origen bacteriano. Clínicamente, se caracteriza por el empeoramiento de los síntomas basales, es decir, aumento de la disnea, aumento de esputo o cambios de coloración del esputo. Para el diagnóstico es importante los gases arteriales (permiten definir tratamiento), radiografía de torax (para descartar complicaciones) y un cultivo del esputo. Respecto a su manejo, se deben considerar: 1. Corticoides endovenosos: disminuye la mortalidad de EPOC descompensado. Hidrocortisona 100 mg IV cada 6 – 8 h o metilprednisolona 40 mg/d x 5 días. 2. Broncodilatadores de acción corta. 3. Antibióticos: a. Ambulatorio: como NAC ATS II, es decir, amoxicilina + ácido clavulánico o macrólido o levofloxacino. b. Hospitalizado: como NAC ATS III, es decir, ceftriaxona o levofloxacino. 4. Oxígeno: en bajas dosis para saturar 88 – 90%. Jamás administrar en altas dosis por riesgo de depresión del centro de respiración. 5. Ventilación mecánica: a. No invasiva: pacientes con acidosis importante (7,25 – 7,35) o hipercapnia (> 55 mmHg) y sin compromiso de conciencia. b. Invasiva: pacientes con acidosis importante (< 7,25) o hipercapnia (> 60 Respiratorio | 4 mmHg) y conciencia. con compromiso de Enfermedad caracterizada por la inflamación difusa de las vías aéreas causada por una variedad de estímulos desencadenantes que da lugar a una broncoconstricción parcial o completamente reversible. Su característica principal es la hiperreactividad bronquial, que está dada por un mecanismo de hipersensibilidad tipo I (mediada por eosinófilos e IgE). Existe una variante llamada “asma del panadero”, la cual es asociada al harina. Se caracteriza por presentar disnea paroxística (ocasionalmente se acompaña de sensación de opresión torácica), que se resuelve espontáneamente o con el tratamiento, respiración sibilante, tos paroxística seca (se agrava con frío, alergias, infecciones o ejercicio). Al examen físico se pesquisan sibilancias y roncus, espiración prolongada. Durante las exacerbaciones se observa aumento de trabajo de los músculos respiratorios accesorios y taquipnea. 1. Espirometría: puede ser normal o presentar patrón obstructivo (VEF1/CVF < 70%) con reversibilidad post prueba de broncodilatador (cambio en VEF1 > 12% y > 200 ml). 2. Rx de tórax: En general es normal, en las exacerbaciones pueden aparecer características de la hiperinsuflación pulmonar y de las complicaciones de la exacerbación (p. ej. neumotórax). También permite descartar focos de infección. 3. Pruebas de provocación bronquial: se utiliza histamina o metacolina, o el ejercicio. Es sensible, pero no especifica. Es positiva en asma, fibrosis quística y rinitis alérgica. Caída del VEF1 > o igual al 20%. Generalmente, cuando se diagnostica asma, se posiciona a los pacientes en el Grado II. Luego de recibir el tratamiento acorde al Grado, se debe controlar al paciente en 1 mes en cuanto a: - Síntomas diarios Limitación de la actividad Síntomas nocturnos Necesidad de medicamentos Función pulmonar (PEF/VEF) Un paciente no controlado presenta alteración de ≥ 3 características anteriores. Respiratorio | 5 Corresponde a la exacerbación del asma, generalmente, a causa de infecciones respiratorias o exposición a alérgenos. Se manifiesta con aumento de los síntomas basales, aparición de sibilancias y uso de musculatura accesoria. 1. Fase catarral: 1- 2 semanas. Síntomas pseudogripales (fiebre leve o sin fiebre), aparece tos al principio nocturna y seca, para posteriormente producirse durante el día y en forma de accesos. 2. Fase paroxística: 4 – 6 semanas. Accesos de tos sofocante sin inhalación de aire (incontrolables) que termina en un estridor laríngeo, al final del ataque el paciente expectora una secreción densa y glutinosa. Los accesos pueden venir acompañados de edema y cianosis facial, equimosis en la cara y conjuntivas. En neonatos y niños pequeños en lugar de tos puede ocurrir apnea y/o convulsiones generalizadas. 3. Fase de convalecencia: 3 – 4 meses. Tos remite gradualmente, pero episódicamente puede intensificarse de nuevo. A modo general su manejo se basa en: 1. 2. 3. 4. Oxígeno en altas dosis (100%). Broncodilatadores de acción corta. Corticoides endovenosos. ATB en caso de sospecha de neumonía. También llamada tos ferina o tos convulsiva. Corresponde a una enfermedad infecciosa bacteriana que se manifiesta por una bronquitis de curso prolongado y con accesos (repetición) de tos. Es causada por el bacilo gramnegativo aerobio Bordetella pertussis, que produce la toxina pertussis, siendo su vía de entrada las vías respiratorias superiores. La toxina provoca necrosis del epitelio respiratorio (más intensa en la tráquea), que resulta en una alteración en la secreción del moco (denso y glutinoso) y una fuerte estimulación del reflejo tusivo. El cuadro clínico es similar a una bronquitis con tos crónica y paroxística. El curso de la enfermedad y la intensidad de sus síntomas son muy variables y dependen del estado inmunitario del paciente. Para la identificación del agente etiológico se utiliza cultivo de exudado faríngeo o nasal, pruebas serológicas (ELISA con detección de anticuerpos específicos contra la toxina) y métodos moleculares (PCR). Otra de las pruebas que se puede hacer es el hemograma, que suele demostrar leucocitosis con predominio de linfocitos (signo útil, pero no patognomónico). Su tratamiento es con ATB, específicamente, con macrólidos (azitromicina en el 1° día 500 mg en la dosis única, desde el 2° hasta el 5° día 250 mg cada 24 h; claritromicina 500 mg cada 12 h durante 7 días o eritromicina 500 mg cada 6 h durante 14 días). Su prevención se realiza en todos los recién nacidos según el plan nacional de inmunización. Se puede dar una profilaxis con macrólidos a los pacientes con esquema de vacunación incompleto y en embarazadas. Se define como la inflamación aguda del parénquima pulmonar de origen infeccioso. Corresponde a la tercera causa de muerte de la población chilena en general. Mientras que, es la principal causa de muerte por enfermedades infecciosas y la primera causa específica de muerte en los mayores de 80 años. Se divide en Respiratorio | 6 neumonía adquirida en la comunidad (NAC) y en neumonía intrahospitalaria (NIH). Se define como comunitaria, cuando se adquiere en un ambiente extrahospitalario o se manifiesta en las primeras 48 – 72 horas del ingreso a una institución de salud y el paciente no estuvo hospitalizado en los 7 días previos a su admisión. La NAC es causada por un número reducido de especies de gérmenes, siendo los más frecuentes: - - - Bacilos gram+ (adultos): Streptococcus pneumoniae (neumococo) [50%] y Mycoplasma pneumoniae (1 – 37%) [germen atípico]. Bacilos gram-: Chlamydophila pneumoniae (4 – 19%) [germen atípico], Haemophilus influenzae (2 – 11%). Casos excepcionales: o Px < 3 años: virus respiratorio sincicial. o Px inmunodeprimido: es característico el pneumocisti carini. o Post influenza: S. Aureus (forma abscesos y es multifocal). Incidencia: S. pneumoniae > H. influenzae > M. pneumoniae. Clínicamente, se presenta con: 1. Síntomas: En general de inicio agudo. Fiebre, escalofríos y sudoración, dolor torácico de características pleuríticas, tos, expectoración purulenta y disnea (en algunos enfermos). En pacientes mayores los síntomas suelen ser inespecíficos y raramente aparece fiebre. Puede aparecer confusión. 2. Signos: taquipnea, taquicardia; sobre el área del infiltrado inflamatorio se puede apreciar matidez a la percusión, estertores secos, aumento de las vibraciones vocales, a veces soplo bronquial, en caso de derrame pleural se aprecia matidez a la percusión, abolición de las vibraciones vocales y disminución de los ruidos respiratorios. 3. Atípicos: cuadro viral con tos y rinorrea, con síntomas respiratorios bajos agregados (crepitación con sibilancias). Para el estudio de una NAC se debe realizar radiografía de torax para identificar complicaciones radiológicas (indicación de hospitalización) tales como multifocalidad, derrame y/o abscesos. Otros exámenes importantes de hacer son hemograma, bioquímica, pulsioximetría y cultivo de esputo (antes de iniciar ATB). Respecto a su tratamiento, se debe aplicar la escala CURB-65, la cual categoriza a los pacientes y su tratamiento en 4 grupos: 1. Ambulatorios: a. Grupo I: < 65 años, sin factores de riesgo ni comorbilidad. Se debe administrar amoxicilina o macrólidos b. Grupo II: > 65 años con o sin factores de riesgo, con o sin comorbilidades, pero sin criterios de gravedad. Se debe tratar con amoxi + clavulánico o macrólidos o quinolonas. 2. Hospitalizados: a. Grupo III: aquellos con criterios de hospitalización y sin criterios de ingreso a UCI. Se debe manejar con ceftriaxona o levofloxacino. b. Grupo IV: pacientes con criterios de gravedad para ingreso a UCI. Va a requerir ventilación mecánica o drogas vasoactivas, así como tratamiento ATB con ceftriaxona + claritromicina o ceftriaxona + levofloxacino o moxifloxacino o cefepime. En casos específicos, su tratamiento va a depender del agente etiológico que se sospeche: - Post influenza: ceftriaxona + cloxaciclina o flucloxacilina. Inmunosupresión: sulfa-trimetroprim ± corticoides EV en altas dosis (solo en caso de que la PaO2 ≤ 70 mmHg). Respiratorio | 7 - Atípicas: macrólidos y luego quinolonas (levofloxacino, no usar ciprofloxacino ni moxifloxacino). Se define como una neumonía que se ha presentado 48 – 72 hrs desde la admisión al hospital en un enfermo no intubado en el momento de admisión (que se presenta en < 7 días luego del ingreso hospitalario por otra causa). Se puede clasificar en neumonía asociada a ventilación mecánica (NAVM) y neumonía asociada al contacto con el sistema sanitario o nosocomial (HCAP). Los primeros 4 días de hospitalización predominan los mismos agentes etiológicos que en la NAC, sin embargo, a partir del quinto día predominan las cepas multirresistentes y bacilos aerobios gram- (Pseudomonas aeruginosa, E. coli, Klebsiella pneumoniae, Acinetobacter spp. y Legionella pneumophila). El cuadro clínico como en la NAC. La mortalidad de los enfermos por NAH posoperatoria es de ~20 % y la mortalidad en la UCI es de 30 – 40 %. El diagnóstico se realiza igual que en la NAC. En los enfermos con sospecha de NAH recoger muestras de vías respiratorias bajas antes de cambiar el antibiótico (mediante aspiración traqueal, lavado broncoalveolar o cepillado bronquial). Realizar los hemocultivos a todo enfermo con sospecha de NAVM. En general, el tratamiento se hace con vancomicina + imipenem para dar cobertura de streptococo resistente a penicilinas. accesoria en los casos más avanzados. Sin embargo, este cuadro clínico la mayoría de las veces progresa con disfonía y estridor y se normaliza en un plazo de tres a 7 días. Así, según su sintomatología, se clasifica en: Grado Clínica Tratamiento I Disfonía (tos y voz). Sintomático con Estridor inspiratorio leve e corticoides y intermitente, acentuado paracetamol. con el esfuerzo (llanto). II Disfonía (tos y voz). Estridor inspiratorio continuo. Tiraje leve (supraclavicular). III Disfonía (tos y voz) Estridor inspiratorio y Nebulización espiratorio. con adrenalina Tiraje intenso y luego (supraclavicular o observar. intercostal). Signos de hipoxemia (palidez, inquietud, sudoración, polipnea). Excitación neurológica Disminución del murmullo pulmonar. IV Disfonía. Estridor. Tiraje intenso (subcostal). Palidez. Cianosis. Hospitalización. Somnolencia (depresión neurológica). Aparente disminución de la dificultad respiratoria. Involucra una obstrucción de la vía aérea superior en la región de la laringe, de preferencia a nivel subglótico y la tráquea. La etiología más frecuente es la infección viral aguda (virus Parainfluenza 1, 2 y 3 dan cuenta del 65% de los casos). Opacidad radiográfica única, esférica, bien circunscrita que mide < 3 cm de diámetro y está rodeada completamente de pulmón aireado. Generalmente, son hallazgos radiológicos secundarios a una toma de examen por otro motivo. Clínicamente, se caracteriza por ser de inicio brusco, pudiendo haber algún síntoma catarral previo y luego se agrega estridor laríngeo (“tos de perro”). Puede haber compromiso de conciencia y uso de musculatura La mayoría de ellos son de carácter benigno, siendo en orden decreciente de causas: granulomas (40%), carcinoma (40%), hamartoma (7%), metástasis solitaria (5%), otros (8%). No obstante, sus causas pueden ser: Respiratorio | 8 neoplásicas (benigna o maligna), inflamatoria (infecciosa o no infecciosa), vascular, congénita u otro (cuerpo extraño, derrame pleural, placa o masa pleural). La historia clínica y el examen físico son esenciales dentro del diagnóstico, sin embargo, suelen ser asintomáticos. El principal examen para evaluar la morfología del nódulo es la radiografía de torax, las cuales deben ser comparadas con radiografías previas (en caso de que las hubiese). De esta forma, tenemos ciertos criterios de benignidad y malignidad: Ante sospecha de malignidad, se debe hacer un diagnóstico histológico a través de: 1. Fibrobroncoscopía: se utiliza en lesiones que se ubican de forma más hacia medial en el tórax. 2. Videotoracoscopía (VAT): se utiliza en lesiones más periféricas, donde la fibrobroncoscopía no tiene buen rendimiento. Se puede realizar también un TAC de tórax con contraste, el cual mejora la evaluación diagnóstica del nódulo pulmonar solitario. Tiene 10 – 20 veces mayor resolución que la radiografía, con una sensibilidad del 80% y una especificidad del 58%. Cuando se utiliza scanner con PET (PET-Scan), su sensibilidad oscila entre 82 – 95% y su especificidad aumenta a un 85%. Este examen posee la capacidad de determinar más certeramente si algo es maligno o benigno. Un estudio negativo permite afirmar la benignidad del nódulo y evita otras intervenciones. La observación se lleva a cabo en los pacientes en los cuales hay escasas posibilidades en que los nódulos sean malignos, donde se encuentran los menores de 35 años, no fumadores y sin antecedentes de una enfermedad maligna. Respiratorio | 9 El cáncer pulmonar es la segunda causa de muerte por cáncer en Chile, inmediatamente después del cáncer gástrico. Sus factores de riesgo más importantes son: hábito tabáquico (90% de los casos), genética, fumadores pasivos, exposición a asbesto y arsénico. 1. Cáncer de células no pequeñas: 75 – 80%. a. Carcinoma escamoso: es el tipo histológico más frecuente (± 35%) Se presenta, generalmente, como un nódulo o una masa pulmonar, central o sea próximo a los grandes bronquios, que puede cavitarse y parecer un absceso pulmonar. Al diagnóstico más del 50% de los casos no tienen extensión extratorácica. b. Adenocarcinoma: En muchos países es el más frecuente. Aunque generalmente lo está, puede no estar relacionado con el hábito tabáquico y desarrollarse en relación con zonas de fibrosis o cicatrices pulmonares. Generalmente, es un tumor periférico y puede dar metástasis precoces. 2. Cáncer de células pequeñas: 20 – 25%. Estos son tumores centrales, que metastizan ampliamente los ganglios mediastínicos. Habitualmente, está diseminado al momento del diagnóstico, dando, frecuentemente, metástasis a los sitios donde metastatiza con mayor frecuencia el cáncer broncógeno en general. El primer síntoma es la tos (75% de los pacientes), seguido por disnea, estridor y, menos frecuente, hemoptisis. También se pueden presentar como una neumonía o un absceso pulmonar. Por otro lado, las manifestaciones no pulmonares se deben principalmente a invasión de la pared torácica (dolor localizado, compromiso de paquete vasculonervioso o Sd de Claude-Bernard Horner), invasión diafragmática (disnea, derrame pleural), invasión de estructuras mediastinales (nervio frénico, nervio laríngeo recurrente, síndrome de vena cava superior, pericardio o esófago). Finalmente, el 2% de los pacientes presenta manifestaciones por síndrome paraneoplásico: osteoartropatía pulmonar hipertrófica, síndrome de secreción inadecuada de ADH, hipercalcemia, síndromes neurológicos. Para su diagnóstico se puede usar radiografía AP y/o lateral o, en su defecto, un TAC de tórax con contraste, el cual tiene mayor sensibilidad y especificidad que la radiografía. El cintigrama óseo permite sospechar y localizar eventuales metástasis óseas (indicado en presencia de dolor óseo, fractura en hueso patológico, hipercalcemia y aumento de fosfatasas alcalinas). Su etapificación se hace con el TAC y con biopsia. La biopsia se puede obtener mediante fibrobroncoscopía, punción pleural, punción con aguja fina o con mediastinoscopia. El tratamiento va a depender de la clasificación del cáncer y su estadio, tal como se presenta a continuación: En un tumor en estadio I que ha recibido cirugía, su sobrevida a 5 años es del 35% para Ca Epidermoide y 30% para Adenocarcinoma / Ca Células Grandes. Respiratorio | 10 En el caso del cáncer de células pequeñas localizado (etapa I) que recibió QT y RT, su sobrevida a los 5 años es de 15 – 25% (los que no se tratan sobreviven de 6 – 17 meses). Por otro lado, los exudados suelen producirse por un proceso inflamatorio o neoplásico a nivel local. Por ende, sus causas más frecuentes son TBC, neumonía y neoplasias (metástasis, linfoma, leucemia, mesotelioma). Manifestaciones clínicas Conjunto de signos y síntomas dados por la ocupación de la cavidad pleural, transformándose ésta en un espacio real. Puede deberse a: 1. Líquido: a. Sangre → hemotórax b. Pus → empiema c. Linfa → quilotórax d. Otro → derrame 2. Aire → Neumotórax 3. Sólido: a. Tumor primario b. Metástasis Los síntomas más frecuentes son disnea, dolor, tos y tope inspiratorio. Mientras que, al examen físico, podemos encontrar disminución/abolición del MAV, matidez, disminución/abolición de vibraciones vocales, egofonía y soplo pleurítico. Diagnóstico Se realiza a través de varias técnicas diagnósticas, tales como: radiografía, TAC, toracocentesis. En la radiografía, se requieren 175 – 525 ml de líquido para borrar el fondo del saco costo-frénico. Etiología Los derrames pleurales suelen clasificarse como trasudados o exudados de acuerdo con las características de laboratorio del líquido (criterios de Light): Criterio Relación LDH pleural/suero Relación proteínas pleural/suero Trasudado < 0,6 Exudado > 0,6 < 0,5 > 0,5 ≤ a 2/3 del LDH en líquido límite superior pleural normal de LDH sérica. Puede ser asintomática, en caso de que el líquido se acumule de manera muy progresiva y en forma de respuesta se produce mecanismos compensatorios que producen que el paciente se acostumbre a esta condición de restricción (p. ej., ERC, IC.). > a 2/3 del límite superior normal de LDH sérica. Los trasudados suelen ser transparente, de color amarillo citrino, con baja concentración de proteínas y baja actividad de LDH, generalmente pH >7,35, escasa celularidad sobre todo linfocitos. Los más importante es que suelen no originarse en la pleura, por lo que sus causas más comunes son ICC (la más frecuente), cirrosis hepática, hipoalbuminemia (ERC, síndrome nefrótico) y diálisis peritoneal (ERC). En el caso de los exudados, estos se pueden dividir según su celularidad en el análisis del líquido pleural en: 1. Mononucleares: se prefieren estudiar con ADA, pudiendo obtener: a. ADA > 50: fuerte sugerente de tuberculosis (tratamiento específico). Otras causas menos frecuentes son lupus, artritis reumatoide, linfomas y empiema (este último cuando hay polimorfonucleares). b. ADA 30 – 50: no es específica, por ende, se debe continuar su estudio como si fuera un cáncer, es decir, con VAT y biopsia. c. ADA < 30: fuerte sugerente de cáncer, por ende, se debe evaluar con VAT y biopsia. 2. Polimorfonucleares: se prefiere estudiar con pH y lactato: a. pH > 7,2 y lactato < 5 mg/dl: sugerente de derrame paraneumónico simple, por ende, se debe tratar con antibióticos y toracocentesis evacuadora. Respiratorio | 11 b. pH < 7,2 y lactato > 5 mg/dl: sugerente de empiema, por ende, se debe tratar con tubo con trampa de agua y antibióticos. En el neumotórax espontáneo secundario se agregarán todos los síntomas y signos propios de la enfermedad pulmonar de base; en el neumotórax traumático existirá el antecedente de trauma y lesiones asociadas; y en el iatrogénico se tendrá el antecedente del procedimiento médico. Definición y clasificación Diagnóstico Corresponde a la presencia de aire en la cavidad pleural, que conlleva a un colapso del parénquima pulmonar en mayor o menor grado según la cuantía de éste. El diagnóstico del neumotórax es clínico-radiológico. El examen imagenológico de primera línea para detectar un neumotórax es la radiografía simple de tórax y, en algunas ocasiones, se puede recurrir a la tomografía computada. Según el mecanismo que lo causa, se puede clasificar en: 1. Espontáneo: a. Primario: Es aquel que se produce sin una causa precipitante aparente, en pacientes sin patología pulmonar conocida. b. Secundario: Aquel que ocurre como complicación de una patología pulmonar subyacente (p. ej., EPOC, fibrosis quística, neoplasias pulmonares, neumonías necrotizantes, etc.). 2. Traumático: a. Abierto: secundario a trauma, dejando una solución de continuidad entre la cavidad pleural y el exterior a través de la pared torácica. b. Cerrado: secundario a trauma, sin conexión de la cavidad pleural con el exterior a través de la pared torácica. 3. Iatrogénico: Se produce a causa de procedimientos médicos. Por ejemplo, secundario a instalación de vías venosas centrales, toracocentesis, barotrauma. Manifestaciones clínicas La presentación de un paciente con neumotórax puede variar desde completamente asintomático hasta insuficiencia respiratoria grave que amenaza la vida. Los síntomas más frecuentes son dolor pleurítico de instalación súbita y disnea de grado variable. Al examen físico, el paciente se presenta con taquipnea, taquicardia, disminución del murmullo pulmonar, aumento de timpanismo e hipersonoridad a la percusión en hemitórax afectado y leve disminución de expansión torácica. Tratamiento El tratamiento conservador es excepcional y se reserva para pacientes con neumotórax mínimo (< 15% en radiografía), sin antecedentes de patología pulmonar, estables y asintomáticos u oligosintomáticos. Consiste en hospitalización, reposo relativo y control seriado con radiografía de tórax por 24 a 48 horas. El drenaje pleural es el tratamiento estándar y tiene por objetivo eliminar el neumotórax al reexpandir el parénquima pulmonar. Se indica en pacientes con neumotórax > 15%, con antecedentes de patología pulmonar, sintomáticos o con insuficiencia respiratoria. Otros tratamientos son la cirugía (VAT) y la pleurodesis química. Neumotórax a tensión Es una emergencia médica que debe ser reconocida rápidamente, ya que es una condición que amenaza la vida del paciente. Es una forma especial de presentación, independiente de la etiología y del tamaño inicial del neumotórax. Se desarrolla cuando se genera un efecto de válvula que perdura la entrada de aire al espacio pleural, elevando la presión en la cavidad, comprimiendo aún más al pulmón afectado y, además, se produce un desplazamiento de las estructuras del mediastino hacia el lado contrario Se debe sospechar un neumotórax hipertensivo en pacientes: muy taquipneicos, hipotensos, cianóticos, diaforéticos, con ingurgitación yugular y/o con desviación de la tráquea. En la radiografía de tórax de un neumotórax a tensión se observa desplazamiento contralateral del mediastino y de la tráquea (aunque en Respiratorio | 12 pacientes intubados la tráquea puede estar alineada), y descenso o inversión del diafragma. NO ESPERAR RX PARA HACER EL DIAGNÓSTICO. Sus principales causas son: sarcoidosis, por exposición (fármacos o radioterapia), enfermedades del tejido conectivo (p. ej., esclerodermia) e idiopática. Cuando se sospecha un neumotórax a tensión es obligatorio realizar una descompresión torácica inmediata (en el segundo espacio intercostal a nivel de línea medio-clavicular), sin esperar una confirmación radiológica del diagnóstico. Clínicamente, suele presentarse con disnea, crepitaciones gruesas, campos pulmonares disminuidos y, en algunos casos, acropaquía (dedos en palillo de tambor). Corresponde a un derrame pleural formado por linfa, que alcanza la cavidad pleural desde el conducto torácico lesionado o desde vaso linfático de gran calibre. Sus etiologías pueden ser traumáticas (post cirugía, heridas penetrantes) o no traumáticas (neoplásico, idiopático). Se caracteriza por ser un líquido pleural blanquecino, con alta cantidad de triglicéridos (> 100 mg/dl), células (> 1000/µg) y linfocitos > 80%. En su tratamiento, siempre se debe tratar la enfermedad de base, si es que la hay, asociado a: drenaje con tubo con trampa de agua, radioterapia y/o cirugía. Es la presencia de sangre en la cavidad pleural, definido por un hematocrito de líquido pleural ≥ 50 % respecto al de la sangre periférica. Su etiología puede ser traumática (la más común), no traumática/espontáneos o iatrogénicos. Se denomina hemotórax masivo cuando el hemotórax está asociado a hipotensión, elimina > 1L en la primera instancia de drenaje o si elimina > 300 ml/hr. Es una zoonosis producida por la parasitación accidental del hombre con la tenia equinococus, especialmente de su variedad granulosus, que produce quistes a distintos niveles, especialmente en el hígado y pulmones. En Chile, se da principalmente desde la IV región hacia el sur, especialmente en regiones patagónicas. La ubicación pulmonar es la segunda en frecuencia (20 – 40%) y la primera es la localización hepática (65%). Es más frecuente en lóbulos derechos. Huevos expulsados por las heces de perro parasitado Infección de suelo, pasto, verduras, agua, etc. Ingesta de huevos por el huésped intermediario o accidental Llegada de los huevos al estómago, donde se disuelven y se libera el embrión Transporte del embrión a través de la vena porta al hígado (1° filtro) Viaja por la circulación sistémica y pasa por el corazón hasta los pulmones (2° filtro) Viaja por las venas pulmonares hacia el corazón izquierdo Alcance de otros órganos como bazo, cerebro, corazón y esqueleto. Respecto a su tratamiento, el hemotórax simple se maneja con tubo con trampa de agua, mientras que, el hemotórax masivo se maneja con toracotomía de urgencia. Conforman un grupo heterogéneo de enfermedades (por la gran variedad de etiologías) que tienen en común elementos clínicos, fisiológicos radiológicos y patológicos como lo es el compromiso intersticial difuso y crónico del tejido pulmonar, es decir, una vez que se instala no se revierte, sino que sigue hacia la progresión. Se debe indagar sobre la procedencia del paciente, recordando que esta patología es más frecuente en zonas rurales. Además, es necesario preguntar si existen antecedentes de trabajo con ganado, familiares con hidatidosis y convivencia con perros. La clínica va a depender del órgano afectado y de la presencia de complicaciones. Aproximadamente, el 60% de los pacientes son asintomáticos. Los pacientes sintomáticos suelen presentar tos, expectoración hemoptoica, fiebre, dolor torácico (por Respiratorio | 13 irritación pleural), fenómenos alérgicos (prurito, urticaria), vómica (< 25% es masiva). Al examen físico, se presenta con signos de tumoración, tales como matidez, disminución del murmullo vesicular y soplo. Exámenes de laboratorio rutinario son inespecíficos, tal como elevación de VSH, leucocitosis con neutrofilia y eosinofilia y, en caso de compromiso de vía biliar, se presenta con hiperbilirrubinemia y elevación de enzimas hepáticas. Los exámenes inmunológicos corresponden a la confirmación específica, los cuales deben enviarse al Instituto de Salud Pública (IPS) para su procesamiento y obtención de resultados. El examen inicial más importante es la radiografía simple de tórax, la cual permite el diagnóstico de: 1. Quistes no complicados: Se evidencia una opacidad, generalmente redondeada, ovoidea o policíclica, de contornos nítidos, única o múltiple y de densidad intermedia. 2. Quiste roto: Se elimina parte del material (líquido o membrana) y es reemplazado por aire (neumatosis quística) por comunicación con bronquios. Los signos radiográficos típicos que se pueden observar son: signo de neumoquiste, signo del doble arco, signo del menisco y signo del camalote (patognomónico). También es posible utilizar el TAC, el cual define localización, densidad, y número de quistes. Permite pesquisar complicaciones y visualizar las cúpulas diafragmáticas y el hígado. A modo general, es importante tener en cuenta que el único tratamiento completamente curativo es la cirugía y que ésta debe realizarse tanto en los pacientes sintomáticos como en los asintomáticos. Por otra parte, el tratamiento médico (albendazol), como única alternativa terapéutica, se puede utilizar en casos muy seleccionados. Sin embargo, el albendazol se utiliza de forma previa a la cirugía. Corresponde a la creación de espacios o cavitación producto a la dilatación y destrucción de grandes bronquios causadas por alguna noxa (generalmente, infecciones). La fisiopatología de la bronquiectasia no se entiende completamente, pero se le considera como el punto final común de diversos trastornos que causan inflamación crónica de las vías respiratorias. Dentro de estos trastornos, los más comunes son infecciones pulmonares graves (p. ej., TBC, adenovirus) y enfermedades pulmonares crónicas (p. ej., fibrosis quística). En general, los síntomas comienzan en forma lenta y empeoran gradualmente con el transcurso de los años, acompañados por episodios de exacerbación aguda. El síntoma más común es la tos crónica con broncorrea (esputo firme, espeso y suele ser purulento), disnea y hemoptisis a repetición (en ocasiones masiva). Al examen físico se presenta con halitosis y ruidos respiratorios anormales (crepitantes, roncus, sibilancias). En los casos de larga evolución, se presentan acropaquías (dedos en palillos de tambor), las cuales son características de bronquiectasias, fibrosis pulmonar, cáncer, pero no de EPOC. El diagnóstico se basa en la anamnesis, el examen físico y los estudios radiológicos, que comienzan con una radiografía de tórax. Para su mejor visualización se puede utilizar un TAC de tórax de cortes finos. También se pueden realizar pruebas de función pulmonar y pruebas específicas para las posibles causas. En caso de que sean localizadas, se puede realizar cirugía. Mientras que, si son difusas se debe dar tratamiento médico (broncodilatadores ± corticoides inhalados, ATB en complicaciones). Por otro lado, en caso de que se Respiratorio | 14 presente con hemoptisis masiva, se debe intervenir con fibrobroncoscopía y, en caso de que no responda, se puede utilizar embolización selectiva o intubación monobronquial (medida de salvataje). ser sintomática y supone un riesgo elevado de TEP masivo. 3. Flegmasía dolens: forma de trombosis venosa de la mayoría de las venas que drenan la sangre de una extremidad, con dolor y edema severos. Se subdivide en flegmasía alba dolens y flegmasía cerúlea dolens. Formación de un trombo en el territorio venoso profundo situado por debajo de la fascia profunda en las extremidades inferiores. Con menor frecuencia aparece en las extremidades superiores. Se evalúa el dímero D en sangre, el cual excluye el diagnóstico de TVP y TEP cuando se encuentra en niveles normales, sin embargo, si se encuentra alterado, no confirma ninguna de las dos. Se produce por una desequilibrio en la triada de Virchow, compuesta por: Para su diagnóstico específico se utiliza ecografía Doppler de extremidades, en la cual, la vena que contiene el trombo no se colapsa con la compresión ejercida con la sonda ecográfica. Se podría considerar un angioTAC en caso de síntomas que sugieran un TEP. 1. Estesia venosa: reposo postquirúrgico, inmovilización, obesidad, embarazo, viaje sentado prolongado, ICC, insuficiencia venosa, varices. 2. Lesión vascular: reacciones inflamatorias, extensión vascular de un tumor o infección, presencia de cuerpo extraño (p. ej., catéter venoso central). 3. Hipercoagulabilidad: síndrome inflamatorio (neoplasia, enfermedad sistémica, síndrome nefrótico, EII), hiperestrogenia endógena (embarazo) o exógena (ACO), tabaco, enfermedades hematológicas (leucemia, trombocitemia, poliglobulia, síndrome mieloproliferativo). Suele ser poco sintomática. Se presenta con dolor al caminar, edema unilateral de pantorrilla, sensibilidad o dolor a la palpación, calor en la extremidad y, raramente el signo de Homans (dolor en la pantorrilla que aparece con la extensión pasiva del pie). Además, se puede presentar de diferentes formas: 1. Distal: la más frecuente. Afecta a las venas tibiales anteriores y posteriores y a las venas peroneas. Suele tener un curso asintomático y ceder espontáneamente. Bajo riesgo de TEP. 2. Proximal: afecta a la vena poplítea, venas femorales, ilíacas y a la vena cava inferior. Suele 1. Medidas generales: movilización y ejercicios de miembros inferiores, hidratación, medias de compresión elástica graduada y compresión neumática intermitente. 2. Anticoagulación: ante un paciente con sospecha de TVP debe iniciarse el tratamiento con HBPM hasta que el diagnóstico sea excluido por pruebas de imagen. a. 3 a 6 meses en pacientes con un primer episodio de TVP + factor de riesgo reversible. b. 6 a 12 meses en pacientes con un primer episodio de TVP + factor de riesgo no identificable. c. 6 a 12 meses en pacientes con un primer episodio de TVP + factor de riesgo irreversible. Considerar tratamiento de por vida. d. De por vida en paciente con TVP recurrente. Respiratorio | 15 - Oclusión o estenosis de la arteria pulmonar o de algunas de sus ramas por material tromboembólico. En general, procedentes de las venas profundas de las extremidades inferiores o de la pelvis menor, menos frecuentemente de las venas de la parte superior del cuerpo. Sus causas son las mismas que las de la TVP. Alta probabilidad: > 6 puntos. Tanto en este caso como en el de probabilidad intermedia se decide por iniciar el estudio con un angioTAC, el cual es el mejor examen para evaluar TEP. En caso de que el paciente esté con compromiso hemodinámico se debe optar por un ecocardiograma (trombólisis endovenosa) o por una angiografía (trombólisis intraarterial). Tiene una presentación clínica poco específica y, frecuentemente, se asocia con otras patologías con signos y síntomas que se superponen. El síntoma más frecuente es disnea de inicio súbito, y dolor torácico pleurítico. Otros síntomas son tos seca, síncope, hemoptisis. Al examen físico, se presenta con taquipnea y taquicardia, dilatación de venas yugulares, crepitaciones y, rara vez, hipotensión asociada a signos de shock. La estrategia diagnóstica requiere primero, establecer una probabilidad clínica de embolia pulmonar, y posteriormente someter al paciente a exámenes que permitan confirmar o descartar este diagnóstico. Esto se hace a través del Score de Wells: Hallazgos clínicos Diagnóstico de EP más probable que otros diagnósticos Clínica de trombosis venosa profunda Frecuencia cardíaca > 100 /min Inmovilización en cama por 3 días o cirugía en el mes previo Antecedentes de embolia pulmonar o trombosis venosa Expectoración hemoptoica Cáncer en tratamiento durante los 6 meses previos - - Puntaje 3 3 1,5 1,5 1,5 Su tratamiento va a depender de la hemodinamia del paciente: 1 1 Baja probabilidad: < 2 puntos. Iniciar estudio con dímero D para descartar TEP (valor predictivo negativo). Probabilidad intermedia: 2 – 6 puntos. Respiratorio | 16 las del medio y posterior (60%, 10% y 20% respectivamente). Ubicación Anterosuperior Medio Posterior En caso de que el paciente presente inestabilidad hemodinámica se debe administrar: dobutamina (ionotrópico positivo), presión positiva y vasodilatadores inhalados. En oportunidades final se puede manejar con ECMO. Por otro lado, la anticoagulación inicial seguida de anticoagulación de mantenimiento está indicada para pacientes con embolia pulmonar aguda para prevenir la extensión del coágulo y posterior embolización, así como la formación de nuevos coágulos. La anticoagulación inicial se puede realizar con heparina no fraccionada o heparina de bajo peso molecular (principalmente, esta última). La anticoagulación de mantención se suele hacer con anticoagulantes oral (neo-sintrom 20 comprimidos de 4 mg de acenocumarol) y se controla con INR. La anticoagulación se debe mantener: - - - 3 a 6 meses en pacientes con un primer episodio de TEP + factor de riesgo reversible. 6 a 12 meses en pacientes con un primer episodio de TEP + factor de riesgo no identificable. 6 a 12 meses en pacientes con un primer episodio de TEP + factor de riesgo irreversible. Considerar tratamiento de por vida. De por vida en paciente con TEP recurrente. La ubicación de las masas mediastínicas más frecuentes varía con la edad. Teniendo en cuenta la edad del paciente, la ubicación de la lesión y la presencia o no de signos y síntomas asociados, se puede llegar a un diagnóstico prequirúrgico bastante acertado. Las lesiones localizadas en el compartimento anterosuperior son malignas con mayor frecuencia que Adultos 65% 10% 25% Niños 38% 10% 52% La mayoría de las masas mediastínicas son en principio asintomáticas, siendo en muchos casos un hallazgo radiológico. Los síntomas más frecuentes son el dolor torácico, tos y disnea, mientras que, los síntomas que hacen pensar en malignidad son: disfonía, Sd. De horner, dolor intenso y síndrome de vena cava superior. La gran mayoría de los tumores de mediastino son detectados en forma incidental durante un examen radiográfico del tórax que se evidencia como ensanchamiento del mediastino. La TAC es el estudio de elección cuando se detecta una lesión de mediastino por radiografía de tórax. Brinda evaluación anatómica del mediastino y las relaciones de esas lesiones con las estructuras adyacentes. Llamado también zona pre-vascular. Se extiende desde la cara posterior del esternón hasta la cara anterior del pericardio y grandes vasos (vena innominada, aorta, vasos braquiocefálicos). Contiene: tráquea, timo, aorta y sus grandes vasos, esófago, venas innominadas, grasa, tejido conectivo y, eventualmente, glándula tiroides, si esta se encuentra en posición endotorácica. Los tumores más frecuentes de este mediastino son: timoma, linfoma, tumor de células germinales, bocio intratorácico. Se dice que la frecuencia tumoral está compuesta mayoritariamente por “las 4 T” (Tiroides, Timo, Teratoma y T de células germinales, “Terrible” linfoma). Llamado también zona visceral. Se extiende desde la reflexión anterior del pericardio hasta el ligamento longitudinal de la columna. Contiene: corazón, pericardio, aorta, bifurcación traqueal, hilios pulmonares, vena cava superior, nervios frénicos y nervios neumogástricos y linfonodos asociados a estas estructuras. Respiratorio | 17 Los tumores más frecuentes de este mediastino son: linfoma/adenopatía, granulomas, quiste pericárdico, quiste broncogénico, quiste entérico. Llamado también zona retrovisceral. Se extiende desde la cara posterior del esófago a la pared torácica. Contiene: el surco paravertebral, aorta descendente, vena ácigos, tronco del simpático, articulaciones costovertebrales, venas y arterias intercostales, linfáticos y tejido conectivo. Los tumores más frecuentes de este mediastino son: tumores neurogénicos (neurofibroma, neurilemoma, neuroblastoma). Respiratorio | 18