Tema 4.- Modelos atómicos y estructura electrónica de los átomos a
Anuncio

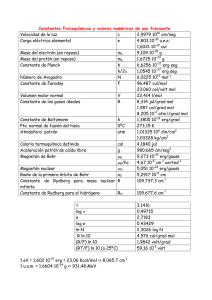
Tema 4.- Modelos atómicos y estructura electrónica de los átomos Problema 1 Calcular la energía de ionización en cm-1, erg y eV del hidrógeno partiendo del electrón en: a) su estado fundamental, b) el nivel n = 3. a) E=− 1 mZ2 e 4 1 = −b 2 2 2 2 8πε 0 h n n Constante de Rydberg = R = 1.097·107 m-1 = b/h·c; h = Constante de Planck = 6.624·10-34 J·s c = Velocidad de la luz = 3·108 m·s-1 En el estado fundamental n = 1 ⇒ 1 =b 12 n n n E = b = R·h·c = 1.097·107 (m-1) · 6.624·10-34 (J·s) · 3·108 (m·s-1) = 21.8·10-19 J Energía de ionización = − b( 1 2 ∞ − 1 2 1 ) = b· 1 2 1 = b· 1(m) = 1.097·10 5 cm −1 100(cm) ν = 1.097·10 7 (m −1 )· 1000( g ) 100 2 (cm 2 ) E = 21.8·10 (kg ·m ·s )· · = 21.8·10 −12 erg 2 1(kg ) 1(m ) 19 -19 E(eV) = 21.8·10 (C·V)·1(e)/1.6·10 (C) = 13.6 eV −19 2 −2 b) Exactamente igual que en el apartado a pero ahora utilizando n = 3 por tanto los resultados del apartado a) hay que dividirlos por 32. a) 109678 cm-1, 2.178 x10-18 J, 2.178 x10-11 erg, 13.6 eV; b) 12186 cm-1, 2.420 x10-19 J, 2.420 x10-12 erg, 1.57 eV Problema 2 Para la luz verde la longitud de onda es de 5500 Å. Calcule la energía en calorías de: a) 1 fotón de esa luz, b) un mol de fotones. −1 6.624·10 −34 ( J ·s )·3·10 8 (m·s ) ∆E = = = 3.61·10 −19 J <> λ 10 −10 (m) 5500( A)· 1( A) 0.24(cal ) <> 3.61·10 −19 ( J )· = 7.23·10 − 20 cal / fotón 1( J ) h·c ∆E = 7.23·10 − 20 (cal · fotón −1 )· 6.022·10 23 ( fotones ) = 43.52·10 3 cal ·mol −1 1(mol ) a) E = 7.23 x10-20 cal/fotón; b) E = 43.52 x103 cal/mol