Feocromocitoma
Anuncio

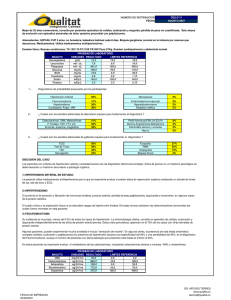
ACTUALIZACIÓN Feocromocitoma F.J. Tébar Massóa y J.M. Rodríguez Gonzálezb a Servicio de Endocrinología y Nutrición. PUNTOS CLAVE Concepto. El feocromocitoma es un tumor poco frecuente, pero su malignidad funcional y su 10% de malignidad histológica obligan a pensar en él. Debemos tener en cuenta que el 15-20% es de localización extraadrenal. b Unidad de Cirugía Endocrina. Hospital Universitario Virgen de la Arrixaca. Murcia. Concepto El feocromocitoma es un tumor que, de forma habitual, asienta en la médula suprarrenal (80-85% de los casos) y más raramente fuera de ella (15-20%), recibiendo en estos casos el nombre de feocromocitoma extra-suprarrenal o paraganglioma. El 90% de estos tumores se presentan de forma esporádica, pero también pueden hacerlo de forma familiar, frecuentemente asociados a los diagnósticos de neoplasia endocrina múltiple (MEN) tipos 2A y 2B, a la enfermedad de von Hippel Lindau (vHL), a la neurofibromatosis de von Recklinhausen tipo 1 (NF1) o en el contexto de un síndrome de paragangliomas hereditarios (PGH)1. Funcionalmente se caracterizan por producir y secretar catecolaminas en cantidades muy superiores a la producción de la médula suprarrenal normal, aunque una minoría no son secretores en el momento del diagnóstico y se comportan como incidentalomas suprarrenales. En la actualidad el feocromocitoma se considera un tumor neuroendocrino2. Las células de la médula adrenal forman parte del sistema simpatocromafín, un característico prototipo de sistema neuroendocrino en el que sus células pueden secretar catecolaminas, sustancias que funcionalmente tienen un comportamiento tanto de neurotransmisor como hormonal. En el sistema nervioso central (SNC) la adrenalina tendrá un efecto de neurotransmisor, al igual que la noradrenalina y la dopamina. En los tejidos periféricos la adrenalina, que se produce mayoritariamente en la médula adrenal, tiene un comportamiento de hormona, mientras que la noradrenalina fuera del SNC se comporta fundamentalmente como neurotransmisora, y escasamente como hormona. A la dopamina no se le reconocen funciones específicas fuera del SNC. Su clínica está representada fundamentalmente por la hipertensión arterial (HTA), considerándose que entre un 0,1 a un 0,6% de los pacientes con HTA pueden presentar feocromocitoma3. Sin embargo, alrededor de un 5% de los incidentalomas suprarrenales son feocromocitomas, descubriéndose incluso un 25% de éstos en el transcurso de una exploración morfológica de abdomen, o también como hallazgo casual en una de cada 2.000 necropsias. En niños, hasta un 1% de los casos de HTA es por feocromocitoma4. En los pacientes con Clínica. La clínica está marcada por la hipertensión arterial, frecuentemente paroxística, en la que puede haber graves complicaciones: infarto de miocardio, accidente vascular cerebral, etc. • Es imprescindible establecer el tratamiento quirúrgico lo antes posible. Preparación preoperatoria. El paciente debe llegar a la cirugía con bloqueo alfa-adrenérgico. • El anestesista debe conocer el manejo de estos tumores, tanto para la inducción de la anestesia como para solventar los problemas que surjan en el acto quirúrgico. Tratamiento quirúrgico.El tratamiento de elección es la cirugía, que bien hecha comporta la curación del proceso. En el feocromocitoma maligno metastásico el uso de 131I-MIBG puede ser útil como coadyuvante de la cirugía. MEN 2A hasta un 52% están asintomáticos en el momento de su diagnóstico, y sólo un 35% presentan HTA5. La malignidad alcanza, incluso, un 10% de los casos. Etiología Debemos considerar por separado la etiología del feocromocitoma familiar y la del esporádico. Feocromocitoma familiar Tanto los feocromocitomas asociados a MEN como los asociados a vHL, NF1 y PGH se encuentran genéticamente bien caracterizados. En los MEN tipo 2A y B el problema se origina en mutaciones del protooncogén RET del cromosoma 10. En el MEN 2A la mutación RET se sitúa en la región extracelular de la proteína RET afectando a los residuos de cisteína. En casi el 100% de los pacientes estudiados los exones afectados son el 10 (codones 609, 611, 618 y 620) y el 11 (codón 634); más raramente se encuentran en el exón 11 Medicine. 2008;10(15):997-1005 997 ENFERMEDADES ENDOCRINOLÓGICAS Y METABÓLICAS (III) (codón 630), en el 13 (codones 790 y 791) y en el 14 (codón 804). En el L-Tirosina MEN 2B la mutación más frecuente se localiza en el exón 16 (codón TH (O2 + BH4) 918) y con menos frecuencia en el L-DOPA exón 15 (codón 883)6. Las mutaAAD (vitamina B6) ciones 634 (MEN 2A) y 918 (MEN 2B) son las que asocian mayor núDopamina mero de feocromocitomas. La freDBH (O2 ascorbato) cuencia con la que se originan mutaciones RET de novo en línea Norepinefrina Epinefrina PNMT (S-adenosilmetionina germinal es diferente para MEN 2A (50%) que para MEN 2B (5COMT MAO 9%). Esto se relaciona con la difeNormetanefrina y metanefrina Dopegal rente expresión familiar: MEN 2A (3,4-dihihidroxifenil-glicol-aldehído) tiene un mayor número de descenMAO COMT ADR-ALR dientes afectos que MEN 2B. 3-metoxi-4-hidroxifenil-glicol 3-metoxi-4-hidroxifenil-glicol-aldehído En los vHL, en donde la apariADH ción de feocromocitoma se limita a AD los subtipos 2a y b, la alteración se centra en una mutación de un gen 3-metoxi-4-hidroxi-mandélico Ácido vanilmandélico supresor localizado en el cromosoma 3p25-26. Los feocromocitomas de vHL son tanto adrenales como Fig. 1. Síntesis y metabolismo de catecolaminas. AAD: L-aminoácido aromático decarboxilasa; AD: aldehídoparagangliomas6,7. deshidrogenasa; ADH: alcohol-deshidrogenasa; ADR-ALR: de la familia aldo-ceto-reductasa; BH4: tetrahidro-biopterina (cofactor); COMT: catecol-O-metil-transferasa; DBH: dopamina  hidroxilasa; MAO: monoEn NF1 la mutación genética aminooxidasa; MEN: neoplasia endocrina múltiple; PNMT: feniletanolamina N-metil transferasa; TH: tirosínse sitúa en el cromosoma 17q11.2. hidroxilasa. Aunque la presentación de feocromocitoma en NF1 es baja (5%), es la mutación del gen NF1, de estirpe supresora, la que da lugar a la aparición de este tumor7. tas mutaciones podrían inhibir genes supresores y favorecer La alteración genética en los PGH se produce por mutael desarrollo del tumor11. Junto a esto, hoy es bien conocido que la angiogénesis desempeña un importante papel en la pación del gen de la succinato-dehidrogenasa (SDH), que se togenia de algunos tumores, y también ocurre en los feocrolocaliza en la rama corta del cromosoma 11. La mutación mocitomas. afecta al complejo mitocondrial II, que se diferencia en 4 En los tumores secretores de adrenalina es la enzima fenisubunidades: A, B, C y D. La mutación del gen SDHD preletanolamina N-metiltransferasa, que cataliza la metilación de dispone a PGH1, las mutaciones de los genes de SDHB y noradrenalina a adrenalina, la que se encuentra sobreexpresaSDHC predisponen a PGH4 y 3, respectivamente. No se ha da. También en feocromocitomas se ha detectado la existencia descrito la susceptibilidad genética para PGH2. La aparición de polipéptido activador de la adenilato-ciclasa hipofisaria, de PGH es más frecuente para la mutación de SDHD y hasque tiene la capacidad de inducir la expresión de enzimas que ta el 50% de los tumores podrían localizarse en el cuello8,9. intervienen en la síntesis de catecolaminas. Por último habría que considerar que el feocromocitoma es diferente a la méduFeocromocitoma esporádico la adrenal normal en su potencial plurisecretor de péptidos, que por su comportamiento hormonal o de otro tipo confieLa etiología del feocromocitoma esporádico es mal conociren significado a la expresión clínica del feocromocitoma7. da. Datos recientes tras estudios genéticos indican que algunos feocromocitomas clínicamente esporádicos presentan alFisiopatología teraciones genéticas. En el estudio de Neumann et al10, en pacientes con feocromocitoma no sindrómico, 66 de 271 suEl eje sobre el que gira la fisiopatología del feocromocitoma jetos (24%) presentaban mutaciones de las que 30 eran de es la hiperproducción de catecolaminas, en especial adrenavHL, 13 de RET, 11 de SDHD y 12 de SDHB. De los 66 lina y noradrenalina. Su producción no es exclusiva de la mésólo 21 tenían feocromocitomas múltiples y ninguno presendula adrenal, pues también se encuentran estas sustancias en taba clínica asociada de MEN 2, vHL, NF1 o PGH. el SNC, nervios simpáticos y células cromafines. En los feocromocitomas malignos se ha encontrado una Las catecolaminas se sintetizan en el citoplasma celular a alta incidencia de mutaciones de p53. También algunos feopartir del aminoácido L-tirosina, que procede de los alimencromocitomas tienen receptores para somatostatina tipo 2 y tos y de su síntesis en el hígado. Como se aprecia en la figu4, y este hecho se acompaña de una pérdida de heterocigosira 1 la síntesis de adrenalina está precedida por la formación dad en el cromosoma 1p y, a veces, en el 3p, 17p y 23q; es998 Medicine. 2008;10(15):997-1005 FEOCROMOCITOMA de una cascada de precursores regulados en su progresión por enzimas específicas12. Tras su producción las catecolaminas son almacenadas en gránulos de secreción bajo la acción de un transportador de monoaminas a vesículas (VMAT)13. La secreción de catecolaminas por las células adrenomedulares se regula fundamentalmente por fibras nerviosas de tipo colinérgico que liberan acetilcolina, lo que termina por interferir con la permeabilidad para Ca++ en la membrana y estimulando la exocitosis y liberación de catecolaminas. Parte de las catecolaminas son recaptadas por las neuronas, pero como se ve en la figura 1 el catabolismo hormonal conduce a la formación de ácido vanilmandélico por la acción de diferentes enzimas. En la periferia las catecolaminas actúan uniéndose a receptores adrenérgicos, de los que hay 2 tipos, ␣ y  receptores, cada uno subdividido en 2 subtipos (␣1 y ␣2; 1 y 2). En líneas generales la estimulación de los receptores ␣ induce vasoconstricción, mientras que la de los receptores  vasodilatación. La noradrenalina incrementa las resistencias vasculares periféricas aumentando la presión arterial, tanto sistólica como diastólica, pero no modifica el flujo cardíaco; la frecuencia cardíaca disminuye o no se altera. Por su parte la adrenalina aumenta el flujo cardíaco y la tensión sistólica, pero no la diastólica, que incluso puede disminuir. La clínica del feocromocitoma dependerá de qué receptores adrenérgicos estén estimulados, pero también de la aparición y efecto de numerosas sustancias que pueden ser secretadas por el tumor: sustancia P, neuropéptido Y (NPY), encefalinas, somatostatina, hormona liberadora de corticotropina ACTH [CRH], ACTH, péptido natriurético atrial (PNA), polipéptido intestinal vasoactivo (VIP), parathormona (PTH), interleucina (IL)-1 y 6, péptido relacionado con el gen de la calcitonina y cromogranina A, entre otros. Todas las sustancias secretadas por el feocromocitoma ejercen efectos intraadrenales y extraadrenales. De los primeros hay que destacar la posible producción de alteraciones más puramente histológicas, como la hiperplasia corticosuprarrenal ipsilateral, hasta cuadros más complejos como el síndrome de ACTH ectópica. Sin embargo, nos interesan más los efectos extraadrenales del feocromocitoma, siendo el más importante la aparición de HTA paroxística, frecuentemente acompañada de cefalea, palidez o a veces sofoco con enrojecimiento facial, hiperhidrosis y palpitaciones. La tríada cefalea, hiperhidrosis y taquicardia tiene una sensibilidad del 90% y una especificidad del 93,8%14. La HTA del feocromocitoma es el resultado de la acción de las catecolaminas circulantes sobre los receptores adrenérgicos cardiovasculares, aunque no hay correlación entre la cantidad de catecolaminas y la gravedad de la HTA. La disminución de la HTA con la administración de clonidina, un ␣-2 antagonista adrenérgico, o del antagonista ␣-1 adrenérgico fentolamina, demuestra la relación de catecolaminas e HTA. Por otro lado, el feocromocitoma puede secretar NPY, que en su acción, aunque no es vasoconstrictor, potencia la acción presora de catecolaminas. En conjunto, adrenalina y noradrenalina aumentan la frecuencia cardíaca, incrementan las resistencias periféricas y la contractilidad cardíaca y disminuyen el tono venoso. Todo ello hace que al feocromocitoma se le atribuya un tipo de HTA hiperquinética, vasoconstrictora e hipovolémica14,15. La posible asociación de feocromocitoma a fiebre y signos inflamatorios se debe a la producción de IL-6 por el tumor, citocina que también puede producir anemia, trombocitosis e hiperfibrinogenemia. Si el feocromocitoma es productor de IL-1 puede cursar con colestasis intrahepática. Con frecuencia en el feocromocitoma aparece hiperglucemia. Esto se debe a un efecto directo e indirecto de las catecolaminas sobre el metabolismo de los hidratos de carbono (HC). Directamente las catecolaminas estimulan adrenorreceptores situados en tejidos metabólicamente relacionados con los HC. Indirectamente lo hace a través de su acción sobre la producción hormonal del páncreas. En el hígado existen receptores -adrenérgicos, que tras ser estimulados por las catecolaminas dan lugar por un lado a un incremento de la glucogenólisis, pero más importante es el aumento de la gluconeogénesis; ambas contribuyen a la aparición de hiperglucemia. Todavía más relevante es su efecto periférico disminuyendo la captación de glucosa por los tejidos, especialmente el muscular. Este hecho se explica también por una estimulación -adrenérgica. Indirectamente las catecolaminas inducen una disminución de la producción de insulina por la célula  del páncreas por un efecto de estimulación ␣2 adrenérgica, que es de más intensidad que el efecto estimulador de la secreción insulínica a través de la -2 estimulación15. Clínica Las manifestaciones clínicas del feocromocitoma estarán en función de sus condiciones asociadas, edad, benignidad o malignidad, tiempo de evolución, esporádico o familiar, tipo predominante de catecolamina secretada y secreción asociada de otras hormonas. Hipertensión arterial En cualquier caso, y dado que la HTA es el dato clínico más sugestivo de feocromocitoma, pensaremos en él ante la aparición de HTA de tipo lábil resistente a tratamientos convencionales; paroxismos de HTA acompañados de sofoco, cefalea, palidez, palpitaciones, dolor abdominal y a veces sensación de muerte inminente; HTA en niños o jóvenes; HTA inducida por la anestesia, parto, cirugía o procedimientos invasivos; HTA asociada a diabetes mellitus; hallazgo de masa adrenal en sujeto con HTA o HTA en un miembro de una familia MEN, vHL, NF1 o PGH. Si la HTA se acompaña de cefalea, hiperhidrosis y palpitaciones la especificidad para feocromocitoma es de un 94% y la sensibilidad de un 91%. La HTA, la más consistente manifestación del feocromocitoma, no aparece en todos los casos; algunos son asintomáticos y en otros predominan otras manifestaciones cardiovasculares o no. Cuando existe HTA puede ser continua con o sin paroxismos, o ser el paciente habitualmente normotenso con aparición de paroxismos hipertensivos. DuranMedicine. 2008;10(15):997-1005 999 ENFERMEDADES ENDOCRINOLÓGICAS Y METABÓLICAS (III) pos de arritmias. En pacientes con secreción pura de adrenalina puede aparecer un cuadro de hipotensión e incluso de shock que a veces alterna con las crisis hipertensivas. Manifestaciones abdominales El feocromocitoma es un tumor que con frecuencia sufre necrosis heFig. 2. Necrosis distal de las extremidades en una paciente con un gran feocromocitoma. morrágica en mayor o menor grado. En casos importantes puede cursar con clínica de te la noche el paciente suele quedar normotenso, pero al desabdomen agudo. El cuadro inducido por la necrosis significapertar e incorporarse de la cama puede aparecer un paroxistiva es grave, pues puede liberar grandes cantidades de catemo. Hay que saber que estos paroxismos comportan diferencolaminas que induzcan una crisis hipertensiva, que a veces se te grado de gravedad, y que ocasionalmente pueden inducir sigue de hipotensión, shock y muerte19. En el aparato digestivo se ha descrito hasta en un 13% de la muerte del paciente de forma súbita o por complicaciones los pacientes la existencia de estreñimiento crónico, en oca(infarto de miocardio, edema agudo de pulmón, etc.). siones acompañado de cuadros pseudoobstructivos. En casos En el momento del diagnóstico, especialmente en los caextremos se han descrito angor abdominal, enterocolitis issos esporádicos, es frecuente que el paciente tenga retinopaquémica y hemorragia digestiva. Si el tumor es secretor de tía hipertensiva en diferentes grados, proteinuria y, a veces, VIP puede cursar con diarreas acuosas e hipokaliemia20. datos de hiperaldosteronismo, en este caso secundario, que no nos debe plantear dudas entre el diagnóstico de feocromocitoma e hiperaldosteronismo. Manifestaciones metabólicas La HTA en niños es un dato muy valorable para el diag16 nóstico de feocromocitoma. Para unos la HTA del niño es Las alteraciones metabólicas son clásicas en este tumor. La semenos paroxística y más continua; sin embargo, para otros17 la presentación clínica del feocromocitoma en el niño es sicreción crónica de catecolaminas incrementa los niveles de milar a la del adulto. lactato, pudiendo desencadenar una acidosis láctica. También el metabolismo de los HC se ve alterado con una situación hiperglucemiante, que puede llegar a franca diabetes mellitus. Crisis catecolamínica Existe intolerancia al calor por aumento de la actividad metabólica, que a veces cursa con fiebre. La hipercalcemia, infreEl paroxismo severo, también conocido como crisis catecolacuente pero posible en ausencia de hiperparatiroidismo, tamminérgica aguda, se debe a una liberación masiva de catecolabién nos debe hacer pensar en una forma de MEN 2. La minas y, a veces, de otras sustancias por el tumor. Su magnitud aparición de osteoporosis puede ser por causa de la acción de y duración son variables, pero, en general, la crisis dura entre las catecolaminas o porque el tumor secrete algún factor que 15 a 30 interminables minutos, asociada sobre todo a cefalea y la induzca. También se ha descrito rabdomiólisis asociada a fesensación de gravedad reconocida por el propio paciente. Las ocromocitoma que puede inducir insuficiencia renal. cifras tensionales pueden alcanzar hasta 300 mmHg o más de sistólica y 150 mmHg de diastólica. Con frecuencia el cuadro Alteraciones hematológicas se complica con angina de pecho o infarto de miocardio (IAM), que se acompaña a veces de bradicardia si la secreción domiCon frecuencia se encuentra un aumento del hematocrito, que nante es de noradrenalina, o de taquicardia si es de adrenalina. se corresponde con un contenido celular normal en un contiEl fenómeno de Raynaud, y a veces gangrena isquémica de exnente reducido por la vasoconstricción crónica. Es importantremidades (fig. 2), pueden ocurrir durante una crisis. También te tener este hecho en cuenta, pues tras la cirugía el descenso está descrito el angor abdominal, a veces acompañado de nedel hematocrito es frecuente y puede inducir a un error diagcrosis intestinal, y el accidente vascular cerebral (ACV). El nóstico y terapéutico de anemia o hemorragia. Es preciso que 75% de las muertes por feocromocitomas en pacientes no diagpasen unas horas para que el volumen plasmático y el tono nosticados o no tratados, son por crisis hipertensivas o hipovascular se regulen, desapareciendo la bajada de hematocrito. tensivas graves, IAM o ACV18. Cardiopatía Plurisecreción hormonal El corazón del paciente con feocromocitoma también se ve afectado por otras patologías como la miocardiopatía dilatada, el edema agudo de pulmón, la miocarditis o diferentes ti- Aunque no sea frecuente, el potencial plurisecretor del feocromocitoma puede hacer que el cuadro catecolaminérgico se enmascare con otros síndromes variados según sean las 1000 Medicine. 2008;10(15):997-1005 FEOCROMOCITOMA TABLA 1 Diferencias en el modo de presentación entre feocromocitomas esporádicos y familiares Esporádico (n = 23) MEN 2 A (n = 23) Primera manifestación HTA Número % % p 14 60 Número 3 13 < 0,001 Estudio familiar 0 0 19 83 < 0,001 Hallazgo por ecografía de abdomen 5 22 0 0 < 0,05 Taquicardia 1 4 0 0 NS Masa abdominal 1 4 0 0 NS Dolor abdominal 1 4 0 0 NS Necropsia 1 4 1 4 NS 5 Fuente: Pomares FJ, et al . HTA: hipertensión arterial; NS: no significativo. hormonas o citoquinas secretadas. Así, el síndrome de Cushing por ACTH ectópica, hiperparatiroidismo por PTH ectópica, diarrea acuosa e hipokaliemia por VIP, fiebre y proceso inflamatorio por IL-6, hipotensión por taquiquininas o histamina son algunos de los cuadros descritos asociados al feocromocitoma. Como se demuestra en la tabla 15, el modo de presentación es diferente según se trate de feocromocitoma familiar o esporádico. Por último, existen feocromocitomas asintomáticos cuyo diagnóstico se hace de forma casual en el transcurso de una exploración abdominal o en una necropsia. Formas especiales de feocromocitoma Síndromes familiares El feocromocitoma es uno de los tumores neuroendocrinos que más debemos contemplar en el entorno de presentación familiar. MEN 2 A y 2 B, vHL, NF1 o PGH, así como el propio feocromocitoma en su forma hereditaria, han de tenerse en cuenta en la valoración clínica de cualquiera de estos procesos o en cualquier feocromocitoma recíprocamente. En los MEN 2 el feocromocitoma acontece en el 4050% de los casos. En una reciente evaluación de nuestros pacientes, de 101 MEN 2 el diagnóstico de feocromocitoma se ha realizado en 37 pacientes. En la actualidad la evaluación periódica de los MEN hace que el feocromocitoma se detecte en fase poco agresiva. Sin embargo, todavía se ven casos de muerte súbita en pacientes con este tumor. El feocromocitoma se presenta en el 14% de los casos de vHL y nunca en el vHL tipo 1. En el VHL tipo 2 sí se presenta, sobre todo en la forma 2C, donde sólo hay feocromocitoma. Por este motivo es importante hacer el diagnóstico genético en todo caso de feocromocitoma familiar. En vHL el feocromocitoma es productor de noradrenalina, pero no de adrenalina, con frecuencia es bilateral, raramente maligno y a veces es multifocal con localizaciones extraadrenales en el abdomen y el tórax. En la NF1 el feocromocitoma es raro, aproximadamente en un 1% de los casos. Sin embargo, en necropsias de pacientes con NF1 se hallan feocromocitomas hasta en un 13%. Los tumores producen tanto adrenalina como noradrenalina. Los feocromocitomas y PGH forman una entidad bien conocida en la actualidad, en la que la mutación del gen de la SDH da lugar a 4 subtipos PGH: 1,2, 3 y 4. El interés de conocer la mutación viene dado por el diferente pronóstico, ya que la mutación SDHB que se corresponde con el tipo 4 alcanza casi un 50% de malignidad. El feocromocitoma se asocia también a otras entidades poco frecuentes, así como a algunas facomatosis, como la esclerosis tuberosa y el síndrome de Sturge-Weber, la ataxiateleangiectasia y algunos casos de complejo de Carney. En el embarazo La aparición de HTA en el embarazo siempre es un riesgo para la madre y para el feto. Suele aparecer después de la vigésima semana y con frecuencia desaparece a las 4-8 semanas postparto. En casos graves evoluciona a una situación de eclampsia que precisa atención urgente. En cualquier caso, pero más si hay paroxismos, se debe descartar la existencia de feocromocitoma, en especial por su gravedad durante el tercer trimestre. No obstante, es raro con una prevalencia de 1 por cada 50.000 embarazos. La clínica suele ser la habitual, pero muchos de los síntomas usuales del feocromocitoma se superponen con los del embarazo con HTA: la propia HTA, la cefalea, la fatiga, el dolor abdominal, los vómitos, las náuseas, los mareos, la hipotensión postural, etc. La HTA puede ser más precoz e intensa que en otros tipos de HTA gestacional, teniendo una alta morbimortalidad. El crecimiento uterino, o los mismos movimientos del feto, pueden desencadenar la crisis hipertensiva. Además, si no se diagnostica durante el embarazoparto la HTA del feocromocitoma se mantiene durante el postparto, hecho que habitualmente no ocurre con HTA ligada al embarazo. Ante la sospecha el estudio con catecolaminas debe realizarse de la forma más precoz posible21. La falta de diagnóstico puede llevar a la paciente a una cardiomiopatía y al riesgo de arritmias o, mucho peor, a la muerte súbita como es el caso “propósito” de una de nuestras familias MEN 2 A que, estando sin diagnóstico, murió en el parto de muerte súbita por sus feocromocitomas. Su tratamiento es más eficaz cuanto antes se realice. La cirugía es la norma, previa preparación con bloqueadores alfa, preferentemente durante el primer o segundo trimestre. Si la madre está ya en el tercer trimestre se debe intentar conseguir un tiempo de embarazo ideal para hacer cesárea y cirugía del feocromocitoma en un mismo acto. En el niño El feocromocitoma tan sólo es la causa de un 1% de la HTA de los niños. En una reciente estadística Ludwing et al22 analizan los datos de 15 niños con feocromocitoma diagnosticados y tratados a lo largo de 34 años. La edad media de presentación era de 11,8 años, siendo similar a otras series. La clínica está representada por cefalea, HTA, náuseas e hiperhidrosis, muchas veces desencadenada por el ejercicio físico. Dos casos fueron asintomáticos, uno con micro-feocromocitomas descubiertos casualmente y otro perteneciente a familia vHL. Las metanefrinas proporcionaron un 100% de sensibilidad. La exploración con metaiodobencilguanidina (MIBG) fue la que más rendimiento tuvo al localizar feocroMedicine. 2008;10(15):997-1005 1001 ENFERMEDADES ENDOCRINOLÓGICAS Y METABÓLICAS (III) mocitomas múltiples en el mismo paciente. La preparación a la cirugía la hicieron con fenoxibenzamina y con metirosina, un inhibidor de la síntesis de catecolaminas, con buenos resultados en ambos casos. Tras la cirugía la supervivencia fue del 100%; sólo el 95% estaban libres de enfermedad a los 5 años, lo que indica la necesidad de seguir a estos pacientes tras la cirugía. Feocromocitoma maligno Aproximadamente el 10% de los feocromocitomas son malignos, aunque la malignidad puede ser mayor o menor en función de la mutación genética que pueda existir. La única prueba evidente de malignidad es la existencia de metástasis a distancia. La infiltración del tumor sugiere malignidad, pero no siempre es así. La MIBG es la mejor opción para localizar las metástasis tumorales, sirviendo además de marcador para posibles tratamientos con MIBG-131I. Diagnóstico De laboratorio Para intentar paliar la falta de guías clínico-diagnósticas en materia de feocromocitoma, en 2005 tuvo lugar en Nueva York el primer simposio internacional sobre feocromocitoma. En él se llegó a la conclusión de que el método de elección para confirmar o excluir la presencia de un feocromocitoma es la determinación plasmática o en orina de 24 horas de metanefrinas, bien totales o, si se puede, fraccionadas (metanefrinas y normetanefrinas). Esto no excluye que, de entrada, también se puedan medir catecolaminas totales o fraccionadas en plasma u orina de 24 horas. La causa de elegir las metanefrinas es porque el feocromocitoma presenta la enzima catecol-O-metiltransferasa (COMT), que cataliza el paso de catecolaminas a metanefrinas en la célula tumoral. También se eligieron a las metanefrinas porque su producción es continua en el tumor, y son las que mejor reflejan la masa tumoral secretora15,23,24. Las metanefrinas tienen la más alta sensibilidad y especificidad para el diagnóstico de feocromocitoma. En el metaanálisis realizado por Grossman23 a partir de 6 importantes estudios de cohorte, la sensibilidad media obtenida es del 98% y la especificidad del 87%, alcanzando en el estudio más numeroso de Lenders25, con 214 feocromocitomas, una sensibilidad del 99% y una especificidad de 89%. En este trabajo sólo 2 de 76 pacientes con feocromocitoma hereditario y 1 de 38 con feocromocitoma esporádico se mostraron como falsos negativos en la determinación de metanefrinas plasmáticas libres. Los dos pacientes con feocromocitoma hereditario eran vHL con feocromocitomas < 1 cm y fueron un hallazgo casual durante la cirugía de carcinoma renal. Nuestra experiencia en el manejo del feocromocitoma hereditario es similar. En 110 pacientes MEN 2 A hemos diagnosticado 28 feocromocitomas, de los cuales 13 no eran sintomáticos y 15 sí. Las catecolaminas, metanefrinas y ácido vanilmandélico (AVM) en orina de 24 horas se midieron en todos los pacientes, siendo los niveles patológicos en 24 de ellos (85,7%) y normales en los 4 restantes (14,3%). Cuando fueron pato1002 Medicine. 2008;10(15):997-1005 lógicos las metanefrinas se mostraron como el mejor indicador diagnóstico, seguidas por las catecolaminas, siendo el peor indicador el AVM. Debido a que en tumores pequeños podemos encontrarnos con estos falsos negativos, a todos nuestros pacientes MEN 2 A les realizamos una primera tomografía axial computarizada (TAC) abdominal a los 20 años, que ha servido para diagnosticar a 4 pacientes con estudio bioquímico normal. También existen falsos positivos en las pruebas bioquímicas. Esto ocurre sobre todo en tres grupos de personas: a) muy estresadas; b) consumidoras de cafeína y c) que ingieren determinados fármacos y/o alimentos. El estrés es una causa de liberación de catecolaminas de los nervios simpáticos y de la médula adrenal. La extracción de sangre para la determinación de metanefrinas/catecolaminas debe hacerse en ambiente tranquilo, en reposo tras 12 horas de ayuno y previa inserción intravenosa de una cánula tipo abbocath al menos 15 minutos antes de la extracción. El ácido cafeico se encuentra no sólo en el café normal, sino también en el descafeinado, y se metaboliza a ácido dihidrocafeico, que interfiere directamente con la determinación de catecolaminas y también con la de metanefrinas. De los fármacos, hay una larga lista que deben eliminarse antes de la recogida de muestras. Los de uso más frecuente son: fenotiazinas, antidepresivos tricíclicos, calcioantagonistas, inhibidores de la enzima de conversión de la angiotensina, bromocriptina, cimetidina, bloqueadores alfa, bloqueadores beta, labetalol, minoxidil y ácido nalidíxico. De los alimentos deben evitarse los que contengan cacao, vainilla o las frutas tropicales, como el plátano. Pruebas de imagen Una vez hecho el diagnóstico bioquímico se procede a la localización del feocromocitoma. También nos sirve la imagen para el seguimiento de incidentalomas y para orientar si ese tumor puede depender de la corteza suprarrenal o de la médula por sus diferentes intensidades. Por otra parte, tal y como se ha comentado antes, en el feocromocitoma familiar no es infrecuente diagnosticar el tumor antes por la imagen que por la alteración bioquímica. Excepto para niños, embarazadas o personas con alergia a contrastes, hay un consenso en utilizar la TAC como método de inicio; la resonancia magnética (RM) quedaría para los pacientes en los que la TAC está contraindicada. Tomografía axial computarizada La TAC tiene una contrastada sensibilidad de un 90-95% para la localización del tumor. Feocromocitomas adrenales de 1 cm o metástasis de 1 a 2 cm son fácilmente detectados. Además permite distinguir por densitometría, usando unidades Hounsfiel (HU), si estamos ante adenomas adrenales u otros tumores, incluyendo el feocromocitoma, que se presenta como tejido blando de unas 40-50 HU. También la TAC permite encontrar lesiones de hemorragia o necrosis intratumorales, frecuentes en el feocromocitoma23. Los modernos sistemas de TC permiten una reconstrucción 3D especialmente útil en metástasis o paragangliomas. Asimismo hay que considerar el menor coste de la TAC frente a la RM. FEOCROMOCITOMA Resonancia magnética Esta última es igualmente útil para el estudio de imagen del feocromocitoma, presentando similar sensibilidad que la TAC. Clásicamente se describe que el feocromocitoma tiene una mayor intensidad en T2, pero hay que tener en cuenta que esa señal también pueden presentarla situaciones diferentes en las que haya hemorragia, hematoma o carcinomas. La RM es de elección cuando se sospecha que el feocromocitoma puede localizarse en cavidades del corazón o junto al corazón o a vasos principales. También será de elección en niños, embarazadas o personas alérgicas al contraste. Gammagrafía con MIBG La escintigrafía con MIBG marcada con 123I ó 131I nos permite la exploración funcional y localización del tumor y, sobre todo, la localización de metástasis cuando el feocromocitoma es maligno. Su indicación principal es cuando existe un diagnóstico clínico-bioquímico muy importante y la TAC/RM son negativas. También se puede utilizar ante un incidentaloma. Antes de su realización se ha de bloquear el tiroides con yodo, acción que se inicia uno o dos días antes de dar la MIBG y se mantiene hasta 7 días después. Las imágenes, posteriormente de dar una dosis de 3 a 10 mCi, se obtienen a las 24, 48 y 72 horas para el 131I o a las 6, 18, 24 y 48 horas para el 123I. Tomografía por emisión de positrones La tomografía por emisión de positrones (PET) también es útil. La más frecuentemente utilizada para detectar el feocromocitoma es la [18F]-fluordeoxiglucosa, pero no es un agente específico de este tipo de tumor, sino que puede compartir diagnóstico con cualquier otro tumor que también tenga un alto gasto metabólico. Más específico es el uso de otras moléculas, como: 6-[18F]-fluorodopamina, [18F]- dihidroxifenilalanina, [11C]-hidroxiefedrina o [11C]-epinefrina. Octreoscan El feocromocitoma también expresa receptores de somatostatina (SST) hasta en un 75% de los tumores, y en ese sentido la escintigrafía con octreoscan es útil para la localización de feocromocitomas malignos y, sobre todo, de sus metástasis. Comparada esta exploración con la MIBG, ésta es más sensible, pero en algunos casos en los que el feocromocitoma maligno o sus metástasis han perdido los transportadores de noradrenalina de la membrana dan positividad para octreoscan si tienen receptores de SST, lo que nos ayuda a localizar el tumor y además nos indica la posibilidad de uso de análogos de somatostatina en el tratamiento de feocromocitomas metastáticos. En definitiva, nuestro consejo es utilizar siempre que se pueda la TAC como técnica de primera línea, asociada o no a MIBG. Diagnóstico diferencial entre feocromocitoma y paraganglioma Las manifestaciones clínicas del paraganglioma simpático y del feocromocitoma con frecuencia son muy parecidas. No así el paraganglioma parasimpático, que raramente es secretor de catecolaminas. En una reciente revisión del tema26 el diagnóstico por clínica adrenérgica se hizo en el 65% de los feocromocitomas, en el 44% de paragangliomas simpáticos y curiosamente también en el 40% de los parasimpáticos. En ese sentido, el diagnóstico porcentual de clínica adrenérgica baja mucho cuando se diagnostican feocromocitomas del MEN 2 en la investigación rutinaria de este cuadro familiar, que nos lleva a diagnósticos bioquímicos o de imagen antes de que aparezca la clínica adrenérgica. Por el contrario, el efecto masa está presente en el 100% de los paragangliomas parasimpáticos, bajando ya al 45% en los simpáticos. El diagnóstico de paragangliomas se realiza con frecuencia postcirugía, quizás por no ser remitidos todos los tumores sospechosos a un Servicio especializado de Endocrinología. La importancia estriba en la alta frecuencia de malignidad de los paragangliomas, a menudo con metástasis que los médicos deben conocer antes de someter al paciente a cirugía. Además, la aparición de uno de estos tumores en un paciente “propósito” debe seguirse del estudio genético del mismo y de los familiares de primer grado cuando éste sea positivo. Tratamiento Por definición el tratamiento es quirúrgico, pero ante el riesgo de liberación masiva de catecolaminas durante el acto quirúrgico el paciente debe ser preparado para la cirugía con bloqueo ␣-adrenérgico, que restablezca el volumen circulante y evite los picos hipertensivos. La liberación de catecolaminas puede realizarse en la inducción de la anestesia, durante la incisión abdominal o en el neumoperitoneo de la cirugía laparoscópica, o más frecuentemente en la manipulación del tumor antes de ligar la vena suprarrenal. Preparación para la cirugía El tratamiento con fenoxibenzamina, quizá el más común, induce un bloqueo ␣-adrenérgico. Se administra durante al menos 10-15 días antes de la cirugía a dosis de 10-20 mg (3 veces día) hasta que se controle la tensión arterial. Este fármaco es un bloqueador ␣1-adrenérgico postsináptico y ␣2-adrenérgico presináptico, por lo que puede producir hipotensión ortostática y prolongar la hipotensión postoperatoria. Otro bloqueador ␣1 es: prazosín selectivo ␣-1, de acción más corta; se utiliza a dosis de 2-5 mg cada 12 horas y se puede aumentar hasta 20 mg. Los calcioantagonistas también se usan en el manejo de la HTA1,27,28. Si aparecen taquicardias o arritmias se deben utilizar bloqueadores beta, pero nunca antes de instaurar el bloqueo ␣. El fármaco de elección es propanolol a dosis de 10 mg/6-8 horas por vía oral los 3-5 días previos a la cirugía. Labetalol, bloqueador ␣1 y  efectivo en el control de la HTA, puede interferir con la captación del 131I-MIBG. De existir hiperglucemia se puede necesitar tratamiento insulínico preoperatorio. Medicine. 2008;10(15):997-1005 1003 ENFERMEDADES ENDOCRINOLÓGICAS Y METABÓLICAS (III) Tratamiento quirúrgico Manejo intraoperatorio Se precisa una completa monitorización del paciente, que incluye vía venosa central y periférica, catéter arterial con monitorización de tensión, electrocardiograma y sonda vesical. Algunos de los fármacos que pueden utilizarse en el acto anestésico, como los relajantes musculares, pueden ser peligrosos. Se recomienda vecuronio, ya que otros relajantes pueden condicionar hipertensión. Para el tratamiento de las crisis hipertensivas se emplea nitroprusiato sódico intravenoso; fentolamina, otro potente hipotensor, no cesa tan rápidamente su efecto y esmolol a pequeñas dosis intermitentes puede ser también muy eficaz. En caso de arritmias puede emplearse lidocaína o bloqueadores beta, dependiendo del tipo de arritmia. Se debe evitar droperidol, estimulante de la secreción de catecolaminas y de atropina, que induce taquicardia. Una vez resecado el feocromocitoma el problema es la hipotensión, como consecuencia de la vasodilatación y por los efectos residuales de los bloqueadores alfa preoperatorios. El tratamiento es reposición generosa, pero muy vigilada de volumen. Los agentes vasopresores no son efectivos hasta la repleción vascular28. Manejo quirúrgico La resección quirúrgica del feocromocitoma debe ser completa, evitando la ruptura capsular y la diseminación celular local. La manipulación tumoral debe ser mínima, con cierre precoz de la vena suprarrenal para minimizar las crisis hipertensivas. La fiabilidad de las exploraciones complementarias preoperatorias permite una cirugía más dirigida, tanto abierta como laparoscópica, sin necesidad de grandes disecciones. La vía de abordaje de elección, como en toda patología suprarrenal, es laparoscópica, con mejores resultados con respecto a la abierta en relación con el dolor, menor incisión, estancia media e incorporación laboral. Sin embargo, la laparoscopia no estaría indicada ante sospecha de malignidad de la lesión o ante tumores de gran tamaño. Aunque se han resecado así tumores de hasta 12 cm, la indicación va a depender de la experiencia del cirujano, considerándose tumores grandes por encima de 8-10 cm. La cirugía abierta, cuando se realiza, suele ser por laparotomía media o por incisión subcostal bilateral. Se indica si el cirujano tiene poca experiencia en laparoscopia, en pacientes con adherencias por cirugía abdominal previa, en casos con sospecha de feocromocitoma maligno o en tumores de gran tamaño28-30. Postoperatorio inmediato Los problemas son fundamentalmente dos: 1. El primero es la hipotensión por hipovolemia, como se ha descrito en las consideraciones intraoperatorias. El tratamiento es la reposición hídrica. Es importante evitar la hemorragia postoperatoria, dada la gran vascularización del feocromocitoma. 2. En segundo lugar también pueden producirse hipoglucemias graves por el hiperinsulinismo de rebote al cesar el 1004 Medicine. 2008;10(15):997-1005 efecto inhibitorio de las catecolaminas sobre la insulina. El bloqueo -adrenérgico dificulta la recuperación de la glucemia. Hay que vigilar la acidosis metabólica por cúmulo de lactato. En suprarrenalectomía bilateral es imprescindible la prevención y el tratamiento de la insuficiencia suprarrenal. Tratamiento posquirúrgico La disminución de los niveles de adrenalina y noradrenalina puede ser motivo de hipotensión durante algunos días, máxime en pacientes que han sufrido bloqueo ␣. Si persiste la HTA puede ser porque queda “feocromocitoma funcionante” o porque presenta asociadamente HTA vascular o de otro tipo. Cirugía en situaciones especiales Paraganglioma Desde el punto de vista quirúrgico hay que tener en cuenta que los paragangliomas suelen ser de localización abdominal, a veces múltiples y más frecuentemente malignos que en la localización adrenal. Esto obliga a una perfecta localización con técnicas de imagen para excluir multiplicidad y metástasis. La vía de abordaje suele ser abdominal, bien por laparotomía tradicional o por laparoscopia. Feocromocitoma familiar (MEN 2) El tipo óptimo de cirugía a realizar ha sido muy discutido. La adrenalectomía bilateral, teóricamente de elección, condiciona entre el 10-30% de crisis addisonianas, habiéndose descrito incluso muertes. Hoy en día se prefiere la adrenalectomía de la glándula afectada (valoración con TAC/RM y escintigrafía con MIBG). La adrenalectomía unilateral previene la insuficiencia suprarrenal, pero se estima que el 50% o más de pacientes con adrenalectomía unilateral van a desarrollar un feocromocitoma contralateral en los siguientes 10 años. Esto obliga a un estricto seguimiento. En pacientes con tumor bilateral el tratamiento estándar es la adrenalectomía bilateral. Sin embargo, algunos grupos realizan adrenalectomía total de un lado y subcortical del otro. Suele elegirse para la resección parcial la glándula con el tumor más pequeño o de localización más periférica. Esta técnica es difícil, no siempre técnicamente realizable y con un índice de recidivas superior al 30%30. Feocromocitoma maligno En estos casos debe intentarse la resección, aunque esto incluya la cava, el riñón u otros órganos adyacentes. Puede estar también indicada la resección de metástasis a distancia. En general se puede decir que la reducción de la masa tumoral permite un mejor control de los síntomas derivados de la secreción tumoral y aumenta la eficacia de la terapia adyuvante. La cirugía de las metástasis, si las hubiera, ha de ser lo más radical posible, y si es necesario de repetición, seguida de tratamiento isotópico; es lo más efectivo, aunque no curativo. La cirugía debe hacerse tanto en el tumor primitivo como en sus metástasis, localizadas previamente. Tras la ci- FEOCROMOCITOMA rugía se administran 200 mCi de MIBG-131I, que deben repetirse entre los 4 y 6 meses. La escintigrafía después del 131I nos informa de cuál es la situación. Si un nuevo rastreo con MIBG, RM o TAC a los 4 meses demuestra nuevos focos accesibles para cirugía se debería plantear una nueva intervención antes de seguir con el 131I. Si el tumor tiene receptores para somatostatina se puede probar el tratamiento con análogos de somatostatina, conjuntamente con la cirugía y el tratamiento isotópico. Es obligado utilizar la fenoxibenzamina; en algunos casos es muy útil la ␣-metil-tirosina. Bibliografía • Importante •• Muy importante ✔ Metaanálisis ✔ Artículo de revisión Ensayo clínico controlado ✔ ✔ Guía de práctica clínica ✔ Epidemiología 1. • Pacak K, Linehan WM, Eisenhofer G, Walter MM, Goldstein ✔ DS. Recents advances in genetics, diagnosis, localization, and treat- 12. • Schulz C, Eisenhofer G, Lehnert H. Principles of catecholamine ✔ biosynthesis, metabolism and release. En: Lehnert H, editor. Pheochromocytoma. Pathophysiology and clinical management. Basel (Switzerland): KARGER; 2004. p. 1-25. Mahata SK, Mahata M, Fischer-Colbrie R, Winkler H. Vesicle monoamine transporters 1 and 2: Differential distribution and regulation of their mRNAs in chromaffin and ganglion cells of rat adrenal medulla. Neurosci Lett. 1993;156:70-2. Bravo EL, Tagle R. Pheochromocytoma: State-of-the-art and future prospects. Endocr Rev. 2003;24:539-53. Zapanti E, Ilias I. Pheochromocytoma. Physiopathologic implications and diagnostic evaluation. Ann N Y Acad Sci. 2006;1088: 346-60. Stackpole RH, Melicow MM, Uson AC. Phaeochromocytoma in children. Report of 9 cases and review of the first 100 published cases with follow-up studies. J Pediatr. 1963;63:315-30. Pham TH, Moir C, Thompson GB, Zarroug AE, Hamner CE, Farley D, et al. Pheochromocytoma and paraganglioma in children: a review of medical and surgical management at tertiary care center. Pediatrics. 2006;118:1109-17. Platts JK, Drew PJT, Harvey JN. Death from phaeochromocytoma: lesson from a post-mortem survey. J R Coll Physicians Lond. 1995;29:299-306. Kaltsas GA, Papadogias D, Grossman AB. The clinical presentation (symptoms and sings) of sporadics and familial chromaffin cell tumours (phaechromocytomas and paragangliomas). En: Lehnert H, editor. Pheochromocytoma. Pathophysiology and clinical management. Basel (Switzerland): KARGER; 2004. p. 61-75. Bravo L. Phaeochromocytoma. Cardiol Rev. 2002;10:44-50. Kamari Y, Sharabi Y, Leiba A, Peleg E, Apter S, Grossman E. Peripartum hypertension from pheochromocytoma: a rare and challenging entity. AJH. 2005;18:1306-12. Ludwing AD, Feig DI, Brandt ML, Hicks MJ, Fitch ME, Cass DL. Recent advances in the diagnosis and treatment of pheochromocytoma in children. Am J Surgery. 2007;194:792-7. Grossman A, Pacak K, Sawka A, Lenders JWM, Harlander D, Peaston RT, et al. Biochemical diagnosis and localization of pheochromocytoma. Can we reach a consensus? Ann N Y Acad Sci. 2006;1073:332-47. Manger WM. An overwiew of pheochromocytoma. History, current concepts, vagaries and diagnostic challenges. Ann N Y Acad Sci. 2006;1073:1-20. Lenders JWM, Pacak K, Walther MCM, Linehan WM, Mannelli M, Friberg P, et al. Biochemical diagnosis of pheochromocytoma. Wich test is best? JAMA. 2002;287:1427-34. Hervás Abad E, Páramo Fernández C, Casteras Román A, Luna Cano R, Encisa de Sa JM, García-Mayor R. Similitudes y discrepancias en las características clinicopatológicas de feocromocitoma y parangangliomas. Endocrinol Nutr. 2007;54:519-24. Ponce Marco JL. Tratamiento quirúrgico del feocromocitoma. En: Tébar Massó FJ, Rodríguez González JM, editores. Neoplasias Endocrinas Múltiples. Barcelona: EDIKAMED; 2004. p. 165-9. Karangiannis A, Mikhailidis DP, Atrios VG, Harsoulis F. Pheochromocitoma: an update on genetics and management. Endocr Rel Cancer. 2007;14:935-56. Plaggemars HJ, Targarona EM, Couwelaar GV, D´Ambra M, García A, Rebasa P, et al. ¿Qué ha cambiado en la adrenalectomía? De la cirugía abierta a la laparoscópica. Cir Esp. 2005;77:132-8. Walther MCM. New therapeutic and surgical approaches for sporadic and hereditary pheochromocytoma. Ann N Y Acad Sci. 2002;979:41-53. 13. • ✔ 14. • ✔ 15. • ✔ 16 • ✔ 17. • ✔ 18. • ✔ 19. • ✔ 20. • ✔ 21. • ✔ ment of pheochromocytoma. Ann Inter Med. 2001;134:315-29. 22. • ✔ Rev. 2004;25:485-511. 23. •• ✔ 2. • Kaltsas GA, Besser GM, Grossman AB. The diagnosis and me✔ dical management of advanced neuroendocrine tumors. Endocr 3. • Omura M, Saito J, Yamaguchi K, Kakuta Y, Nishikawa T. Pros✔ pective study on the prevalence of secondary hypertension among hypertensive patients visiting a general outpatient clinic in Japan. Hypertens Res. 2004;27:193-202. Barontini M, Levin G, Sanso G. Characteristics of pheochromocytoma in 4- to 20-year-old population. Ann N Y Acad Sci. 2006;1073:30-7. Pomares FJ, Cañas R, Rodríguez JM, Hernández AM, Parrilla P, Tébar FJ. Differences between sporadic and multiple endocrine neoplasia type 2A phaeochromocytoma. Clin Endocrinol. 1998;48:195-200. Bernabé MJ, Carbonell P. Genética de MEN 2. Diagnóstico genético. En: Tébar FJ, Rodríguez JM, editores. Neoplasias Endocrinas Múltiples. Barcelona: EDIKAMED; 2004. p. 132-8. Kazumasa I, Kazuhiro T, Yasushi K, Toshiaki K. Pathogenesis of pheochromocytoma. En: Lehnert H, editor. Pheochromocytoma. Pathophysiology and clinical management. Basel (Switzerland): KARGER; 2004. p. 26-44. Boedeker CCH, Neumann HPH, Ridder GJ, Maier W, Schipper J. Paragangliomas in patients with mutations of the SDHD gene. Otolaryngol Head Neck Surg. 2005;132:467-70. Benn DA, Robinson BG. Genetic basis of phaeochromocytoma and paraganglioma. Best Pract Res Clin Endocrinol Metab. 2006;20:435-50. Neuman H, Bausch B, McWhinney SR, Bender BU, Gimm O, Franke G, et al. Germ-line mutations in nonsyndromic pheochromocytoma. N Engl J Med. 2002;346:1459-66. Benn DE, Dwight T, Richardson AL. Sporadic and familial pheochromocytomas are asociated with loss of at least two discrete intervals on chromosome 1p. Cancer Res. 2000;60:7048-51. 4. • ✔ 24. • ✔ 5. • ✔ 25. 6. • ✔ 7. •• ✔ 8. • ✔ 9. • ✔ 10. •• ✔ 11. • ✔ • 26. • ✔ 27. • ✔ 28. • ✔ 29. • ✔ 30. • ✔ Páginas web www.ncbi.nlm.nih.gov/sites/entrez?db=pubmed Medicine. 2008;10(15):997-1005 1005