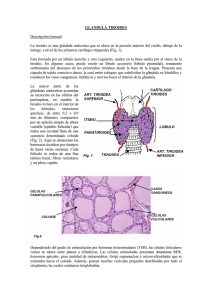
tesis - Universidad de Colima
Anuncio

UNIVERSIDAD DE COLIMA FACULTAD DE CIENCIAS BIOLdGfCAS YAGROPECUARIAS “CARACTERIZACIÓN MORFOLÓGICA Y FUNCIONAL DE TIROCITOS DE EXPLANTES TIROIDEOS DE RATA SPRAGUE - DAWLEY’ T E S I S QUE PRESENTA: PARA OBTENER EL GRADO DE : MAESTRO EN CIENCIAS ÁREA: BIOTÉCNOLOGíA LíNEA HERENCIA DE INVESTIGACIÓN: Y ADAPTACIÓN DI DR. SERGIO DR. TECOMÁN, RECTORES HUGO JAME COLIMA, : SA’NCHEZ MOLINA MÉXICO, ANIMAL R O D R ÍGUEZ OCHOA SEPTIEMBRE DE 1999 Tesis elaborada bajo la dirección de los Doctores: Dr. Sergio Hugo Sánchez Rodrígue Dr. Jaime Molina Ocho Y por el comitC particular de asesores, por los Doctores: Dr. Javier Farías Lario Dr. Oscar Rebolledo Domíngue Dr. Roberto Lezama Gutiérrez Dr. Rafael Herrera Esparza Quienes manifestamos que hemos revisado y aceptado el informe final de investigación, mismo que reúne los requisitos académicos para obtener el grado de: Maestro en Ciencias Especialidad: Biotecnologia. Linea de Investigación Herencia y Adaptación Animal. Facultad de Ciencias Biológicas y Ag ropecuarias C. EDUARDO MANZANARES ACUÑA ALUMNO DEL POSGRADO DE LA FGBA PRESENTE titulada En base a los dictámenes emitidos a su tesis “CARACTERIZACI6N MORFOLÓGICA Y FUNCIONAL DE TIROCITOS DE EXPLANTES TIROIDEOS DE RATA SPRAGUE-DAWLEY” por el cuerpo académico de la Facultad y el asesor externo, me permito informar a usted, que habiendo cumplido el documento con los requisitos académicos de forma y fondo, se autoriza la impresión de misma para ser presentada ante un jurado, con el fin de obtener el titulo de “MAESTRO EN CIENCIAS, ÁREA BIOTECNOLOGÍA, en la línea de investigación “Herencia y Adaptación Animal”. Dicho trabajo fue realizado bajo la dirección de los Doctores Sergio Hugo Sánchez Rodríguez de la Universidad Autónoma de Zacatecas (UAZ) y Jaime Molina Ochoa y los asesores Drs. Roberto Lezama Gutiérrez, Oscar Rebolledo Dominguez, Javier Farias Larios de la Universidad de Colima y Dr. Rafael Herrera Esparza del Centro de Biología Experimental de la UAZ. ATENTAMENTE Tecomán, Col. a 09 ÍNDICE Agradecimientos ............................................................................................................ i Dedicatorias ................................................................................................................... ii ... Resumen ........................................................................................................................ 1 1 1 Abstract ......................................................................................................................... iv Lista de Figuras.. ........................................................................................................... v I.- INTRODUCCIÓN . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . ..~........... 1 II. REVISIÓN DE LITERATURA. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . ...*................................................... 7 2.1 Glhdula tiroides ...................................................................................................................................... 2.1.1.2 Fisiologia de las chlas tiroideas .................................................................................................... 2.1.2 Hormonas tiroideas TI y T, ................................................................................................................. 2.1.3 Tiroglobulina ........................................................................................................................................ 2.2 Hormona estimulante de la tiroides (TSH) .......................................................................................... 2.3 Citoesqueleto.. ......................................................................................................................................... 2.4 Cultivo celular.. ....................................................................................................................................... 7 10 10 14 15 18 20 III. MATERIALES Y MÉTODOS ......... ..*.............................*.....,......................*................. 2 3 3.1 Panorama general ................................................................................................................................... 3.2 Sujetos experimentales ........................................................................................................................... 3.3. Obtención de las cklulas tiroideas......................................................................................................... 3.3.1 Explante tiroideo.. ................................................................................................................................ 3.3.2 Disociación celular ............................................................................................................................... 3.3.3 Cultivo celular ...................................................................................................................................... 3.4 Determinación de la viabilidad celular.. ............................................................................................... 3.5 Lisis celular ............................................................................................................................................. 3.6 Determinación de proteinas en extractos totales.. ................................................................................ 3.7 Electroforksis (F’AGE-SDS) .................................................................................................................. 3.8 Transferencia de proteinas a membrana de nitrocelulosa .................................................................. 3.9 Bloqueo de la membrana de nitrocelulosa ............................................................................................ 3.10 Inmunodetección .................................................................................................................................. 3.11 Determinación de tiroglobulina .......................................................................................................... 3.12 Inmunoflorescencia indirecta para detectar receptores a TSH, filamentos de Actina y microtúbulos ................................................................................................................................................. 3.13 Anhlisis estadlstico.. ............................................................................................................................ 23 23 24 24 24 25 26 26 27 .27 28 28 .28 .28 29 .29 IV. RESULTADOS.................................................................................................................. 3 1 4.1 Viabilidad celular ................................................................................................................................... 31 4.1.1 Concentración de suero fetal de ternera.. .......................................................................................... 4.2 Caracterización morfológica .................................................................................................................. 4.3 Determinación de Tiroglobulina.. ......................................................................................................... 4.4 Expresión de receptores a TSH ............................................................................................................ 32 33 .35 .36 V. DISCUSIÓN ......*.......,..........,..,...............,...................*....................................................... 4 1 5.1 Tkcnicas de disociación, a partir del explante tiroideo y medición de la viabilidad celular.............4 1 43 5.1.1 Condiciones del cultivo ........................................................................................................................ 45 5.2 Caracterización morfológica .................................................................................................................. .47 5.3 Caracterización funcional ..................................................................................................................... 5.4 Expresión de los receptores a TSH y componentes del citoesqueleto.. .............................................. .48 VI. CONCLUSIONES ................ .......... .................................... ..*....................*....................... 5 2 53 VII. LITERATURA CITADA. . . . . . . . . . . . . . . . . . . . . . . . . ...*................................................................... AGRADECIMIENTOS Al cuerpo de Asesores Internos de la Universidad de Colima: Facultad de Ciencias Biológicas y Agropecuarias. Dr. Jaime Molina Ochoa. Dr. Oscar Rebolledo Domínguez. Dr. Javier Farías Larios Dr. Roberto Lezama Gutierrez. A la Universidad Autónoma de Zacatecas, en especial para el director y asesor de la tesis respectivamente: Dr. Sergio Hugo Sánchez Rodríguez. Dr. Rafael Herrera Esparza. Al Consejo Nacional de Ciencia y Tecnología por su apoyo mediante la beca 121262, muchas gracias. A PROMEP, por su apoyo complementario. DEDICATORIAS En memoria de mi abuelo: Don José Manuel Acuna de Santiago. A mis padres, Teresita del NiAo Jesús Acuña Félix y Lic. J. Jesús Manzanares Jacobo A Mis Hermanos: Teresa Eugenia, José de Jesús, María Rosaura, Miguel Angel, Sergio, Ernesto Manuel, Héctor Martín, Gustavo Adolfo, Edmundo y María del Rocío. A mi esposa Laura Josefina, por su gran apoyo, comprensión e impulso para alcanzar ésta meta. A mis hijos: Luis Eduardo, Alejandro y Laura Karina, por su amor y apoyo. Al Dr. Miguel Arenas Vargas y al Dr. Luis Felipe Bojalil Jaber, por haberme motivado y mostrarme otra gran faceta del proceso enseñanza-aprendizaje. A mis amigos, por sus acertados consejos: Héctor René Vega Carrillo, Sergio Hugo Sánchez Rodríguez, Rómulo Bañuelos Valenzuela, Miguel Angel Salas Luévano, Carlos Moran Rodríguez y Héctor Alfredo Robles Martínez. Al Dr. Rafael Herrera Esparza, por sus muy atinados consejos y guía. A mis compañeros del CREN, por su estímulo y tolerancia. A mis compañeros de la FCBA. Para aquellos a los que omití involuntariamente. RESUMEN En el presente trabajo se realizó la estandarización de un modelo biológico in vitro para llevar a efecto estudios fisiológicos de la glandula tiroides. Se efectuó la digestión enzimática del explante tiroideo, y se determinó la viabilidad celular. Se utilizaron diferentes concentraciones de hormonas y 5% de suero fetal de ternera. La caracterización morfológica de las células tiroideas se realizó comparándolas contra las de la línea célular FRTLS. La caracterización funcional se determinó por la presencia de tiroglobulina por RIA, posteriormente las células tiroideas en monocapa se procesaron para IFI y se observó la expresión de receptores a la TSH y a los componentes del citoesqueleto tubulina y actina. Se analizó la expresión del receptor contra TSH, en extractos celulares de tirocitos, células HeLa, hepatocitos, y linfocitos. En la digestión enzimática con tripsina-EDTA y colagenasa 1, se encontró que el rendimiento es igual usando tiempos de digestión de 30 y 60 min; y se encontró que fue mas eficiente (PcO.05) en comparación con tripsina-verseno. Al medir los niveles de tiroglobulina, se encontró una elevación importante en la tercera semana de 7.04 ng/mI, en comparación a la cifra basal de 1.47 ng/ml. Los cultivos primarios de tirocitos, expresaron los receptores a la TSH, y al citoesqueleto de actina y tubulina, mientras que en las células HeLa (control), se observó dicho fenómeno sólo para tubulina y actina, más no para el receptor a la TSH. La presencia de los receptores a la TSH en los tirocitos, se demostró ademas por medio de inmunodetección. Los resultados indican que el método utilizado, permite la obtención y mantenimiento de cultivos primarios de células tiroideas. Palabras clave: Cultivo celular, tripsina, colagenasa, tirocitos. ABSTRACT In this research work, the standarization a in vifro biological model, has been carried out, in order to fi.trther physiological studies in the thyroid gland. Enzimatic digestion, followed by the ce11 viability determination. Cell culture was performed with different hormones concentrations and 5% calf serum was used. Morphological characterization of cultured thyroid cells was compared with the cell line FRTLS. Functional characterization was performed through the measurements of thyroglobulin by Radioimmunoassay method. Using indirect immunofluorescence, thyrotropin receptors and cytoskeleton components were observed, meanwhile actin and tubulin. During the ce11 disgregation with trypsin - EDTA and collagenase was found that the enzimatic digestion, was more effrcient (PcO.05) than using trypsin-verseno. Yield using tripsyn - EDTA, for 30 and 60 min was statistical similar. Measure of thyroglobulin showed a bigger leve1 during the third week, 7.04 ng/ml, in comparison with basal leve1 of 1.47 @ml. Thyroid cells in the primary culture, expressed the thyrotropin receptors (TSHr), and the cytoskeleton componer& as the actin and tubulin, meanwhile in the HeLa cells (control) only the tubulin and actin were observed. The presente of TSHr was observed by immunodetection. The method developed here allows us to obtain and maintain primary thyroid ce11 cultures. Keywords: Ce11 Culture, Trypsin, Collagenase, Tbyrocytes. LISTA DE FIGURAS Figura 1 .- Página Porciento de viabilidad obtenida con el método de Rapoport, a las 2 h (barraly2)yalas3h(barra3y4) ..* . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 31 2 .- Datos obtenidos en la viabilidad celular de acuerdo al método de Ambesi-Impiombato, a tiempos de 30 min (barras 1-4) y 60 min (barras 5-8) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3 2 3 .- Microfotografia de cultivo de tirocitos después de 21 días, donde se muestra a las células tiroideas obtenidas en cultivo primario (izquierda) y las células tiroideas de la línea celular FRTLS (derecha) tomadas con un objetivo 40)3.........33 4 .- Microfotografía de los tirocitos obtenidos después de 15 días de cultivo primario (izquierda) comparando contra la línea celular de tirocitos FRTLS (derecha) utilizando un objetivo 40X . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 34 5 .- Microfotografía en donde se muestra la morfología adoptadas por los tirocitos en cultivo primario obtenida con un objetivo 10X . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 34 6 .- Comportamiento de la producción de tiroglobulina desde la 1’ a la 5” semana y donde se observa que la primera barra es la concentración basal del medio de cultivo, y las 5 siguientes son las cifras determinadas cada semana . . . . . . . . . . . . . . . . . . . . . . 35 7 .- Microfotografía de los tirocitos obtenidos después de 15 días de cultivo primario tomada por contraste de fases (izquierda) y por inmunofluorescencia para la detección de los receptores a la TSH (derecha) con objetivo 100X . . . . . . . . . . . . . . . . . . . . . . . 36 8 .- Microfotografia de los tirocitos obtenidos, después de 15 días de cultivo observados por medio de contraste de fases (izquierda) y por IFI para detectar a la or-tubulina (derecha) utilizando un objetivo 100X . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 37 9 .- Microfotografla de los tirocitos obtenidos, después de 15 días de cultivo, observados por medio de contraste de fases (izquierda) y por IFI para detectar filamentos de actina (derecha) utilizando el objetivo 100X . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 37 lO.- Microfotografía de los tirocitos a los 15 días de cultivo, por contraste de fases (izquierda) y por inmunofluorescencia para detectar filamentos de actina (derecha) por medio de un objetivo 100X . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 38 1 l.- Microfotografia de los tirocitos cultivados en cubreobjetos a los 15 días de cultivo, por contraste de fases (izquierda) y por IFI para detectar p - tubulina (derecha) por medio de un objetivo 100X. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 38 12.- Microfotografía de las células HeLa, observadas por contraste de fases (izquierda) e IFI para detectar filamentos de actina (derecha) tomada con un objetivo 100X . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 39 13.- Inmunodetección de receptores a TSH, en la que se presentan en primer lugar, a los extractos de células hepáticas (H), tiroideas (T), células HeLa (He) y linfocitos respectivamente, se observa la presencia del receptor a TSH en hepatocitos, tirocitos y linfocitos, pero no en las células HeLa . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 40 vi I.- INTRODUCCIÓN En el presente trabajo, se utilizaron los métodos de Rapoport (1976), y de AmbesiImpiombato (1980), para lograr el desarrollo de células en cultivo primario, a partir de explantes tiroideos de rata Sprague-Dawley, cuyo comportamiento fuera lo mas aproximado a las de la línea celular FRTLS. En los cultivos celulares, un fenómeno observado, es el de una respuesta celular completamente anormal, al proceso que ocurre in vivo. La modificación del medio ambiente in vitre propuesto por Eagle (1955), permitió el desarrollo de las diversas líneas celulares. Koningsberg, (1963) Mostró que las deficiencias en las técnicas de cultivos celulares, son perfectibles, ya que muestran limitaciones intrínsecas, que no se han satisfecho, ademas realizó una revisión de los problemas más frecuentes en el cultivo de tejidos, tendientes a la diferenciación celular y a las propiedades supracelulares. Ham (1965) y Conn (1966) reportan la fabricación de medios sintéticos para el cultivo de células de mamíferos. Sato (1975) propuso agregar suero a los medios de cultivo, con la idea de que éste es una importante fuente fisiológica por el contenido de hormonas, contribuyendo potencialmente a la tecnología de cultivos. La tiroides, es una glándula de secreción interna, considerada la mas grande del organismo (Wolf et al., 1989). Tiene gran influencia sobre el crecimiento y desarrollo de los organismos vertebrados. Sintetiza tiroxina o tetraiodotironina (Td), y triiodotironina (TJ), es controlada por un mecanismo de retroalimentación negativo por la hormona estimulante de la tiroides (TSH) y ésta a su vez por la hormona liberadora de TSH (TRH) y éstas por el nivel de hormonas tiroideas (Grossmann et al., 1997). Los primeros estudios acerca del crecimiento y alteración de la tiroides fueron realizados por De Vijdler et al., (1979) en modelos animales utilizando la vaca africana y la cabra danesa. Wollman desarrolló un método para el cultivo de células tumorales de tiroides en rata Fisher en 1963 (Grollman et al., 1977), posteriormente Knopp et al., (1970) y Burke et al., (1973) aislaron células tiroideas bovinas y mostraron que la TSH activa la vía de la adenilatociclasa produciendo incremento del cAMP. Rapoport (1976) cuya aportación al aislamiento de células en cultivo, fue el utilizar un sistema mecánico y la enzima tripsina para realizar la digestión de tejidos, por períodos de 2 a 3 horas. Grollman et al., (1977) encontraron evidencias de la interacción de la TSH con un receptor específico de la membrana. Ambesi-Impiombato et al., (1980) desarrollaron una línea de células tiroideas normales de rata a la que denominaron FRTLS, basada en la clonación de células, adición de seis hormonas o factores de crecimiento (6H), y una concentración inicialmente baja (0.1 a 0.5%) de suero fetal de ternera. A través del modelo biológico FRTLS se realizaron estudios con el fin de establecer la relación entre el crecimiento celular y el cAMP (Valente et al., 1983a), los promotores de crecimiento (Valente et al., 1983b); estudios sobre las alteraciones de las células irradiadas utilizando Láser (Andreoni et al., 1983),. Otras líneas de investigación se hicieron sobre los mecanismos de transporte y síntesis de proteínas (Weiss et al., 1984), mecanismos de control hormonal en células diferenciadas (Tramontano et al., 1986), propiedades y regulación del receptor a TSH (Tramontano e Ingbar, 1986), así como sobre la regulación de la membrana celular por la TSH (Beguinot et al., 1987). Por sus caracteristicas las células FRTLS fueron consideradas ideales para realizar trabajos investigación, por lo que son comúnmente utilizadas (Dumont et al., 1992). Para estudiar el comportamiento de los diferentes modelos biológicos, así como los mecanismos responsables de las alteraciones de la tiroides. Se han realizado varias investigaciones, asi se ha estudiado el funcionamiento de la TSH en la transformación de folículos a monocapas en células tiroideas porcinas (Yap el al., 1986), la exposición de las células tiroideas a anticuerpos contra los receptores de la TSH, que se presentan en las enfermedades de Graves y Hashimoto (Madec et al., 1988). Se cultivaron células tiroideas humanas a las cuales se transfectó con el virus de simio DNA 40, y se les denominaron células epiteliales tiroideas humanas inmortalizadas, que son factibles para la manipulación genética, manteniendo sus características tiroideas diferenciadas, y en comparación con otras células, éstas no requieren suero para su proliferación (Lemoine et al., 1989). Por otro lado, se ha descrito el transporte de iones y la regulación del volumen folicular tiroideo en células tiroideas porcinas (Yap et al., 1991). Para denotar la importancia del citoesqueleto y de las uniones celulares, estructuras y componentes, que son de primordiales durante el crecimiento y diferenciación celular, se abordó el estudio de la histoarquitectura folicular y la regulación de los diferentes substratos de adhesión célula - célula y el balance entre las diferentes fuerzas de unión que actúan en las 2 células tiroideas (Yap et al., 1992). La activacion del transporte de yodo y la regulación del volumen folicular ha sido estudiada en respuesta a medios hipotónicos mediada por la absorción de sodio a través del epitelio (Yap et contactos al., 1993a). La TSH en el sinergismo en célula - célula y para la adhesión al sustrato, manteniendo los agregados multicelulares, inhibiendo la expansión celular, pero no la adhesión celular (Yap y Manley, 1993b). Yap y Mamey (1994), encontraron que la TSH inhibe la locomoción intrínseca de las células tiroideas organizadas como folículos en cultivo primario, y tiene importancia determinante en la histoarquitectura folicular. Estos mismos investigadores continuaron con los tipos de adhesión focal, los microfilamentos de actina y la actividad de la tirosina cinasa, y sugirieron una relación entre la presencia de la TSH y la formación de los folículos (Yap et al., 1994a), además analizaron una serie de parámetros mecánicos para los distintos estados de formación y crecimiento de las células tiroideas (Yap et al., 1994b); también caracterizaron algunas de las moléculas de adhesión, como la caderina en las uniones célula - célula, y 20-l (Proteína asociada a las uniones estrechas), y señalaron que la polarización del epitelio tiroideo es crucial en la formación del lumen folicular, con el agregado celular tridimensional (Yap et al., 1995a). Encontraron una relación entre los filamentos de actina y la sensibilidad de las uniones a la citocalasina D, sefialando que las células tiroideas en cultivo y la asociación entre los filamentos de actina y las uniones celulares difiere, dependiendo de la forma en que se haya cultivado (Yap et al., 1995~). La tiroglobulina es una proteína, producida exclusivamente por las células tiroideas. Su presencia en un cultivo sugiere que las células cultivadas son del tipo tiroideo. La tiroglobulina es una matriz proteica sobre la cual se sintetizan las hormonas tiroideas (Glinoer, 1997). La producción de tiroglobulina ocupa el 50% de la síntesis proteica de la tiroides. Esta síntesis forma un grupo de polisornas unidos a la membrana y son dirigidos por un RNA mensajero @RNA) para el ensamble de las subunidades. Durante su traslado, del retículo endoplásmico al aparato de Golgi, la tiroglobulina sufre glicosilación, donde un complejo de azúcar es transferido del fosfato dolicol unido a la membrana y al nitrógeno amina de los residuos de aspargina. Al salir del sistema Golgi, es incluida en vesículas que se unen a la membrana apical de la célula, para su posterior liberación al lumen folicular por exocitosis. La síntesis y secreción de tiroglobulina son reguladas por la TSH (Glinoer, 1997). Las hormonas tiroideas circulan unidas a las proteínas plasmáticas, cuya fracción libre es la parte mas útil de las hormonas tiroideas, ya que mientras permanezcan unidas a su proteína transportadora no son funcionales. El 70% de la TJ va unida a la globulina transportadora de la tiroxina (TBG), el 20% a la prealbúmina fijadora de tiroxina (TBPA) y el 10% a la albúmina, mientras que la mayor parte de la T3 se encuentra unida a la TBG. La fracción libre de las hormonas tiroideas se sitúa en torno al 0.003% de la T4 y al 0.3% de la T3. La proporción de unión durante el embarazo es mayor, y obedece al estimulo estrogénico. La vida media de la TBG es aproximadamente de 5 días, y su concentración varía de 10 a 22 mg/l (Glinoer, 1997). En el estudio de la disociación del explante tiroideo, se utilizaron las enzimas tripsina y colagenasa. La tripsina, es una enzima proteasa pancreática con especificidad al sustrato se basa en cargas positivas de las cadenas de lisina y arginina. La tripsina ha sido aislada de diferentes fuentes como: el pez perro, alces, ballenas, elefantes marinos, Streptomyces griseus, perros, cerdos, ratas y humanos, entre otros. La tripsina tiene un peso molecular de 23,800 daltons, produce autólisis limitada de otras formas activas que tienen dos o mas cadenas - peptídicas unidas por puentes disulfuro, sus formas predominantes son dos cadenas peptídicas de 01 - tripsina y una de p - tripsina. La tripsina hidroliza específicamente a los péptidos unidos a los terminales carboxilos de los residuos de lisina y arginina (httu://www.promega.comítbs/tb5 12/tb5 12.html). Existen condiciones que se deben de cumplir para que la tripsina sea mas eficiente: La temperatura debe ser de 37’C, el pH debe ser > 4, estar libre de suero fetal de ternera, compuestos organofosforados, soya, lima, huevo, plata iónica y calcio. La disociación de las células, se inicia con el lavado de las monocapas de los cultivos, con una solución con bajas concentraciones de calcio y magnesio, para remover el suero fetal de ternera, para abatir los inhibidores de la tripsina. (http://www.worthington-biochem.com/manuaVT/TRY.html). Otra enzima utilizada para la disociación celular es la colagenasa, cuya función es degradar las fibrillas nativas helicoidales de colágena. Esta es el mayor componente fibroso A del tejido conectivo extracelular como la piel, tendones musculares, vasos sanguíneos, hueso, entre otros. La colágena consiste de fibrillas compuestas por agregados de moléculas de tropocolágena. Cada tropocolágena consiste en 3 helices de cadenas alfa alrededor del eje. La secuencia de aminoácidos es característica del tejido de origen. Las enzimas atacan simultáneamente las 3 cadenas y son importantes en el metabolismo del tejido conectivo y son producidas por las células encargadas de los procesos de remodelación. Bajo condiciones normales, las enzimas se encuentran unidas a la ct-2-macroglobulina y antiproteasas del suero. La primera colagenasa fue estudiada de tejido de cola de rana en 1966. Se reporta la colagenasa de plaquetas en 1974, y la colagenasa en la parte pancreático hepática procedente del cangrejo violinista. También existe colagenasa en las bacterias, utilizada durante la invasión del huésped. Esas enzimas difieren de las colagenasas de mamífero. La colagenasa del Clostridium histolyticum ha sido la mas estudiada, igualmente la procedente del Achromobacter iophagus, Pseudomonas aeruginosa y la de bacterias marinas (http://www.worthington-biochem.com/manualKXLS.html). La disponibilidad de las colagenasas ha permitido el desarrollo de cultivos primarios de riîrón humano en 1973 y a partir de entonces se dio para el cultivo de múltiples tejidos como los pancreáticos, hígado, células suprarenales y de tejido graso. Se han descrito cuatro tipos de colagenasa: el tipo 1 (contiene colagenasa, caseinasa y clostripaína) recomendada para tejido graso, glándula suprarenal y células hepáticas. El tipo II (contiene gran actividad de clostripaina) utilizada para corazón, hueso, músculo, tiroides, cartílago y células hepáticas. El tipo III [contiene baja actividad proteolítica) utilizada en células mamarias y fetales. El tipo IV (contiene baja actividad triptica) es comúnmente utilizada en islotes y donde la integridad de los receptores es crucial (http://www.worthington-biochem.com/manualK/CLS.html). Una vez abordado el origen, morfología y funcionamiento del modelo biológico, se puede observar la gran diversidad de modelos utilizados y las vías involucradas. Debido a que las hormonas tiroideas ejercen su acción directamente sobre la función general del organismo, con el desarrollo de los cultivos primarios de células tiroideas funcionales, utilizadas como modelo biológico, se puede apoyar a los diferentes trabajos de investigación tendientes al estudio y comprensión de los factores celulares y moleculares que originan las alteraciones de la tiroides. Basados en la revisión de la literatura se plantea la siguiente pregunta ¿Cómo lograr el aislamiento y reproducción de las c6lulas tiroideas in vitro? Con el fin de tener un modelo in vitro, que permita conservar las características morfológicas y funcionales de las células tiroideas in vivo. Se considera que con la combinación de enzimas proteolíticas en la disociación celular y la concentración de suero fetal de ternera, permiten la obtención de tirocitos normales en cultivos primarios, sin alterar las características funcionales y morfológicas. El objetivo general de este estudio fue estandarizar una técnica para el cultivo in vitro de tirocitos morfológica y fisiológicamente diferenciados en cultivos primarios de glándula tiroides de rata Sprague - Dawley. Objetivos específicos: 1 .- Aislar las células de explantes de glándula tiroides de rata. 2.- Caracterizar morfológicamente las células tiroideas de los cultivos primarios. 3.- Caracterizar funcionalmente determinando la tiroglobulina. 4.- Determinar sí las células tiroideas obtenidas expresan los receptores de la TSH, y a los componentes del citoesqueleto actina y tubulina. 6 II. REVISIÓN DE LITERATURA Dado que el propósito del presente trabajo fue generar información para estandarizar una tecnica para el cultivo in vifro de tirocitos morfológica y fisiológicamente diferenciados, obtenidos de cultivos primarios de explantes de glándula tiroides de rata. Es fundamental pasar en revisión todas las características del modelo biológico, por tal motivo se revisan las características anatómicas, embriológicas, funcionales y de cultivo; así como las diversas interrelaciones que se suceden. 2.1 Glándula tiroides La glándula tiroides, produce las hormonas T3 y T4 las cuales tienen influencia preponderante en el crecimiento, diferenciación y desarrollo de todas las células del organismo de los vertebrados. La importancia biológica de la glándula tiroides fue reconocida hace siglos. En el siglo XIX se definió el cretinismo y el mixedema como el resultado de una disminución de la función tiroidea (Lazar, 1993), desde entonces la Sociedad Clínica de Londres seÍíaló la importancia de la glándula tiroides en el desarrollo del cerebro (Oppenheimer, 1997). Harrington (1926) sintetizó la T4. La T3 se obtuvo por desiodinación periférica de T4 en 1960, siendo ademas la iodotironina mas activa, biológicamente (Roti ef al., 1993). Enseguida fueron descritos los receptores nucleares a T3 (TRs) (Lazar, 1993). La glándula tiroides consiste en dos lóbulos situados a los lados de la traquea e interconectados por el istmo a nivel del 2” o 3er anillo traquéales, inmediatamente por debajo de la piel y los delgados músculos cutáneos del cuello, usualmente el lóbulo derecho es más grande que el izquierdo. La dimensión vertical es de 3 a 5 cm. Una tercera parte de los individuos portan una proyección de tejido que nace en el istmo y se le denomina lóbulo piramidal. La circulación es importante, con un gasto de 1 ml/min por gramo de tejido comparado con otros que (<http://www.fhere.org/science/phs/htds/4nf-thdx.html/, tiroideo, órganos es muY 1997; Dumont et al., 1992) alta Es muy importante conocer la microestructura del tejido tiroideo, para seleccionar las enzimas para la disociación y calcular el rendimiento celular. El tejido tiroideo esta compuesto por tirocitos en un 70%, células endoteliales en un 20% y fibroblastos en un lo%, todo es soportado por tejido mesenquimatoso (Dumont et al., 1992). Los folículos de la tiroides normal son alrededor de 3 millones y varían de 50 a 500 pm de diámetro. Una capa simple de esas células rodea un lumen que contiene un fluido llamado coloide. Están rodeados por un extenso plexo capilar. El espacio interfolicular contiene fibras reticulares, una red linfática que provee canales para la comunicación intraglandular, y fibras nerviosas simpáticas. También contiene a las células parafoliculares o células C, que producen la calcitonina, cuya acción es la de regular el metabolismo del calcio (Dumont et al., 1992). 2.1.1. Anatomía comparada y desarrollo Es fundamental analizar, que otras especies pueden producir prohormonas tiroideas, como las yodotirosinas y yodotironinas. En la evolución de la función tiroidea, la atención fue enfocada a los protocordados, como el anfíoxo y sobre el más primitivo de los vertebrados, la lamprea y el pez brujo (ciclostomas). En los procordados, el yodo puede ser concentrado e incorporado‘ en yodoproteinas por el endostilo, un órgano situado en la línea media de la glándula suprafaríngea cuya función es la formación de moco. La larva de la lamprea o ammocoetes, tiene una estructura como la tiroides, la glándula suprafaríngea, cuyos conductos son vaciados en la faringe, ésta glándula sintetiza yodoproteínas y son liberadas como yodotironinas al tracto digestivo, éstas acciones permiten especular que la función inicial de las yodotironinas fue digestiva (Su et al., 1997). En los homeotermos como los mamíferos y las aves, las hormonas tiroideas tienen una íunción común, la de regular el metabolismo, son esenciales en el crecimiento y desarrollo normal y éste aspecto es similar al desempefiado hormonas tiroideas envían las sefíales en la metamorfosis de los anfibios, donde las para inducir los cambios morfológicos y funcionales. Las hormonas tiroideas tienen una función similar en algunas especies de peces y reptiles (Sing-Yung y Visser, 1994; Su et al., 1997). 2.1.1.1 Embriología Es primordial el conocer la evolución de la tiroides durante el desarrollo humano, desde la concepción hasta el nacimiento y en la edad adulta, puesto que los tejidos embrionarios pueden ser una fuente viable de tejidos. La tiroides es visible durante la tercera semana de desarrollo, como una evaginación en la faringe ventral, migra hacia abajo y al 8 frente de la faringe, y en este descenso se observa como una estructura bilobulada conectada por el conducto tirogloso. Este conducto posteriormente se reabsorbe, pero si persiste, se observa en la base de la lengua en el denominado foramen Secar. Durante la séptima semana se fusiona tejido de la porción ultimobraquial del cuarto arco braquial de donde se originan las células parafoliculares. Las células epiteliales tiroideas proliferan y se diferencían en folículos. La capacidad para sintetizar tiroglobulina y formar el coloide, es manifiesta alrededor de la décima semana; ademas se inicia la capacidad para acumular y organificar yodo. En el segundo trimestre se pueden detectar cantidades de T4 y de TSH, lo que sugiere que la actividad de la tiroides esta bajo el control de la hipófisis (Dumont et al., 1992). Durante la diferenciación fetal, el tejido crece al paralelo del peso corporal y permanece así hasta la vida adulta. La tiroides fetal pesa 0.2 g, mientras que en el adulto su peso varía de 16.7 a 28.0 g (Pankow et al., 1985), este crecimiento requiere de 6 a 7 divisiones celulares. Las células tiroideas humanas se dividen alrededor de 5 veces en la etapa adulta, con lo que se demuestra que tienen una constante de crecimiento lenta (Su et al., 1997). En el adulto, la tiroides mantiene su tarntio con un lento crecimiento, pero retiene su capacidad a crecer por hipertrofia celular y proliferación en respuesta a un estímulo (Dumont et al., 1992). Por medio de cordocentesis, desde las 12 semanas, se ha observado un incremento de T4, T3, TSH y Tiroglobulina (tg), que reflejan la madurez del hipotálamo, hipófisis, tiroides e hígado (Porterfield y Hendrich, 1993). El tejido tiroideo hipertrofiado extraído quirúrgicamente se puede convertir en fuente potencial de células tiroideas. El bocio se manifiesta, como un crecimiento de la glandula tiroides y puede ser debido a agentes bocibgenos, seguido de un incremento progresivo del peso tiroideo, con mesetas después de 3 meses (hasta 12 veces el volumen original). El primer signo en los tejidos involucrados es la disminución del espacio luminal de los folículos, del estroma avascular y un aumento en las células epiteliales y espacios de los vasos sanguíneos (Dumont et al., 1992). La proliferación de células endoteliales va precedida de los tirocitos, y la vascularización varía mas que la masa celular folicular con el nivel de estimulación de la tiroides. El incremento global en el espacio de las células epiteliales es seguido de hipertrofia (Studer y Derwahl, 1995) y multiplicación celular, todos los tipos de células, proliferan durante este estadio (Dumont et al., 1992). La tiroides es un epitelio de transporte que separa el espacio coloidal del lumen folicular, del líquido extracelular y la sangre. Las cClu1a.s epiteliales tiroideas median las formas de transporte vectorial que son necesarios para la función tiroidea normal, en especial el movimiento transepitelial de yodo, de hormonas tiroideas y de sus precursores. Posee un sistema bidireccional de transporte de iones, que contribuye al control del tama.iIo de los folículos tiroideos, determinando el flujo neto de líquidos al lumen folicular (Yap y Stevenson, 1995). 2.1.1.2 Fisiologia de las células tiroideas Es fundamental el conocer como operan las diferentes vías en la fisiología normal, para poder detectar las alteraciones, dichos factores son básicos para el crecimiento y diferenciación de los tirocitos. La unidad funcional de la glándula tiroides es el folículo, que es una estructura semiesférica compuesta de una capa de células rodeando un espacio llamado lumen folicular, que secreta una proteína, llamada tiroglobulina. La síntesis de tiroglobulina se da en el retículo endoplásmico rugoso, continúa en el aparato de Golgi, y concluye hasta pasar al lumen folicular, con la yodinación de tirosina y el acoplamiento de yodotirosinas para formar las yodotironinas. El yodo es captado en la célula por difusión y transporte activo (bomba de Yodo). La per-oxidasa tiroidea, se encuentra localizada en la membrana apical, oxida el yodo y une la tirosina a la tiroglobulina (Sing-Yung y Visser, 1994). La peroxidasa es una enzima crucial en la síntesis de hormonas tiroideas, y se incrementa en la enfermedad de Graves, carcinoma y tumores tiroideos benignos (Massini-Repiso et al., 1994). El mayor regulador para la secreción de las hormonas tiroideas es la TSH (Guksouma et al., 1998). 2.1.2 Hormonas tiroideas T4 y T3 En los organismos superiores (vertebrados), bajo condiciones normales, la tiroides metaboliza el yodo y conduce la síntesis de las hormonas tiroideas. El mecanismo tiene lugar en tres estadios secuenciales: a) transporte activo de yoduro hacia la tiroides, b) oxidación de yoduro y yodación en forma oxidada de residuos tirosílicos dentro de la tiroglobulina, c) acoplamiento de yodotirosinas para formar la 3,5,3’,5’ Tetrayodotironina o tiroxina (Th) y 3,5,3’ Triyodotironina (T3). Las hormonas así formadas se unen por enlaces peptídicos a la tiroglobulina que es el componente más importante del coloide folicular (Sing-Yung y Visser, 1994). Harrington en 1926 sintetizó la Ta, qué I en 1960, era considerada la fuente más importante de TX por desyodinación periférica de la Tq, siendo la yodotironina mas activa biológicamente. Aproximadamente el 80% de T3 es producida por conversión y el 20% restante por producción directa de la tiroides en los sujetos normales (Chanoine et al., 1993; Roti et al., 1993). El 80% de la producción de T3 a partir de la T4 ocurre en órganos perifericos de los cuales los más importantes son el hígado, riííón, hipófisis y cerebro. En estos órganos el proceso se lleva a cabo cuando la T4 se desyodina por medio de las enzimas llamadas desyodinasas. El tipo 1, 1 ,S- desyodinasa (una seleno proteína), el tipo II, 5’- desyodinasa y el tipo III 5- desyodinasa, encargadas de regir todos los pasos catabólicos en la conversión de Ta hasta la T2 (Contempré et al., 1991). Las hormonas tiroideas están implicadas en grado superlativo, en el crecimiento y desarrollo de la mayoría de los tejidos corporales (Galton, et al., 1983), 1993), principalmente del cerebral durante la edad fetal y neonatal (Porterfield y Hendrich, ejercen su efecto catabólico y anabólico en el metabolismo de lípidos, carbohidratos y proteínas mediante la interacción con proteínas receptoras específicas localizadas en el núcleo de todas las células del organismo (Muller y Seitz, 1984a). La entrada de las tironinas al compartimento celular se da por un proceso activo conocido como potocitosis, que utiliza vesículas de la membrana celular llamadas caveolas. Las caveolas se difunden por gradiente al citoplasma celular (Jones et al., 1994). En la célula ambas hormonas se unen a las proteínas del citosol y al núcleo por medio de receptores que tienen mayor afinidad para la T3, que para la T4, explicándose en parte el porqué la T3 es la hormona más activa biológicamente. La interacción de la Ts con los receptores se inicia con activación de genes y da como resultado cambios en la síntesis de proteínas (Ishii et al., 1982; Sing-Yung y Visser, 1994). Existen ademas receptores en la mitocondria, con los que se median cambios en la cadena respiratoria y sobre la membrana plasmática para regular el transporte de nutrimentos al interior de las células, proceso que no requiere de síntesis proteica. La mayor vía metabólica de las hormonas tiroideas es por desiodinación de T4 formando T3 y rT3 (T3 reversa), y T2 a partir de T3. En virtud de la gran potencia de la T3, la formación a partir de T4 es considerada como un proceso de activación (Ishii et aZ,. 1982; Sing-Yung y Visser, 1994). 11 La desyodinasa tipo 1 se encuentra en el hígado y el riAón (Lee et al., 1993), la T3 formada por ésta enzima es rápidamente liberada a lakrculación y es la mayor fuente de T3 en el organismo. La desyodinasa tipo II se ubica en el cerebro y la hipófisis (Tang et al., 1994), cuya actividad se incrementa en hipotiroidismo y este mecanismo opera para conservar los niveles de T3 en el sistema nervioso central, La desyodinasa tipo III, es la responsable de la formación de la rT3 y de la T2, su acción es a nivel de sistema nervioso central, placenta y durante el desarrollo fetal (Ishii et al., 1982; Sing-Yu y Visser, 1994). En adición a la monodesyodinación, el hígado puede sintetizar conjugados de yodotironinas con glucuronato y sulfamatos, los conjugados son excretados por la bilis. La desaminación oxidativa y la descarboxilación de las yodotironinas puede ocurrir en el hígado y el rifión cuyo metabolito resultante es el ácido tetrayodotiroacético formador de la Tq (SingYu y Visser, 1994). Las hormonas tiroideas regulan el metabolismo en los tejidos y la síntesis de muchas enzimas involucradas en el metabolismo intermedio, generalmente favoreciendo la movilización y ruptura de los nutrientes como son los ácidos grasos y los azucares. Estimulan la frecuencia y fuerza de contracción del corazón, actúan sinérgicamente con las catecolaminas, y la acción más importante es durante el crecimiento y la sobrevivencia de las especies. Estimula la síntesis y secreción de hormona del crecimiento (GH) (Porterfield y Hendrich, 1993; Oppenheimer y Schwartz, 1997) y ésta a su vez, el crecimiento celular. La GH media este efecto regulando la síntesis y secreción de Insulina como factor de crecimiento 1 (IGF-1). Este es un factor de crecimiento p’leiotrópico sintetizado por muchos tejidos para regular la división celular y la firncibn diferenciada (Wolf et al., 1989). Los eventos de fosforilación en la célula son indispensables para la activación transcripcional, vía isoformas del receptor de hormonas tiroideas, ciertas isoformas del receptor pueden ser fosforiladas in vivo e in vitro (Jones et al., 1994). 2.1.2.1 Metabolismo extratiroideo del yoduro El yodo es la materia prima para la síntesis de hormonas tiroideas, y sirve como monitor para evaluar el metabolismo de la glándula tiroides. La tiroglobulina almacenada en la tiroides contiene yodo suficiente para cubrir las necesidades hormonales temporalmente, 12 durante algunas semanas. Alrededor de las tres cuartas partes + yodo se encuentran en forma de yodotirosinas. Del yodo remanente, un 90% esta en forma de T4, 8 al 9% de Tj, y el resto como trazas de otras yodotironinas. La secreción de hormonas requiere que la tiroglobulina sea ingerida por la célula; las vacuolas fagocíticas resultantes se fusionan con los lisosomas para formar fagolisosomas, en los que la tiroglobulina es digerida por enzimas proteolíticas liberando aminoácidos yodados. La monoyodotironina (MIT) y diyodotironina (DIT) pueden desyodinarse completamente por acción de la tirosina deshalogenasa, y el yodo libre resultante es reciclado. Existe evidencia que la T3 segregada por la tiroides es formada por desyodinación periferica de Ta. El rango de T4 a T3 es de alrededor de 10: 1 en sujetos normales (Arvan y Castle, 1998). La tiroides contiene grandes cantidades de yodo orgánico, la actividad de la bomba de yodo esta relacionada con la cantidad de yodo inorgánico almacenada y puede mantener dichas cantidades sin que se provoquen variaciones de la TSH. La proporción del yodo disponible para la síntesis hormonal varia con la captación de yodo, que usualmente es del 10% y bajo condiciones de deficiencia extrema de yodo la proporción captada puede alcanzar hasta el 100%. El sistema de transporte, se lleva a cabo en la zona basal de los folículos, es dependiente del metabolismo oxidativo (puede inhibirse por anoxia, cianuro y otros inhibidores de la fosforilación oxidativa) y requiere del funcionamiento normal de Na+ - K’dependiente de adenosin trifosfato (ATPasa). El yodo difunde al interior por gradiente electroquímico. El yodo derivado de la dieta, catabolismo periférico de hormonas tiroideas y yodotironinas por desyodinación constituyen el concentrado inorgánico extratiroideo, que entra en equilibrio dinámico principalmente en dos órganos, la glándula tiroides y el riñón. La captación diaria de yodo en sujetos normales es de 150 pg, la disminución del yodo puede conducir a la insuficiente producción hormonal (Glinoer, 1997). El yodo utilizado en la síntesis de las hormonas tiroideas es extraído del yoduro inorgánico que esta en el líquido extracelular (LEC). Este yoduro es parcialmente recuperado cuando se libera por la desyodinación de las hormonas tiroideas en los tejidos periféricos. Sin embargo, la dieta es la fuente más importante de yoduro, tanto en su forma inorgánica como orgánica. El yodo inorgánico se absorbe rápidamente en el tracto gastrointestinal, perdiéndose muy poco por las heces. Hasta que se unen los compuestos orgánicos (fundamentalmente 13 h tirosina), el yoduro que entra en la tiroides por transporte activo forma parte del yoduro extracelular, y como tal está en equilibrio con el del compartimento principal de yoduro. La concentración de yoduro en el LEC normalmente es baja: de 1 a 1.5 pg/lOO ml, el contenido en el torrente circulatorio es aproximadamente de 250 pg, el cual se recambia varias veces durante el día (Sin@;-Yung y Visser, 1994). Se pierden pequeiias cantidades de yodo por el aire espirado y a través de la piel. Es importante considerar el mecanismo de depuración renal de yoduro, ya que puede modificar la disponibilidad de yoduro. A pesar de que es completamente fíltrable en el glomérulo, la tasa de depuración de yoduro en un adulto normal es de 30-40 ml/min, y es reabsorbido fundamentalmente de forma pasiva. Normalmente se eliminan en la orina unos 500 ug de yodo, casi todo en forma inorgánica. Esta cantidad es inferior a la que se ingiere con los alimentos, reflejando pérdidas muy bajas del elemento por las otras vías como el tracto gastrointestinal donde se pierden unos 12 ug, principalmente en forma orgánica (Sing - Yung y Visser, 1994). En el déficit familiar de deshalogenasa, se pierden por la orina tirosinas yodadas y la eliminación fecal de yodo orgánico puede ser muy intensa en ei síndrome de malabsorción intestinal, también por la acción de ciertos alimentos, como la soya (Rumsey el al., 1997). Se pueden ademas producir perdidas notables de yodo durante el período de lactancia, de aquí nació la propuesta de la Organización Mundial de la Salud para aplicar la suplementación de yodo a mujeres gestantes, y durante el período de lactancia de 200 @día (Glinoer, 1997). 2.1.3 Tiroglobulina La tiroglobulina es una matriz protéica sobre la cual las hormonas tiroideas son sintetizadas en la glándula tiroides (Glinoer, 1997). Es una glicoproteína que pesa 660 kD, se le conocen dos subunidades de 330 kD. La producción de tiroglobulina ocupa el 50% de la síntesis protéica de la tiroides. Esta síntesis forma un grupo de polisomas unidos a la membrana y son regidos por un RNA mensajero (mRNA) para el ensamble de las subunidades, durante su traslado del retículo endoplásmico al aparato de Golgi, la tiroglobulina sufre glicosilación, donde un complejo de azúcar es transferido del fosfato dolicol unido a la membrana. El azúcar sufre un proceso multiestado que involucra el 1A P movimiento de glucosa, residuos de manosa y la adición de ácido siálico. Al salir la tiroglobulina del sistema Golgi, es incluida en vesículas que se unen a la membrana apical de la célula, para su posterior liberación al lumen folicular por exocitosis (Glinoer, 1997). Las hormonas tiroideas son transportadas por la TBG por medio de uniones covalentes, se adhieren a las proteínas plasmáticas, aproximadamente, el 70°/ de la T4 se fija a la globulina fijadora de la tiroxina (TBG), el 20% a la prealbúmina fijadora de tiroxina (TBPA) y el 10% a la albumina, mientras que la mayor parte de la T3 se encuentra unida a la TBG. La vida media de la TBG es alrededor de unos 5 días, su concentración es de 10 a 22 mg/L (Glinoer, 1997). 2.2 Hormona estimulante de la tiroides (TM-I) La TSH es una de las señales extracelulares involucradas en el control de la proliferación y diferenciación de las células tiroideas, tanto in vivo como in vitre. Es considerada de manera general como el principal elemento controlador del crecimiento tiroideo in vivo (Dumont et al., 1992). La historia de la TSH viene desde 1920 con el descubrimiento de su actividad en la glándula hipófisis. En 1970 se determinó la secuencia de aminoácidos de las subunidades de la TSH. En 1980, se realizó la descripción detallada de la estructura de carbohidratos y la clonación de la unidad a y /3, facilitó el entendimiento de algunos mecanismos moleculares de la TSH (Grossman et al., 1997). La TSH es una glicoproteína de 20 a 30 kDa producida por las tirotropas de la hipófisis anterior. Esa síntesis y secreción son estimuladas por la TRH e inhibidas por las hormonas tiroideas en un mecanismo clásico de retroalimentación negativa (Dahl et al., 1994). La TSH controla el mecanismo de activación del receptor y facilita el acoplamiento de la sefial a la familia de las proteínas G. Este receptor estimula las diferentes cascadas de regulación como: la vía de la adenilato ciclasa y la hidrólisis de fosfatidil inositol bifosfato por fosfolipasa C. El cAMP es estimulado a bajas concentraciones de TSH (0.1 a 1 mU/ml), mientras que la fosfolipasa es de 1 a 10 mUVm1 (Allgeier et al., 1994). La TSH regula la proliferación y diferenciación funcional de las células tiroideas, como son la organificación de yodo, la síntesis de tiroglobulina, el metabolismo de las iodoproteínas y la secreción de hormonas tiroideas (Tramontano e Ingbar, 1986). La TSH es un miembro de 15 la familia de glicoproteínas en las que se incluye la hormona folículo estimulante (FSH), gonadotrofina coriónica (CG) y hormona luteinizante (LH) se encuentran prácticamente en todas las especies de mamíferos y en pequefios glicoproteicas vertebrados. Estructuralmente las hormonas son heterodímeros afines, compuestos de una subunidad 01 común conteniendo una apoproteína central de 92 aminoácidos incluyendo 10 medios residuos de cistina unidos por puentes disulfuro. Es codificado por un gen localizado en el cromosoma 6 en humanos con secuencia idéntica de aminoácidos. La subunidad p es distinta y puede estar alineada en 12 formas invariantes de residuos medios de cistina por 6 puentes disulfuro en humanos, y en secuencia de aminoácidos es idéntica a la de otras especies (Grossman et al., 1997). Los genes de la subunidad p de hormonas glicoprotéicas, difiere en longitud, organización estructural y localización cromosómica. La subunidad p es una proteína madura de 118 residuos de aminoácidos y es localizado en el cromosoma 1. Un importante componente estructural de esas hormonas es la cantidad de carbohidratos constituyentes entre el 15 al 35% por oligosacáridos unidos y la subunidad beta (1 en TSH y LH) o (2 en CG y FSH) (Grossman et al., 1997). 2.2.1 Receptor a TSH El proceso de reconocimiento y respuesta a estímulos es crítico para el crecimiento y función de las células. La estimulación del receptor a la TSH, es sin duda la mayor vía de transducción de sefiales desde la membrana celular, estimulando las vías de señalización intracelulares. Las vías moleculares involucradas son mediadas por el cAMP y PKC en respuesta al estímulo aplicado. Las vías de sefialización se dan a través de eventos de mecanorecepción en la superficie celular, por medio de los receptores transmembranaks (Wang et al., 1993). El receptor a TSH, tiene un peso molecular de entre 30 a 200 kD (Misrahi et al., 1990), y como todos los receptores a glicoproteínas constan de un dominio extracelular (394 aminoácidos), un dominio transmembranal consistente en siete segmentos (268 residuos) y un dominio carboxilo terminal de aproximadamente 50 residuos. La transducción de señales se hace a través de la unión a proteínas que unen GTP (proteínas Gs), que a su vez activan las vías de la adenilatociclasa y fosfolipasa C, induciendo la hidrólisis de los fosfoinosítidos 16 (PIP2) y la liberación de Ca* de los reservorios intracelulares, dando como resultado la activación del cAMP y PKC (Dallas et al., 1994). La distribución del receptor a la TSH en tejido tiroideo normal, se localiza en la superficie basolateral de la célula, y se sobreexpresa en la enfermedad de Graves. La TSH al unirse a su receptor estimula la producción de T3 y T4 (Seetharamaiah et al., 1994), mas aun, el receptor a la TSH sirve como blanco antigénico, de aquí se desprende que al unir autoanticuerpos antireceptor causen hipertiroidismo. Igualmente se han encontrado anticuerpos antireceptor a TSH en la enfermedad de Hashimoto, los cuales inhiben la unión de la TSH a su receptor (Madec et al., 1988). La enfermedad de Graves (GD) es un trastorno endocrino caracterizado por hipertiroidismo, bocio y exofkhnos. El hipertiroidismo de la GD es producido por autoanticuerpos que se unen al receptor a TSH y estimulan la sobreproducción de hormonas tiroideas (Patibandla et al., 1987). La clonación molecular y expresión funcional del receptor a TSH han mostrado rápidos avances para el entendimiento de la estructura y función. Los sitios de unión de anticuerpos contra receptor a TSH no parecen ser los mismos que para la TSH. Dos de los 6 sitios potenciales de glicosilación en el dominio extracelular son importantes en la expresión del receptor funcional. Los puentes disulfuro contribuyen a mantener la estructura tridimensional del receptor, en la región extracelular la homología de aminoácidos del TSHr entre humanos, perros y rata es alta (8590%) (Nagayama y Rapoport, 1992). 2.2.3 El Hz02 como regulador de la yodinación y formacibn de hormonas tiroideas El peróxido de hidrógeno (H202) es muy importante en la organificación, regulación de la yodinación y formación de hormonas tiroideas, tanto en cultivos celulares, como en cClu1a.s in vivo (Chen et al., 1993). Para sintetizar hormonas tiroideas, las reacciones de yodinación de proteínas requiere la presencia de tiroglobulina, peroxidasa tiroidea (TPO) y yodo. El Hz02 es un aceptador de electrones y un sustrato de TPO en la yodinación de proteínas y en las reacciones de acoplamiento. El sistema de generación de Hz02 ha sido estudiado extensivamente en células tiroideas porcinas, de perro y de rata. La TSH estimula la yodinación y la generación de H202, y media el transporte y organificación de yodo, 17 sugiriendo que hay una regulación de la reacción de yodinación en la generación de Hz02 intra y extratiroidea (Chen ef al., 1993). 2.3 Citoesqueleto Es muy importante en los cultivos celulares, puesto que son los constituyentes para generar el huso mitótico durante la división celular, ademas son la estructura rígida y móvil de las células. Ademas interviene a través de los microtúbulos, como vías para el transporte de una gran cantidad de productos de exocitosis y endocitosis, y forman las estructuras de crecimiento y unión de las células constituída por la llamada matriz extracelular. Las células ejercen sus funciones, sólo después de adquirir una morfología específica, y la función del citoesqueleto es importante para establecer y mantener ésta forma. Del citoesqueleto dependen una variedad de procesos celulares como la movilidad celular, migración, transporte intracelular de partículas, meiosis y mitosis, distribución espacial de los organelos celulares, respuesta celular a los eventos de la membrana, comunicación intracelular incluyendo la conducción de sefiales eléctricas, localización del mRNA, síntesis de proteínas, y en el caso de las hormonas, desde la síntesis, transporte, secreción, degradación y su influencia en las células blanco. Ademas median los efectos de las hormonas relacionadas con el crecimiento, transporte transepitelial, esteroidogénesis, funcionamiento tiroideo y paratiroideo, movilidad y maduración de los oocitos (De Loof eC al., 1996). El citoesqueleto funciona como sistema de sostén y locomoción de las células, participan en muchas de las funciones celulares, como el de adoptar una gran variedad de formas, transportar mc.éculas de manera ordenada, moverse, unirse a un sustrato y dividirse entre otras funciones (Hitt et al., 1994). Las diversas actividades del citoesqueleto dependen de tres tipos de proteínas filamentosas que son: filamentos de actina, microtúbulos y filamentos intermedios. Cada tipo de filamentos esta formado por diferentes subunidades de proteínas: a) actina, por filamentos de actina, b) microtúbulos; a, p, y y tubulina, c) filamentos intermedios; las relacionadas con la familia de las proteínas fibrosas tales como la vimentina, proteína glial fibrilar, laminas celular y citoqueratinas. La actina y tubulina se han conservado durante la evolución de los eucariotes; sus filamentos protéicos unen una gran variedad de proteínas accesorias, las cuales hacen posible que los mismos filamentos participen en distintas funciones, en diferentes regiones de la célula (Yap et al., 1995; Hollembeck et al., 1995). 18 Generalmente la diversidad del citoesqueleto es una parte esencial en la diferenciación durante la embriogénesis. Todas las celulas constitutivas son descendientes de un mismo cigoto y tienen el mismo genoma, pero los genes se expresan diferentemente, esto permite que las celulas constituyan y adquieran diferentes morfologías y una gran variedad de funciones (Schdit y Hall, 1998). 2.3.1 Actina El citoesqueleto de actina es un compuesto de polímeros altamente dinámico y con una gran variedad de proteínas asociadas. Las principales funciones del citoesqueleto de actina son las de mediar la movilidad celular y los cambios en la morfología durante el ciclo celular en respuesta a estímulos externos, para organizar al citoplasma y generar fuerza mecánica en la célula. El cambio de morfología y funciones de la actina es regulado por las vías de sefialización (Schidt y Hall, 1998). La movilidad celular basada en la actina tiene dos eventos moleculares, la polimetización regulada y los motores moleculares (Cooper y Mitchinson, 1995). La actina existe en forma monomérica o globular (Actina G) o en forma polimérica o filamentosa (Actina F). El arreglo de microfilamentos es muy dinámico, capaz de cambiar su organización y orientación en respuesta a estímulos del receptor. Muchas proteínas forman complejos con la actina, como con la tropomiosina y la dematina (Hitt y Luna, 1994; Luna y Hitt, 1992), participa ademas en la sefialización transmembrana, endocitosis y secreción (Luna y Hitt, 1992). 2.3.2. Microtúbulos (MT) Son polímeros de tubulina, que se encuentran en todas las células eucarióticas. Durante la división celular, los arreglos dinámicos de microtúbulos llamados huso mitótico, funcionan para la segregación y orientación de la fijación de los cromosomas. En células no divididas, los microtúbulos están en el citoplasma, posicionan el núcleo y los organelos, sirven como un elemento estructural de cilios y flagelos. Los microtúbulos son polímeros robustos, con una resistencia intrínseca para retraerse y comprimirse (Desai y Mitchinson, 1997). 19 En 1984 un mecanismo llamado inestabilidad dinámica fue propuesto para los MT basada en un analisis de la longitud de distribución de MT fijos. De acuerdo a éste modelo la población de microtúbulos exhibe una gran masa en estado fijo, un solo microtúbulo que nunca se estrecha, pero persiste en estados prolongados de polimerización y despolimerización que frecuentemente SC interconvierten (Desai y Mitchinson, 1997), y se define la ganancia y pérdida de subunidades en el mismo extremo (sea polo positivo o negativo) de un MT durante el crecimiento o acortamiento (Radionov y Borisy, 1997). 2.3.3 Filamentos intermedios En contraste a los microfilamentos y microtúbulos, cuyos componentes están evolutivamente conservados y son muy similares en todas las células, los filamentos intermedios (FI) despliegan una gran diversidad en número, secuencia y abundancia. En los humanos existen más de 50 diferentes genes de FI, quienes son expresados diferencialmente en casi todas las células del organismo. Los FI constituyen generalmente el 1% del total de proteína celular, y en algunas células como en los queratinocitos epidérmicos y neuronas, la constitución alcanza hasta el 85%. La superfamilia de los FI tienen una estructura común, que es un dímero compuesto de dos cadenas a helicoidales paralelas (Fuch y Weber, 1994; Fuchs y Cleveland, 1998). Los filamentos intermedios interactúan con microtúbulos y microfilamentos, para reforzar el citoesqueleto. Las subunidades de microtilamentos, quizás actúen como transmisores de seaales de la periferia celular hacia el núcleo (Schdit y Hall, 1998). 2.4 Cultivo celular Es una de las mejores alternativas para generar un modelo biológico, si bien existen modelos de tiroides, se ha observado que tienen funciones comunes, y algunos muestran limitaciones, por lo que no se puede hablar de un modelo perfecto. Para evitar el sacrificio sistemático y masivo, así como la interferencia de trabajar con el animal in vivo se inició el cultivo primario de células, en éste caso para el estudio fisiológico y patológico de la glándula tiroides (Tramontano et al., 1986). Los modelos animales han sido utilizados para estudiar la influencia de las hormonas tiroideas en el desarrollo de los tejidos de mamíferos, tal es el caso de las ratas, ovejas, bovinos, primates, porcinos y caninos (Porterfield y Hendrich, 1993). El cultivo de tejidos comprende todos aquellos aspectos tendientes a estudiar los diferentes mecanismos de reproducción celular así como las anomalías que presenta al dividirse y originar nuevas células. El estudio de la morfología celular la inició Wilson en 1928, al observar las estructuras como arreglos lineales y la polarización de la célula, durante el desarrollo de la división celular (Desai y Mitchinson, 1997). Los cultivos celulares se iniciaron a finales de 1940 con Eagle, quién propuso algunos métodos y técnicas para modificar el medio ambiente celular in vitro, y lograr de esta manera el desarrollo de células bajo condiciones controladas. Las células foliculares tiroideas derivadas de tiroides de rata retienen muchas de las funciones diferenciadas intrínsecas y despliegan una serie de respuestas metabólicas a la TSH incluyendo el aumento en la actividad de la adenilato ciclasa y la síntesis y secreción de tiroglobulina, captación de yodo. Este sistema experimental ha mostrado ser un modelo ideal para estudiar el mecanismo de acción de la TSH en estas células blanco “in vitro” (Tramontano et al., 1986). La TSH tiene efecto mitógeno sobre las células derivadas de la glándula tiroides de rata normal, y permite mantener las características morfológicas y metabólicas diferenciadas, desarrollo y reproducción in vitre, requieren la presencia continua de 6H como parte esencial para el crecimiento y la función diferenciada (Tramontano et al., 1986). El desarrollo de nuevos procedimientos y medios de cultivo, han hecho posible el desarrollo de algunos tipos de células diferenciadas en cultivo clonado. La dediferenciacibn emergió como una de las más notables generalizaciones de los estudios in vitre y ocasionó una gran discusión acerca de la estabilidad del estado diferenciado. Algunos experimentos muestran que las poblaciones celulares dediferenciadas, re expresa sus características diferenciadas, bajo condiciones de cultivo adecuadas (Conn, 1966). La mayoría de los cultivos que han sido adaptados para crecer in vitre y han sido clonados de cklulas mesenquimatosas o células derivadas de tumores. Recientemente se han incrementado el numero de cultivos amnióticos debido a que se ha generado una mejor defmición en los requerimientos celulares y en la disponibilidad de medios de cultivo. Muchas de las células cultivadas, especialmente los fibroblastos requieren cantidades relativamente elevadas de suero fetal de ternera (SFB) para su crecimiento (520%). La adición del suero es considerada necesaria para proveer a la célula 71 “factores del suero” que son necesarios para que la célula se una al sustrato y se reproduzca (Coon, 1966; Sato, 1975). 22 III. MATERIALES Y MÉTODOS 3.1 Panorama general Los métodos utilizados para el aislamiento de celulas tiroideas de rata SpragueDawley, fueron el obtener el explante de la glándula tiroides, el cual se fragmentó y se sometió a disociacibn enzimática, una vez aisladas las celulas, se les cuantificó la viabilidad, por la técnica de azul de tripano y posteriormente fueron sembradas en cajas de cultivo y en botellas con medio Ham F12 adicionado con 6 hormonas y suero fetal de ternera, bajo condiciones controladas a una temperatura de 37’C en un ambiente con 95% aire hrímedo y 5% de COZ. El medio de cultivo fue cambiado cada 4 días y fue recolectado para realizar la determinación de tiroglobulina por medio de RIA, utilizando al medio nuevo como estándar o nivel basal de Tg. Se realizó una secuencia fotográfica a partir de la siembra, para observar y caracterizar la morfología adoptada por las células en cultivo primario y compararlas contra células tiroideas de la línea celular FRTLS. Asimismo se sembraron celulas sobre cubreobjetos fueron sembradas y procesadas para inmunofluorescencia para inmunodetectar al receptor de la TSH, y a los componentes del citoesqueleto de actina y tubulina. Como control, se utilizaron células HeLa, luego fueron observadas en un microscopio invertido para fluorescencia y se imprimieron en película fotográfica (Ambesi-Impiombato et al., 1980). 3.2 Sujetos experimentales Las glándulas tiroides fueron obtenidas de ratas Sprague-Dawley de 24 semanas de edad, con un peso promedio de 250 g, mantenidas con luz y temperatura controladas (12 hrs luz/oscuridad a 23 +- 2OC de temperatura), alimento balanceado y agua ad livitum. Las ratas fueron obtenidas del bioterio del Centro Regional de Estudios Nucleares (CREN), la parte experimental fue realizada en el Laboratorio de Biología Celular del mismo Centro, en la Universidad Autónoma de Zacatecas, en Zacatecas, Zac. 23 3.3. Obtención de las cdlulas tiroideas 3.3.1 Explante tiroideo Este paso tuvo como propósito el obtener la glándula tiroides de la rata SpragueDawley, y a partir de éste tejido; aislar las células tiroideas, de acuerdo a la técnica propuesta por Ambesi-Impiombato et al, (1980). El proceso se realizó bajo condiciones de esterilidad en una campana de flujo laminar. Las ratas (Sprague-Dawley) fueron anestesiadas en una cámara conteniendo cloroformo (J. T. Baker), posteriormente se fijaron y se les realizó lavado de cuello con jabón líquido neutro (Carboquim), asepsia con jabón quirúrgico (Dermocleen) y antisepsia con benzal (Temer). Se utilizó un estuche de disecciones (Chrome, USA) para extraer cuidadosamente la glándula tiroides utilizando, se utilizó un escalpelo No. 21 (Feather Safety) para la incisión de la piel y otro para la disección de la glándula tiroides. Se siguió el mismo procedimiento para la obtención de explantes de hígado, rifión, y linfocitos periféricos. 3.3.2 Disociación celular En éste paso se utilizaron dos procedimientos, el propuesto por Rapoport (1976) y el de Ambesi-Impiombato el al., (1980). El primer método utilizado para la obtención del explante y disociación celular fue el propuesto por Rapoport (1976) consistente en la utilización de un homogenizador de tejidos y la utilización de tripsina -verseno (0.075%) y colagenasa III, en solución de Hank’s, para la disociación celular, con digestión de 2 y 3 hr, posteriormente se midió la viabilidad celular y se sembró las células en botellas y cajas de cultivo, en medio de Ham F12 y 6H y con 0.5% de suero fetal de ternera. El segundo procedimiento fue realizado mediante la metodología sugerida por AmbesiImpiombato et al., (1980). Se extrajo el explante tiroideo, y se depositó en solución amortiguadora de fosfatos (PBS) estéril para su lavado primario. Luego se seccionó en fracciones de aproximadamente de lmm3 utilizando una caja de Petri y una hoja de escalpelo estéril. Los segmentos de tiroides fueron lavados nuevamente en PBS estéril y se dejaron sedimentar, se extrajo el PBS. Los segmentos de tiroides se sometieron a digestión enzimática en un tubo cónico de polipropileno de 15 ml (Costar 33 18) en solución de Hank’s (Microlab, Lote 5 Il) adicionada con 20 U/ml de Colagenasa tipo 1 A (Sigma C-2674), tripsina - EDTA al 0.075% (Gibco, No. Cat. 15400 - 054) y suero de pollo al 2% (Gibco No. Cat. 1600 - 044), la digestibn fue por 30 minutos, a 37’C en bailo María con agitación (Lab Line), una vez concluido este paso, se dejó sedimentar por 5 minutos, se extrajo el sobrenadante y se centrifugó a 1700 rpm (378 g) en una centrífuga clínica (Sorvall TC6). 3.3.3 Cultivo celular Este paso se efectuó de acuerdo a la propuesta de Ambesi-Impiombato et al., (1980). El sobrenadante fue eliminado, quedando el paquete celular, el cual se suspendió en medio de cultivo de Ham F12 (Gibco, No. Cat. L 21700075) adicionado con insulina 10 pg/ml (Lilly), transferrina 5 l.tg/ml (Sigma T-4382), somatostatina 10 ng/ml (Sigma S-9129), hidrocortisona 10 nM (Sigma H-0396), glicil histidil lisina 10 ng/ml (Sigma G-1887) y TSH 10 mU/ml (Sigma T-8931) nominados en conjunto 6H, y 5% de suero fetal de ternera (Gibco No. Cat. 26170). 3 ml de la suspensión celular se sembró en 3 cajas de cultivo de 100 X 20 (Costar 3060) conteniendo 8 cubreobjetos (Corning), asi como en una botella de cultivo de 25 cm2 (Costar 3055). Las cajas y botellas de cultivo conteniendo las células, se colocaron en una incubadora (Scientific Form) con 95% de humedad y 5% de CO2 a una temperatura de 37°C. Los fragmentos de tejido remanentes, fueron sometidos a digestión bajo las mismas condiciones iniciales por otros 30 minutos y las células se obtuvieron bajo las condiciones seiialadas. El medio de cultivo se cambió cada cuatro días a partir de la siembra inicial. Para analizar la función del suero fetal de ternera sobre el desarrollo celular, se montó un experimento utilizando diferentes concentraciones desde 0.0, 0.1, 0.5, 3.0, 5.0, 7.5, 10.0 y 15.0%, y se observó el desarrollo celular a las 48 horas, utizando un microscopio (Axiovert 25) con el objetivo 40X (Karl Zeiss), consistente en contar el número y tamaño de las colonias en proceso de crecimiento (Ambesi-Impiombato et al., 1980). 3.4 Determinación de la viabilidad celular Una vez aisladas las células, se realizo el recuento celular y la determinación del porcentaje de viabilidad celular, mediante la técnica de tincibn de exclusión con azul de tripano (Boyum, 1968). Se utilizó azul de tripano al 4% como colorante supravital. Se transfirieron 0.5 ml de una solución al 4% (p/v) de azul de trípano en un vial de 1.5 ml (Costar Cambridge MA.). Se afíadíeron 0.3 ml al PBS pH de 7.2 y 0.2 ml de la suspensión celular (factor de dilución = 5), mezclando por 15 seg. Se dejó reposar de 5 a 10 mín. Con la solución formada, se llenaron por capilaridad las cámaras del hematocítómetro (cámara de Neubauer, Spencer Bright-líne Buffalo N.Y.), cubiertas por un cubreobjeto. Se contaron todas las células utilizando un microscopio óptico (Carl Zeiss objetivo 4X) en el cuadrado mílímétrico central y en los cuadrados de cada esquina, llevando cuenta separada de las células tefíidas y células totales. Cada cuadro del hematocímetro representa un volumen total de lo4 por rnn?. Para determinar la concentración de células/ml de la suspensión celular, se realizaron los cálculos considerando un factor de dilución del 50%, ya que la tincíón se realizó a partes iguales con la suspensión. El procedimiento fue el siguiente (Sigma. 1999): Conteo celular: Cada cuadro del hematocímetro con la cubierta en su lugar, representa un volumen de 0.1 mm3 ó 104/cm3. Ya que 1 cm3 equivale aproximadamente 1 ml, la subsecuente concentración celular por ml (y el numero total de células) fue determinado siguiendo los siguientes cálculos: Células por ml = a la cuenta promedio por cuadrante por el factor de dilución por 1 04. Células totales = células por ml X el volumen original del cual se tomó la muestra. Viabilidad celular = Total de células (no teñidas) entre las células totales (teñidas y tetidas) por 100. no 3.5 Lisis celular Después de haber sido obtenidas las células tiroideas, el precipitado de células se lavó con 1 ml de PBS, pH de 7.2 a 4OC, posteriormente se resuspendió dicho precipitado en 150 pl de la solución de lisis que contenía: 1% de Tritón X-l OO (Merck West Germany) 140 mM NaCl, 1 mM EDTA, 10 mM Tris-HCl pH 7.6 (Gibco BRL Grand Aisland NY ), mas 1 mM de PMSF. El lisado celular se homogenizó y centrifugó por 10 min a 16,000 g recuperandose exclusivamente el sobrenadante, que fue transferido a viales etiquetados para congelarse hasta su procesamiento. 3.6 Determinación de proteínas en extractos totales Para determinar la cantidad total de proteína de los explantes celulares, se utilizó la técnica de Bradford (1976), para su posterior caracterización por medio de electroforesis en geles de poliacrilamida. 3.7 ElectroforCsis (PAGE-SDS) Se realizó el corrimiento de las proteínas del lisado celular, en geles de poliacrilamida, de acuerdo a la técnica propuesta por Laemmli (1970). Se ensamblaron los cristales de vidrio de acuerdo a las instrucciones del fabricante. Se agregó la solución de poliacrilamida al 10% entre los cristales. El menisco de solución de poliacrilamida llegó aproximadamente a 8 cm del borde superior, se mantuvo el gel en posición vertical a temperatura ambiente. El gel se formó (entre 20-30 min), se inclinaron los cristales por su vértice, se lavó el gel de separación tres ocasiones con agua destilada, y se evitó la presencia de algún residuo. Se preparo la solución de poliacrilamida para el gel concentrador. Esta solución se agregó directamente sobre el gel separador polimerizado. Se colocó el peine, apropiado dentro de la solución cuidando de no producir burbujas. El gel se mantuvo en posición vertical a temperatura ambiente. El gel concentrador polimerizó en aproximadamente 10 min. Los pozos se lavaron 3 veces con agua destilada o solución de corrida para eliminar la poliacrilamida no polimerizada. Los pozos se cargaron con 30 ug de las muestras problema, previamente tratadas con buffer de muestra, y calentadas a 95OC por 5 min. La corrida electroforética se llevó a cabo a 1 OO V, a temperatura ambiente y por 80 min de acuerdo a la técnica de 0 ‘Farrel (1975). 3.8 Transferencia de proteinas a membrana de nitrocelulosa Para detectar a los receptores a TSH, y los componentes del citoesqueleto, tubulina y actina, las proteínas en los geles de poliacrilamida, se transfirieron a una membrana de nitrocelulosa (Amersham Hybond-C # FWN303C), utilizando la técnica de Towbin et al., (1979). 3.9 Bloqueo de la membrana de nitrocelulosa Para evitar la absorción inespecífíca del anticuerpo en la membrana de nitrocelulosa, ésta se lavó tres veces con PBS. Después se le agregó solución bloqueadora (3% de leche descremada Sbelty de Nestlé en PBS) y se dejó en la solución por 12 h (Sharon, 1979; Olmsted, 198 1). 3.10 Inmunodetección Las proteínas transferidas a la membrana de nitrocelulosa, se identificaron utilizando anticuerpos específicos contra los diferentes tipos de proteínas; anti TSHr, tubulina y actina y un segundo anticuerpo conjugado a peroxidasa (Towbin et al., 1979). Después de bloquear la membrana de nitrocelulosa con la solución de leche descremada al 3% en PBS durante 12 h, se lavó tres veces con PBS a 4°C. Posteriormente se incubo por 1 h en solución bloqueadora y por separado con los anticuerpos anti receptor a TSH, anti actina y ami tubulina respectivamente, enseguida la membrana de nitrocelulosa fue lavada en forma alternada 5 veces con PBS, y 5 veces con PBS-Twin-20. Después la membrana se incubó 1 h con un segundo anticuerpo conjugado a peroxidasa, con agitación suave. Pasado el tiempo de incubación se procedió a lavar de nuevo en la forma anteriormente descrita y por último se utilizó un reactivo quimioluminiscente (ECL, Amersham Little, Chalfont Buchinghamshire England), el cual, al reaccionar con la peroxidasa emite luz, misma que fue detectada en una película fotográfica (Dupont de Neumors, USA). 3.11 Determinación de tiroglobulina La presencia de tiroglobulina fue detectada por medio de RIA, que es una metodología con una alta sensibilidad y especificidad (99.5%) para la tiroglobulina (Berson y Yallow, 1956; Larsen et al., 198 1). 28 Para medir los niveles de tiroglobulina (secretada por los tirocitos en el medio de cultivo), fueron utilizados paquetes para radioinmunoanálisis en fase líquida de tiroglobulina (Diagnostic Products Corporation, DPC Los Angeles, USA). Las muestras fueron corridas por duplicado, introduciendo estándares altos, medio y bajo para tiroglobulina. Para la validación de los datos, se utilizó el programa RIAWHO, donado por la Organización Mundial de la Salud, que provee ademas del cálculo de resultados, los diferentes parámetros de control de calidad para asegurar la validez de los datos obtenidos (Lamen ef al., 198 1). 3.12 Inmunoflorescencia indirecta para detectar receptores a TM-I, y microtúbulos filamentos de Actina Para evidenciar los receptores y componentes del citoesqueleto, fueron utilizados marcadores biológicos fluorescentes. Esta técnica, ha sido utilizada para medir la dinámica de macromoléculas en las células obtenidas, de acuerdo a la técnica propuesta por Harlow y Lane (1988). Las células tiroides que crecieron en los cubreobjetos, se fijaron y permeabilizaron con metano1 absoluto a -20°C, por 20 segundos, el experimento fue realizado por duplicado con los tirocitos y con células HeLa, como control negativo para receptores a TSH, y positivo para actina y para microtúbulos: Cada laminilla se permeabilizó con SFB y se agregó 10 pl de primer anticuerpo anti TSH (dilución 1: 1 OO), anti actina (dilución 1: 1 OO)(A 4700, Clone AC 40, SIGMA) y anti 01 - tubulina (dilución 1: lOO)(T - 5 168, Clone B - 5 - 1 - 2, SIGMA), l3 tubulina ( T - 5293, Clone 2 - 28 - 33, SIGMA). Posteriormente fue agregado un segundo anticuerpo anti ratón desarrollado en conejo y conjugado con fluoresceína (F - 9137, SIGMA), una vez concluído éste proceso, los cubreobjetos fueron montados en laminillas y utilizando aceite de inmersión, y se observaron en un microscopio invertido (Axiovert 25) equipado con lámpara y filtros para fluorescencia y cámara fotográfica, obteniendo imágenes por contraste de fases y por fluorescencia. 3.13 Análisis estadistico Para evaluar el efecto de la digestión con tripsina - EDTA a tiempos de 30 y 60 minutos fue utilizada la prueba de t de Student, partiendo de las siguientes hipótesis; Hipótesis nula: (Ho) La viabilidad celular para un tiempo de digestión de 30 min del tejido tiroideo, es igual a la viabilidad celular para un tiempo de digestión de 60 minutos. 29 Ho: V30 - Vho = 0, Donde V30 es la viabilidad celular a 30 min , y VIO es la viabilidad celular a 60 min. Hipótesis alternativa: (Ha) El tiempo de digestión de 30 min del tejido tiroideo, permite obtener una viabilidad celular diferente al tiempo de digestión de 60 minutos. Ha: V3o--Va#O Para determinar sí la viabilidad de las cClulas expuestas a tripsina - EDTA varía en función del tiempo de digestión, 30 y 60 min, se realizó la prueba estadística t de Student (Kokoska y Nevison, 1989; Lyman, 1993). La prueba se realiz& para comparar el efecto analizando los valores de la desviación estándar de los promedios de la viabilidad. IV. RESULTADOS 4.1 .Viabilidad celular En el aislamiento de células del tejido tiroideo de rata, se emplearon 4 diferentes tipos de enzimas (tripsina-versenokolagenasa tipo III; tripsina-EDTAkolagenasa tipo 1) en dos grupos experimentales para lograr la disociación tisular (digestión) de las células del tejido tiroideo. En la Figura 1 se observa el porcentaje de la viabilidad celular, obtenido en cuatro cultivos empleando las enzimas tripsina-verseno y colagenasa tipo III; con un tiempo de digestión de 2 y 3 h. Los porcentajes de viabilidad obtenidos fueron 14.23 f 6.15 a 2 h y de 29.99 f 9.06 a las 3 h. 100 60 4 60 3 s 40 20 0 I Figura 1 1 2 CULTIVOS Porcentaje de viabilidad celular obtenida 3 4 con el método de Rapoport usando 2 tiempos de digestión. En la Figura 2 se aprecia que la viabilidad celular fue sensiblemente mayor, al utilizar las enzimas tripsina-EDTA y colagenasa tipo 1, enzimas recomendadas por Ambesi Impiombato et al., (1980) para llevar a cabo la disociación celular con tiempos de digestión muy cortos en comparación con la técnica propuesta por Rapoport 1976), mostrada en la Figura 1, lo que permite una menor manipulación y contacto con los agentes proteolíticos. 31 1 2 3 4 CUJlVO6A(3OMN) Figura 2 5 6 7 CUllVCE(6OMN) 6 Valores obtenidos en la viabilidad celular de acuerdo al método de Ambesi Impiombato, a 30 min (barras l-4) y a 60 min (barras 5-8). Para determinar sí la viabilidad de las células expuestas a tripsina - EDTA varia en función del tiempo de exposición, 30 y 60 min, se realizó la prueba estadística de t de Student, para comparar el efecto analizando los valores de la desviacion estándar de los promedios de la viabilidad. La prueba de t de Student se aplicó bajo la hipótesis de que la viabilidad a 30 min es estadísticamente igual a la viabilidad a 60 min. Bajo este criterio se acepta Ho, por lo tanto la viabilidad celular no fue estadísticamente distinta al tiempo de exposición a la enzima. Como Ttab > Tcal, entonces se puede decir con un 95 % de certeza que la viabilidad 1 no es diferente de la viabilidad 2. La utilización de las pruebas estadísticas para comparar; sí la viabilidad celular fue igual a los 30 y a los 60 min, permitió establecer un efecto similar entre ambos tiempos, por lo tanto se puede utilizar cualquiera, sin tener diferencias significativas en la viabilidad celular. 4.1.1 Concentración de suero fetal de ternera Para seleccionar de la cantidad más eficiente de suero fetal de ternera, el experimento qué se montó con 8 diferentes concentraciones y dio como resultado que del 0.0 al 3.0 % el rendimiento celular por el desarrollo de colonias fue escaso, en relación con el campo visual del microscopio con un áirea menor al 20%, mientras que para el 5% las colonias y densidad celular fue mayor del 50% del campo visual. A concentraciones mayores, 7.5, 10.0 y 15.0%, no se observó diferencia visual respecto a la concentración del 5%, razón por la que se continuó con una concentración al 5%. 4.2 Caracterización morfológica Los cultivos primarios de tirocitos se caracterizaron morfológicamente comparando su desarrollo con la línea FRTLS. Los cultivos celulares aislados a partir del tejido tiroideo, se muestran en las Figuras 3 a 5, como se puede observar, los resultados obtenidos en cuanto a las formas celulares, tamaiio de los folículos y por el tipo de desarrollo, se puede presumir que son tirocitos. Figura 3 Microfotografía de cultivos de tirocitos después de 21 días, donde se muestran, las células tiroideas obtenidas en cultivo primario (izquierda) y las células tiroideas de la línea celular FRTLS (derecha), tomadas con un objetivo 40X. En la Figura 3 una microfotografia en donde se muestra un cumulo de células tiroideas obtenidas en cultivo primario (izquierda), el cual guarda la morfología respecto a los tirocitos de la línea celular FRTLS (derecha), en donde se observan los tirocitos organizados en ll folículos, rodeando unos espacios correspondientes al lumen folicular. En la Figura 4 también se comparan ambos grupos celulares. Figura 4 Microfotografia de los tirocitos obtenidos después de 15 días en cultivo primario (izquierda), comparado contra la línea celular de tirocitos FRTLS (derecha) utilizando un objetivo 40X. Figura 5 Microfotografía en donde se muestra una de las morfologías adoptadas por los tirocitos en cultivo primario obtenida con un objetivo 1 OX. 34 4.3 Determinación de Tiroglobulina Para determinar si las células tiroideas en cultivo primario, producen tiroglobulina en el medio de recambio procedente de los cultivos, se realizó la medición a partir de la semana 1 a la 5, utilizando como control el medio de cultivo, que contenía 1.47 ng/ml de tiroglobulina. La cuantificación en ng/ml de ésta proteína fue realizada por medio de radioinmunoanálisis (RIA) (Berson y Yallow, 1956; Larsen, 1981). Los datos obtenidos son mostrados en la Figura 6, en la cual no se aprecia diferencia en la primera semana respecto a la cifra control, mostrando una elevación importante durante la segunda semana, encontrando una elevación más importante a la 3” semana, luego el comportamiento se mantuvo a manera de meseta, durante la cuarta y quinta semanas que fue monitoreada. Lo anterior demuestra que las células cultivadas son células tiroideas en cultivo primario, ya que es el único tejido que es capaz de producir tal metabolito. Figura 6 Comportamiento de la producción de tiroglobulina desde la 1” a la 5” semana, y en donde se muestra que la primera barra es la concentración basal del medio de cultivo, y las 5 siguientes son las cifras determinadas cada semana (La incertidumbre asociada es < 0.05%). 4.4 Expresión de receptores a TSH Para demostrar que las células que se obtuvieron de la glándula tiroides fueron tirocitos y no otras células, a las células que se sembraron sobre cubreobjetos y se procesaron para IFI, con anticuerpos antireceptor contra TSH. Se encontró que los tirocitos en cultivo primario expresaron los receptores a la TSH, más no en las células HeLa, como se muestra en la Figura 7. Asi mismo, las cClulas se procesaron por IFI para detectar componentes del citoesqueleto utilizando anticuerpos contra actina y tubulina, en donde dio positivo para las células tiroideas como para células HeLa, como se observa en las Figuras 8,9, 10 y ll. Figura 7 Microfotografia primario, obtenida de los tirocitos obtenidos después de 15 días de cultivo por contraste de fases (izquierda) y por inmunofluorescencia para la detección de los receptores a la TSH (derecha) con objetivo 100X. Figura 8 Microfotografia de los tirocitos obtenidos, después de 15 días de cultivo, observados por contraste de fases (izquierda) y por inmunofluorescencia para detectar la a tubulina (derecha), utilizando un objetivo 100X. Figura 9 Microfotografía de los tirocitos obtenidos, después de 15 días de cultivo, observados por medio de contraste de fases (izquierda) inmunofluorescencia para detectar filamentos de actina objetivo 100X. Y por (derecha) utilizando un Figura 10 Microfotografia de los tirocitos obtenidos a los 15 días de cultivo, observados por contraste de fases (izquierda) y por inmunofluorescencia para detectar filamentos de actina (derecha), con el objetivo 100X. Figura ll Microfotografia de los tirocitos cultivados en cubreobjetos, después de 15 días, observados por contraste de fases (izquierda) e inmunofluorescencia para p tubulina (derecha), con el objetivo X 1 OO. Figura 12 Microfotografía de las células HeLa, observadas por contraste de fases (izquierda) e inmunofluorescencia para detectar los filamentos de actina (derecha), tomada con un objetivo 100X. Para corroborar por western blot que los tirocitos en cultivos primarios expresaran el receptor a la TSH, las células en cultivo se lisaron y sus proteínas se caracterizaron en geles de poliacrilamida, se transfirieron a papel de nitrocelulosa y se procesaron para inmunodetectar el receptor a la TSH, con un anticuerpo específico. Como control se utilizó lisado de células HeLa, de hepatocitos y de linfocitos de rata Sprague - Dawley. Se encontró que las células tiroideas, de hígado y linfocíticas, fueron las únicas en donde se expresó el receptor a la TSH, mientras que las HeLa no, como se observa en la Figura 13. Figura 13 Los extractos de células hepáticas (H), tiroideas (T), células HeLa (He), y linfocitos (L) respectivamente. Se observa que las células tiroideas, hepáticas y linfocitos expresan al receptor de la TSH, mientras que las c4ula.s HeLa no como se observa por IFI. V. DISCUSIÓN El objetivo general de ésta investigación fue estandarizar una técnica para el desarrollo de tirocitos morfológica y fisiológicamente diferenciados, en cultivos primarios a partir de glándula tiroides de rata Sprague - Dawley. Los resultados obtenidos permiten concluir que: a partir de los explantes tiroideos, con la combinación de enzimas proteolíticas y la concentración de suero fetal de ternera, es factible la obtención de tirocitos normales en cultivos primarios sin alterar sus características funcionales y morfológicas. 5.1 Tknicas de disociación, a partir del explante tiroideo y medición de la viabilidad celular El primer paso para la obtención del modelo biológico, es el explante de la glándula tiroides, disociación y aislamiento de los tirocitos y la siembra en un medio de cultivo específico. Existen pasos cruciales en la optimización de los procedimientos de aislamiento para un tipo particular de células y es dependiente de una recuperación adecuada teniendo VUklS características: un manejo enzimático apareado (http://www.worthington-biochem.com/tissueDissociation/cellOpt.html, con la viabilidad. 1999). Uno de los aspectos importantes en la obtención de los cultivos primarios, es conocer el porcentaje de c&las vivas, que serán sembradas luego de su aislamiento, a partir del explante tiroideo. Esto es con el fin de contrastar su desarrollo en el cultivo específico, con respecto al numero inicial contabilizado. Esto permitió la estandarización en cuanto a que tipo de enzimas utilizar, y durante cuanto tiempo se debe de exponer el explante glandular, así como determinar el rendimiento celular obtenido, que fue de 3.16 X 1 O6 células totales y una viabilidad celular del 68% en promedio (Ambesi-Impiombato et al., 1980) Para la disociación del explante tiroideo fueron utilizados dos grupos con dos enzimas cada uno, el primero comprendió a la tripsina - verseno / colagenasa III, y en el segundo a la tripsina - EDTA / colagenasa 1. Para el primer grupo se observó un numero total de células, similar al descrito por Rapoport (1976) 1 X lo5 células por ml, y al aplicarle la prueba de Al exclusión con azul de tripano, se encontró que la viabilidad celular fue de 14.225 f 6.145 a las 2 h, mientras que a las 3 h fue de 29.985 f 9.058. Esto condujo a buscar alternativas, para mejorar dicha viabilidad, que de manera inicial se consideró crucial, para la obtención de un rendimiento celular a confluencia, ya que se parte de que sí se siembra una baja cantidad de células vivas, esto retrazará el tiempo de respuesta previsto para que alcancen dicha confluencia. En cambio para el segundo grupo de enzimas, la disociación se realizó durante perIodos de 30 min (n=4) y 60 min (n=4), encontrándose que a los 30 min, la viabilidad fue de 67.4875 f 6.3517, y del 69.3575 f 5.8705 a los 60 min. Esto es casi similar al promedio aceptable para la obtención de un cultivo primario reportado por Kolodny (1985) que osciló de entre el 60 al 70 %, pero es bajo respecto al 90% registrado para el cultivo de hepatocitos por Lykkesfeldt et al., (1998) y respecto al reportado para las células FRTLS, cuando son reactivadas que debe ser mayor al 95% según Ambesi-Impiombato et al., (1980). Para el segundo grupo de enzimas, y para evidenciar sí existe o no alguna ventaja en cuanto a la obtención de células viables a 30 y 60 min, los datos fueron analizados aplicando la prueba t de Student, y se encontró, que no existe diferencia estadísticamente significativa, (pcO.05) y que por lo tanto, se puede disgregar los tejidos por 30 o 60 min, sin variar la viabilidad celular, con una exactitud del 95%. Esto sugiere que es indistinto utilizar 30 o 60 min para digerir los explantes. Esto se basa en que al aplicar la prueba estadística para los 2 tiempos, tratando de encontrar diferencias, ésta no se pudo demostrar, en ese sentido se observa que es indistinto la utilización de uno u otros, tiempos, qué servirán como un parámetro cuando se utilice ésta metodología. Se encontró en primer lugar que el aislamiento celular total con células vivas, fue mejor en el segundo grupo de enzimas, ya que existe diferencia entre el método propuesto por Rapoport (1976), (primer grupo) y el grupo propuesto por Ambesi-Impiombato et al., (1980). Por otro lado, los autores de los métodos utilizados como base para la operativización del trabajo (Rapoport, 1976; Ambesi - Impiombato et al., 1980), incluyendo algunos otros que han obtenido cultivos primarios a partir de explantes, centraron su atención en los 42 procedimientos de disociación y aislamiento del modelo biológico, en los medios enzimaticos y mecánicos como el utilizado por Pourati et al., (1998), o ambos métodos Rapoport (1976), pero la viabilidad celular, no fue contemplada por ninguno de los autores quienes disefiaron medios de cultivo, como Ham (1964) y Conn (1965), el que disefió y estandarizó el cultivo de la línea celular FRTLS, Ambesi-Impiombato et al., (1980), el que comenzó a utilizar las células tiroideas bovinas utilizando la TSH y un antimicótico, para observar cambios, Knopp et al., (1970). En todos los casos anteriormente expuestos la viabilidad celular no fue medida, se puede argumentar que es un fenómeno estudiado desde principios del siglo, pero según los autores del manual Worthington, es un factor crucial, cuando se está llevando a cabo un proceso de estandarización de un cultivo, así como para medir la variación de células viables durante un experimento. Otros autores han considerado, la estandarización de cultivos básicamente dirigidos hacia la disociación celular, medios de cultivo y factores de crecimiento específicos, pero dejan de lado la viabilidad celular, a diferencia de los autores del manual de Worthington, los parámetros a considerar en cualquier esquema para la estandarización de un cultivo son la viabilidad celular por un lado y el rendimiento celular. Por lo tanto, no basta tan solo con disociar un gran numero de células, sino que se debe de buscar un balance entre el numero de CélUhS disociadas y su biochem.com/manual/tissueDissociation/cellOpt.htlm~, viabilidad (<http://www.worthington19992 5.1.1 Condiciones del cultivo Se debe elegir un acondicionador nutritivo general para las células de los mamíferos, y proporcionar las condiciones metabólicas específicas para un tipo individual de célula. Estableciendo los requerimientos más favorables para la supervivencia y crecimiento de la célula, las condiciones de cultivo deben de promover el mantenimiento del estado diferenciado (Koningsberg, 1963). La función del medio condicionado general de Eagle y Piez (1955), fue constituído por 30 aminoácidos y 8 vitaminas como elementos esenciales para las diferentes células de mamífero, pero se deben adicionar algunas otras sustancias para lograr las condiciones específicas de un cultivo en especial. Este es el caso de las células tiroideas, que aparte del medio específico Ham F 12 (modificado de Conn), se requieren además 6 hormonas o factores de crecimiento específicos para su desarrollo, los cuales son esenciales para la proliferación de los tirocitos aislados (Ambesi-Impiombato et al., 1980). Los factores de crecimiento específicos, en el caso de las células tiroideas son la insulina, transferrina, somatostatina, glicil histidil lisina y TSH, y substituye la hidrocortisona por cortisol (Smelderly et al., 1993), mientras que otros utilizan los considerados como mínimos, la insulina, transferrina y TSH (Dere et al., 1985). Se estableció el experimento conforme lo recomendado por Ambesi - Impiombato et al., (1980), en el cual se inició con una serie de ensayos tendientes a estandarizar las concentraciones de los diferentes factores de crecimiento hormonal, y se observó que no hubo el desarrollo celular esperado, por lo anterior se considera que la fuente de error no depende de la concentración de las 6H, posiblemente influyeron factores como la disociación enzimática y la resiembra semanal, o la actividad específica de las hormonas utilizadas. Asi mismo en la preparación del medio de cultivo, se realizó una modificación en la concentración de suero fetal de ternera, para lo cual se instaló un experimento utilizando diferentes concentraciones que fueron desde 0, 0.1, 0.5, 3.0, 5.0, 7.5, 10.0 y 15.0 %, y la concentración en donde se observó un mejor crecimiento fue al 5%, misma que es utilizada por Ambesi - Impiombato et aZ.,( 1980) para la línea celular FRTLS, mas no para la siembra de tejidos nativos, cuya propuesta es a una concentración de 0.1 a 0.5 %, para evitar la proliferación de los fibroblastos sobre los tirocitos. En este experimento con la modificación de suero fetal de ternera a diferentes concentraciones, no se observó el desarrollo de los fibroblastos, probablemente a que los factores de crecimiento específico para los tirocitos, interfieren con el desarrollo de los fibroblastos, privilegiando exclusivamente la proliferación de los tirocitos. En cambio hay autores quienes no utilizan ni suero, ni hormonas, como en el cultivo de células epiteliales de pulmón (Nielsen et al., 1997), (Lemoine, 1989), o células transfectadas de tiroides humana ya que no logran ventaja adicional con su uso. 44 Algunos explantes obtenidos quirúrgicamente en humanos con enfermedad de Graves, fueron digeridos con colagenasa IV y dispasa, a 32’C por 30 min, el medio utilizado fue el Ham F12 y el RPM1 1640 (1: l), el suero fetal varió de 0 al lo%, en donde se observó gran reactividad a la bTSH a bajas concentraciones entre 1 al 2 %, perdiéndose ésta respuesta entre 3 aI 10% (MacNeil el al., 1994; Sato el al., 1995). 5.2 Caracterización morfolhgica Los cultivos celulares tiroideos en cultivo primario, obtenidos in vitro, pueden permitir su utilización como un modelo biológico que facilite, evidenciar algunos mecanismos celulares y moleculares, en el desarrollo de las diferentes enfermedades tiroideas, desde las simples disfunciones endocrinas, como en el hipotiroidismo e hipertiroidismo, hasta la investigación de los factores precipitantes de neoplascias y algunas enfermedades autoinmunes, que ya no solo afectan el proceso de secreción hormonal, sino que pueden tener efectos devastadores en otros ámbitos no tiroideos. Para la caracterización morfológica de los tirocitos obtenidos, se realizó la comparación entre éstas células de cultivo primario, contrastándolas contra los tirocitos de la línea celular FRTLS (Figuras 4 y 5) respectivamente. Se puede evidenciar cuan importante es la morfología asumida por las células tiroideas, de tal manera que Yap y Manley (1984), consideran como la base anatómica y funcional a la histoarquitectura folicular de la tiroides. La organización de las células epiteliales tiroideas en formas quisticas, conteniendo coloide en el lumen permite la síntesis, procesamiento y secreción de hormonas tiroideas. Esos eventos morfogenéticos son coordinados por procesos como la adhesión celular, el tráfico intracelular, ensamble de uniones especializadas y la regulación de los movimientos celulares morfogenéticos (Yap et al., 1992). La morfogénesis folicular tiroidea es alterada en enfermedades endócrinas como la tiroiditis de Hashimoto y neoplasia de la tiroides, cuya característica es la alteración de la histoarquitectura folicular (Yap et al., 1987). Por otro lado cuando se siembran células a alta densidad en presencia de TSH, las células tiroideas se adhieren unas a otras. La influencia morfogenética de la TSH es mediada por la proteína cinasa A, vía cAMP, y lo identifican como el principal determinante de la morfología folicular tiroidea in vitro. La TSH regula la adhesión de células tiroideas, la organización del citoesqueleto e inhiben la locomotilidad celular. Los patrones de las celulas tiroideas en cultivo, no son fijos, ya que pueden disociarse y migrar convirtiendo los folículos en monocapas (Yap y Manley, 1994; Yap et al., 1997). Para asumir una funcionalidad y morfología adecuadas, es importante que la célula esté polarizada. La polaridad celular (asimetría) es extensamente distribuida y altamente conservada en los diferentes tipos celulares, desde procariotes hasta los grandes eucariotes. En organismos multicelulares es mas conspicuo, pero no esta restringido a neuronas y células epiteliales. La membrana plasmática esta organizada en dos dominios, el apical y el basolateral. Esta función inherente a las células epiteliales es acomptiada de funciones mas especializadas incluyendo la absorción y la secreción (Salas et al., 1997). La morfología de los folículos tiroideos tiene un comportamiento similar en las diferentes especies de vertebrados, como en células de rata (Ambesi-Impiombato et al., 1980), en células humanas transfectadas (Lemoine, 1989), células de cerdo (Yap et al., 1997), células bovinas y caninas (Depoortere et al., 1998), entre otros modelos biológicos de células tiroideas utilizados. La organogénesis y el remodelado de tejido requieren no solo la proliferación y diferenciación extensiva de los tejidos, sino también de la eliminación selectiva de células indeseables. Las hormonas tiroideas son esenciales durante el desarrollo de los humanos, ya que regulan directamente la transcripción genética a través de los receptores a hormonas tiroideas, como son los factores de transcripción nuclear. Muchos de los genes son regulados por la T3, han sido aislados y caracterizados, confiriéndoles a las células tiroideas una función importante dentro de los mecanismos de apoptosis (muerte celular programada) en especial en ésta especie, pero que a futuro se pueden extender las investigaciones a otras especies (Su et al., 1997). Uno de los fenómenos observados durante el desarrollo de los folículos tiroideos fue la generación de estructuras extracelulares, con morfología aproximadamente hexagonal, nominada matriz extracelular (ECM). La interacción de células con las proteínas de ECM, afecta muchos aspectos del comportamiento y regulación de los procesos biológicos, 46 incluyendo (Vitale ef la al., morfología celular, migración, diferenciación, transformación y crecimiento 1997). La comparación gráfica-gráfica permite cotejar las similitudes morfológicas entre las células obtenidas de glarrdula tiroides de rata y las de línea celular FRTLS. No se observó diferencia en cuanto a distribución y tarnaiio de los tirocitos, en la formación de folículos y de los espacios interfoliculares. Cabe mencionar que las células de línea FRTLS, no se desarrollaron adecuadamente bajo las condiciones proporcionadas por la patente, por lo que no se pudieron obtener patrones de cúmulos mayores a las aproximadamente circulares, mostradas en las Figuras 4 y 5. 5.3 Caracterización funcional La tiroglobulina es uno de los marcadores específicos que se expresa en las células tiroideas, y es una glicoproteína yodada en la cual se sintetizan las hormonas tiroideas (Fontana, 1982). Este proceso de yodación de hormonas tiroideas se lleva a cabo en la membrana apical de las células epiteliales de la tiroides (Lemansky, 1998). La tiroglobulina, es el precursor de las hormonas tiroideas T4 y T3, deriva de las células epiteliales tiroideas. La tiroglobulina es almacenada en el lumen del folículo tiroideo y su transporte a la circulación, es a través de transporte vesicular transepitelial (trancitosis). La depuración de la tiroglobulina de la circulación ocurre en el hígado, por endocitosis en las células de Kupffer. La intemalización de la tiroglobulina es acompañada por la liberación proteolítica de las hormonas tiroideas, de sus moléculas precursoras. El significado biológico de esta liberación extratiroidea de hormonas por los macrófagos, quizás consista en interacciones parácrinas con los hepatocitos (Brix, 1998). La tiroglobulina se detectó, por medio de RIA, desde la 1” a la 5” semana, y se utilizó como control estandar o cifra basal, la determinada en el medio de cultivo (1.47 ng/ml) a utilizar para el recambio, encontrando que la tiroglobulina mostró una elevación incipiente durante la primera semana (1.88 ng/ml), se observó una mayor elevación en la segunda semana (4.96 ng/ml), alcanzando el umbral a la tercera semana (7.04 ngml). Durante la cuarta (6.71 ng/ml) y la quinta semanas (6.80 ng/ml), el comportamiento observado fue a manera de meseta. La medición por medio de RIA mostró una sensibilidad para tiroglobulina del 99.5%, A-l aunque las cifras obtenidas, son bajas en relación a las reportadas por Fontana et al., (1982) que fue desde una producción de 60 a 80 pg/ml hasta 20 ng/ml, encontrando que en el cultivo de tirocitos, la liberación de tiroglobulina, al medio de cultivo es de 30 pg/ml, y ésta respuesta es directamente proporcional al numero de células (Fontana et al., 1982). En el experimento no fue posible medir la densidad celular in sifu, debido a no contar con la infraestructura para tal fin. Existe evidencia de que algunas hormonas polipeptídicas son degradadas en los órganos blanco, y sugiere que la inactivación local, quizás funcione como un importante mecanismo de regulación celular, así como de inactivación de la señal hormonal (DeRubetis et al., 1975). Se han reportado secreción y formas anormales de tiroglobulina, como lo mencionó Medeiros-Neto et al., (1996), donde identificaron una alteración en el retículo endoplásmico, con inducción de una proteína chaperona y deficiencia de tiroglobulina. Abramowicz et al., (1997) describieron la presencia de una tiroglobulina mutante estructuralmente y la propusieron como un factor potencial para la presencia de hipotiroidismo congénito, cuyos efectos intra y extraútero, son muy importantes, dentro. del esquema de evolución, que relaciona al hipotiroidismo con el retraso mental. 5.4 Expresión de los receptores a TSH y componentes del citoesqueleto La presencia de receptores y componentes del citoesqueleto fue determinada de dos formas, la primera fue el procesamiento por medio de inmunofluorescencia indirecta (IFI) y la segunda por Western Blot. La importancia de la inmunofluorescencia indirecta, se encuentra dentro de las técnicas para evidenciar estructuras utilizando marcadores biológicos fluorescentes. Los biosensores protéicos fluorescentes, están involucrados en la citoquímica y espectroscopia fluorescente, y han sido utilizadas para medir la dinámica de macromoléculas, metabolitos, iones, y para explorar las bases moleculares de las funciones vitales, en los campos de la química orgánica, bioquímica y biología celular y molecular, incorporándolas en diversas células, tejidos y órganos. Se han desarrollado ademas dispositivos como son los paquetes de cómputo, e instrumentación para el procesamiento digital de las imágenes obtenidas, como la AQ cristalografia por rayos “X” y la resonancia magnética nuclear, que acoplado a un modelo molecular que permite definir la relación entre la estructura y función de proteínas “in vitre” (Giuliano et al., 1995). La tendencia acerca de los receptores a TSH y de los receptores nucleares para hormonas tiroideas, es estudiar las vías de acción y expresión de los componentes de ambos receptores en la termogénesis, lipogénesis y maduración cerebral (Wilkstrom et al., 1998), específicamente en el desarrollo del sistema auditivo, funciones cocleares y en el órgano de Corti (Rusch et al., 1998) y en la alteración de la expresión del receptor a hormonas tiroideas y de otros receptores nucleares, que provocan resistencia a hormonas tiroideas (Weiss el al., 1999). Igualmente la atención se enfoca hacia los factores de crecimiento que actúan en la organogénesis y que pueden causar agenesia de glándulas endócrinas y exocrinas, rifion, pulmón, estructuras cutáneas, anormalidades craneofaciales y del esqueleto humano, provocado por una mutación en el factor de crecimiento de los fibroblastos (Celli et al., 1999). Los tirocitos obtenidos en cultivo primario, y procesados para IFI, así como los resultados obtenidos, por medio de las estructuras y receptor expresados, pueden permitir que sea factible su utilización para evidenciar las estructuras celulares antes mencionadas, lo expuesto en los resultados es tan solo una parte de la verificación funcional, y su potencial para facilitar su utilización combinando variables que serán exploradas a futuro. En algunas disciplinas, los sistemas in vitre, no son bien vistos como una alternativa de reemplazo, pero son una norma para los estudios en el ámbito celular y molecular. En muchos casos el reemplazo es relativo, porque requiere de células y tejidos frescos. Aun así, los animales utilizados son económicamente mejores, puesto que de un sólo animal se obtienen tejidos y sirven para realizar numerosos cultivos. El material humano puede en algunas ocasiones ser utilizado, pero es muy difícil de obtener, guardar y distribuir. Algún tejido humano puede estar disponible después del explante quirúrgico. La placenta humana ha sido utilizada como fuente para algunos tipos de tejidos para investigación, ya que contiene algunas estructuras con células nerviosas para estudios neurológicos. El utilizar tejidos humanos tiene el riesgo de contener virus peligrosos como el SIDA y la hepatitis, que requieren mayores precauciones. A9 En trabajos de investigación la utilización de cultivos celulares es más económica, que con la utilización de un <http://hayato.med.osaka.ac.ip/index/g;uide/inform/renulation/standard.html>, animal completo las células diferenciadas en cultivo proveen de una herramienta muy útil para estudiar los mecanismos de acción de hormonas y otros factores que influyen en el crecimiento y metabolismo celular (Tramontano eC al., 1986). Trabajos a futuro van encaminados a cómo la TSH interacciona con su receptor. Pero más importante para la perspectiva clínica es definir los epítopes de las células B y células T sobre el receptor a TSH que son reconocidas por el sistema inmunológico. Esta información facilita el desarrollo para una aproximación inmunológica para controlar la enfermedad de Graves e hipertiroidismo, y quizás ofrezca un evidenciar los mecanismos acerca de la destrucción de la glándula tiroides y el consecuente hipotiroidismo (Nagayama et al., 1992). A pesar de los avances en el cultivo celular, es pequeño el número de células epiteliales diferenciadas en cultivo. Las células obtenidas en dichos cultivos se han empleado no sólo para el diagnóstico citológico de enfermedades de tipo metabólico y hereditario, sino también en deficiencias bioquímicas para plantear o resolver problemas de investigación, que actualmente demandan soluciones a los diferentes problemas que afectan a la salud humana, soluciones que se han de encontrar utilizando los diversos métodos existentes para lograrlo (Ambesi-Impiombato et al., 1980). Aún se ignoran muchas de las vías que son utilizadas en polimerización dinámica de los microtúbulos, y se pueden remarcar en algunos aspectos. A muchos niveles fundamentales la polimerización dinámica permite la rápida reorganización del citoesqueleto. La hidrólisis de NTP es el potencial para poder realizar el trabajo mecánico, (estos mecanismos son pobremente entendidos). Existe evidencia que la polimerización de actina produce trabajo mecánico y fuerza en las células (Inoue y Salmon, 1995) y que la atención en su distribución es crucial para la función celular tiroidea, ya que este se encuentra asociado con el receptor de la TSH. Los resultados, muestran que la estandarización del modelo biológico propuesto inicialmente como alternativa a la línea celular FRTLS, sirve como punto de partida para proseguir la investigación en el ámbito celular y transpolarlo a las diferentes anormalidades que sufren las células tiroideas in vivo como son el estudio de la alteración de los productos característicos que endocita o exocita la célula tiroidea normal, como es la produccibn de tiroglobulina, el estudio de los segundos mensajeros, las vías de activación, y alteraciones en la bomba de yodo, entre otros (Martínez-Galán et al., 1997). Es un hecho que los avances logrados en éste trabajo pueden proporcionar un buen modelo biológico que permita la relativamente fácil obtención y reproducción de células tiroideas en cultivo primario, y que sus características tanto fisiológicas como metabólicas sean de utilidad para investigar algunas funciones normales complementarias y las alteraciones que afectan dicho funcionamiento de la glándula tiroides. Los resultados conseguidos a la fecha impulsan la continuación para lograr superar los objetivos que a futuro se tienen contemplados tomando como punto de partida el presente trabajo. Tanto el objetivo principal como cada uno de los particulares propuestos, fueron realizados en su totalidad, pero queda la inquietud para continuar en ésta línea de investigación, dado que cada día la incidencia de enfermedades tiroideas es mayor y las alternativas de solución muy escasas. Cl VI. CONCLUSIONES l.- La técnica propuesta para la obtención de los tirocitos de rata Sprague-Dawley, ha sido estandarizada. 2.- Se obtuvieron cultivos de tirocitos cuya morfología fué similar a la línea celular FRTLS. 3.- Los cultivos tiroideos son morfológica y funcionalmente similares a las células in vivo, ya que éstas células expresan el receptor a la TSH y producen tiroglobulina. Asimismo, al utilizar anticuerpos contra citoesqueleto se observa una distribución de manera normal. 4.- Lo anterior, provee una herramienta importante para poder estudiar in vitro, la distribución y función del receptor de la TSH y el citoesqueleto, como alteraciones como son el hipo e hipertiroidismo. VII. LITERATURA CITADA Abramowics, M. J., Duprez, L., Parma, J., Vassart, G. and Heinrichs, C. 1997. Familia1 congenital hypothyroidism due to inactivating mutation of the thyrotropin receptor causing profound hypoplasia of the thyroid gland. J. Clin. Invest. 99 (12); 3018 - 3024. Allain, T. J. and Mc Gregor, A. M. 1992. Thyroid hormones and bone. J. Endocrinol. 139: 9 - 18. Allgeier, A., Offermans, S., Van Sande, J., Spicher, K., Schultz, G. and Dumont, J. E. 1994. The hurnan thyrotropin receptor activates G - proteins Gs and Gq/l 1. J. Biol. Chem. 269 (19): 13733 - 13735. Ambesi - Impiombato, F. S., Parks, L. A. M. and Coon, H. G. 1980. Culture of hormone dependent functional ephitelial cell form rat thyroids. Proc. Natl. Atad. Sci. USA. 77 (6): 3455 - 3459. Andreoni, A., Cubeddu, R., De Silvestri, S., Laporta, P., Ambesi-Impiombato, F. S., Esposito, M., Mastrocinque, M. and Tramontano, D. 1983. Effects of laser irradiation on haematoporphyrin - treated normal and transformed thyroid cells in culture. Cancer Res. 43: 2076 - 2080. Aragay, A. M., Katz, A. and Simon, M. 1. 1992. The Ga, and Gaii proteins couple the thyrotopin - releasing hormone receptor to phospholipase C in GH3 rat pituitary ce%. J. of Biol. Chem. 267 (35): 24983 - 24988. Archer, J. and Solomon, F. 1994. Deconstructing the microtubule-organizing center. Cell. 76: 589-591. Arvan, P. and Castle, D. 1998. Sorting and storage during secretory granule biogenesis: looking backward and looking forward. Biochem. J. 332: 593 - 610. Baas, P. W. and Joshi, H. C. 1992. y - Tubulin distribution in the neuron: implications for the origins of neuritic microtubules. J. Ce11 Biol. 119 (1): 17 1 - 178. Beguinot, F., Beguinot, L., Tramontano, D. Duilio, C., Formisano, S., Bifulco, M., Ambesi Impiombato, F. S. and Aloj, S. M. 1987. Thyrotropin regulation of membrane lipid fluidity in the FRTL-5 thyroid ce11 line. J. Biol. Chem. 262 (4): 1575 - 1582. Bradford, M. M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principie of protein - dye binding. Anal. Biochem. 72: 248 - 254. Bradley, D. J., Towle, H. C., and Young III, W. S. 1994. a and p Thyroid hormone receptor (TR) gene expression during auditory neurogenesis: evidente for TR isoforrn-specific transcriptional regulation in vivo. Neurobiology. 91: 439 - 443. Brix, K., Lemansky, P. and Herzog, V. 1996. Evidente for extracellulary acting cathepsins mediating thyroid hormone liberation in thyroid epithelial cells. Endocrinol. 137: 1963 1974. Brix, K., Summa, W., Lottspelch, F. and Herzog, V. 1998. Extracellularly occuning histone Hl mediates the binding of thyroglobulin to the ce11 surface of mouse macrophages. J. Clin. Invest. 102: 283 - 293. Burke, G., Chang, L. L., Szabo, M. 1973. Thyrotropin and cyclic nucleotide effects on prostaglandin levels in isolated thyroid cells. Science 180: 872 - 875. Celli, G., LaRochelle, W. J., Mackem, S., Sharp, R. and Merlino, G. 1998. Soluble dominantnegative receptors uncovers essential roles for fibroblast growth factors in multi-organ induction and patteming. EMBO. 17: 1642 - 1645. Clapham, D. E. 1993. Mutations in G protein - linked receptors: novel insights on disease. Cell. 75: 1237 - 1239. Contempré, B., Denef, J. F., Dumont, J. E. and Many, M. C. 1993. Selenium deficiency aggravates the necrotizing effects of a high iodide dose in iodine deficient rats. Endocrinol. 132 (4): 1866 - 1868. Contempré, B., Vanderplas, J. and Dumont. 1991. Cretinism, thyroid hormones and selenium. Mol. Ce11 Endocrinol. 81: Cl93 - C195. Coon, H. G. 1966. Clonal stability an phenotypic expression of chick cartilage cells in vitro. Proc. Natl. Atad. Sci. USA. 55: 66 - 73. Cooper, J. A. and Mitchinson, T. J. 1995. Cytoskeleton. Curr. Op. Cell Biol. 7: 1 - 3. Corvilain, B., Contempre, B., Longombe, A. O., Goyens, P., Gervy-Decoster, C., Lamy, F., Vanderpas, J. B., and Dumont, J. 1993. Selenium and the thyroid: how the relationship was established. Am. J. Clin. Nutr. Suppl. 57: 2448-2483. Costagliola, S. Many M. C., Stalmans-Falys, M., Tonacchera, M., Vassart, G., and Ludgate, M. 1993. Recombinant thyrotropin receptor and the induction of autoimmune thyroid disease in BALB/c mice: a new animal model. Endocrinol. 135: 2150 - 2159. Chanoine, J. P., Braverman, L. E., Farwell, A. P., Safian, M., Alex, S., Dubord, S. and Leonard, J.L. L. 1993. The thyroid gland is the major source of circulating T3 in the rat. J., Clin, Invest. 91: 2709 - 2713. Chen, G., Pekary, A. E., Sugawara, M. and Hershman, J. M. 1993. Effècts exogenous hydrogen peroxide on iodide transport and iodine oranification in FRTLS rat thyroid cell. A. Endocrinol. 129: 89 - 96. Dahl, G. E., Evans, N. P., Thrun, L. A. and Karsch, F. J. 1994. A central negative fedback action of thyroid hormones on thyrotropin - releasing hormone secretion. Endocrinol. 135: 2392 - 2397. Dallas, J. S., Desai, R. K., Cunningham, J. S., Monis, J. C., Seetharamaiah, G. S., Wagle, N., Goldblum, R. M. and Prabhakar, B. S. 1994. Thyrotropin (IX-I) interacts with multiple discrete regions of the TSH receptor: polyclonal rabbits antibodies to one more of these regions can inhibit TSH binding and function. Endocrinol. 134 (3): 1437 - 1445. Das, S. C., Isichel, U. P., 1993, The “Feto-maternal” thyroid function interrelationships in an iodine-deficient region in afiica -the role of T3 in possible fetal defense, A. Endocrinol. 128: 116-l 19. De Loof, A., Van Den Broec, J., and Jansen, I., 1996, Hormones and the cytoskeleton of animals and plants. Int. Rev. Cytol. 166: 1 - 57. Evangelista, M., Blundell, K., Longtine, M. S., Chow, C. J., Adames, N., Pringle, J. R., Peter, M. and Boone, Ch. 1997. Bn lp, a yeast formin linking Cdc42p and the actin cytoskeleton during polarized morphogenesis. Science. 276 (4): 118 - 122. Few, J., Thompson, N. W., Angelos, P., Simeone, D., Giordano, T., and Reeve, T. 1996. Riedel’s thyroiditis: treatment with tamoxifen. Surgery. 120 (6): 993 - 999. Fontana, S., Tramontano, D., Ambesi - Impiombato, F. S. and Rossi, G. 1982. Thyroglobulin production by rat thyroid cells in culture: a study at the leve1 of single cells. Endocrinol. 110: 1790 - 1982. Fuchs, E. and Cleveland, D. W. 1998. A structural scarffolding of intermediate filaments in health and disease. Science. 279 (23): 5 14 - 5 19. Fuchs, E. and Weber, K. 1994. Intermediate filaments: structure, dynamics, function and disease. Annu Rev. Biochem. 63 : 345 - 382. Giordano, C., Stassi, G., De Maria, R., Todaro, M., Richiusa, P., Papoff, G., Ruberti, G., Bagnasco, M., Testi, R. and Galluzzo, A. 1997. Potential involvement of fas and its ligand in the pathogenesis of Hashimoto’s thyroiditis. Science. 275: 960 - 963. Giuliano, K. A. and Post, P. L., Hahn, K. M. and Taylor, L. 1995. Fluorescent protein biosensors: measurement of molecular dynamics in living cells. Annu. Rev. Biophys. Biomol. Struct. 24: 405 - 434. Glinoer, D. 1997. The regulation of thyroid function in pregnancy: pathways of endocrine adaptation fiom physiology to pathology. Endocrine Rev. 18 (3): 404 - 433. Graebert, K. S., Bauch, H:, Neurnuller, W., Brix, K. and Herzog, V. 1997. Epithelial folding in Vitro: Studies on the cellular mechanism underlying evagination of thyrocyte monolayers. Exp. Ce11 Res. 23 1: 2 14 - 225. Grollman, E. F., Lee, G., Ambesi-Impiombato, F. S., Meldolesi, M. F., Aloj, S. M., Conn, H. G., Kaback, H. R. and Kohn, L. D. 1977. Effects of thyrotropin on the thyroid cell membrane: hyperpolarization induced by hormone-receptor interaction. Proc. Natl. Atad. Sci. USA. 74 (6): 2352 -2356. Grossmann, M., Weintraub, B. D. and Szkudlinski, M. W. 1997. Novel insights into the molecular mechanism of human thyrotropin action: structural, physiological and therapeutic implications for the glycoprotein hormone family. Endocrine Rev. 18 (4): 476 - 500. Guissouma, H., Ghorbel, M. T., Seugnet, I., Ouatas, T. and Demeneix, B. A. 1998. Physiological regulation of hypothalamic TRH transcription in vivo is T3 receptor isoform specific. FASEB. 12: 1755 - 1764. Ham, R. G. 1965. Clonal growth of mammalian cells in a chemically defined, synthetic medium. Proc. Natl. Atad. Sci. USA. 53: 288 - 293. Hidaka, Y., Guimaraes, V., Soliman, M., Yanagawa, T., Okamoto, Y., Quintans, J., and DeGroot, L. J. 1995. Production of thyroid - stimulating antibodies in mice by immunization with T - cell epitopes of human thyrotropin receptor. Endocrinol. 136: 1642 - 1647. Hin, A. L. and Luna, E. J. 1994. Membrane Interactions with the Actin Cytoskeleton. Curr. Opin. Ce11 Biol. 6: 120 - 130. Hoffmann, J., Pietrzik, C. U., Kummer, M. P., Twiesselmann, C., Bauer, C. and Herzog, V. 1999. Binding and selective detection of the secretory N-terminal domain of the Alzheimer amyloid precursor protein on ce11 surface. J. Histochem. Cytochem. 47(3): 373 - 382. Hollembeck, P. J. 1990. Cytoskeleton on the move. Nature. 343 (1): 408 - 409. Hurd, R. E., Santini, F., Lee, B., Naim, P., and Chopra, 1. 1993. A study of the 3,5,3’triiodothyronine sulfation activity in the adult and the fetal rat. Endocrinol. 133 (5): 1951-1955. Inoué, S. and Sato, H. 1967. Ce11 motility by labile association of molecules. J. Gen. Phys. 50 (6): 259 - 291. Ishii, H., Inada, M., Tanaka, K., Mashio, Y., Naito, K., Nishikawa, M., Matsuka, F., Kuma, K., and Imura, H. 1982. Sequential deiodination of thyroxine in human thyroid gland. J. Clin. Endocr. Metab. 55 (5): 890-896. Jones, K. E., Brubaker, J. H. and Chin, W.W. 1994. Evidency that phosphorilation events participate in thyroid hormone action. Endocrinol. 134 (2): 543- 548. Kessler, S. W. 1975. Rapid isolation of antigens fiom cell with a staphylococcal protein a antibody adsorbent parameters of interaction of antibody - antigen complexes protein A. J. Immunol. 115: 1627 - 1633. Kirby, J. D., Arambepola, N., Porkka-Heiskanen, T., Kirby, Y. K., Rhoads, M. L., Nitta, H., Jetton, A. E., Iwamoto, G., Jackson, G. L., Turek, F. W., and Cooke, P. S. 1997. Neonatal hypothyroidism permanently alters follicle-stimulating hormone and luteinizing hormone production in the male rat. Endocrinol. 138 (7): 2713-2721. Knopp, J., Stolc, V. and Tong, W. 1970. Evidente for the induction of iodide transport in bovine thyroid cells treated with thyroid-stimulating hormone or dibutyryl cyclic adenosine 3’5’- monophosphate. J. Biol. Chem. 245 (17): 44034408. Kokoska, S. and Nevison, Ch. 1989. Statistical tables and formulae, Springer - Verlag, (New York, Inc.) pp. 57 - 58; 60 - 62 . Kolodny, J. M., Leonard, J. L., Lamen, P. R. and Silva, J. E. 1985. Studies of nuclear 3,5,3’triiodothyronine binding in primary cultures of rat brain. Endocrinol. 117 (5): 1848 1857. Konigsberg, 1. R. 1963. Clonal analysis of myogenesis. Science. 140 (3573): 1273-1284. Kraiem, Z., Sadeh, O., Yosef, M. and Aharon, A. 1995. Mutual antagonistic interactions between the thyrotropin (adenosine 3’, 5 ‘- monophosphate) and protein kinase C/epidermal growth factor (thyrosina kinase) pathways in ce11 proliferation and differentiation of cultured human thyroid follicles. Endocrinol. 136: 585 - 590. Laemmli, U. K. 1970. Cleavaje of structural proteins during assembly of the head of bacteriophage T4. Nature. 227: 680. Lazar, M. A. 1993. Thyroid hormones receptors: multiple forms, multiple possibilities. Endocrine Rev. 14 (2): 184 - 193. Ledent, C., Parma, J., Dumont, J., Vassart, G., and Targovnik, H. 1994. Molecular genetics of thyroid disease. E. J. Endocrinol. 130: 8-14. Lee, W - S., Berry, M. J., Hediger, M. A. and Lamen, P. R. 1993. The type 1 iodothyronine 5’ - deiodii messenger ribonucleic acid is localized to the S3 segment of the rat kidney proximal tubule. Endocrinol. 132: 2 136 - 2 140. Lemansky, P., Brix, K. and Herzog, V. 1998. Iodination of mature cathepsin D in thyrocytes as an indicator for its transport to the ce11 surface. EJCB. 76: 53 - 62. Lemoine, N. R., Mayall, E. S., Jones, T., Sheer, D., McDermid, S., Kendall-Taylor, P. & Wynford - Thomas, D. 1989. Characterization of human thyroid epithelial cells inmortalised in vitro by simian virus 40 DNA transfection. Br. J. Cancer. 60: 897 - 903. Lowry, 0. H., Rosembrough, A., Farr, L and Randall, R. J. 195 1. Protein Measurement with the folin phenol reagent. J. Biol. Chem. 193: 265 - 275. Luna, E. J. and Hitt, A. L. 1992. Cytoskeleton-plasma membrane interactions. Science. 258: 955-964. Lykkesfeldt, J., Hagen, T. M., Vinarsky,.V. and Ames, B. N. 1998. Age - associated decline in ascorbic acid concentration, recycling, and biosyntesis in the rat hepatocytes reversal with (R) - a - lipoic acid supplementation. FASEB J. 12: 1183 - 1189. Lyman, R. 1993. An introduction to statistical methods and data analysis. Duxbury Press (Belmont, CA, USA): 390 - 395 y 234 - 243. MacNeil, S., Munro, D. S., Metcalfe, R., Cotterell, S., Ruban, L. Davies, R. and Weetman, A. P. 1994. An investigation of the ability of TSH and Graves’immunoglobulin G to increase intracellular calcium in human thyroid cells, Rat FRTL-5 thyroid cells and eukariotic cells transfected with the human TSH receptor. 3. Endocrinol. 143: 527 - 540. Madec, A. M., Clavel, S., Stefanutti, A. and Orgiazzi, J. 1988. Blocking anti - thyrotropin receptor antibodies desensitize cultured human thyroid cell. Endocrinol. 123: 2062 2066. Martínez-Galán, J. R., Pedraza, P., Santacana, M., Escobar del Rey, F., Monrreale de Escobar, G. and Ruiz-Marcos, A. 1997. Early effects of iodine deficiecy on radial glial cells of the hippocampus of the rat fetus. J. Clin. Invest. 99:2701-2709. Masini - Repiso, A. M., Cabanillas, A. M., Bonaterra, M. and Coleoni, Dissociation of thyrotropin - dependent enzime activities, reduced A. H. 1994. iodide transport, and preserved iodide organification in nontünctioning thyroid adenoma and multinodular goiter. J. Clin. Endocrinol. Metab. 79: 39 - 44. Mc Lean, W. H. 1. and Lane, E. B. 1995. Intermediate filaments in disease. Curr. Opin. Ce11 Biol. 7: 118 - 125. Medeiros - Neto, G., Heredotou, D. T., Rajan, S., Kommareddi, S., de Lacerda, L., Sandrini, R., Boguszewski, M. C. S., Hollenberg, A. N., Radovic, S. and Wondisford, F. E. 1996. A circulating, biologically inactive thyrotropin caused by mutation in the beta subunit gene. J. Clin. Invest. 97: 1250 - 1256. Meinkoth, J. L., Goldsmith, P. K., Spiegel, A. M., Feramisco, J. R. and Burrow, G. N. 1992. Inhibition of thyrotropin - induced DNA synthesis in thyroid follicular cells by microinjection of an antibody to the stimulatory G protein of adenilate cyclase, Gs. J. Biol. Chem. 267 (19): 13239 - 13245. Misrahi, M., Loosfelt, H., Atger, M., Sar, S., Guiochon-Mantel, A. and Milgrom, E. 1990. Cloning, secuencing and expression of human TSH receptor. Biochem. Biophys. Res. comm. 166 (1): 394 - 403. Moritz M., Braunfeld B. M., Sedat W. J., Bruce A. and Agard D. A. 1995. Microtubule nucleation by y - tubulin - containig rings in the centrosome. Nature. 378: 638 - 640. Morley, J. E. 198 1. Neuroendocrine control of thyrotropin secretion. Endocrine Rev. 2: 396 436. Morris, J. C., Gibson, J. L., Haas, E. J., Bergert, E. R., Dallas, J. S. and Prabhakar, B. S. 1994. Identification of epitopes and affinity purification of thyroid stimulating auto-antibodies using synthetic human TSH receptor peptides. Autoimmun. 17: 287-299. Muller, M. J. and Seitz, H. J. 1984a. Thyroid hormone action on intermediary metabolism. 1. respiration, thermogenesis and carbohydrate metabolism. II. Klin Wochenschr. 62: ll. Muller, M. J. and Seitz, H. J. 1984b. Thyroid hormone action on intermediary metabolism. II. lipid metabolism in hypo - hypertiroidism. Klin Wochenschr. 62:49. Murphy, C., Saffrich, R., Grummt, M., Gournier, H., Rybin, V., Rubino, M., Auvinen, P., Lutchke, Parton, R. G. and Zerial, M. 1996. Endosome dynamics regulated by a rho protein. Nature. 384 (5): 427 - 432. Nagayama, Y. and Rapoport, B. 1992. The thyrotropin receptor 25 years after its discovery: new insight afier its molecular cloning. Mal. Endocrinol. 16 (2): 145 - 156. O’Farrel, P. H. 1975. High resolution two dimensional electrophoresis of proteins. J. Biol. Chem. 250: 4007. Olmsted, J. B. 1981. Aff~nity purification of antibiotics from diazotized paper blots of heterogeneus protein samples. J. Biol. Chem. 256: 11955 - 11957. Oppenheimer, J. H. and Swartz, H. L. 1997. Molecular basis of thyroid hormone-dependent brain development. Endocrine Rev. 18 (4): 462 -475. Pankow, B. G., Micha& J., and McGee, M. K. 1985. Adult human thyroid weight. Health Phys. 49 (6): 1097-l 103. Patibandla, S. A., Seetharamaiah, G. S., Dallas, J. S., Thotakura, N. R., Peake, R. L. and Prabhakar, B. S. 1997. Differential reactivities of recombinant glycosylated ectodamains of mouse and human thyrotropin receptors with patient autoantibodies. Endocrinol. 138 (5): 1559-1566. Paul, S., Das, S., Poddar, R., and Sarkar, P. K. 1996. Role of thyroid hormone in the morphological differentiation and maturation of astrocytes: temporal correlation with syntesis and organization of actin. Eur. J. Neurosci. 8: 2361-2370. Phillips, D. 1. W., Barker, D. J. P. and Osmond, C. 1993. Infant feeding, fetal growth and adult thyroid function. A. Endocrinol. 129: 134 - 138. Pietrzik, C. U., HofIinann, J., Strober, K., Chen, Ch-Y., Bauer, C., otero, D. A. C., Roch, MR. and Herzog, V. 1998. From differentiation to proliferation: the secretory amyloid precursor protein as a local mediator of growth in thyroid epithelial cells. Proc. Natl. Atad. Sci. 95: 1770 - 1775. Poop, G. M., Graebert, K. S., Pietrik, C. U., Rosentreter, Lemansky, P. and Herzog, V. 1996. Growth regulation of rat thyrocytes (FRTLS cells) by the secreted ectodomain of pamyloid precursor-like proteins. Endocrinol. 137(5): 1975 - 1983. Portertield, S. P. and Hendrich, Ch. E. 1993. The role of thyroid hormones in prenatal and neonatal neurological developement - current perspectives. Endocrine Rev. 14: 94 106. Pourati, J., Maniotis, A., Spiegel, D., Schaffer, J. L., Butler, J. P., Fredberg, J. J., Ingber, D. E., Starnenovic, D. and Wang, N. 1998. 1s cytoskeletal tension a major determinant of ce11 deformability in adherent endothelial cells?. Am. J. Physiol. 274 (Ce11 Physiol. 43): Cl238 - C1289. Rapoport, B. 1976. Dog thyroid cells in monolayer tissue culture; adenosine 3’,5’ - cyclic monophosphate response to thyrotropic hormone. Endocrinol. 98 (5): 1189 - 1197. Ricketts, M.H., Simmons, M. J., Parma, J., Mercken, L., Dong, Q., Vassart, G. 1987. A nonsense mutation causes hereditary goitre in the afrikander altemative splicing of thyroglobulin transcripts. Proc. cattle and unmask Natl. Atad. Sci. U.S.A. 84: 3181- 3184. Roti, E., Minelli, R., Gardini, E. and Bravearan, L. E. 1993. The use and misuse of thyroid hormone. Endocrine Rev. 14 (4): 401- 423. Rumsey, T. S., Elsasser, T. H., and Kahl, S. 1997. Roasted soybeans and an estrogenic growth promoter affect the thyroid status of beef steers. J. Nutr. 127: 352-358. Rusch, A., Erway, L. C., Oliver, D., Vennstrom, B. and Forrest, D. 1998. Thyroid hormone receptor P-dependent expression of a potassium conductance in inner hair cells at the onset of hearing. Proc. Na& Atad. Sci. 95(26): 15758 - 15762. Salas, P. J. I., Rodríguez, M. L., Viciana, A. L., Vega - Salas, D. E. and Hauri H. P. 1997. The apical submembrane cytoskeleton participates on the organization of the apical pole in ephitelial cells. J. Cell Biol. 137 (2): 359 - 375. Salvatore, D., Tu, H., Harney, J. W. and Lamen, P. R. 1996. Type 2 iodothyronine deiodinase is highly expressed in human thyroid. J. Clin. Invest. 98 (4): 962 - 968. Santini, F. Hurd, R. E., Lee, B. and Chopra, 1. J. 1993. Thyromimetic effects of 35.3 ‘triiodothyronine sulfate in hypothy-roid rats. Endocrinol. 133 (1): 105 - 110. Sato, G. H. 1975. The Role of Serum in Ce11 Culture, Biochemical actions of hormones, Edited By Gerald Litwatck, Vol. III, Academic Presa, New York, 391 - 396. Sato, K., Yamasaki, K., Shizume, K., Kanaji, Y., Obara, T., Ohsumi, K., Demura, H.? Yamaguchi, S. and Shibuya, M. 1995. Stimulation by thyroid - stimulating hormone and Graves immunoglobulin G of vascular endothelial growth factor mRNA expression in human thyroid follicles in vitro and fit mRNA in the rat thyroid In vivo. J. Clin Invest. 96: 1295 - 1302. Schidt, A., and Hall, M. N. 1998. Signaling to the actin cytoskeleton. Annu. Rev. Ce11 Dev. Biol. 14: 305 - 338. Seetharamaiah, G. S. Wagle, N. M., Morris, J. C. and Prabhakar, B. S. 1995. Generation and characterization of monoclonal antibodies to the human thyrotropin (TSH) receptor: ~~- _-= --=- -antibod&r -carr&& -to discretem-eonformational or - hnneare#t.opesand...block TSH binding. Endocrinol. 136: 28 17 - 2824. Setharamaiah, G. S., Kurosky, A., Desai, R. K., Dallas, J. S., and Prabhakar, B. S. 1994. A recombinat extracellular domain of the thyrot.ropin(TSH) receptor binds TSH in the absence of membranes. Endocrinol. 134: 549 - 554. Shimon, I., Taylor, J. E., Dong, J. Z., Bitonte, R. A., Kim, S., Morgan, B., Coy, D. H., Culler, M. D. and Melmrd, S. 1997. Somatostatin receptor subtype specificity in human fetal pituitary cultures. J. Clin. Invest. 99 (4): 789 - 798. Shu, H. B. and Joshi, H. C. 1995. y - tubulin can both nucleate microtubule assembly and self - assemble into novel tubular structures in mammalian cells. J. Ce11 Biol.. 130 (5): 1137 - 1147. SIGMA. 1999. Reactivos y Productos Químicos. Use of trypan blue and the hemacytometer to determine total ce11 counts and viable ce11 number. 1885 - 1886. Silva, C. M., Weber, M. J. and Thorner, M. 0. 1993. Stimulation of tyrosine phosphorilation in human cells by activation of the growth hormone receptor. Endocrinol. 132: 101 108. Smerdely, P., Pitsiavas, V. and Boyages, S. 1993. Evidente that the inhibitory effects of iodide on thyroid ce¡1 proliferation are due to arrest of the cell cycle at GOGI and G2M phases. Endocrinol. 133: 2881- 2888. Sprang, R. S. 1997. G protein mechanisms: Insights from structural analysis. Annu. Rev. Biochem. 66: 639 - 78. Standards relating to the care and management of experimental animals. Experimental Animal Regulation (TEXAS). motification No. 6, march 27, 1980 of the Prime Minister Office].<http:/kayato.med.osaka-u.ac.iplindexl~uidelinform/regulation/stand~d.h~l~. [Consulta 2 1/05/99]. Studer, H. and Derwahl, M. 1995. Mechanism of nonneoplastic endocrine hyperplasia - a changing concept: a review focused on the thyroid gland. Endocrine Rev. 16 (4): 411 426. Su, Y., Shi, Y., Stolow, M. A. and Shi, Y-B. 1997. Thyroid hormone induces apoptosis in _ _,_ p.fiq-ary ._1’ q+l+qzs~ ef tadpole~-., intestine: cell._ type specificity and effects of extracelular .- ._i. __ = -- * r-=--m -- “.xmca~.~~__. _ _ matrix. J. Cell Biol. 139 (6): 1533 - 1543. Tang, K-T., Bravennan, L. E. and DeVito, W. J. 1994. Effects of fibroblast growth factor on type 15’-deiodinase in FRTL-5 rat thyroid cells. Endocrinol. 135: 493 - 500. Thyroid Disease and approach to diagnosis. Hanford thyroid disease study. A project of the Fred Hutchinson Cancer Research Center, Seattle, Washington. 1997. <http://www.fhere.org/science/phs/htds/4r!f-thdx.html> [Consulta 19/08/97]. Towbin, H., Staehelin, T. and Gordon, 5.1979. Electrophoretic transfer of proteins from polyacrilamide gels to nitrocellulose sheets: procedure and some applications. Proc. Natl. Atad. Sci. 76 (9): 4350 - 4354. Tramontano, D. and Ingbar, H. 1. 1986. Properties and regulation of the thyrotropin receptor in the FRTLS rat thyroid ce11 line. Endocrinol. 118: 1945 - 195 1. Tramontano, D., Rotella, M. C., Toccafondi and Ambesi - Impiombato, F. S. 1986. Thyrotropin - independent mutant clones form FRTLS rat thyroid cells: hormonal control mechanism in differentiated cells. Endocrinol. 118 (2): 862 - 868. Ullrich, N. and Sontheimer, H. 1997. Ce11 cycle - dependent expression of a glioma - specific chloride current: proposed link to cytoskeletal changes. Am. J. Physiol. 273 (Ce11 Physiol. 42): C 1290 - C 1297. Valente, W. A., Vitti, P., Kohn, L. D., Brandi, M. L., Rotella, C. M., Toccafondi, R., Tramontano, D., Aloj, S. M. and Ambesi- Impiombato, F. S. 1983. The relationship of growth and adenilate cyclase activity in cultured thyroid cells: separate bioeffects of thyrotropin. Endocrinol. 112 (1): 71 -79. Valente, W. A., Vitti, P., Rotella, C. M., Vaughan, M. M., Aloj, S. M. Grolhnan, E. F., Ambesi- Impiombato, F. S. and Kohn, L. D. 1983. Antibodies that promote thyroid growth. N. Eng. J. Med. 309: 1028 - 1034. Vitale, M., Illario, M., Di Matola, T., Casamassima, A., Fenzi, G., and Rossi, G. 1997. Integrin binding to inmovilized collagen and fibroconectin stimulates the proliferation of human thyroid cells in culture. Endocrinol. 138: 1642 - 1648. Vitale, M., Illario, M., Di Matola, T., Casasima, A., Fenzi, G. and Rossi G. 1997. Integrin binding to immobilized collagen and fibroconectin stimulates the proliferation of human thyroid cells in culture. Endocrinol. 138 (4): 1642 - 1648. Vlase, H., Matsuoka, N., Graves, P. N:, Magnusson, R. P. and Davies, T. F. 1997. Folding dependent binding of thyrotropin (TSH) and tsh receptor autoantibodies to the murine TSH receptor ectodomain. Endocrinol. 138: 1658 - 1666. Walker, R. A. and Sheetz, M. P. 1993. Cytoplasmic microtubule - associated motors. Annu. Rev. Biochem. 62: 429 - 45 1. Wang, N., Butler, J. P., Ingber, D. E. 1993. Mechanotransduction across the ce11 surface and through the cytoskeleton. Science. 260: 1124 - 1127. Weiss, S. J., Philp, N. J., Ambesi - Impiombato, F. S. and Grollman, E. F. 1984. Thyrotropin stimulated iodide transport mediated by adenosine 3”, 5”- monophosphate and dependent on protein syntesis. Endocrinol. 114 (4): 1099 - 1107. Weiss, R. E., Xu, J., Ning, G., Pohlenz, J., O’Malley, B. W. and Refetoff, S. 1999. Mice delicient in the steroid receptor co-activator 1 (SRC-1) are resistant to thyroid hormone. EMBO. 18: 1900 - 1904. Wikstrom, L., Johansson, C., Saltó, C., Barlow, C., Campos, B. A., Baas, F., Forrest, D., Thorén, P. and Vennstrom, B. 1998. Abnormal heart rate and body temperature in mice lacking thyroid hormone receptor al. EMBO. 17: 455 - 461. Williams, N. 1997. Thyroid Disease: A case of Cellular Suicide. Science. 275: 926. Wolf, M., Ingbar, S. H. and Moses, A. 1989. Thyroid hormone and growth hormone interact to regulate insulin-like growth factor - i messenger ribonucleic acid and circulating levels in the rat. Endocrinol. 125 (6): 2905 - 2914. Worthington Enzime Manual, Ce11 Isolation Techniques: Cell isolation theory. ~http://www.worthin~ton-biochem.com/m~ual/tissueDissociation/cellMeth.html~. [Consulta 05/07/99]. Worthington Manual, Cell Isolation Techniques: Methods and Materials. ~http://www.worthin~on-biochem.com/manual/tissueDissociation/cellMeth.html~. [Consulta 05/07/99]. Worthington Manual, Cell Isolation Techniques: Optimization. <http://www.worthingtonbiochem.com/manual/tissueDissociation/cellOpt.html~ Worthington Enzimes [Consulta 05/07/99]. Manual, Ce11 Isolation Techniques: Trypsin - Trypsinogen. *<http://www.worthington-biochem.com/manual/T/TRY.html> Worthington Manual, . [Consulta 05/07/99]. Cell Isolation Techniques: Collagenase. ~http://www.worthin~ton-biochem.com/manual/C/CLS.html~. [Consulta 05/07/99]. Worthington Manual, Cell Isolation Techniques: Tissue Dissociation Guide Glosary. C.html>. <http://www.worthin~ton-biocheln.conl/manual/tissueDissociationjglossarA [Consulta 05/07/99]. Yamamoto, K., Hirai, A., Ban, T., Saito, J., Tahara, T., Terano, T., Tamura, Y., Saito, Y. and Kitagawa, M. 1996. Thyrotropin induces Gl cyclin expression and accelerates Gl phase after insulin - like growt factor in stimulation in FRTLS cells. Endocrinol. 137 (5): 2036 - 2042. Yap, A. S. and Manley, S. 1993. Contact inhibition of cell spreading: a mechanism for the maintenance of thyroid cell aggregation in vitro. Exp. Ce11 Res. 208: 12 1 - 127. Yap, A. S. and Manley, S. 1994, Thyrotropin inhibits the intrinsic locomotility of thyroid cells organized as follicles in primary culture. Exp.Cell Res. 214: 408-417. Yap, A. S., Abel, K. C., Bourke, J. R. and Manley, S. W. 1992. Differential regulation of thyroid ce11 - cell and ce11 - substrate adhesion by thyrotropin. Exp. Cell Res, 202: 366 369. Yap, A. S., Armstrong, J. W., Cragoe Jr., E. J., Bourke, J. R., Huxham, G. J. and Manley, S. W. 1991. Regulation of thyroid follicular volume by bidirectional transepitelial ion transport. Mol. Ce11 Endocrinol. 82: Rl - R5. Yap, A. S., Bourke, J. R. and Manley S. W. 1987. Role of the ce11 - ce11 contact in the preservation of differentiation and response to thyrotropin in cultured porcine thyroid Cells. J. Endocr. 113: 223 - 229. Yap, A. S., Keast, J. R. and Manley, S. 1994. Thyroid ce11 spreading and focal adhesion formation depend upon protein tyrosine phosphorilation and actin microfilaments. Exp. Ce11 Res. 210: 306 - 314 Yap, A. S., Stevenson, B. R., Abel, K. C., Cragoe Jr., E. J. and Manley, S. W. 1995b. Microtubule integrity is necessary for the epithelial barrier function of cultured thyroid ce11 monolayers. Exp. Ce11 Res. 218: 540 - 550. Yap, A. S., Stevenson, B. R., Armstrong, J. W., Keast, J. R. and Manley, S. 1994. Thyroid epithelial morphogenesis in vitro: a role for bumetanide sensitive cl- secretion during folicular lumen development. Exp. Ce11 Res. 2 13: 3 19-326. Yap, A. S., Stevenson, B. R., Cooper, V. and Manley, S. W. 1997. Protein Thyrosine Phosphorilation Influentes Adhesive Junction Assembly and Follicular Organization of Cultured Thyroid Epithelial Cells. Endocrinology. 138: 23 15 - 2324. Yap, A. S., Stevenson, B. R., Keast, J. R. and Manley, S. 1995. Cadherin - mediated adhesion and apical membrane assembly define distinct steps during thyroid epithelial polarization and lumen formation. Endocrinol. 136 (10): 4672 - 4680. Yap, A. S., Stevenson, B. R., Waters, M. J., Keast, J. R. and Manley, S. 1995a. Vinculin localization and actin stress fibers differ in thyroid cells organized as monolayers or follicles. Ce11 Motil. Cytos. 32: 3 18 - 33 1. Yap. A. S., Armstrong, J. W., Cragoe Jr., E. J., Bourke, J. R., Huxham, G. J. and Manley, S. W. 1993. Activation of sodium transport mediates regulation of thyroid follicie volume in response to hypotonic media. Am. J. Physíol (Endocr. Metab. 27): E644 - E649. Youde, S. J., Mower, J., Moore, D. P. and Parkes, A. B. 1998. Stress protein expression ín primary and immortalízed cultures of human thyroid cells: a model system for the study of stress proteíns ín the pathogenesis of autoímmune 3(2): 89 - 93. dísease. Cell & Stress Chaperones