Capítulo 6 Estereoquímica II
Anuncio
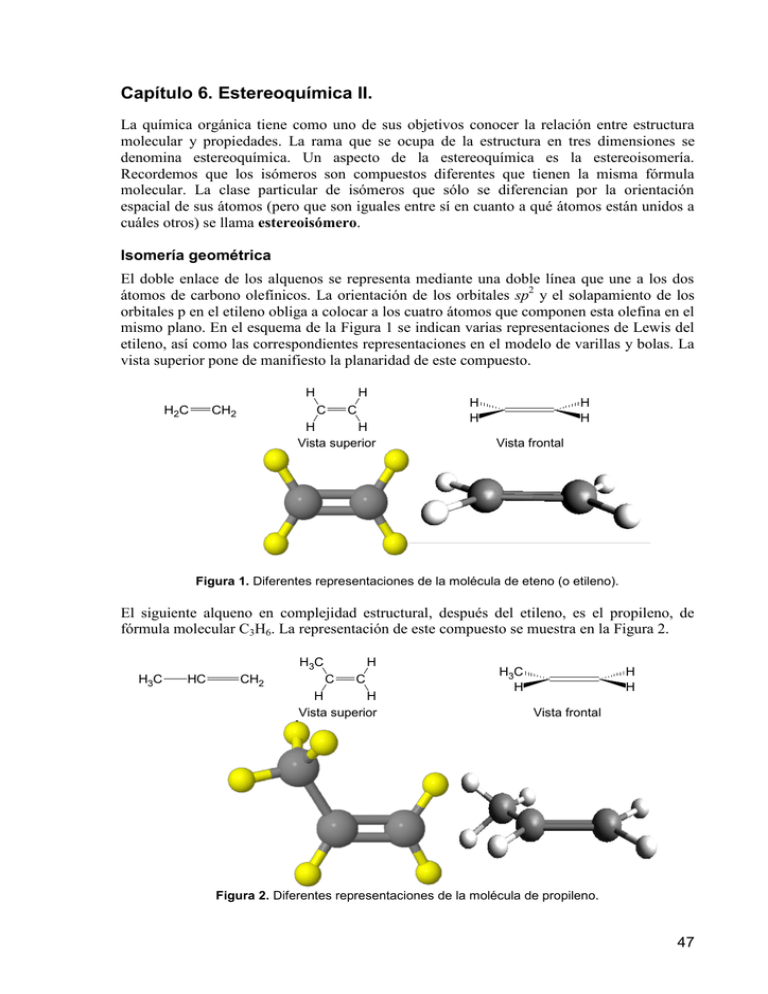
Capítulo 6. Estereoquímica II. La química orgánica tiene como uno de sus objetivos conocer la relación entre estructura molecular y propiedades. La rama que se ocupa de la estructura en tres dimensiones se denomina estereoquímica. Un aspecto de la estereoquímica es la estereoisomería. Recordemos que los isómeros son compuestos diferentes que tienen la misma fórmula molecular. La clase particular de isómeros que sólo se diferencian por la orientación espacial de sus átomos (pero que son iguales entre sí en cuanto a qué átomos están unidos a cuáles otros) se llama estereoisómero. Isomería geométrica El doble enlace de los alquenos se representa mediante una doble línea que une a los dos átomos de carbono olefínicos. La orientación de los orbitales sp2 y el solapamiento de los orbitales p en el etileno obliga a colocar a los cuatro átomos que componen esta olefina en el mismo plano. En el esquema de la Figura 1 se indican varias representaciones de Lewis del etileno, así como las correspondientes representaciones en el modelo de varillas y bolas. La vista superior pone de manifiesto la planaridad de este compuesto. H H2C CH2 H C C H H Vista superior H H H H Vista frontal Figura 1. Diferentes representaciones de la molécula de eteno (o etileno). El siguiente alqueno en complejidad estructural, después del etileno, es el propileno, de fórmula molecular C3H6. La representación de este compuesto se muestra en la Figura 2. H 3C H3C HC CH2 H C C H H Vista superior H3C H H H Vista frontal Figura 2. Diferentes representaciones de la molécula de propileno. 47 En la molécula de propileno los tres átomos de carbono y los tres átomos de hidrógeno unidos a los carbonos sp2 están contenidos en un plano, no así los tres átomos de hidrógeno del grupo metilo (CH3) que están enlazados a un carbono con hibridación sp3. El siguiente hidrocarburo olefínico es el de fórmula molecular C4H8. Con esta fórmula se pueden dibujar hasta un total de cuatro olefinas diferentes, que son las que se indican en la Figura 3. H2C CH CH2 CH3 1-buteno H3C CH3 H2C C CH3 2-metilpropeno CH3 C H H3C H C C H cis-2-buteno P. Eb. = 4 C P. F. = -139 C μ = 0,33 D C H CH3 trans-2-buteno P. Eb. = 1 C P.F. = -106 C μ = 0,00 D Figura 3. Estructuras químicas posibles para la fórmula molecular C4H8. Dos de los isómeros anteriores, los denominados cis-2-buteno y trans-2-buteno no son isómeros estructurales entre sí, puesto que ambos tienen la misma secuencia de átomos enlazados covalentemente. La diferencia entre ellos consiste en la posición relativa en la que se encuentran dispuestos los grupos metilo y los átomos de hidrógeno. Esta clase de isómeros, que se forman como consecuencia de la distinta orientación espacial de átomos o grupo de átomos alrededor de un enlace doble, se denominan isómeros geométricos. En el denominado cis-2-buteno los dos grupos metilo están del mismo lado del doble enlace, mientras que en el trans-2-buteno estos dos grupos metilo están situados en lados opuestos del doble enlace. cis-2-buteno trans-2-buteno Figura 4. Representaciones cis- y trans-2-buteno. ¿Cómo se explica la existencia de dos isómeros diferentes del 2-buteno? La respuesta reside en la rotación restringida a lo largo del doble enlace carbono-carbono. La energía de disociación del doble enlace C=C es aproximadamente de 146 kcal/mol y la energía de disociación de un enlace simple C−C es de 83 kcal/mol. Por tanto, la energía de disociación del enlace π debe ser de 63 kcal/mol. Los extremos de la molécula de 2-buteno no pueden torcerse entre sí, porque para ello se debería romper el enlace π. Por tanto, a diferencia de lo 48 que ocurre en los enlaces simples, en los enlaces dobles C=C no hay libre rotación. Como se ha apuntado antes, este es el origen de la isomería cis-trans. Nomenclatura de los isómeros geométricos El cis-2-buteno se denomina así porque los dos grupos iguales, como los dos grupos metilo (CH3), están del mismo lado del doble enlace. Por el contrario, en el trans-2-buteno los dos grupos iguales (CH3) están en lados opuestos del doble enlace. Por tanto, la configuración cis de los enlaces dobles se asigna en aquellos isómeros geométricos que contienen grupos iguales o similares del mismo lado del doble enlace y la denominación trans se aplica en aquellos isómeros geométricos que contienen grupos iguales o similares de lados opuestos del doble enlace. El problema de la nomenclatura cis/trans es que presenta muchas ambigüedades ya que muy a menudo se hace complicado elegir cuáles son los grupos iguales o similares situados en los carbonos olefínicos. Por ejemplo, no sería fácil asignar la configuración cis o trans de los dos isómeros geométricos del 1-bromo-1-fluoro-propeno (Figura 5). H H3C F I Br Br H H3C II F Figura 5. Isómeros geométricos del 1-bromo-1-fluoro-propeno Para evitar las ambigüedades que se producen en el sistema de nomenclatura cis/trans la I.U.P.A.C. ha propuesto un sistema de nomenclatura basado en las reglas de Cahn-IngoldPrelog, que establecen un orden de prioridad según el número atómico. Si el doble enlace presenta los dos grupos de mayor prioridad del mismo lado del plano de referencia se le asigna la configuración Z (del alemán zusammen). Si el doble enlace presenta los dos grupos de mayor prioridad de lados opuestos del plano de referencia se le asigna la configuración E (del alemán entgegen) (Figura 6). 2 2 1 2 H H H3C H H3C 1 CH3 1 Grupos principales del mismo lado: doble enlace Z H 2 CH3 1 Grupos principales de lados opuestos: doble enlace E Figura 6. Nomenclatura cis/trans. La asignación de prioridades se basa en el número atómico de los átomos directamente unidos a los carbonos sp2. En la Figura 7 se observa a modo de ejemplo la configuración E o Z de uno de los isómeros del 1-bromo-1-fluoro-propeno (Figura 7). 49 H3C F H Br Figura 7. 1-bromo-1-fluoro-propeno. 1. El carbono sp2 de la izquierda de la figura está unido a CH3 y a H. Como el C tiene mayor número atómico que el H se le asigna a este átomo, y por tanto al grupo CH3, la prioridad (Figura 8). 1 2 Figura 8. Importancia de los radicales unidos a uno de los carbonos. 2. El carbono sp2 de la derecha de la figura está unido a Br y a F. Como el Br tiene mayor número atómico que el F se le asigna a este átomo la prioridad (Figura 9). 2 1 Figura 9. Importancia de los radicales unidos al otro átomo de carbono. 3. Como los dos átomos o grupos de átomos prioritarios están de lados opuestos del doble enlace éste tiene configuración E (Figura 10). 1 1 Figura 10. (E)-1-bromo-1-fluoro-propeno. Aplicando las mismas reglas se puede ver como el estereoisómero II del 1- bromo-1-fluoropropeno es de configuración Z (Figura 11). 1 H F H3C Br 1 Figura 11. (Z)-1-bromo-1-fluoro-propeno. 50 Quiralidad: noción de centro estereoquímico. Nomenclatura R y S Enantiómeros El tipo de estereoisomería más interesante es el que da lugar a la actividad óptica. A principios de siglo XIX Biot señaló que algunas sustancias orgánicas de origen natural poseían la propiedad de girar el plano de la luz polarizada. Este fenómeno consiguió explicarse cuando los químicos comenzaron a considerar la disposición tridimensional de las moléculas en el espacio y la configuración tetraédrica del átomo de carbono. Las propiedades geométricas de un carbono con hibridación sp3 hacen que, en el caso de que esté unido a cuatro átomos o grupos de átomos diferentes, la molécula no tenga plano de simetría y que existan dos maneras diferentes de ordenar a los cuatro átomos o grupos de átomos. Estas dos ordenaciones o configuraciones generan dos formas isoméricas denominadas enantiómeros, que son imágenes especulares entre sí pero que no son superponibles. Cuando esto ocurre se dice que la molécula es quiral y ópticamente activa, puesto que es capaz de desviar el plano de la luz polarizada. Dos enantiómeros desvían el plano de la luz polarizada en la misma magnitud pero en sentidos opuestos. Al carbono con hibridación sp3 que está unido a cuatro átomos o grupos de átomos diferentes se le denomina estereocentro o centro estereogénico. En la Figura 12 se dibuja un compuesto de carbono con hibridación sp3 unido a cuatro grupos diferentes, representados por cuatro colores distintos. El reflejo de esta estructura genera su enantiómero. Carbono sp3 y su imagen especular Figura 12. Imagen especular de compuestos enantiómeros. En la Figura 13 se indican dos compuestos enantioméricos, cuyo estereocentro está unido a cuatro grupos diferentes simbolizados. Se puede observar en el dibujo la imposibilidad de superposición entre los enantiómeros.Cuando una molécula es superponible con su imagen especular se dice que no es ópticamente activa y por tanto es incapaz de desviar el plano de la luz polarizada. Normalmente esto ocurre cuando la molécula presenta un plano de simetría. La quiralidad no es una propiedad exclusiva de las moléculas orgánicas que contienen estereocentros. En la vida ordinaria se pueden encontrar objetos quirales, y por 51 tanto, no superponibles con su imagen especular, como la mano derecha y la mano izquierda, el pie derecho y el izquierdo, el zapato derecho y el izquierdo, etc (Figura 13). Objetos quirales: no tienen plano de simetría Imágenes especulares no superponibles Objetos aquirales: presentan plano de simetría Figura 13. Imágenes especulares. La Figura 14 muestra algunos ejemplos de enantiómeros. Los enantiómeros tienen propiedades físicas idénticas, exceptuando la dirección de rotación del plano de la luz polarizada; por ejemplo (ver Tabla 1), ambos 2-metil-1-butanoles tienen idénticos puntos de fusión y ebullición, densidades, índices de refracción y toda constante física que se pueda medir, excepto una: uno rota la luz polarizada en un plano a la derecha, y el otro, a la izquierda, hecho que no es sorprendente, puesto que las interacciones de ambos tipos de moléculas con sus compañeras deben ser las mismas. Solamente la dirección de la rotación es diferente; la magnitud es la misma, siendo la rotación específica de uno de ellos + 5.90º, y la del otro, por lo contrario, -5.90º. Al ser estas moléculas tan semejantes, resulta razonable que puedan rotar la luz la misma magnitud. Son imágenes especulares, como también lo son sus propiedades: la imagen especular de una rotación en el sentido de las manecillas de un reloj es una rotación contraría y de, exactamente, la misma magnitud. Uno de los isómeros, el (-)-2-metil-1-butanol es producto de procesos de fermentación. COOH H C OH COOH HO CH3 C H C2H5 HOH2C C CH3 I C SO3H Cl C CH2OH CH3 2-metil-1-butanol C2H5 H Cl H CH3 ácido láctico H H C2H5 C SO3H ácido cloroiodometanosulfónico I Cl C CH3 H C2H5 H C Cl CH3 cloruro de sec-butilo Figura 14. Representación de algunos enantiómeros. 52 Tabla 1. Propiedades físicas del (+)-2-metil-1-butanol y su enantiómero. (+)-2-metil-1-butanol (-)-2-metil-1-butanol (producto de fermentación) Rotación específica +5,90° -5,90° Punto de ebullición 128,9 °C 128,9 °C Densidad relativa 0,8193 0,8193 Índice de refracción 1,4107 1,4107 Nomenclatura de los isómeros configuracionales El sistema más aceptado para nombrar la configuración de un centro estereogénico es la denominada convención de Cahn, Ingold y Prelog, que asigna una letra R o S a cada centro estereogénico de una molécula quiral. Las reglas que hay que seguir para asignar una configuración R o S son las siguientes: 1º. Cada átomo unido al carbono estereogénico recibe un número 1, 2, 3 ó 4. El 1 se asigna al grupo de mayor prioridad y el 4 al de menor prioridad. La prioridad se establece según el número atómico: el átomo de mayor prioridad es el de mayor número atómico. 2º. Una vez asignado el orden de prioridad se mira el carbono estereogénico desde el lado opuesto al grupo de menor prioridad. Si el orden de prioridades decreciente de los restantes grupos representa una secuencia en el sentido de las agujas del reloj se asigna al estereocentro la configuración R (rectus, derecha). Si la secuencia gira en el sentido opuesto a las agujas del reloj la configuración del estereocentro es S (sinister, izquierda). A continuación se aplican estas reglas de prioridad para la asignación de las configuraciones de centros estereogénicos en una serie de compuestos quirales. Ejemplo 1: Asignación de la configuración R o S de los dos enantiómeros del 1-cloro-1fluoroetano. La representación tridimensional de los dos enantiómeros del 1-cloro-1fluoroetano es la de la Figura 15. F F C H H3C C Cl Cl H CH3 Figura 15. Configuración R o S de un enantiómero. Para asignar las configuraciones de estos dos compuestos se procede del siguiente modo: 1º. El orden de prioridad de los grupos unidos al carbono estereogénico en base al número atómico es, de mayor a menor, Cl > F > C > H. Por tanto, el orden de prioridad será Cl (1º), F (2º), C (3º) y H (4º). 2º. Una vez asignado el orden de prioridad hay que mirar al compuesto quiral desde el lado opuesto al que ocupa el último grupo en prioridad, tal y como se indica en la Figura 16. 53 2 2 F F 4 4 H H C C Cl Cl 1 1 Secuencia en sentido contrario a las agujas del reloj configuración S Secuencia en el sentido de las agujas del reloj configuración R 3 H3C 3 CH3 Figura 16. Forma de asignar la configuración de un compuesto. Resolución de mezclas racémicas Cuando la acetofenona se reduce con NaBH4 se genera una mezcla racémica de (R)-1-fenil1-etanol y (S)-1-fenil-1-etanol (Figura 17). O OH NaBH4 OH + Ph CH3 acetofenona Ph CH3 (R)-1-fenil-1-etanol 50% Ph CH3 (S)-1-fenil-1-etanol 50% Figura 17. Mezcla racémica de la reducción de la acetofenona. Si se necesitase uno de los dos enantiómeros en forma pura habría que separarlo de la mezcla racémica. La separación de enantiómeros de mezclas racémicas se denomina resolución. Hay diferentes procedimientos para la resolución de mezclas racémicas pero los más utilizados son la resolución química y la resolución cromatográfica. Diastereoisómeros Los estereoisómeros que no son imágenes especulares entre sí se denominan diastereoisómeros (Figura 18). [1] Centro que se mantiene igual en ambas moléculas [2] Centro que cambia (cloro e hidrógeno cambiados de posición) 54 Figura 18. Diastereoisómeros Se deben reconocer cuántos estereoisómeros pueden existir para compuestos cuyas moléculas contienen no un centro quiral, sino más de uno. Un ejemplo es el 2,3dicloropentano. Este compuesto contiene dos centros quirales, C-2 y C-3. (¿Cuáles son los cuatro grupos unidos a cada uno de estos átomos de carbono?) ¿Cuántos estereoisómeros son posibles? CH3CH2 CH Cl CH CH3 Cl 2,3-dicloropentano Figura 19. Molécula de 2,3-diclorometano. Los carbonos señalados representan centros quirales. Analizando las especies I y II (Figura 20) observamos que son imágenes especulares no superponibles, por lo tanto resultan enantiómeros. espejo CH3 CH3 H C Cl Cl C H Cl C H H C Cl C2H5 C2H5 I II Figura 20. Enantiómeros. Imágenes especulares no superponibles. Sin embargo, existen otros estereoisómeros del 2,3-dicloropentano. Podemos construir la estructura III, que resulta imposible de suponer a la I y a la II (Figura 21); desde luego, no es la imagen especular de ninguna de las dos. ¿Cuál es la relación entre III y I? ¿Entre III y II? Son estereoisómeros, pero no enantiómeros. Los estereoisómeros que no son imágenes especulares entre sí se denominan diastereómeros. El compuesto III es un diastereoisómero de I y también de II. 55 espejo CH3 CH3 H C Cl Cl C H H C Cl Cl C H C2H5 C2H5 III IV Figura 21. Enantiómeros. Imágenes especulares no superponibles. Empleando modelos, construimos su imagen especular, la estructura IV, y apreciamos que no es superponible (o interconvertible) con III, por lo que III y IV representan un segundo par de enantiómeros. Al igual que III, el compuesto IV es un diastereómero de I y II. Los diastereómeros tienen propiedades químicas similares, puesto que son miembros de la misma familia; sin embargo, esas propiedades no son idénticas. En la reacción de dos diastereómeros con una sustancia determinada, ni los dos conjuntos de reactivos ni los dos estados de transición son imágenes especulares. Los valores de las Energías de Activación serán diferentes, lo mismo que las velocidades de reacción. Los diastereómeros tiene propiedades físicas diferentes: Distintos puntos de fusión y de ebullición, solubilidades en un disolvente determinado, índices de refracción, etc. También difieren en la rotación específica: pueden tener igual o diferente signo de rotación, y algunos ser inactivos. Como consecuencia de sus diferencias en puntos de ebullición y solubilidad, al menos en principio, pueden separarse por destilación o cristalización fraccionadas; igualmente, debido a diferencias en forma molecular y polaridad, difieren en adsorción, por lo que pueden separarse por cromatografía. De este modo, la presencia de dos centros quirales puede conducir a la existencia de hasta 4 estereoisómeros. Para compuestos que tienen tres centros quirales podría haber hasta 8 estereoisómeros; para los que contienen cuatro, hasta 16, y así sucesivamente. El número máximo de estereoisómeros que pueden existir es igual a 2n, donde n corresponde al número de centros quirales. El azúcar (+)-glucosa es el carbohidrato más importante y abundante en la naturaleza, contiene 5 centros quirales, lo que da origen a 25 ó 32 estereoisómeros. 56