Alcanos bicíclicos
Anuncio

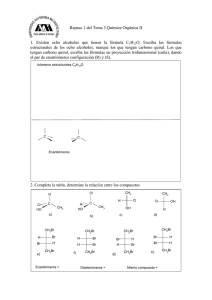
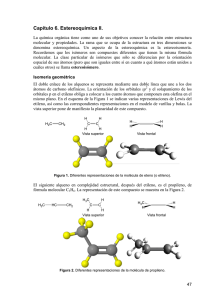
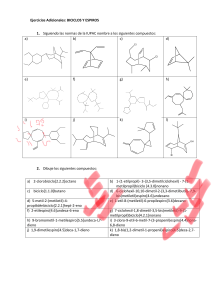
Alcanos bicíclicos biciclos puenteados biciclos f usionados espirocíclicos Carbonos cabezas de puente biciclo[4.4.0]decano (decalina) Espiro[4.4]nonano Biciclo[2.2.1]heptano (norbornano) Nomenclatura: nombre del alcano correspondiente al total de número de carbonos; prefijo: biciclo, y números separados por puntos y entre corchetes que dan cuenta del número de carbonos de cada ciclo, y los carbonos involucrados en el puente: 2 1 3 1 1 2 4 1 Puente de cero carbonos Biciclo[4.2.0]octano 1 2 3 2 Biciclo[3.2.1]octano Tipos de reacciones orgánicas rearreglos adición eliminación sustitución Clasificar las siguientes reacciones: a) CH3Br + KOH b) CH3CH2OH c) H2C=CH2 + H2 CH3OH + KBr H2C=CH2 + H2O CH3CH3 Estudio de las reacciones Se establece un mecanismo (descripción completa de pasos para pasar de reactivos a productos, mostrando la ruptura y formación de enlaces). Termodinámica. Constantes de equilibrio. Se consideran los cambios de energía que acompañan a las transformaciones químicas. A +B Keq = C +D [productos] = [reactivos] [C][D] [A][B] Cinética. Estudio de la velocidad de las reacciones. A +B C +D Velocidad = kr[A]a[B]b Kr = Ae-Ea/RT Ecuación de Arrhenius A= cte. (factor de frecuencia) Ea = energía de activación R= cte. de los gases T= temperatura absoluta (ºK) Keq >1 equilibrio favorecido a productos Keq <1 equilibrio favorecido a reactivos Energéticamente: G = energía libre de productos – energía libre de reactivos Relación entre G y Keq: Keq=e- G/RT Ea Reactividad de alcanos y cicloalcanos 1. Halogenación (reacción de sustitución) R' R R' C H + X2 calor o luz R R'' C X + HX R'' R,R',R'' = H ó grupo alquilo X=halógenos Reactividad: F2 >>Cl2>Br2>I2 125ºC hv CH3-H + Br2 CH3-Br + HBr bromometano (ó bromuro de metilo) Cl H H + Cl2 25ºC hv H + HCl clorociclohexano (ó cloruro de ciclohexilo) 42% Cl + + Cl2 Cl Cl + + 23% Cl 35% 0.51% Br + + Br2 Br Br + + Br 9.25% 90% Energías de disociación: H-Cl: 103 kcal H-Br: 88 kcal Halogenación del propano CH3CH2CH3 Porqué la bromación es más selectiva? Estados de transición Postulado de Hammond E Ea pequeña E Ea grande productos --------reactivos productos Coordenada de reacción Reacción exotérmica (rápida). Estado de transición () parecido a reactivos reactivos --------- Coordenada de reacción Reacción endotérmica (lenta). Estado de transición () parecido a productos Las especies que están más próximas en energía, también están más próximas en estructuras. 1.1. Halogenación a partir de cloruro de sulfurilo (SO2Cl2) Otra reacción por radicales libres O trazas de peróxido de benzoílo R-H + Cl S Cl R-Cl + SO2 + HCl 60-80ºC O CH3 CH3 CH3 Cl CH 3 H 3C SO2Cl 2 H2 C H 3C + CH 3 H 3C Cl CH 3 CH 3 38% CH 3 62% 2. Nitración (también por radicales libres) CH4 + HO-NO2 (HNO3) CH3-CH3 + HO-NO2 400-500ºC CH3-NO2 + H2O presión 400-500ºC CH3CH2-NO2 + CH3-NO2 + H2O presión 3. Combustión CH4 + 2O2 CO2 + 2H2O C5H12 exceso + 8 O2 C5H12 limitado + O2 C5H12 muy limitado C + H2O + O2 5 CO2 + 6 H2O CO + 6 H2O ISOMERÍA Los isómeros son compuestos diferentes con la misma fórmula molecular Isómeros Estereoisómeros Constitucionales (ó estructurales) Difieren en su secuencia de enlaces (conectividad) Solo se diferencian en la orientación de sus átomos en el espacio; sus átomos están enlazados en el mismo orden. Isómeros geométricos (involucra dobles enlaces) Isómeros ópticos (carbonos con 4 sustituyentes diferentes) Estereoquímica La estereoquímica se ocupa del estudio de las molécula en tres dimensiones. Estereoisómeros: isómeros con la misma secuencia de enlaces, pero diferente orientación de algunos átomos en el espacio. Quiralidad. Es la propiedad de algunas moléculas de ser imágenes especulares no superponibles (no son indénticas). Objeto quiral Objeto aquiral Otros ejemplos de objetos quirales: Coche inglés Coche americano Las moléculas que son imágenes especulares no superponibles se conocen como ENANTIÓMEROS. La causa principal de la quiralidad es la presencia de un átomo de carbono enlazado a cuatro grupos diferentes. A ese tipo de átomos de carbono se les llama carbonos asimétricos ó carbonos quirales (se denotan a menudo con un *). 2-bromobutano Los enantiómeros son moléculas diferentes A Carbono quiral (asimétrico ó estereogénico) C D B C CH 3 * 3,3-dietilpentano Cl * * CH 3 3-cloro-4,5-dimetilnonano Ph OH * * Ph CH 3 * 3-metil-5,6-dif enil-1-hexanol Prueba de asimetría A No es posible definir un plano de simetría tal que los átomos de un lado sean los mismos a los del otro lado. C D B Buscar un plano de simetría para: Cl C Cl A H C Cl D B C Cl H H Cl Br Cl Br enantiómeros C 3 H7 Me Me Me Me C3 H 7 Ejercicio: Dibujar ambos enantiómeros del 3-bromo-3-metilheptano Me Me molécula aquiral C 4 H9 Me Me C4 H 9 H H enantiómeros C 4 H9 C3 H 7 C 3 H7 C4 H 9 No es un plano de simetría porque no hay correspondencia entre átomos. Entonces, son enantiómeros. Cl H H Cl H Cl Cl H De manera generalizada, se puede proponer el siguiente principio: Cualquier molécula que tenga un plano de simetría especular no puede ser quiral, incluso en presencia de carbonos asimétricos. Pero, OJO !!, el hecho de no encontrar un plano de simetría no necesariamente implica que la molécula es quiral. Cl Br Br Cl Br Cl Cl Br Nomenclatura (R) y (S) de carbonos asimétricos (Cahn-Ingold-Prelog) NH 2 O H3 C C H COOH C C * Alanina H 3C O HO OH * H H2 N H NH 2 CH3 alanina no natural alanina natural Pasos: 1. Se asigna una prioridad a cada grupo enlazado al carbono asimétrico (1: prioridad más alta y 4: prioridad más baja). Los átomos con números atómicos más altos, tienen las prioridades más altas. Ejemplo: Los cuatro sustituyentes son: H, CH3, NH2 y F No. Atómico: Prioridad: Ejemplo de priorización: 1 4 6 3 7 2 9 1 I>Br>Cl>S>F>O>N>13C>12C>Li>3H>2H>1H En el caso de que los átomos sean iguales (OJO, no los grupos), se consideran los átomos que siguen en la cadena para asignar la prioridad. Ejemplo: CH 3 CH 2CH3 C H CH2CH2Br CH3 Mayor prioridad etilo isopropilo Mayor prioridad H H Cl Br > H CH 3 CH 2Br CH 3 > Cl CH 3 > CH 3 H -CH2CH2CH2CH3 > Los dobles y triples enlaces se consideran como enlaces por separado. Un doble enlace “se duplica”, y un triple enlace “se triplica” H H H C C C C H R C R C H H Se rompe y se duplica el enlace H H H H R R C C R C N N C Se rompe y se duplica el enlace N C H R C C C C C C H Se rompe y se triplica el enlace 2. Utilizando alguna representación molecular tridimensional, se orienta el grupo con prioridad 4 (más baja) hacia atrás. Se traza entonces una flecha curva, empezando por el grupo con mayor prioridad, dirigiendo la flecha a los grupos de menor prioridad (2 y 3). Si la flecha va en dirección a las manecillas del reloj, el átomo de carbono asimétrico se denota como (R), del latín rectus ( a la derecha). Si la flecha va en dirección contraria a las manecillas del reloj, el átomo de carbono asimétrico se denota como (S), del latín sinister ( izquierda). 1 1 2 4 conf iguración (R) 4 3 3 2 rotación 1 1 2 3 4 2 rotación 4 3 conf iguración (S) Proyecciones de Fisher Emil Fisher (Alemania; 1825-1919) Cl Cl Cl H CH 3 H CH3 CH2 CH3 CH 2CH3 enantiómero Definición: Línea horizontal: proyección hacia adelante. Línea vertical: proyección hacia atrás. Proyección de Fisher Cambiando cualquiera de los dos grupos en la línea horizontal ó vertical, se genera el enantiómero correspondiente. Ejercicio: Dibujar la estructura del 3bromohexano, y su enantiómero, usando proyección de Fisher. Cl H Cl CH3 CH2 CH3 H3 C H CH2 CH 3 Asignación (R) ó (S) en proyecciones de Fisher En la proyección de Fisher, la cadena de carbonos está en la línea vertical, y el átomo de hidrógeno (de menor prioridad) está en la línea horizontal (hacia enfrente). Una vez asignadas las prioridades, se apunta la flecha curva hacia los grupos 1, 2 y 3, y dado que el hidrógeno se encuentra hacia adelante, mentalmente se asigna el sentido contrario para determinar la configuración (R) ó (S), según sea el caso. ejercicio