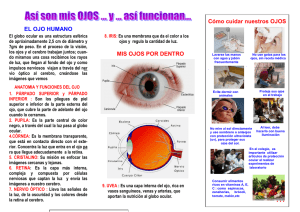
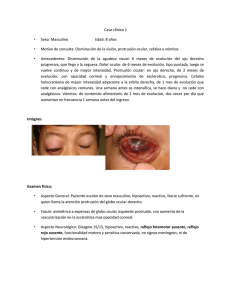
UNIVERSIDAD VERACRUZANA
Anuncio

UNIVERSIDAD VERACRUZANA FACULTAD DE MEDICINA VETERINARIA Y ZOOTECNIA “EXAMEN OFTALMOLÓGICO, PROCEDIMIENTOS DIAGNÓSTICOS Y TRATAMIENTO DE ENFERMEDADES MÁS RECURRENTES EN PERROS” TRABAJO RECEPCIONAL EN LA MODALIDAD DE: MONOGRAFIA COMO REQUISITO PARCIAL PARA OBTENER EL TÍTULO DE MÉDICO VETERINARIO ZOOTECNISTA PRESENTA: ARELY GÓMEZ CRUZ ASESORES: M.V.Z. ESP. PAULINA REYES VILLANUEVA VERACRUZ, VER. FEBRERO 2011 INDICE GENERAL ÍNDICE DE CUADROS .................................................................................................. v ÍNDICE DE FIGURAS ................................................................................................... vi AGRADECIMIENTOS ................................................................................................. viii DEDICATORIA............................................................................................................... ix RESUMEN ....................................................................................................................... x 1. INTRODUCCIÓN ........................................................................................................ 1 2. ANTECEDENTES....................................................................................................... 3 3. JUSTIFICACIÓN......................................................................................................... 7 4. OBJETIVOS ................................................................................................................ 8 4.1. OBJETIVO GENERAL............................................................................................ 8 4.2. OBJETIVOS ESPECÍFICOS .................................................................................. 8 5. METODOLOGIA ......................................................................................................... 9 6. ANATOMÍA DEL OJO ............................................................................................. 10 7. EXPLORACIÓN OFTALMOLÓGICA ..................................................................... 15 8. EVALUACIÓN Y MÉTODOS DIAGNÓSTICOS .................................................... 17 8.1. EXAMEN NEUROLOGICO .................................................................................. 17 8.1.1. RESPUESTA A LA AMENAZA ........................................................................ 17 8.1.2. REFLEJO PALPEBRAL ................................................................................... 17 8.1.3. REFLEJOS FOTOMOTORES PUPILARES ................................................... 18 8.1.4. REFLEJO DE DESLUMBRAMIENTO ............................................................. 18 8.1.5. RESPUESTA DE SEGUIMIENTO .................................................................... 18 ii 8.1.6. PRUEBA DE LABERINTO ............................................................................... 19 8.2. OFTALMOSCOPIA ............................................................................................... 20 8.2.1. OFTALMOSCOPIA DIRECTA .......................................................................... 20 8.2.2. OFTALMOSCOPIA INDIRECTA ...................................................................... 21 8.3. TEST DE SCHIRMER ........................................................................................... 21 8.4. COLORANTES OFTÁLMICOS ........................................................................... 22 8.4.1. FLUORESCEÍNA ............................................................................................... 22 8.5. TONOMETRÍA ....................................................................................................... 23 8.5.1. TONOMETRÍA DIGITAL ................................................................................... 23 8.5.2. TONÓMETRO DE SCHIÖTZ ............................................................................ 23 8.6. GONIOSCOPÍA ..................................................................................................... 24 8.7. PRUEBAS DE LABORATORIO ......................................................................... 25 8.7.1. FROTIS................................................................................................................ 25 8.7.2. LA CITOLOGÍA DE IMPRESIÓN ..................................................................... 25 8.8. PROCEDIMIENTOS RADIOGRÁFICOS (RAYOS X) ....................................... 25 8.9. ULTRASONOGRAFÍA .......................................................................................... 26 9. PATOLOGÍAS ........................................................................................................... 27 9.1. PÁRPADOS ........................................................................................................... 27 9.1.1. BLEFARITIS ....................................................................................................... 27 9.1.2. ENTROPIÓN ....................................................................................................... 33 9.1.3. ECTROPIÓN ....................................................................................................... 36 9.2. CONJUNTIVA ........................................................................................................ 39 9.2.1. CONJUNTIVITIS AGUDA CANINA ................................................................. 39 9.3. CÓRNEA ................................................................................................................ 42 iii 9.3.1. ÚLCERA CORNEAL.......................................................................................... 42 9.3.2. QUERATOCONJUNTIVITIS SECA (QCS) ..................................................... 46 9.4. CRISTALINO ......................................................................................................... 49 9.4.1. CATARATA ........................................................................................................ 49 9.4.2. CATARATA DIABÉTICA EN EL PERRO ....................................................... 51 9.4.3. ESCLEROSIS NUCLEAR ................................................................................. 53 9.5. ÓRBITA Y GLOBO OCULAR .............................................................................. 54 9.5.1. PROPTOSIS ....................................................................................................... 54 9.6. ÚVEA ...................................................................................................................... 57 9.6.1. UVEÍTIS ............................................................................................................... 57 9.6.2. HIPEMA ............................................................................................................... 61 9.6.3. GLAUCOMA ....................................................................................................... 63 10. CONCLUSIÓN ........................................................................................................ 68 11. RECOMENDACIONES .......................................................................................... 69 12. BIBLIOGRAFÍA ...................................................................................................... 70 13. GLOSARIO ............................................................................................................. 76 iv ÍNDICE DE CUADROS Cuadro 1. Causas de Blefaritis.(Donaldson, 2000; Donohue, 1995; Scott, 2001)..28 Cuadro 2. Diagnostico diferencial (Esteban, 2007)…………………………………..59 v ÍNDICE DE FIGURAS Figura 1. Anatomía macroscópica de la sección transversal del ojo de un animal doméstico (Radostits, 2002). ............................................................................. 10 Figura 2. Reflejo a la amenaza (Radostits, 2002). ................................................ 17 Figura 3. Prueba para la evaluación del reflejo palpebral (Radostits, 2002). ........ 17 Figura 4. Se ilumina con luz intensa (izquierda) y el reflejo................................... 18 Figura 5. Prueba de tirar una bola de algodón (Radostits, 2002). ......................... 19 Figura 6. Prueba de sorteo de obstáculos (Radostits, 2002)................................. 19 Figura 7. Óptica para oftalmoscopia directa, A: fuente de luz, B: espejo o prisma; C: ojo del animal; D: imagen (Gelatt, 2003). ..................................................... 20 Figura 8. Oftalmoscopia indirecta utilizando un oftalmoscopio binocular indirecto de cabeza. El clínico está situado a un brazo de distancia del perro, mientras dirige una luz a través de la lente de exploración y la pupila (Radostits, 2002)........... 21 Figura 9. Se coloca una tira de Schirmer en la zona media del fórnix conjuntival inferior de un perro y se deja durante 1 minuto para que estimule y absorba las lágrimas reflejas (Radostits, 2002)..................................................................... 22 Figura 10. Tonómetro de Shiötz. Obsérvese (a) la placa de recepción de la córnea, (b) el émbolo de indentación, (c) las asas de sujeción para el clínico, (d) la placa de peso de 5,5 g. (e) el peso de 7.5 g. (f) el peso de 10 g y (g) la escala de Schiötz (Radostits, 2002). .................................................................................. 24 Figura 11. Blefaritis en un Spaniel macho. (Turner, 2010). ................................... 27 Figura 12. Rottweiler macho de 15 meses con entropión palpebral inferior (Turner, 2010).................................................................................................................. 33 vi Figura 13. Diagrama esquemático de un entropión palpebral inferior con involución cantal lateral (Turner, 2010)............................................................................... 34 Figura 14. Ojo derecho de un retriever con ectropión (Turner, 2010). .................. 36 Figura 15. Corte transversal de la cornea normal (Turner, 2010) .......................... 42 Figura 16. Ulcera superficial y ulcera profunda (Turner, 2010) ............................ 42 Figura 17. Queratoconjuntivitis seca en un cocker spaniel con secreción mucopurulenta abundante y blefatiris cantal medial. ......................................... 46 Figura 18. Catarata súbita en un perro diabético (Turner, 2010). .......................... 51 Figura 19. Diagrama de proptosis del globo ocular (Turner, 2010) ....................... 54 Figura 20. Hipema total en un west Highland White terrier ................................... 61 Figura 21. Basset Hound con glaucoma bilateral (Gelatt, 2003). .......................... 63 vii AGRADECIMIENTOS A cada uno de mis profesores que contribuyeron a mi desarrollo profesional durante mi carrera, sin su ayuda y conocimientos no estaría en donde me encuentro ahora. MVZ. PhD. Rubén Loeza Limón, MVZ. Miguel Ángel Leano Ortiz, MVZ MSc Arturo Moreno Loyo y MVZ MC. Sergio Muñoz Melgarejo, gracias por ser buenos maestros y saber escuchar a sus alumnos. Gracias a mi asesora, M.V.Z. Esp. Paulina Reyes Villanueva por permitirme ser parte de su grupo de trabajo además de su infinita paciencia, consejos y opiniones. A todos mis amigos que estuvieron conmigo por hacer de mi estancia en esta escuela algo inolvidable. viii DEDICATORIA A mis padres Irma Cruz Córdova y José C. Gómez Hernández, por su amor, apoyo incondicional y por darme el regalo ideal, mi educación. Con mucho cariño a mis hermanos Carlos y Pepé, por su compañía durante todos estos años de mi vida. A mis sobrinas Sarah y Ximena que con risas e inocencia han llenado de alegría nuestro hogar. Le dedico este trabajo a cada uno de los integrantes de mi familia, en especial a mi tía Rosalba y a mis abuelitos. ix RESUMEN Gómez Cruz Arely. 2011. Examen oftalmológico, procedimientos diagnósticos y tratamiento de enfermedades más recurrentes en perros. Monografía de licenciatura. Facultad de Medicina veterinaria y Zootecnia, Universidad Veracruzana. Veracruz, Ver. Asesor: MVZ Esp. Paulina Reyes Villanueva. El examen oftalmológico se debe apropiadamente al paciente, realizar para valorar y tratar es obligado conocer con precisión la anatomía ocular, además de contar con un equipo oftálmico básico para la exploración de este. El conocimiento y comprensión de diversas técnicas y procedimientos no invasivos facilitan la identificación diagnostica de numerosas enfermedades oculares además de un historia médica completa y detallada para establecer un diagnostico clínico y así planear un tratamiento adecuado para el paciente. x INTRODUCCIÓN Los problemas oftalmológicos se presentan con relativa frecuencia en nuestros pacientes, es por ello que un examen oftalmológico puede ayudar a establecer un diagnóstico rápido y exacto de numerosas enfermedades oftalmológicas y sistémicas. Las quejas más habituales incluyen pérdida de visión, malestar o secreción ocular y/o cambios en el aspecto del ojo (Morgan, 2004). Un examen oftalmológico, diagnóstico o tratamiento incorrecto puede poner en peligro un sentido especialmente importante en todas las especies de los animales, conduciendo a un cuadro doloroso e incluso ocurrir la pérdida del ojo, esto se puede evitar con solo saber el correcto abordaje del paciente. Es necesario realizar una exploración ocular cuidadosa para establecer el grado de lesión (Gelatt, 2003). Siempre se deben examinar ambos ojos, aun cuando el ojo que no motivó la consulta se encuentra normal o parece estarlo (Barnett et al, 2003). Muchos procedimientos son no invasivos, el conocimiento y la comprensión completa de estas técnicas pueden facilitar la identificación diagnóstica de numerosas enfermedades oculares (Gelatt, 2003). Se debe tener en cuenta la opción de transferir el caso a un compañero más experimentado siempre que sea necesario. Este trabajo incluye imágenes, necesarias debido a que es claramente una especialidad visual, además de contener las enfermedades oculares más 1 frecuentes, proporcionando información precisa con el fin de ayudar de forma rápida y eficaz en la consulta diaria. Se espera que este trabajo ayude a los profesionales y estudiantes de medicina veterinaria a la hora de tratar los casos clínicos de esta rama de la medicina. 2 ANTECEDENTES Al investigar el aspecto histórico de la oftalmología veterinaria, impresionan los datos que se han acumulado en la disciplina. Apsyetus, un veterinario, estaba entre los autores de una publicación encontrada en "Hippiatrica" cerca de 1.000 años antes de Cristo, que se refería las enfermedades del ojo en perros y ganado. En Egipto antiguo se tenían referencias de enfermedades similares en la misma especie (Wyman, 2008). En el año de 1704, Méry logra ver el fondo del ojo de un gato al cual ahogó dentro del agua, observando el fondo del ojo fácilmente con la pupila midriática (Güemez, 2008). La revista Farrier publicó en 1818, 46 páginas relacionadas con la patología del ojo del caballo escrito por el Dr. J. Carver, cirujano veterinario y miembro de la Sociedad Médica Veterinaria Real de Londres. Este material fue dirigido hacia estudiantes de medicina y otros interesados en estudiar enfermedades. Carver propuso la "higiene" en la prevención de enfermedades oculares (Wyman, 2008). Leonardo Da Vinci hizo observaciones anatómicas y filosóficas, dado su interés en oftalmología comparativa. Él condujo muchas disecciones de cadáveres humanos y animales de los cuales concluyó que la visión de animales nocturnos era relacionada con el tamaño del ojo y el cerebro, puesto que el ojo más grande permitía que una pupila más grande viera mejor en la noche (Wyman, 2008). En 1823, se descubrió una poderosa herramienta para la examinación del fundus del ojo. Johannes Purkinje, fisiólogo checo, describió su experimento de oftalmoscopia. En palabras de Purkinje, "...cuando observé el ojo del pequeño 3 perro en cierta dirección, la luz parecía ser lanzada detrás, hasta que descubrí que la luz se reflejaba de la superficie hueca de la lente del ojo (Wyman, 2008). Urbain Leblanc, escribió su tratado de enfermedades del ojo visto en animales domésticos en 1824 (Wyman, 2008). En el año de 1847, Babagge, físico inglés, diseña un instrumento para observar el fondo del ojo, se los presenta a algunos oftalmólogos los cuales no valoraron el instrumento, por lo tanto no publica el desarrollo de su invento y este no se da a conocer (Güemez, 2008). El 6 de diciembre de 1850, ante la Sociedad de física de Berlín, Hermann von Helmholtz presenta el “augenspiegel”, aparato por medio del cual se puede ver el fondo del ojo, mismo que después se conocería mundialmente como oftalmoscopio (Güemez, 2008). La demanda de Austria a la fama fue limitada al Dr. José Bayer que era profesor de la cirugía en la universidad del veterinario de Viena. Él era médico y entonces graduado más adelante como veterinario en 1874. Él recogió centenares de ojos post mortem, y comenzó el museo oftalmológico, que se convirtió en famoso bajo dirección de Otto Uberreiter. Profesor Bayer influenció el establecimiento de la oftalmología veterinaria como disciplina en muchas escuelas veterinarias europeas (Wyman, 2008). Alemania era el primer país que dio a la disciplina un énfasis en veterinaria y medicina humana. Entre los líderes contemporáneos del tiempo estaba Rudolf Berlín que comenzó su carrera de enseñanza en oftalmología en la universidad veterinaria de Stuttgart en 1875 mientras que practicaba la oftalmología humana. 4 Él contribuyó avanzando en la ciencia a través de los diarios específicos de la oftalmología (Wyman, 2008). Mientras que la veterinaria general creció, también lo hicieron algunas las especialidades. La oftalmología era obligatoria en el plan de estudios de todas las escuelas veterinarias en Europa desde 1875 (Wyman, 2008). Profesor de la cirugía en la escuela veterinaria en Utrecht, W. C. Schimmel, primero que incorporó la oftalmología en su programa en 1882. Después de la muerte de Schimmel, el Dr. Heinrich Jakob asumió la enseñanza de la oftalmología animal pequeña y grande (Wyman, 2008). Eugene Nicolas era un veterinario militar que contribuyó importantemente con un texto publicado en 1914 oftalmología veterinaria y comparada (Güemez, 2008). En 1919 la oftalmología fue hecha una especialidad en Utrecht (Wyman, 2008). El Dr. George Coats, un cirujano humano en el hospital del ojo de Moorfields en Londres escribió docenas de papeles en anomalías congénitas de los ojos del animal. El Dr. Coats tenía un colega, el Dr. Edward Nettleship que era un veterinario que hizo más adelante oftalmólogo con una carrera británica distinguida. Él recogió una gran cantidad de ojos de animales para estudios y era co-autor de una monografía en albinismo en el hombre, que contuvo la información sobre enfermedades oculares en perros y seres humanos (Wyman, 2008). El Dr. Henry Gray estableció una de las primeras prácticas que se especializaron en animales pequeños. Él primero escribió sobre atrofia retiniana progresiva (ARP) en Setters irlandes. Su contribución importante a la oftalmología 5 veterinaria era su traducción de la oftalmología veterinaria comparativa del libro de Nicolas que era la única fuente de la información oftálmica para los veterinarios en países de habla inglesa durante la primera parte del vigésimo siglo (Wyman, 2008). Actualmente existen libros, manuales y revistas especializados en oftalmología veterinaria, muchos textos publicados incluyen apartados o capítulos referentes a esta especialidad, debido a la relevancia de este conocimiento e interés se han traducido a varios idiomas incluyendo el español. 6 JUSTIFICACIÓN Las patologías oftalmológicas son comunes en las pequeñas especies, esto constituyen un desafío para muchos clínicos, por ello la importancia de realizar esta compilación para el buen uso y mejoramiento de los diagnósticos que se efectúan en la práctica clínica. 7 OBJETIVOS OBJETIVO GENERAL Reunir información adecuada, actualizada y relevante acerca del examen oftalmológico, procedimientos diagnósticos y tratamiento de enfermedades oculares más recurrentes en la práctica clínica de pequeñas especies. OBJETIVOS ESPECÍFICOS Describir el Examen oftalmológico Explicar los procedimientos diagnósticos complementarios en el examen oftalmológico. Exponer las enfermedades frecuentes en la práctica clínica perros y el tratamiento para estas. 8 METODOLOGIA El presente trabajo se realizará a través de una selección de información relevante acerca del tema “Examen oftalmológico, procedimientos diagnósticos y tratamiento de enfermedades más recurrentes en perros”. Obteniendo la información de publicaciones recientes en Journals, páginas de internet y libros especializados de oftalmología veterinaria, medicina interna veterinaria y manuales clínicos. La consulta de la información se hará en diferentes bibliotecas como son: biblioteca de la FMVZ de la UV además de colecciones particulares disponibles. La recopilación de la información se llevará a cabo en el periodo de septiembre - diciembre del 2010. El trabajo se estructurará de la siguiente manera: repaso anatómico, examen oftalmológico, métodos diagnósticos, descripción de enfermedades, recomendaciones y conclusiones. 9 ANATOMÍA DEL OJO El ojo canino está compuesto por estructuras diversas, las cuales se encargan de la protección, acomodamiento, nutrición y percepción de la luz para poder enfocar la imagen de algún ente visual (Maggs et al, 2009). Figura 1. Anatomía macroscópica de la sección transversal del ojo de un animal doméstico (Radostits, 2002). Los párpados son pliegues dorsales y ventrales de piel tapizados en su cara interna por conjuntiva palpebral y forman la hendidura palpebral en la que se encuentra el globo ocular. Los parpados también contienen músculos lisos y estriados, así como una rica vascularización e inervación. El músculo más importante es el orbicular de los párpados (Turner, 2010). Las pestañas o 10 blefárides se ubican sobre la superficie exterior del margen palpebral superior y carecen de éstas en el margen palpebral inferior (Lau-Choleón, 2010). Los párpados poseen glándulas sudoríparas modificadas, llamadas glándulas de Moll, también poseen glándulas sebáceas rudimentarias que se abren en los folículos que producen pestañas, además los párpados contienen a las glándulas tarsales o meibomianas cuyas secreciones cumplen la función de formar la capa lipoide superficial de la película lacrimal precorneal y cubre los bordes palpebrales para evitar el derrame de las lágrimas. Los puntos lagrimales se ubican en la superficie interna de los párpados a unos 3 o 4 mm del canto medial (Gelatt, 2003). La conjuntiva es una membrana delgada mucosa y transparente que cubre las superficies internas de los párpados, superficie interna y externa de la membrana nictitante y la parte inferior del globo ocular adyacente al limbo. La conjuntiva está compuesta de dos porciones adyacentes que son: la conjuntiva palpebral que forma la capa más cercana a los párpados, la cual se extiende hacia el fórnix para luego continuar como conjuntiva bulbar sobre el globo ocular. La función principal de la conjuntiva es la protección del ojo (Lau-Choleón, 2010). Tercer párpado o membrana nictitante, es una estructura protectora móvil ubicada entre la córnea y el párpado inferior en la porción nasal del saco conjuntival inferior. El tercer párpado presenta tres partes: el esqueleto cartilaginoso, la glándula de la membrana nictitante y la cobertura conjuntival, responsable de la producción de aproximadamente 30 % de la película lagrimal acuosa (Slatter, 2004). 11 La córnea es una porción única de la túnica fibrosa externa del ojo: es transparente y desempeña una función principal de refracción, al tiempo que constituye una barrera física fuerte e impermeable entre el ojo y el entorno (Gelatt, 2003). Posee capas las cuales son: película lagrimal precorneal, epitelio y su membrana basal, estroma, membrana de Descemet y endotelio. La esclerótica es la porción más grande de la túnica fibrosa del ojo. Su función es la de dar forma y proteger los elementos más internos. Posee tres capas: la epiesclerótica, la esclerótica propia y la lámina fusca. La epiesclerótica es una membrana colagenosa e hipervascularizada, cuya función es unir la cápsula de Tenon a la esclerótica, la esclerótica propia está compuesta por fibras de colágeno y fibroblastos; la lámina fusca es la zona de transición entre la esclerótica y las capas externas de la úvea o túnica vascular (Maggs et al, 2009). La úvea forma la túnica vascular del ojo y cuenta con tres partes: el iris, el cuerpo ciliar y la coroides. El iris es la parte más externa del tracto uveal o túnica vascular. Divide el compartimiento ocular en cámaras anterior y posterior, las cuales se comunican a través de la pupila. El iris controla la cantidad de luz que ingresa al ojo mediante la modificación del tamaño pupilar. La reducción del tamaño pupilar también incremente el campo para los objetos cercanos y reduce las aberraciones ópticas (Slatter, 2004). El cuerpo ciliar se ubica detrás del iris y ambos toman el nombre de úvea anterior. Visto en una sección, el cuerpo ciliar es de forma triangular, un lado articula con la esclerótica, el otro lado está junto al cuerpo vítreo y la base da origen al iris y al ángulo iridocorneal. Cuando el musculo ciliar se contrae origina cambio en la forma del cristalino y su acomodamiento para la visión cercana, así como el aumento del drenaje del 12 humor acuoso. (Lau-Choleón, 2010). La coroides es un tejido muscular pigmentado que forma la parte posterior de la úvea. Externamente se une con el cuerpo ciliar y se ubica detrás de la retina y la esclerótica. La coroides es un tejido hipervascularizado, con sus capilares distribuidos en un solo estrato sobre la superficie interna que sirven para nutrir a las capas retínales externas (Maggs et al, 2009) El cristalino es un cuerpo biconvexo, avascular, transparente, con la superficie anterior más plana o de menos curvatura que la superficie posterior. Su función es enfocar una perfecta imagen sobre la retina (Slatter, 2004). Retina es una membrana delgada, delicada y transparente, la cual se conecta con la corteza visual a través del nervio óptico mediante el quiasma óptico, cintillas ópticas y el cuerpo geniculado lateral. Los fotorreceptores de la retina son una capa compleja de células especializadas: los bastones y conos, los cuales contienen fotopigmentos que producen energía química ante la exposición lumínica. Esta energía se convierte en energía eléctrica que es transmitida hasta la corteza visual para la interpretación de la visión (Gelatt, 2003). El cuerpo o humor vítreo ocupa casi tres cuartas partes del volumen ocular. El humor vítreo es un gel complejo formado por agua en un 99% y por fibrillas de colágeno, células hialocitos y mucopolisacáridos. Debido a su estructura simple y a la carencia de irrigación vascular y linfática, el nivel de reacción del cuerpo vítreo se limita a licuefacción en respuesta a muchos estímulos, cicatrización después de la inflamación de los tejidos circundantes y neovascularización a partir de una retina inflamada (Gelatt, 2003). 13 El humor acuoso es un líquido claro que carece de células y proteínas, el cual se forma por un proceso pasivo y por una secreción activa del epitelio que cubre el cuerpo ciliar. Este líquido da rigidez, volumen y forma al globo ocular. El flujo constante del humor acuso suple de nutrientes a la córnea avascular y al cristalino, también remueve los desechos metabólicos. El nivel de producción del humor acuoso debe ser igual a su nivel de salida, de manera que la presión intraocular se mantenga a un nivel relativamente constante y además mantenga los niveles de refracción de los ojos en posición normal. El grado de formación del humor acuso dentro del tejido estromal ciliar depende de la presión sanguínea arterial ciliar, que es igual a la presión intraocular y facilita el flujo hacia el capilar ciliar y la pared capilar. Su velocidad de producción en el perro es de 2 ml/min (Morgan, 2004). 14 EXPLORACIÓN OFTALMOLÓGICA Las partes básicas de la exploración oftalmológica, son (Turner, 2010): Anamnesis Inspección ocular Exploración intervencionista: -Test lagrimal de Schirmer. -Pruebas de visión y pruebas neurológicas. -Oftalmoscopia. Anamnesis Es la obtención de datos acerca de un paciente con el propósito de identificar los problemas actuales de salud. Es importante determinar (Radostits, 2002): La duración de los signos clínicos. La rapidez con la que ha aparecido la alteración Si la afección es uni o bilateral. Otra información adicional que puede ser útil incluye (Radostits, 2002): Si la alteración está mejorando o empeorando lenta o rápidamente Si el exudado o los cambio de color han aparecido a lo largo del tiempo Si el animal padece otras lesiones o enfermedades sistémicas Si el animal está siendo tratado Si existe una historia familiar de enfermedad ocular 15 Inspección ocular Es importante observar el comportamiento de las mascotas, junto con el aspecto macroscópico de los ojos y la cara (Turner, 2010). Exploración intervencionista Debe realizarse en una sala bien iluminada, sujetando la cabeza del animal, preferentemente con la ayuda de otra persona (Turner, 2010). La inspección de los ojos y cara se realiza con la iluminación proporcionada por una linterna de bolsillo. Entre los aspectos que deben determinarse se encuentran la presencia de cualquier tipo de secreción ocular, su naturaleza, uniteralidad o bilateridad, y la cantidad (Turner, 2010). Valorar: tamaño, posición y simetría de los ojos. En este momento de la exploración, en ciertos casos puede ser necesario obtener muestras para realizar análisis de laboratorio. Las muestras para realizar cultivos y aislamientos bacterianos deben obtenerse antes de limpiar las secreciones (Turner, 2010). 16 EVALUACIÓN Y MÉTODOS DIAGNÓSTICOS EXAMEN NEUROLOGICO RESPUESTA A LA AMENAZA Los gestos amenazadores harán que el animal parpadee y se aparte ligeramente. El reflejo estudia la vía visual (II par craneal) y la capacidad para cerrar los parpados (VII par craneal). El otro ojo puede taparse con la otra mano para estudiar cada ojo por separado (Turner, 2010). Figura 2. Reflejo a la amenaza (Radostits, 2002). REFLEJO PALPEBRAL La estimulación sensitiva del nervio trigémino (V par craneal) al tocar la piel del canto lateral y medial debe resultar en el cierre enérgico de los párpados (VII par craneal) (Turner, 2010). Figura 3. Prueba para la evaluación del reflejo palpebral (Radostits, 2002). 17 REFLEJOS FOTOMOTORES PUPILARES Para estudiar este reflejo se necesita una linterna de bolsillo con luz intensa. Tras dirigir la luz a un ojo, la respuesta normal consiste en el cierre pupilar rápido, lo que se conoce como reflejo directo. Mientras se ilumina el primer ojo también se debe prestar atención al ojo contralateral, en el que también debe producirse el cierre pupilar, lo que se conoce como reflejo consensual o indirecto (Turner, 2010). Figura 4. Se ilumina con luz intensa (izquierda) y el reflejo fotomotor indirecto (derecho) (Radostits, 2002). REFLEJO DE DESLUMBRAMIENTO Se necesita una fuente de luz, el animal parpadeará y en ocasiones se retirara, cuando la luz intensa es dirigida a un ojo cada vez. Se evalúa el II y VII par craneal (Turner, 2010). RESPUESTA DE SEGUIMIENTO Se utilizan pelotas de algodón, se dejan caer desde arriba de la cabeza del animal, deberán seguir la pelota de algodón mientras está cayendo (Turner, 2010). 18 Figura 5. Prueba de tirar una bola de algodón (Radostits, 2002). PRUEBA DE LABERINTO Se utiliza una habitación que el animal no conozca. Por la habitación se disponen aleatoriamente una mezcla de objetos sólidos. Se sujeta al animal en una esquina de la habitación, mientras que el dueño llama a su mascota desde el otro lado de la habitación. En condiciones normales los animales con vista se desplazan por la habitación con seguridad, mientras que los que sufren alteraciones visuales se desplazan con lentitud y de modo indeciso, pudiendo chocar contra los objetos (Turner, 2010). Figura 6. Prueba de sorteo de obstáculos (Radostits, 2002). 19 OFTALMOSCOPIA Técnica esencial en el examen oftalmológico mediante la cual se explora fundamentalmente el segmento posterior del ojo (fondo ocular, y las estructuras transparentes del mismo). Este sistema se basa en captar la luz que sale reflejada del fondo del ojo (Estaban, 2007). Existen dos tipos de oftalmoscopia: Oftalmoscopia directa Oftalmoscopia indirecta OFTALMOSCOPIA DIRECTA Se dirige un rayo de luz hacia el ojo del paciente, y el observador se coloca en la posición correcta para ver el haz reflejado y los detalles del interior ocular (Maggs, et al 2009). Posee un disco giratorio (disco Recoss) en el que van montadas unos lentes, los números indican la potencia, para este examen se necesita una habitación semiobscura. Empezamos a una distancia de unos 10-15 cm., nos vamos acercando hasta unos 2 cm. Podemos examinar la retina, vítreo, cristalino e iris (Esteban, 2007). Figura 7. Óptica para oftalmoscopia directa, A: fuente de luz, B: espejo o prisma; C: ojo del animal; D: imagen (Gelatt, 2003). 20 OFTALMOSCOPIA INDIRECTA Se basa en la emisión de un haz luminoso sobre el fondo de ojo del paciente, se interpone una potente lentilla convergente y se obtiene así, una imagen real e invertida de la retina del paciente (Esteban, 2007). Para la visualización adecuada del fondo de ojo, la pupila se dilata con una o dos gotas de atropina o tropicamida al 1% 15 a 20 minutos antes de la exploración. (Beránek, 2010). Figura 8. Oftalmoscopia indirecta utilizando un oftalmoscopio binocular indirecto de cabeza. El clínico está situado a un brazo de distancia del perro, mientras dirige una luz a través de la lente de exploración y la pupila (Radostits, 2002). TEST DE SCHIRMER Es un método semicuantitativo para medir la producción del componente acuoso de la película lagrimal precorneal en milímetros por minuto (Magg et al, 2009; Ford y Mazzaferro, 2007). Antes de abrir el paquete de la tira comercial, se debe doblar el extremo de la tira por la muesca (para evitar el sudor o grasa) (Ford y Mazzaferro, 2007). El extremo más corto se introduce en el centro del fondo de saco conjuntival ventral. La tira debe dejarse en esa posición durante 1 minuto antes quitarla, la lectura del nivel de humedecimiento debe realizarse 21 inmediatamente. Los valores normales en el perro son de 15 a 22 mm por minuto, los valores inferiores a 10 sugieren un déficit en la producción de lágrima (Turner, 2010). Cantidades mayores de 25 mm pueden ser normales o pueden tener como consecuencia una producción excesiva de lágrima o epifora (Ford y Mazzaferro, 2007). Figura 9. Se coloca una tira de Schirmer en la zona media del fórnix conjuntival inferior de un perro y se deja durante 1 minuto para que estimule y absorba las lágrimas reflejas (Radostits, 2002). COLORANTES OFTÁLMICOS FLUORESCEÍNA Es un colorante hidrosoluble de color naranja que tiñe de verde las úlceras cornéales. La córnea intacta es lipofilica, por lo que no permite la captación de fluoresceína, pero cuando existe una lesión epitelial el colorante se une al estroma expuesto (Turner, 2010). Aunque el estroma corneal expuesto en las úlceras se teñirá de verde intenso, las úlceras muy profundas pueden no teñirse; la membrana de Descemet 22 no capta el colorante (porque es rica en lípidos, como el epitelio). Por lo tanto, si se observa un patrón de tinción alrededor de borde pero con un centro claro, es probable que se trate de una úlcera muy profunda, que puede ser sumamente grave (Turner, 2010). TONOMETRÍA Esta es utilizada para el diagnóstico de presión intraocular, en la cual se valora la tensión de la capa más externa del ojo midiendo la impresibilidad o aplanamiento de la córnea (Ford y Mazzaferro, 2007). TONOMETRÍA DIGITAL Se realiza presionando el globo ocular alternativamente con los dedos índice, apreciando la mayor o menor dureza del globo ocular. Es un procedimiento inexacto y solamente orientativo en aquellos casos en que la presión intraocular (PIO) es muy elevada (Pérez, 2004). TONÓMETRO DE SCHIÖTZ Consta de una platina cóncava que apoya sobre la córnea. En el centro de la platina existe un orificio por el que asoma un émbolo que se mueve libremente dentro del cilindro que compone el cuerpo del tonómetro. El desplazamiento de este émbolo se transmite mediante una aguja a una escala numerada de 0 a 20 divisiones. El peso del émbolo es de 5,5 g, pudiendo aumentarse con pesas adicionales (7,5, 10 y 15 g). Para realizar la medición se sitúa al paciente en decúbito supino. Se instilan unas gotas de colirio anestésico y se coloca la base (platina) del tonómetro suavemente sobre la córnea. Se anota el desplazamiento 23 de la aguja sobre la escala y el peso utilizado. Se trasladan estos datos a las tablas de conversión, obteniéndose la cifra de PIO en mmHg. Pero esta técnica presentaba una serie de factores de error (Pérez, 2004). La tensión intraocular normal con el tonómetro de Shiötz en perros es de 15 a 25 mmHg (Ford y Mazzaferro, 2007). Figura 10. Tonómetro de Shiötz. Obsérvese (a) la placa de recepción de la córnea, (b) el émbolo de indentación, (c) las asas de sujeción para el clínico, (d) la placa de peso de 5,5 g. (e) el peso de 7.5 g. (f) el peso de 10 g y (g) la escala de Schiötz (Radostits, 2002). GONIOSCOPÍA Consiste en la exploración del ángulo iridocorneal o “de drenaje “(la unión entre el iris y la córnea). En el ojo normal los rayos de luz reflejados del ángulo de drenaje inciden sobre la córnea posterior y sufren una reflexión interna total como en un prisma. Este fenómeno se debe a la diferencia de índices de refracción entre la 24 córnea y el aire circundante y al gran ángulo de incidencia de los rayos de luz provenientes del ángulo de drenaje (Maggs et al, 2009). PRUEBAS DE LABORATORIO La obtención y el manejo de muestras de los ojos es una práctica común en la oftalmología veterinaria (Turner, 2010). FROTIS Los frotis se pueden obtenerse de la conjuntiva, córnea o las secreciones. Anestésicos tópicos no deben utilizarse, ya que contienen conservantes y pueden inhibir el crecimiento de bacterias o dañan las células mucosas (Beránek, 2003 ;Ford y Mazzaferro, 2007). Una torunda estéril se desliza con suavidad sobre la superficie adecuada. La muestra debe refrigerarse si existe retraso entre la recogida de la muestra y el proceso de la misma (Turner, 2010). LA CITOLOGÍA DE IMPRESIÓN Un portaobjetos seco se presiona con firmeza contra el tejido objeto de estudio, las células que se exfolien con facilidad quedarán adheridas al porta. La valoración en la consulta mediante tinción rápida de Gram puede ser útil para identificación de bacterias, hongos y estudiar los tipos celulares (Turner, 2010). PROCEDIMIENTOS RADIOGRÁFICOS (RAYOS X) La radiografía orbital permite la identificación de los cambios en la órbita y las cavidades paranasales. Es un método esencial para traumatología (Beránek, 2010). 25 ULTRASONOGRAFÍA Es un procedimiento diagnóstico no invasivo que permite la evaluación cualitativa y cuantitativa de diferentes anormalidades orbitales e intraoculares. Esta técnica resulta especialmente útil para examinar los aspectos posteriores del ojo o cuando está presente una opacificación corneal o del cristalino, así como para estudiar las enfermedades de la órbita (Gelatt, 2003). 26 PATOLOGÍAS PÁRPADOS BLEFARITIS Blefaritis o inflamación de los párpados (Morgan, 2004). Aparecen hinchados e hiperémicos y suele observarse exudado ocular sobre la piel (Radostits, 2002). Puede afectar a un solo párpado o ambos. La inflamación puede ser unilateral o bilateral, y a su vez focal o difusa (Esteban, 2007; Morgan, 2004). Figura 11. Blefaritis en un Spaniel macho. (Turner, 2010). 27 Etiología Cuadro 1. Causas de Blefaritis Parasitaria Demodex canis localizado Sarcoptes scabiei var. canis Onchocerca Fúngica Microsporum canis y M. gypseum Trichophyton mentagrophytes Malassezia Blatomicosis, criptococosis, histoplasmosis y aspergiliosis sistémicas. Bacteriana Foliculitis bacteriana(especies de Staphylococcus) Celulitis juvenil Cervicofacial Antinomyces viscosus Protozoaria Neosporosis Leishmaniosis Vírica Virus de moquillo canino 28 Inmunomediada Pénfigo ampolloso, foliáceo, vulgar. Lupus eritematoso discoide y sistémico Vitíligo Síndrome uveodermatológico Dermatomiositis Seborrea y foliculitis bacteriana Idiopática Blefaritis ulcerativa crónica del canto medial Dermatitis solar Dermatosis inducida por zinc Atopia Alérgica Alérgica alimentaria Otras Automutilación Erupción por fármacos Dermatosis inducida por zinc Linfoma epiteliotropo (Donaldson y Brightman,2000; Donohue y Day, 1995; Scott et al, 2001) 29 Fisiopatología En el caso de parásitos, hongos, bacterias y virus, el animal se expone al microorganismo y se establece una infección (Morgan, 2004). A menudo la producción de toxinas provoca una inflamación. Los animales más jóvenes presentan mayor predisposición (Scott et al, 2001). Signos Clínicos Prurito, eritema, hiperemia, epifora, blefarospasmo, edema, alopecia periocular, ulceraciones, exudados, escamas, costras y cicatrices (Esteban, 2007). La hiperemia o la alopecia periorbitaria pueden ser signos de autolesiones (Turner, 2010). Diagnóstico Los antecedentes, signos clínicos, administración simultánea de fármacos y la estacionalidad son muy importantes para orientar el diagnóstico. Tinción de las córneas con fluoresceína para descartar ulceración corneal. Exploración con la lámpara de Wood y cultivos fúngicos para descartar dermatofitos. Raspado de piel y la citología son especialmente importantes para identificar causas parasitarias (Morgan, 2004). En caso de blefaritis bacteriana o fúngica están indicados el cultivo y el antibiograma. La biopsia de piel seguida de su estudio histopatológico son útiles para confirmar las causas inmunomediadas, nutricionales, neoplásicas e idiopáticas de la blefaritis. Las pruebas intradérmicas, así como las de 30 alimentación, resultan de utilidad en el caso de animales atópicos o con alergias alimentarias (Morgan, 2004). Tratamiento Colocación de un collar isabelino para evitar los autotraumatismos (Peiffer, 2002). Blefaritis parasitaria: La mayoría de las demodicosis localizadas se resuelven de forma espontánea en 6-8 semanas. Los casos resistentes se tratan con dosis elevadas de ivermectina a 0.4-0.6 mg/kg V.O. 1 vez/día durante 1-3 meses. La aplicación de cloranfenicol y eserina por vía tópica ayudan a disminuir la población de ácaros. En caso de sarnas sarcópticas se pueden tratar de forma sistémica con ivermectina a 0.2-0.4 mg/kg S.C. 1 vez/semana durante 3 semanas (Morgan, 2004). Fúngica: Recortar el pelo. Aplicación de pomadas antifúngicas (miconazol). Tratamientos antifúngicos vía sistémica en el caso de enfermedades generalizadas (Morgan, 2004). Bacteriana: Antibioterapia vía sistémica según el cultivo y los resultados del antibiograma. Administración de lincomicina 20 mg/kg v.o. 2 veces/día o cefalexina 20 mg/kg v.o. 3 veces/día durante un mínimo de 3 semanas. Se pueden aplicar antibióticos 31 tópicos junto con hidrocortisona, 2 veces/día. En los casos de celulitis juvenil se administran corticosteroides sistémicos y antibióticos (Morgan, 2004). Vírica: Cuidados de soporte en el caso de animales con enfermedad sistémica, incluidos fluidoterapia mas antibióticos de amplio espectro. Pomada triple antibiótica vía tópica junto con hidrocortisona, 2-3 veces/día (Morgan, 2004). Inmunomediada: Pomadas tópicas de neomicina-polimixina B-dexametasona, 3-4 veces/día. Dosis inmunosupresoras de prednisona a 2-4 mg/kg, 1-2 veces/día que se disminuyen de forma progresiva en 3-4 semanas (Morgan, 2004). Idiopática: La leucotriquia periocular no necesita tratamiento. La blefaritis eosinofílica se trata con corticosteroides (dexametasona, prednisolona) por vía tópica y/o sistémica (Morgan, 2004). Alérgica: Retirada del alérgeno responsable, en caso de que se identifique. Antihistamínicos por vía sistémica (p. ej., hidroxicina 2,2 mg/kg v.o., 2-3 veces/día (Morgan, 2004). Nutricional: Conseguir un equilibrio nutricional adecuado. Administración complementaria de zinc por v.o. (Morgan, 2004). 32 Seguimiento: Los animales en tratamiento con corticosteroides (dexametasona, prednisolona) sobre todo con dosis inmunosupresoras, deben vigilarse de forma estrecha para evitar los efectos secundarios sistémicos de los mismos (Morgan, 2004). ENTROPIÓN Definición El entropión se define como la rotación interna de parte (o de toda la extensión) del margen del párpado, de tal manera que una porción de piel cubierta de pelo frota tanto la superficie corneal como la conjuntival (Gelatt, 2003). Figura 12. Rottweiler macho de 15 meses con entropión palpebral inferior (Turner, 2010). 33 Figura 13. Diagrama esquemático de un entropión palpebral inferior con involución cantal lateral (Turner, 2010). Etiología Se produce de forma relativamente frecuente en ciertas razas de perros como Shar pei, Chow chow, Rottweiler, Bulldog inglés, Mastín napolitano, Dogo de Burdeos, entre otras (Gelatt, 2003). Estas razas, por tener piel laxa y con mucha grasa subcutánea, es frecuente que los párpados sean muy flexibles y fácilmente se enrrollen provocando la fricción de las pestañas y pelo en cada parpadeo (Asteinza, 2010). El entropión se clasifica, ya sea como un defecto del desarrollo (entropión primario) y suele ser secundario a procesos dolorosos del ojo (e.j. úlceras corneales, triquiasis, queratitis, uveítis) por un incremento del tono del músculo orbicular que origina blefaroespasmo e inversión del párpado, consecuencia de traumatismos, de procesos inflamatorios crónicos de los párpados o de cirugías palpebrales. (Gelatt, 2003). 34 Signos clínicos El entropión puede producir lagrimeo, blefarospasmo (párpados cerrados por dolor), conjuntivitis, queratitis e incluso úlceras corneales o pérdida de visión por vascularización y pigmentación de la córnea en los casos más extremos. Diagnóstico Examen minucioso del párpado procediendo a la retracción manual para exponer el margen palpebral invertido. No debe utilizarse sedación ni anestesia general porque alteran la conformación del párpado (Barnett et al, 2003). Diagnóstico diferencial Distiquiasis, Triquiasis, cilios ectópicos, queratitis ulcerativa y ectropión (Morgan, 2004). Tratamiento Si es entropión primario, el tratamiento es quirúrgico y consiste en reparar la morfología de los párpados para corregir este defecto, se dan unos puntos de eversión del margen palpebral para evitar el daño corneal (Esteban, 2007). En entropión adquirido o secundario, se debe eliminar la existencia de causas primarias capaces de inducir el entropión. En algunos casos como traumatismos, procesos inflamatorios crónicos o cirugías palpebrales el tratamiento es igualmente quirúrgico. La técnica de Hotz-Celsus, consiste en eliminar tiras de piel y del músculo orbiculares oculi del parpado inferior (Gelatt, 2003). Técnica de blefaroplastia de 35 Stades consiste en eliminar un segmento de piel y la parte correspondiente del músculo orbicular en el párpado superior (Rodriguez, 2009). Prevención El entropión tiene un porcentaje de propensión a heredarse, es recomendable evitar la reproducción de ejemplares con este problema (Asteinza, 2010). ECTROPIÓN Definición El ectropión es el defecto que aparece cuando una parte (o todo) del párpado queda enrollada hacia fuera, de tal manera que el tejido conjuntival queda expuesto y puede aparecer un lagoftalmos. El párpado inferior es el que se ve afectado con mayor frecuencia (Gelatt, 2003). Figura 14. Ojo derecho de un retriever con ectropión (Turner, 2010). 36 Etiología Se clasifica como un defecto del desarrollo (ectropión primario) o como un defecto adquirido (ectropión secundario) (Gelatt, 2003). Es característico de los perros de raza San Bernardo, Bloodhound, Gran Danés, Terranova, Bull Mastiff y distintas razas del grupo de los Spaniel (Gelatt, 2003). El ectropión adquirido en cualquiera de los dos párpados puede ser resultado de un traumatismo, pérdida del tono del músculo orbicularis oculi, por la senilidad o por lesiones del nervio palpebral (Gelatt, 2003). Fisiopatología El ectropión puede tener (o no) un significado clínico evidente pero, en cualquier caso, la exposición de la conjuntiva puede favorecer la presentación de una conjuntivitis de bajo grado y predisponer al animal a la aparición de una epífora y una deficiencia en la película lagrimal (Gelatt, 2003). Signos clínicos Marcado párpado caído o más bajo. Ojos lloroso, inflamación o enrojecimiento en la conjuntiva. Diagnóstico Clínicamente evidente, se basa simplemente en la raza del perro, la historia y la presentación clínica. 37 Diagnóstico diferencial Conjuntivitis, entropión, distiquiasis, triquiasis y blefaritis (Esteban, 2007). Tratamiento En casos leves: limpieza continua con Ringer lactato y gasas, higiene facial profunda, regular y constante. Procedimientos quirúrgicos para corregir el ectropión: Técnica de Kunhnt-Hembolt esta técnica consiste en eliminar una porción triangular del pedículo tarsoconjuntival central (Gelatt, 2003). Técnica de Kuhnt-Szymanowski, en la cual la longitud del párpado inferior se reduce y se consigue un aumento de la estabilidad del canto lateral (Esteban, 2007). Técnica de Wharton-Jones en “V” a “Y”, consiste en hacer una incisión cutánea en “V” sobre la zona evertida, se elimina la porción cutánea y finalmente los bordes de la herida son cerrados creando una “Y” (Esteban, 2007; Gelatt, 2003). Ritidectomía, se realiza en perros con mucha piel en la cara y orejas péndulas, se hace una incisión cutánea en forma hexagonal de la región de la nuca, este tejido cutáneo se extirpa. En el posoperatorio se emplea antibióticos tópicos y sistémicos (gentamicina, cloranfenicol, neomicina), antiinflamatorios (dexametasona, prednisolona), y analgésicos (meloxicam). Los puntos se retiran en 10-15 días. 38 CONJUNTIVA CONJUNTIVITIS AGUDA CANINA Definición Inflamación de los tejidos conjuntivales (Morgan, 2004). Etiología Se clasifica en: Conjuntivitis primaria: vírica, bacteriana, alérgica, tóxica o química. Irritantes exógenos: polvo, arena, cuerpo extraño, humo, viento, polución ambiental general. Irritantes endógenos: queratoconjuntivitis seca, entropión, ectropión, anomalías de pestañas, triquiasis (Turner, 2010). Conjuntivitis secundaria: enfermedades de anexos, corneales, retrobulbares o sistémicas (Turner, 2010). Signos clínicos “Ojo rojo” inflamado repentinamente, con algo de secreción. La secreción inicialmente es serosa, pero puede volverse mucopurulenta en 1-2 días. Irritación o molestias que pueden variar de un blefaroespasmo leve a un cuadro grave de autolesiones y afectación palpebral o periorbitaria secundaria. El cuadro puede ser uni o bilateral (Turner, 2010). 39 Fisiopatología Cualquiera de las causas inespecíficas provoca vasodilatación, lo que produce edema e infiltración de células inflamatorias. Diagnóstico Buscar meticulosamente cualquier signo de otra enfermedad ocular, en los perros la conjuntivitis secundaria es más frecuente que la primaria. Realizar el test de Schirmer y tinción con fluoresceína (Turner, 2010). Citología, biopsia, identificación de microorganismos: cultivo e inmunofluorescencia (Morgan, 2004). Búsqueda de cuerpos extraños bajo la membrana nictitante y en el fondo del saco conjuntival ventral (Turner, 2010). Diagnóstico diferencial Uveítis, glaucoma, queratitis y escleritis. Tratamiento Bacterias Grampositivas: aplicación tópica 4 veces al día de antibióticos de amplio espectro (neomicina) (Morgan, 2004). Virus: Vidarabina, en pomada, 5-8 veces al día, disminuir la frecuencia a medida que los signos clínicos disminuyen (Morgan, 2004). Parásitos: Tratamiento sistémico especifico y esteroides tópicos, dexametasona 0.1% 2-4 veces al día (Morgan, 2004). 40 Atopia: determinación y eliminación de la causa, administración de esteroides tópicos (dexametasona, prednisolona) (Morgan, 2004). Conjuntivitis eosinofílica: administración de esteroides oftálmicos (dexametasona, prednisolona) (Morgan, 2004). Procesos irritantes: eliminar o tratar el agente causar, uso de esteroides tópicos (dexametasona, prednisolona) (Morgan, 2004). Traumatismos: uso de esteroides tópicos (dexametasona, prednisolona) (Morgan, 2004). Antiinflamatorios: Ketorolaco 0.5% 2-4 veces/día (Morgan, 2004). Antibiótico: Eritromicina 0.5% en pomada 3-4 veces al día, Bacitracina-neomicinagramicidina solución y pomada 3-4 veces al día (Morgan, 2004). 41 CÓRNEA ÚLCERA CORNEAL Es la perdida de continuidad de una o más capas de la córnea, con el consiguiente defecto tisular. En función de los estratos de la córnea dañados se dividen en (Esteban, 2007): Úlcera superficial Úlcera profunda Descemetocele Figura 15. Corte transversal de la cornea normal (Turner, 2010) Figura 16. Ulcera superficial y ulcera profunda (Turner, 2010) 42 Etiología Cuerpos extraños, sustancias irritantes (ácidos y álcalis), alteraciones anatómicas (entropión, cilios ectópicos), queratoconjuntivitis seca y afecciones virales o bacterianas (moquillo) (Esteban, 2007). Signos clínicos Blefarospasmo, epifora y fotofobia. Patogenia Úlcera superficial, afecta el epitelio y a veces las primeras capas del estroma, estas son muy dolorosas debido al mayor número de terminaciones nerviosas (Esteban, 2007). Úlcera profunda, se dañan más estratos del estroma corneal, reacción uveal (anillo periquerático y/o hipopión) (Esteban, 2007). Descemetocele, cuando la úlcera afecta a la totalidad del estroma corneal, protruye la membrana de Descemet, los pacientes tienen menos dolor debido a la casi inexistencia de terminaciones nerviosas en estas capas de la córnea (Esteban, 2007). Diagnóstico El diagnóstico es a través de la observación directa de la úlcera con el uso de fluoresceína (Morgan, 2004). 43 El Descemetocele se aprecia un “cráter”, el centro de la lesión no se tiñe de verde, la fluoresceína se fija solo al estroma corneal, se forma un “anillo” (Esteban, 2007). Tratamiento Úlcera superficial. El tratamiento es médico, se elimina la causa. Aplicar antibiótico, cloramfenicol o triple antibiótico: neomicina, bacitracina y polimixina B, cada 4-6 horas. Ciclopléjicos: atropina o tropicamida cada 2-3 horas al comienzo hasta producir midriasis, luego cada 8-12 horas (Esteban, 2007). Úlcera profunda. El tratamiento es quirúrgico (Gelatt, 2003): Colgajos en isla: se pueden crear a partir de la conjuntiva bulbar o la conjuntiva palpebral del párpado superior y deben ser un 10% mayores que la lesión corneal sobre la que se van a suturar. Colgajos pediculados: se crea a partir de la conjuntiva bulbar a partir del área lateral o dorsal del limbo. Colgajo pediculado tarsoconjuntival: se crea el pedículo con la base dirigida hacia el margen del párpado y se utiliza la disección cortante para separar la conjuntiva del músculo orbiculares oculi subyacente. Colgajos en puente. Se crea realizando dos incisiones paralelas en la conjuntiva bulbar dorsal, con la primera incisión cercana al limbo. Colgajos de avance (180°): se crea incidiendo la conjuntiva bulbar cerca del limbo y disecando la conjuntiva de la cápsula de Tenon subyacente, de forma caudal, dirigiéndose hacia el fórnix. 44 Colgajo conjuntival en 360°. Se puede crear realizando un peritomía conjuntival de 360°, la disección de la conjuntiva bulbar a partir de la cápsula de Tenon debe realizarse caudalmente desde el limbo, hasta que se haya movilizado una cantidad suficiente de conjuntiva como para cubrir completamente la córnea con una tensión mínima. Además debemos añadir antibiótico de amplio espectro (cloramfenicol y tobramicina), ciclopléjicos (atropina y tropicamida) y analgesia sistémica (buprenorfina) (Esteban, 2007). Descemetocele. El tratamiento es quirúrgico al igual que en úlceras profundas añadiendo el tratamiento médico descrito anteriormente (Esteban, 2007). 45 QUERATOCONJUNTIVITIS SECA (QCS) Definición Afección inflamatoria y progresiva de la superficie ocular, principalmente de la córnea y de la conjuntiva, ocasionada por una deficiencia cualitativa y/o cuantitativa de la película lagrimal precorneal (Esteban, 2007). Figura 17. Queratoconjuntivitis seca en un cocker spaniel con secreción mucopurulenta abundante y blefatiris cantal medial. Etiología Desórdenes autoinmunes asociados con QCS - Atopía - Hipotiroidismo - Hiperadrenocorticismo - Lupus eritematoso sistémico - Artritis reumatoidea 46 - Diabetes mellitus - Hepatitis activa crónica - Trastornos penfigoides Desórdenes secretorios asociados con QCS - Seborrea - Xerostomía/periodontitis - Insuficiencia pancreática exócrina Desórdenes de hormonas sexuales asociados con QCS - Desequilibrios en animales esterilizados - Desequilibrios asociados con parición /lactación Causas varias - Distemper Canino (Moquillo) - Sulfonamidas - Atropina/anestésicos - Hipoplasia lagrimal congénita - Injuria o neuropatología del nervio facial Causa idiopática (sin enfermedad sistémica identificada) Signos Clínicos Blefarospasmo, secreción mucosa o mucopurulenta, córnea sin brillo, hiperemia conjuntival y edema, neovascularización corneal, úlceras corneales, infiltración celular y fosas nasales secas. (Esteban, 2007). 47 Diagnóstico Por los signos clínicos, además es fácilmente confirmado por medio de la Prueba Lagrimal de Schirmer (Herrera, 1998). Tratamiento Eliminar la causa de la QCS (retirar sulfamidas, atropina, etc.) Empleo de humectantes o sustitutos de la lágrima: dextranos, alcohol polivinílico, metilcelulosa, etc. Estimular la producción lagrimal: Ciclosporina A al 0,2 – 2%, en colirio o pomada, de 2 a 3 veces al día por 2 semanas (Esteban, 2007; Barnett et al, 2003; Herrera, 1998). En caso de existir contaminación bacteriana secundaria debemos emplear antibióticos de elección para la superficie ocular (bacitracina; polimixina y neomicina; tobramicina). 48 CRISTALINO CATARATA Definición Pérdida de la transparencia, parcial o total, de alguna parte del cristalino, de sus cápsulas o de ambos. Puede presentarse de forma uni o bilateral y adoptar formas muy variables (puntos, fisuras, rayas, rosetas, etc.) (Esteban, 2007). Etiología Traumáticas (contusiones, arañazos, cuerpos extraños que penetran la córnea) Metabólicas (catarata diabética, catarata hipocalcémica y catarata por deficiencia de arginina) Tóxicas (radiaciones, descargas eléctricas, dinitrofenoles) Hereditarias (catarata congénita, catarata juvenil) Signos clínicos Leucocoria y déficit visual. Diagnóstico Signos clínicos, además del empleo de oftalmoscopia directa e indirecta, ultrasonografía, pruebas laboratoriales, bioquímica sanguínea para descartar cataratas diabéticas (Esteban, 2007). 49 Diagnóstico diferencial Esclerosis, edema corneal, tumores intraoculares, inflamación del vítreo, uveítis, alteraciones de la nutrición en cachorros. (Thompson, 2008; Morgan, 2004). Tratamiento Está contraindicado el empleo de midriáticos. Tratamiento quirúrgico es la elección, las técnicas son tres (Esteban, 2007): Extracción extracapsular: el núcleo del cristalino se extrae entero, a través de una amplia incisión en la córnea. Extracción extracapsular mediante facoemulsificación: el núcleo es fragmentado mediante ultrasonidos y aspirado al mismo tiempo. Extracción intracapsular: extracción del cristalino con sus cápsulas (anterior y posterior). Una vez concluida la cirugía, el tratamiento consiste en antibiótico (gentamicina, neomicina, cloranfenicol) y antiinflamatorio (dexametasona, prednisolona) 50 CATARATA DIABÉTICA EN EL PERRO Definición Opacidad del cristalino (Turner, 2010). Figura 18. Catarata súbita en un perro diabético (Turner, 2010). Etiología Diabetes mellitus (Turner, 2010). Fisiopatología La causa de la catarata es el aumento de glucosa en el humor acuoso. Este exceso de glucosa se metaboliza por la vía de la aldosa reductasa, produciéndose una elevada concentración de sorbitol. El sorbitol actúa como agente osmótico, atrayendo agua al interior de las células del cristalino, lo que provoca que las fibras se hinchen y pierdan su transparencia. El exceso de glucosa también puede afectar directamente a las proteínas cristalinianas, alterando su estructura, lo que ocasiona dispersión de la luz que atraviesa el cristalino (Peiffer, 2002). 51 Signos Clínicos Signos típicos de diabetes en los pacientes no diagnosticados, polidipsia con poliuria, pérdida de peso, polifagia, deshidratación, debilidad (Turner, 2010). Formación aguda de cataratas, generalmente asociada a ceguera súbita (Schaer, 2006). Pacientes diabéticos con tratamiento pueden mostrar procesos patológicos que hayan afectado al metabolismo de la insulina (Turner, 2010). El examen oftalmológico revelara respuestas de amenaza reducidas o ausentes y mala visión (Turner, 2010). La catarata diabética siempre es bilateral, simétrica, total e irreversible (Barnett et al, 2003). Diagnóstico Exploración oftalmológica completa, medición de la presión intraocular, análisis completo para el diagnóstico de diabetes (Morgan, 2004). Diagnóstico diferencial Esclerosis, edema corneal, tumores intraoculares, inflamación del vítreo. Tratamiento Médico Corrección de la dieta y antiinflamatorios no esteroideos tópicos (diclofenaco, ketarolaco) (Peiffer, 2002; Morgan, 2004). 52 Quirúrgico Facoemulsificación con o sin implantación de lente intraocular, en esta técnica se utilizan vibraciones ultrasónicas de alta frecuencia para fragmentar el cristalino, combinándolo con irrigación controlada para mantener la presión normal en la cámara anterior y succión para eliminar los fragmentos de cristalino y el líquido de irrigación (Turner, 2010; Blood y Studdert ,1994). ESCLEROSIS NUCLEAR Un hallazgo frecuente en perros mayores de 7 años, es un cambio relacionado con la edad que se produce como resultado de la formación progresiva de fibras en el cristalino y de la compresión interna de las fibras más antiguas de la lente. Las propiedades ópticas alteradas de las fibras lenticulares centrales comprimidas producen un reflejo de la luz, que proporciona un aspecto blanco azulado o grisáceo, apreciable clínicamente cuando se ilumina con luz difusa el núcleo del cristalino (Gelatt, 2003). 53 ÓRBITA Y GLOBO OCULAR PROPTOSIS Definición La proptosis es el resultado de un desplazamiento anterior repentino del globo ocular con un atrapamiento simultáneo de los párpados por detrás del ecuador del propio globo ocular (Gelatt, 2003). Figura 19. Diagrama de proptosis del globo ocular (Turner, 2010) Etiología La proptosis se debe a algún tipo de traumatismo. Ocurre con facilidad en razas braquicefálicas, debido a que la órbita en estos animales es poco profunda (Morgan, 2004). Signos Clínicos Exposición extrema aguda del globo Ulceración corneal y queratitis por exposición 54 Estrabismo lateral por la rotura de los músculos rectomedial, oblicuo ventral y recto ventral. Diagnóstico Se basa en los antecedentes de un traumatismo previo, acompañado de los síntomas típicos (Morgan, 2004). Tratamiento Resituar el globo en el interior de la órbita lo antes posible. Bajo anestesia general, lubricar el globo con pomada oftálmica estéril. Usando presión digital o la parte plana de un mango de bisturí y tracción simultánea de los márgenes del párpado mediante fórceps o suturas, ajustar con cuidado el globo ocular dentro de la órbita (Morgan, 2004). Realizar cantotomía, esta técnica consiste en aumentar la longitud funcional de la fisura palpebral, para disminuir la tensión de los párpados si la reposición es difícil. Se utiliza una red horizontal de suturas de colchonero para realizar una tarsorrafia temporal parcial (cierre de la fisura palpebral) (Morgan, 2004). Algunos autores no aconsejan esto, ya que dificulta el tratamiento tópico posterior (Tovar, 2010). Se deben colocar las suturas de un modo seguro. Muy profundas rozan la córnea. Una sutura poca profunda provoca la inversión de los márgenes palpebrales y el roce de la córnea. 55 Colocar la sutura directamente en los orificios de las glándulas de Meibomio. Dejar abierta una pequeña porción de la fisura palpebral en la parte medial para observar la evolución y administrar la medicación. Administrar una dosis única antiinflamatoria de dexametasona 0.5-1.0 mg/kg s.c. para reducir la inflamación y controlar el dolor. Administrar antibiótico, cloranfenicol cada 6-8 horas para prevenir una infección (Esteban, 2007; Morgan, 2004). La enucleación se realiza en aquellos casos donde se ha perdido la estructura ocular o existe una infección severa (Tovar, 2010), consiste en la eliminación del globo ocular (Gelatt, 2003). A los 20-25 días retirar los puntos de la tarsorrafia (Esteban, 2007). El pronóstico es reservado ya que se ha observado que el setenta por ciento de todas las proptosis terminan perdiendo la visión (Rodríguez, 2010). El estrabismo lateral es una secuela común debido a la lesión del nervio oculomotor o a la avulsión del músculo recto medial (Peiffer, 2002). 56 ÚVEA UVEÍTIS Definición Inflamación de una o más partes de la capa vascular del ojo (tracto uveal) (Esteban, 2007; Schaer, 2006) Etiología • Traumatismos oculares • Infecciones víricas sistémicas (Moquillo canino, Herpes virus canino, Hepatitis vírica canina) • Infecciones sistémicas bacterianas (Tuberculosis, Leptospirosis, Brucelosis) • Enfermedades parasitarias sistémicas (Lehismaniosis, Babesiosis, Rickettsia, Ehrlichia canis, Dirofilariosis, Angioestrongilosis, Toxocaras) • Micosis (Cryptococus, Blastomyces, Histoplasmas, Aspergilosis, Candidiasis) Enfermedades metabólicas (Lipodisproteinemias, Diabetes) • Neoplasias • Enfermedades autoinmunes Uveítis facoalérgicas Síndrome de Vogtt-Koyanagi-Harada Síndrome de Cheik-Higashi. 57 Signos Clínicos Agudos: Blefarospasmo, fotofobia, epífora, enoftalmo y protrusión de la membrana nictitante, congestión de vasos esclerales, pérdida en la transparencia de la córnea, miosis, turbidez del humor acuoso, precipitados queráticos, hipopión hipema (Zapata, 2006). Los cambios en el iris pueden observarse con alteración en el color, granulomas y engrosamiento, disminución de la presión intraocular (Zapata, 2006). Crónicos: Pérdida de transparencia de la cornea, edema corneal, modificaciones en el color del iris, catarata, desprendimiento de retina, alteraciones en la función visual, glaucoma secundario a uveítis (Zapata, 2006). Diagnóstico Signos clínicos, bajada de presión intraocular por hipoproducción de humor acuoso (PIO), ecografía ocular. Laboratorio: la realización de un hemograma y pruebas bioquímicas y serológicas podrían aportar datos para arribar al diagnóstico. 58 Cuadro 2. Diagnóstico diferencial de uveítis Conjuntivitis Queratitis superficial Glaucoma Uveítis Conjuntiva Inflamada, hiperémica Sin espesamiento Normal Normal Vascularización Superficial, difusa Neovasos gruesos, superficiales, largos y dicotomizados Inyección episcleral Neovasos cortos, finos, paralelos, profundos y no dicotomizados Córnea Normal Normal, opaca Normal, edema Opacidad, normal Pupila Normal Normal Midriasis Miosis o irregular Iris Normal Normal Edema Edema, color anormal Presión intraocular Normal Normal Elevada Normal, baja, algo elevada Reflejo fotomotor pupilar Normal normal No existe Atenuado o nulo sintomatología general Ausente Ausente Dolor, fatiga Según causas Secreciones Acuosa, serosa y mucopurulenta Acuosa Ninguna, epifora Ninguna, epifora Visión Normal Normal, cierto déficit Ausencia, disminución Disminuida Fotofobia normal moderada Ligera, moderada Moderada, importante (Esteban, 2007) 59 Tratamiento Pretende reducir cuanto antes la inflamación, disminuir el dolor, si es posible identificar la causa y tratarla. Antiinflamatorios Corticoides: (no aplicar en caso de queratitis ulcerativa) Tópicos: prednisolona o dexametasona tiene una buena penetrabilidad ocular. Sistémico: Prednisolona o Prednisolona pueden ser usados (1 –2 mg / Kg/ 12 hs. oral). AINES Tópicos: Flurbiprofeno 0,03 % o Suprofeno 1% o Diclofenaco 0,1% cada 6 horas. Sistémico: Carprofeno 2 mg/kg/12hs. Inmunosupresores Sistémico: Azatioprina (2,2 mg/kg), o Ciclosporina (10-5 mg/kg) pueden ser usados en casos de no respuesta de la uveítis a protocolos de antiinflamatorios. Tópico: Ciclosporina A. Ciclopléjicos y midriáticos Tópico: Atropina 1 % 4 veces al día. Terapia especifica Médica: si la causa es encontrada, la medicación especifica es aplicada (antibiótico, antifúngico, antiparasitario) asociada a antiinflamatorios. 60 HIPEMA Definición El hipema es la hemorragia en la cámara anterior (Turner, 2010; Radostits, 2002). Figura 20. Hipema total en un West Highland White terrier de cuatro años (Turner, 2010). Etiología Trastornos sistémicos como coagulopatías o hipertensión, así como en enfermedades oculares como glaucoma crónico, lesiones congénitas asociadas a persistencia de vasos embrionarios, neoplasias, desprendimiento de retina y traumatismos (Peiffer, 2002). Signos Clínicos Glóbulos rojos circulantes o asentados ventralmente en la cámara anterior. 61 Diagnóstico Si hay otros signos de hemorragia, descartar coagulopatías (Thompson, 2008). Medir la presión sistólica para descartar hipertensión (Thompson, 2008). La presión sistólica > 170mm Hg en perros es compatible con hipertensión Indicada la serología frente a enfermedades infecciosas asociadas con vasculitis: Ehrlichia canis, Rickettsia rickettsii, Borrelia burgdorferi (Thompson, 2008). Radiografía ocular para revelar posibles fracturas orbitales o proyectiles metálicos (Morgan, 2004). Tratamiento Tratar la enfermedad subyacente, si es posible. Limitar la actividad para reducir el riesgo de hemorragia. Administración tópica de esteroides antiinflamatorios 3-6 veces diarias hasta la resolución, dexametasona 0.1%, fosfato sódico de prednisolona 1%. Empleo de ciclopléjicos, atropina al 1% (Esteban, 2007) o la administración de fenilefrina tópica 2,5-10% para facilitar la vasoconstricción y la midriasis (Morgan, 2004). 62 GLAUCOMA Definición El glaucoma es el aumento de la presión intraocular por encima de la presión compatible con la función normal. Está incluido en el grupo de enfermedades que manifiestan en común un nivel incrementado de presión intraocular originando daño tisular por lesiones en el nervio óptico (Morgan 2004). En la mayoría de los casos el glaucoma es causado por obstrucción o estenosis de las vías de salida del humor acuoso provocando deterioro de la visión. El glaucoma es una de las causas más frecuentes de ceguera en el canino (Maggs et al, 2009; Herrera 2007). Figura 21. Basset Hound con glaucoma bilateral (Gelatt, 2003). 63 Signos clínicos Blefarospasmo, marcada epifora y en algunos casos rascado insistente, congestión episcleral. Algunos autores describan a esta congestión con aspecto de "cabellera de medusa" (Herrera, 2010). Edema corneal, generalmente difuso, aunque en muchas ocasiones suelen observarse las denominadas estrías descemetales, se observan como opacidades lineales sobre la superficie corneal, midriasis, buftalmos, degeneración o desprendimiento retinal (Herrera, 2010). Diagnóstico Signos y síntomas ya mencionados, estudio de la PIO (tonometría), estudio clínico del ángulo iridocorneal (Herrera, 2010). Tratamiento El glaucoma es una enfermedad incurable; la finalidad terapéutica será conseguir un nivel de PIO regulada en un valor que permita un normal funcionamiento del ojo sin aumentar su deterioro (Herrera, 2010). Tratamiento médico Mióticos La pilocarpina para uso tópico, se presenta en concentraciones que van del 0,5% al 4%, favorecen la eliminación del humor acuoso (Esteban, 2007; Herrera, 2010). 64 Bloqueantes beta adrenérgicos Maleato de timolol, betaxolol (Herrera, 2010). Timolol al 4%, esta concentración produce importantes y peligrosos efectos cardiocirculatorios (Herrera, 2010). Inhibidores de la Anhidrasa Carbónica (IAC) Acetazolamida: tabletas de 250 mg, a dosis de 10 mg/kg en el perro. Metazolamida: tabletas de 25 mg, a dosis de 5 mg/kg. (Herrera, 2010). Agentes osmóticos Manitol al 15 - 20%, 2 gr/kg vía endovenosa rápida. Glicerina 70%, 2 cm3/kg por vía bucal. Puede presentar fenómenos de intolerancia gástrica que pueden eliminarse con la administración de la glicerina fría o mezclada con leche (Herrera, 2010). Alfa agonistas Actúan sobre la producción de humor acuoso. Apraclonidina y la brimonidina (Herrera, 2010). 65 Prostaglandinas Aumentan el flujo de salida del humor acuoso mediante el incremento de la vía uveal no convencional. Unoprostona y el Latanoprost (Herrera, 2010). A tratamiento médico de urgencia: 1.-Administración endovenosa de manitol 15%, 2 gr/kg. 2.-Una vez que el tono ocular disminuye, comenzar con pilocarpina 1% cada 15 minutos hasta lograr miosis. Seguir cada 8 horas. 3.-Mantenimiento del bajo tono ocular mediante la administración de inhibidores de la anhidrasa carbónica por vía oral, acetazolamida (10 mg/kg c/12 horas) (Herrera, 2010). Tratamiento quirúrgico Procedimientos filtrantes: gonioimplantes, implantes subconjuntivales o dispositivos de shunt o by pass. Estos consisten en dispositivos plásticos que se colocan subconjuntivalmente y que van conectados a la cámara anterior a través de un tubo de diverso calibre (Herrera, 2010). La técnica quirúrgica de trabeculectomía, la cual consiste en crear una nueva vía de drenaje del humor acuoso, alternativa, rápida y confiable para el tratamiento resolutivo de la presión intraocular en caninos (Lau-Choleón, 2010) Procedimientos ciclodestructivos: El objetivo es lograr la eliminación del dolor conservando un globo ocular aceptablemente estético. Consisten en 66 la destrucción selectiva de una porción de procesos ciliares. Utilización de frío, energía (laser) y substancias tóxicas la substancia más utilizada es la gentamicina, inyectada por vía intravítrea, 40 mg previa extracción de una cantidad equivalente en mililitros de humor acuoso, puede combinarse con 1 a 2 mg de dexametasona (Herrera, 2010). Evisceración y enucleación. Se elimina el globo ocular y sus anexos en aquellos casos en los que la córnea esté muy dañada, o si la causa del glaucoma fue una neoplasia (Esteban, 2007). 67 CONCLUSIÓN Las enfermedades oftalmológicas son padecimientos a los que el clínico se enfrenta con frecuencia ya que existe un gran número de afecciones oftálmicas. Es vital que el médico veterinario realice una adecuada exploración física, no olvidando la exploración del ojo, además de conocer y aprovechar los diferentes elementos con los que puede contar para la realización de esta. Ante los diferentes padecimientos oculares se debe conocer y proceder de manera adecuada para no comprometer este órgano tan importante, teniendo criterio sobre las ventajas y limitaciones que estas conllevan. Es obligatorio advertir a los propietarios sobre los cuidados que se deben tener ante estos padecimientos. Finalmente no debemos olvidar que es nuestra obligación cuidar de la salud y bienestar de nuestros pacientes. 68 RECOMENDACIONES El médico veterinario clínico debe actualizarse frecuentemente para conocer más sobre las diversas enfermedades que existen y puedan afectar el ojo en sus pacientes, así como los tratamientos y nuevos productos que salen al mercado. Se debe siempre establecer contacto con los especialistas o médicos más experimentados para consultar casos clínicos además de derivar los casos más difíciles a estos profesionales. No olvidar la comunicación con el cliente, explicar de manera adecuada y sencilla las patologías y tratamiento a seguir, ya que este muchas veces es el encargado de la administración del tratamiento, por lo que es un factor decisivo para el fracaso o resolución de los problemas oculares. 69 BIBLIOGRAFÍA 1. Asteinza Iker. Entropión en perros-enfermedad de parpados. Consultado el 18 de octubre de 2010 de http://www.animalhome.com.mx/PDF_Perros_Pura_Sangre/entropion_perro s_enfermedad_parpados.pdf 2. Barnett Keith C., Heinrich Christine., Sansom Jane (2003). Oftalmología Canina atlas & texto. Editorial Inter-médica. Buenos Aires, República de Argentina. Pág. 1-8, 19-21, 23-27, 32-33, 51-52, 55-56, 70-79, 99-106,110118. 3. Beránek J., Oftalmología, examen de los métodos actuales del ojo canino. Consulado el 16 de octubre 2010 de http://www.fecava.org/files/ejcap/EJCAP%2017-3%20p221-226%20Current 4. Birchard Stephen y Sherding Robert G. (1996). Manual Clínico de Pequeñas Especies. Editorial McGraw-Hill interamericana. Pennsylvania U.S.A. Pág. 1047-1490 5. Bistner Stephen I., Ford Richard B., Raffe Mark R. (2002). Manual de terapéutica y procedimientos de urgencia en pequeñas especies. Séptima Edición. Editorial McGraw-Hill Interamericana. Pennsylvania U.S.A. Pág. 89-100. 6. Blood Douglas y Studdert Virginia (1994). Diccionario de veterinaria. Editorial Editorial McGraw-Hill Interamericana. Pág. 142, 232, 286, 360. 7. Butler FK. (2005). The eye in the wilderness. In: Auerbach PS, ed. Wilderness Medicine. 5th ed. St. Louis, Mo: Mosby;chap 25 70 8. Donaldson D, Day MJ. (2000) Epitheliotropic Iymphoma (micosis fungoides) presenting as blepharoconjunctivitis in an Irish setter. J Small Anim Pract 41:317. 9. Donohue DE, Brightman AH. (1995). Cervicofacial Actinomyces viscosus infection in a Brazilian fila: a case report and literature review. J. Am Anim Hosp Assoc 31:501 10. Esteban Martín Javier (2007). Atlas de oftalmología clínica del perro y gato. Editorial Bayer. Madrid, España. Pág. 13-27, 30, 33, 43-50, 64,65, 77-92, 97-103, 117-126,160-167,209-221,241-253,269-278, 322. 11. Ford Richard B. y Mazzaferro Elisa M. (2007). Urgencias en veterinaria procedimientos y terapéutica. Octava edición. Editorial Elsevier. Madrid, España. Pág. 564-571. 12. Gelatt N. Kirk. (2003). Fundamentos de oftalmología Veterinaria. Editorial MASSON, S.A. Barcelona, España. Pág. 1-25, 39-41, 43, 47, 52-69, 76-79, 95-102, 108-111, 125, 129-135, 157-160, 165-185, 201-212, 221-223, 229239. 13. Güemez- Sandoval Eréndira (2008). “Hermann von Helmholtz y el oftalmoscopio”. Rev Mex Oftalmol. Consultado el 10 de octubre de 2010 de http://www.medigraphic.com/pdfs/revmexoft/rmo-2008/rmo081n.pdf 14. Herrera Daniel (1998). Consultado el 10 de octubre de 2010. www.oftalmovet.com.ar/queratoconjuntivitis.htm 71 15. Herrera Daniel (2010). Glaucoma Canino. Portal veterinario MEVEPA Chile. Consultado el 13 de octubre de 2010. http://www.mevepa.cl/modules.php?name=news&file=print&sid=555 16. Lau-Choleón García, Juan Carlos. Aplicación de la técnica quirúrgica de la trabeculectomía para el tratamiento del aumento de la presión intraocular en caninos. Consultado el 16 de octubre 2010 de http://sisbib.unmsm.edu.pe/bibvirtualdata/tesis/salud/lau_chole%C3%B3n/re vision_bibliografica.pdf 17. Maggs David J., Miller Paul E., Ofri Ron. (2009). Slatter Fundamentos de Oftalmología Veterinaria. Cuarta Edición. Editorial Elsevier. Barcelona, España. Pág. 1-20, 82, 102-103, 122,123, 266-277, 142-151, 382. 18. Merck y CO. (2000) El manual Merck de veterinaria. Quinta edición. Editorial océano. Barcelona, España. Pág. 392-402,412 19. Manzo Ruiz Mariana (2006). Examen físico en perros y gatos. Monografía de licenciatura. Universidad Veracruzana. Veracruz, Ver., México. Pág. 25, 45-59 20. Morgan Rhea V., Bright Ronald M., Swartout Margaret S. (2004). Clínica de Pequeños Animales. Cuarta Edición. Editorial Elsevier. Madrid, España. Pág. 927-1046 21. Peiffer Jr. Robert L., Petersen-Jones Simon M. (2002). Oftalmología de pequeños animales un enfoque orientado a la resolución de problemas. Tercera Edicion. Editorial Harcourt. Pág. 1-42, 55, 72, 73, 77, 78, 83, 95, 98, 116, 119, 131-133, 143, 152-159, 181-184, 188-197, 204-207, 212-215, 233-242, 247. 72 22. Petersen-Jones Simon M., Crispin Sheila M. (1999). Manual de oftalmología en pequeños animales. Editorial Harcourt Brace. Barcelona, España. Pág. 16, 69, 79, 144, 148, 185-188, 197-216, 220-228. 23. Pérez Camacho F., Gutiérrez Sevilla MA., Royo Sans M. (2004) Curso breve de Lámpara de Hendidura, oftalmometría, Tonometría, funduscopia y gonioscopia. Consultado el 17 de octubre 2010 de http://www.oftalmo.com/enfermeria/enfermeria2004/14.htm 24. Radostits Otto M., Mayhew Joe, Houston Doreen M. (2002). Examen y diagnostico clínico en veterinaria. Ediciones Harcourt. Pág. 125-138, 543572. 25. Rijnberk A., de Vries H. W. (1997). Anamnesis y exploración corporal de pequeños animales. Ed. Acribia S. A. de C.V. Págs. 1,3,6, 26-35, 71, 74-77. 26. Rodriguez Bazan Sergio. Prolapso ocular. Consultado el 24 de octubre 2010. http://www.ammvepen.com.mx/Pdf/PROLAPSO%20OCULAR.pdf 27. Rodríguez Gómez José (2009). Tratamiento del entropión mediante blefaroplastia de Stades. Consultado el 18 de octubre de 2010 de http://argos.portalveterinaria.com/noticia.asp?ref=2281 28. Schaer Michael (2006). Medicina clínica del perro y el gato. Editorial Elsevier. Barcelona, España. Pág. 44-68 29. Scott DW. Miller WH. Griffin CE: Muller & Kirk´s (2001). Smalll Animal Dermatology. Sexta Edición. WB Saunders, Philadelphia. 73 30. Slatter Douglas (2004). Fundamentos de oftalmología veterinaria. Tercera Edición. Editorial inter-medica. Pennsylvania U.S.A. Pág. 72-73,206, 374385, 390-422, 433-451, 31. Slatter Douglas (1997). Manual de cirugía en pequeñas especies. Editorial MacGraw-Hill Interamericana. Pennsylvania U.S.A. Pág. 460-525 32. Ettinger Stephen (2003). Compendio del tratado de medicina veterinaria. Tercera edición. Editorial Elsevier. Pág. 390-392 33. Thompson Mark S. (2008). Diagnóstico diferencial clínico en pequeños animales. Editorial Elsevier. Pág. 209-212. 34. Turner Sally M. (2010) .Oftalmología de pequeños animales. Editorial Elservier. Barcelona, España. Pág. 1-36, 61-67, 93-101,121-150, 201210,222-228, 241-251, 259-273, 325-328, 350-352 35. Vaccari Gustavo l. El Glaucoma Canino. http://www.reivet.com.ar/archivos/glaucoma_canino._diciembre.pdf 36. Wingfield Wayne (1999). Secretos de la medicina de urgencias en veterinaria. Editorial McGraw-Hill Interamericana. Pennsylvania, U.S.A. Pág. 161-188 37. Wyman M. (2008).Historia de la Oftalmología Veterinaria. Foyel mascotas. Consultado el 9 de Octubre de 2010 de http://www.foyel.com/cartillas/53/historia_de_la_oftalmologia_veterinaria.ht ml 74 38. Zapata Gustavo (2006). Aproximación diagnóstica y tratamiento de la uveítis. Revista electrónica de veterinaria REDVET. http://www.veterinaria.org/revistas/redvet/n101006.html 39. Tovar. Urgencias oculares en la clínica diaria. Consultado el 24 de octubre 2010. http://www.scribd.com/doc/6372724/20-URGENCIAS-OCULARES 75 GLOSARIO Baston: Fotorreceptor retiniano adaptado para la visión en la oscuridad y la detección del movimiento. Blefaritis: Inflamación de los párpados superior o inferior. Blefarospasmo: Cierre marcado de los párpados debido al malestar ocular Buftalmia: Agrandamiento del globo ocular debido a la distensión de la túnica fibrosa. Cámara anterior: Espacio limitado anteriormente por la córnea y posteriormente por el iris y la parte anterior del cristalino. Contiene el humor acuoso. Cámara posterior: Espacio en el que se libera el humor acuoso limitado anteriormente por la superficie posterior del iris y por detrás por la cápsula anterior del cristalino. Cantoplastia: Cirugía plástica en la zona del canto interno o externo. Cantotomía: Incisión quirúrgica del canto (normalmente externo) para mejorar la visualización o el acceso quirúrgico. Cápsula de Tenon: Vaina de tejido conjuntivo que rodea el ojo por detrás del limbo (también se llama fascia del globo ocular). Catarata: Opacidad del cristalino Cilio ectópico: Pelo que nace en el folículo piloso localizado en la glándula de Meibomio y posteriormente sale a través de la conjuntiva palpebral para dirigirse hacia la córnea. Conjuntivitis: Inflamación del epitelio conjuntival. 76 Cono: Fotorreceptor retiniano adapatado para la visión en luz brillante, la visión cromática y la agudeza visual fina. Coroides: Parte posterior de la úvea inmediatamente por fuera de la retina; respensable de la nutrición de las capas retinianas externas. Descemetocele: Úlcera corneal profunda que afecta a la totalidad del estroma y permite la exposición de la membrana de Descemet. No se tiñe con fluoresceína tópica. Distiquiasis: Pelos adicionales que nacen desde los folículos pilosos de localización anormal, por lo conductos secretores de las glándulas de Meibomio y se dirigen hacia la córnea. Distriquiasis: Se diferencias de la distiquiasis en que sale más de un pelo desde el mismo folículo. Ectropión: Eversión del párpado y su borde Entropión: Inversión del párpado y su borde Enucleación: Extirpación del globo ocular. Epífora: lagrimeo excesivo. Escleritis: Inflamación de la esclera. Evisceración: Extracción del contenido del globo ocular manteniendo la túnica fibrosa (córnea y esclerótica). Exoftalmos: globo ocular de tamaño normal, pero situado más hacia fuera en la cavidad orbitaria. Fotofobia: malestar ocular inducido por una estimulación dolorosa 77 Glándulas de Meibomio: glándulas sebáceas modificadas localizadas en los párpados con orificios en el borde palpebral, que producen la capa externa lipídica de la película lagrimal. También se llaman glándulas tarsales. Glándulas de Moll: glándulas apocrinas de los bordes palpebrales superior e inferior. Glaucoma: enfermedad degenerativa y evolutiva del nervio óptico asociada a un incremento de la presión intraocular no compatible con la funcionalidad normal del nervio óptico y de la retina. Gonioscopía: examen del ángulo iridocorneal. Hipema: sangre en la cámara anterior. Hipopión: Pus en la cámara anterior. Lagoftalmos: Oclusión incompleta de los párpados, resultante de bridas cicatrizales traumáticas, de pérdidas de sustancia o de parálisis facial Lagrimeo: Término utilizado clínicamente para dar a entender un exceso en la formación de lágrimas. Leucocoria: literalmente, “pupila blanca”. Suele ser un signo de catarata, esclerosis nuclear o desprendimiento de retina. Midriasis: dilatación pupilar Miosis: contracción de la pupila Proptosis: luxación o salida del globo ocular de la cavidad orbitaria a través de la abertura palpebral. Reflejo: reacción subcortical adaptativa, invariable e involuntaria a un estímulo. 78 Respuesta: Reacción voluntaria de origen cortical frente a un estímulo que puede ser excesiva o anulada y que necesita ser aprendida, por lo que no siempre está presente al nacer. Tarsorrafia: Aposición (utilizando suturas) temporal o permanente de los párpados. Puede ser de una parte (tarsorrafia parcial) o de todo (tarsorrafia completa) el párpado. Tonometría: medición de la presión intraocular Triquiasis: pelos que nacen en su posición correcta pero que se dirigen hacia la córnea o a la conjuntiva de manera anormal. Úlcera corneal: perdida de la continuidad de una o más capas de la córnea Uveítis: inflamación de una o más partes de la capa vascular del ojo. 79