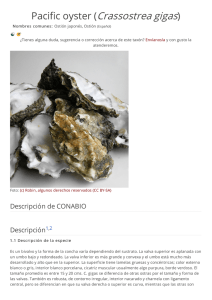
(Linnaeus, 1758) en el Sistema Arrecifal Mesoamericano. Por
Anuncio

Centro de Investigación y de Estudios Avanzados del Instituto Politécnico Nacional Unidad Mérida Departamento de Recursos del Mar Abundancia espacio-temporal de larvas de Strombus gigas (Linnaeus, 1758) en el Sistema Arrecifal Mesoamericano Tesis que presenta Biol. José Francisco Chávez Villegas Para Obtener el Grado de Maestro en Ciencias En la Especialidad de Biología Marina Directora de la Tesis: Dra. Dalila Aldana Aranda Mérida, Yucatán. Julio de 2011 1 DEDICATORIA A mis padres Silvia y Mario por apoyarme siempre A mi mamá Vina por estar siempre conmigo y brindarme su bendición A Cheli, Narcy y Manue por su apoyo durante este tiempo A mis hermanos Sarahi, Nathali y Jairo Al Dr. Jorge Arturo Cid Becerra y a su familia A la memoria de Carlos Francisco Valdez Chávez ii El éxito no depende de la suerte de cada individuo, sino de las oportunidades que logre alcanzar (Chávez JF) iii RESUMEN Cinco sitios del Sistema Arrecifal Mesoamericano (México: Puerto Morelos, XelHá, Sian Ka’an, Mahahual y para Belice: San Pedro), fueron muestreados mensualmente de enero a diciembre de 2008, con la finalidad de conocer la variación espacio-temporal de la abundancia larval de Strombus gigas (Linnaeus, 1758). Se efectuaron arrastres de plancton por triplicado, empleándose una red cónica de 300 µm de abertura de malla. Las muestras fueron fijadas en formol salino al 4% y llevadas al laboratorio para su análisis e identificación. En cada sitio de muestreo se registró temperatura (°C), salinidad (0/00) y oxígeno disuelto (mg.L1 ). La abundancia larval de S. gigas fue diferente entre localidades, siendo Puerto Morelos la que presentó el mayor valor (0.47±1.21 larvas·10 m-3). Se observaron dos picos de abundancia en abril (2.17±1.63 larvas·10 m-3) y de agosto a septiembre (1.81±1.13 y 1.81±3.14 larvas·10 m-3, respectivamente). La correlación entre densidad y parámetros fisicoquímicos no mostró asociación significativa, con excepción de la salinidad (r: 0.6307; p: 0.0000016). Las tallas no presentaron variación temporal significativa (p: 0.3176), pero si espacial (p: 0.0098). El 98.82% de las larvas tuvieron una talla entre 150-450 µm. El análisis de discriminantes mostró dos grupos: densidad larval de 0.39±1.18 a 1.16±2.23 larvas·10 m-3 (Sian Ka’an, San Pedro y Puerto Morelos) y el grupo con densidad menor a 0.12±0.31 larvas·10 m-3(Xel-Há y Mahahual). iv ABSTRACT Five sites found within the Mesoamerican Reef System (Mexico: Puerto Morelos, Xel-Há, Sian Ka’an, Mahahual; Belize: San Pedro) were sampled monthly from January 2008 to December 2008 with the goal of describing spatio-temporal variation in abundance of Strombus gigas (Linnaeus, 1758) larvae. Plankton samples were taken in triplicate using a conical net with a 300 µm aperture size. Samples were fixed in 4% saline formalin and transported to the laboratory for analysis and specimen idenfitication. At each sampling site we recorded temperature (°C), salinity (0/00) and dissolved oxygen (mg.L-1). The abundance of S. gigas larvae varied among localities, with Puerto Morelos having the greatest abundance average value (0.47±1.21 larvae·10 m-3). Additionally, we obseved two abundance peaks, one in April (2.17±1.63 larvae·10 m-3) and another from August to September (1.81±1.13 y 1.81±3.14 larvae·10 m-3, respectively). The correlation between larval density and physico-chemical parameters did not show a significant association in most cases, except for salinity (r: 0.6307; p: 0.0000016). Larval sizes did not vary significant across sampling months (p: 0.3176), but did vary spatially (p: 0.0098). 98.82% of the sampled larvae had size range of 150 to 450 µm. Discriminant analysis based on physical and larval density data showed two groups: one with a larval density ranging from 0.39±1.18 to 1.16±2.23 larvae·10 m-3 (Sian Ka’an, San Pedro and Puerto Morelos) and another group with an average larval density lower than 0.12±0.31 larvae·10 m-3 (Xel-Há and Mahahual). v AGRADECIMIENTOS Académicos Al Consejo Nacional de Ciencia y Tecnología (Conacyt) por la beca N° 340911/240157 que me permitió realizar mis estudios de maestría. Al Centro de Investigación y de Estudios Avanzados del Instituto Politécnico Nacional por brindarme la oportunidad de realizar mi maestría. A la Dra. Dalila Aldana Aranda, por ser una guía en mi desarrollo profesional, gracias por el tiempo dedicado a mi preparación, observaciones, oportunidades de preparación en congresos, cursos y más, muchas gracias Doit. A la Dra. Martha Enríquez Díaz por toda su tolerancia, apoyo, paciencia, consejos, por todos esos días en los que no discutimos, sino confrontamos opiniones, mil gracias Dra. Al Dr. Jorge Arturo Cid Becerra por guiarme hacia nuevos horizontes, de no ser por usted yo no habría llegado aquí, gracias. A los Drs. Ismael de Jesús Mariño Tapia, Mario Rebolledo Vieyra y David Valdés Lozano por sus comentarios acertados hacia mi tesis. Al Dr. Jorge Iván Euán Ávila, María del Carmen Mares y María Isabel Baqueiro por su apoyo y asesoría durante mi estadía en Cinvestav, muchas gracias a todos. Al equipo de trabajo del laboratorio de Biología y Cultivo de Moluscos (Dra. Martha Enríquez, M. en C. Josefina Santos, Karla Zetina, Aurelia Mariles, Irma García y Joanne Peel) e Ictiología (Tere Colás, Ximena Renán, Esperanza Pérez, Jorge Trejo y Virginia Noh), por los ánimos brindados en n cantidad de momentos durante esta etapa, mil gracias. vi A los Drs. Miguel Olvera, Thierry Brulé, Pedro Ardisson, María Eugenia Vega, María de los Ángeles Liceaga, Jorge Herrera, Magali Zacarías, Eucario Gazca y M en C Jorge Montero por el conocimiento aportado durante sus cursos. Al M. en C. Ricardo Saénz Morales por permitirme realizar mi trabajo de campo en las instalaciones del Parque Acuático Xel-Há. Al equipo de trabajo de Xel-Há, a Enrique May, Teresa Rivas, Mario Hoil, Ángel Echeverría, Rafael Benítez, Jorge Montejo, Hilda, Pedro Ku, Josefina Galván y Saitra Pérez, por permitirme formar parte de su grupo y apoyarme durante mi trabajo de campo. Al Dr. Uriel Ordoñez López por asesoría en la colecta y manejo de muestras, así como facilitarme equipo para el trabajo de muestreo. A la Biol. Montserrat Bravo Castro por Capacitación en la identificación larval de Strombus gigas, muchas gracias teacher. A Manuel Sánchez Crespo por la colecta de muestras realizadas en 2008. A Irene Beltrán, doña Josefa Tun, Lilian Espinal y Mildred Sunza por su apoyo en la búsqueda bibliográfica. Al Dr. Ismael Mariño y a Emmanuel Uc por facilitarme equipo para la colecta de datos. A Dora Huerta y Ana Rosa Cristóbal por su apoyo en la toma de imágenes de Microscopía Electrónica. Al personal de Administración, Servicios de apoyo, Telemática, Taller, Consultorio médico y Caseta: Nelly Góngora, María Ucán, Socorro Sosa, Gabriel Ceballos, Genny Kumul, Raúl González, Luisa Ceballos, doña Mary Sánchez, Alfredo Ché, Gaspar Basto, Remigio Flores, Victor Ceh, Juan Kú, Salvador Rodríguez, don Raúl Moreno, don Jorge Carlos Luna, José Antonio Canul, Mireya Carrillo y Flor Ojeda. vii Familia y amigos A mis padres Silvia Villegas y Mario Chávez, por apoyarme durante mi desarrollo profesional, los amo Chaparra y Chinazo. A mis abuelos Liduvina Camacho y José Fco. Villegas, a mis hermanos Sarahi, Nathali y Jairo, mi gran estímulo a seguir adelante los quiero mucho. A mi familia yucateca por apoyarme y brindarme un lugar entre ustedes, gracias Aracelly, Narcy, Manuela, Gabriela, Andrés, Lenny, Miguel, Chuli y Ángel. A la banda Chávez Villegas por echarme porras siempre, especialmente a Eufemia, Marlenne, Juanita, Enedina, Elva, Antonia Mondaca, Manuel Leyva, Susano Zepeda, Manuelito Villegas y a todos mis demás tíos y primos, me faltan las palabras para agradecerle a todos. A Karla Zetina y Josefina Santos por su amistad y apoyo durante mi estancia en Cinvestav, por todas esas mañanas y tardes gratas que compartimos, gracias. A la familia Cid Gastelum, Miriam, Jorgito, Carolina por echarme porras en todo momento. A todos mis amigos y hermanos coreutas por todos los maravillosos momentos que pase junto a ustedes, a ustedes Vicky Cámez, Iván Félix, Horacio Beristain, Ana Karent Godínez, Anita Maldonado, Alix Díaz, José Enrique Denis, Eduardo Ceballos, Cecilia Ruiz, Diana y Vanessa Portillo, Verónica Ruiz, Juan Pablo Cortez, Ligia Martin, Nuria Mis, Don Miguel, etc. A mis amigos y colegas Jesús Alán Valdez y Sara Armenta mis más grandes amigos de la carrera. A Vicky Cámez y Carolina Ruíz por ser siempre un motor en mí desarrollo. viii A la familia Cámez Aguirre por estar siempre impulsándome a seguir adelante. A Alfredo Beristain y al resto de la familia Beristain Navarro, quienes siempre me acogieron de manera grata en su hogar. A Julia Naranjo y Luis Rincón, por su amistad, consejos y las largas tardes de película, gracias amigos. Al maestro Russell Montañez, Sofía Alonso, Henri Mena, Lupita Rivera y P. Antonio Escalante por su apoyo y amistad. A mis amigos de maestría y anexos David Palma, Juan Pablo Caamal, Itzel Sánchez, Arturo Centeno, Laura González, Ana Fuentes, Alejandra Meléndez, Tihui Núñez, Ricardo Flores, Javier Aranda, Tavo, Chilo, Elsy, Mercy y a mis pupilos Francisco Gameros y Nuria Estrada. A la familia Gaxiola Heredia por su apoyo desde los inicios de mi formación profesional, gracias Victor, Nelly, Victor Jr., Gersson y Luis Ángel. A la familia Orduño Félix por su apoyo a mi familia y a un servidor, gracias Betty, Chilalo’s, Naylea, Carmina y Karely. A la familia Félix Valenzuela por su cariño y apoyo, gracias ama Mayra, Ivonne, Mayrita e Iván. Al H. Ayuntamiento de El Fuerte y a la Sindicatura de Jahuara II por su apoyo para iniciar mi estadía en Cinvestav, especialmente a Victor Manuel Sarmiento Armenta (2008-2010), José Eleazar Rubio Ayala (2011-2013), así como a los hermanos Eleazar y Petra Alcantar López, don Celso Piña y demás compañeros de mi madre, muchas gracias a todos. A mi Jahuara y Grullas, mi familia y mi gente querida, por ustedes!!! ix ÍNDICE RESUMEN …………………………………………………………………………………………iv ABSTRACT ………………………………………………………………………………………...v AGRADECIMIENTOS……………………………………………………………………………..vi ÍNDICE……………………………………………………………………………………………...x LISTA DE TABLAS ………………………………………………………………………………xii LISTA DE FIGURAS …………………………………………………………………………….xiv I. INTRODUCCIÓN ………………………………………………………………………………..1 II. ANTECEDENTES ………………………………………………………………………………3 1. Composición del género Strombus …………………………………………………..3 2. Clasificación y posición taxonómica de Strombus gigas …………………………..4 3. Distribución geográfica de S. gigas ………………………………………………….5 4. Sistema Arrecifal Mesoamericano ……………………………………………………5 5. Pesquería de Strombus gigas en el Sistema Arrecifal Mesoamericano …………7 6. Biología de la especie …………………………………………………………………8 6.1. Adulto …………………………………………………………………………8 6.1.1. Hábitat ……………………………………………………………..8 6.1.2. Alimentación ………………………………………………………8 6.1.3. Reproducción ……………………………………………………..9 6.2. Larva de Strombus sp. …………………………………………………….13 6.2.1. Organogénesis …………………………………………………..13 6.2.2. Características de la concha. ………………………………….14 6.2.3. Fase planctónica ………………………………………………..15 6.2.4. Metamorfosis …………………………………………………….15 7. Investigaciones de abundancia larval de S. gigas en el Caribe y SAM ………...16 III. HIPÓTESIS ……………………………………………………………………………………21 IV. OBJETIVOS …………………………………………………………………………………21 4.1. Objetivo general ……………………………………………………………………21 4.2. Objetivos específicos ………………………………………………………………21 x V. MATERIALES Y MÉTODOS ……………………………………………………….23 5.1. Área de estudio …………………………………………………………………..…23 5.2 Colecta de plancton y toma de parámetros fisicoquímicos …………………….23 5.3. Identificación de larvas de Strombus gigas ……………………………………..27 5.4. Análisis estadístico …………………………………………………………………30 5.4.1. Medidas de tendencia central ………………….………………………30 5.4.2. Análisis de varianza ………………….……………………………….…30 5.4.3. Análisis de correlación ………………….…………………………….…31 5.4.4. Estadística multivariada (Análisis de agrupamiento, ordenamiento y de discriminantes) ………………….…………………………….……………..31 VI. RESULTADOS ………………….…………………………….……………………………...36 6.1. Parámetros fisicoquímicos (Salinidad, temperatura y oxígeno disuelto) …….36 6.2. Abundancia espacial y temporal de gasterópodos …………………….…..…..43 6.3. Diversidad de gasterópodos en el Sistema Arrecifal Mesoamericano …...…..43 6.4. Abundancia espacio-temporal de S. gigas. ………………………………....…..52 6.5. Asociación entre parámetros fisicoquímicos y abundancia larval ………....….55 6.6. Tallas de S. gigas (espacio-temporal) ………....………………………………...56 6.7. Distribución horizontal y vertical de larvas en la caleta de Xel-Há (mayodiciembre de 2010) ………....……………………………….......................................60 6.8. Biodiversidad y distribución de especies en la caleta de Xel-Há ....................62 6.9. Patrón de abundancia larval de S. gigas en el SAM .......................................71 6.9.1. Análisis aglomerativo jerárquico (intra e interlocalidades) ………….71 6.9.2. Análisis de componentes principales (intra e interlocalidades) …….76 6.9.3. Análisis de discriminantes .................................................................81 6.9.3.1. Funciones empíricas ortogonales ......................................81 VII. DISCUSIÓN ………………….…………………………….……………………………......83 VIII. CONCLUSIÓN ………………….…………………………….………………………….....89 IX. ANEXOS ………………….…………………………….…………………………................90 X BIBLIOGRAFÍA ….…………………………….……………………………..…...................91 xi LISTA DE TABLAS Tabla 1. Desarrollo de tres especies del género Strombus sp. (Davis et al., 1993). …………………………………………………………………………………. 13 Tabla 2. Número de vueltas de espira por estadio en tres especies del género Strombus, S. gigas, S. costatus y S. raninus (Davis et al., 1993)…….. 14 Tabla 3. Características de las larvas de tres especies del género Strombus, S. gigas, S. costatus y S. raninus (Davis et al., 1993). …………………………. 15 Tabla 4. Relación cronológica de los estudios realizados en áreas con presencia de larvas de Strombus sp. en el Caribe y Atlántico, indicando la estrategia de muestreo aplicada, puntual o zonal. ……………………………… 20 Tabla 5. Densidad larval de gasterópodos (larvas•10 m3) en las localidades muestreadas dentro del Sistema Arrecifal Mesoamericano. n: número de muestras procesadas por muestreo; Media: valor medio por localidad; D.E.: Desviación estándar. Var: Varianza; Mín.: Valor mínimo; Máx.: Valor máximo; p: Valor de probabilidad obtenido del análisis de varianza de una vía por localidad. ……………………………………………………………………. 44 Tabla 6. Densidad media larval de S. gigas (Larvas•10m-3). n: número de muestras procesadas; Media: media muestral obtenido por localidad; D.E.: Desviación estándar; Var.: Varianza obtenida por localidad; Mín.: Valor mínimo; Máx.: Valor máximo; p: Valor de probabilidad resultante del análisis de varianza de una vía. …………………………………………………………….. 54 Tabla 7. Medias y valor de probabilidad para salinidad (0/00), temperatura (°C), oxígeno disuelto (O. D. mg·l-1) y densidad larval (Larvas·10 m-3); n, número de datos analizados; p(α0.05), valor de probabilidad del anova entre parámetro y localidades; r, coeficiente de correlación de Spearman. P, valor de significancia entre parámetro fisicoquímico y densidad larval. …………….. 55 Tabla 8. Tallas registradas en larvas de S. gigas (Longitud sifonal µm). Media: valor promedio muestral obtenido por localidad. D.E.: Desviación estándar. Var: Varianza muestral obtenida por localidad. Mín: Valor mínimo obtenido por localidad. Máx: Valor máximo obtenido por localidad. …………... 57 Tabla 9. Prueba de Duncan entre talla media y localidades; n2, número de larvas; —, sin dato; A y B, diferencias significativas (p≤ 0.05). ………………… 57 Tabla 10. Análisis de varianza entre tallas (Longitud sifonal en µm) y meses. FV, Factor de variación; SC, suma de cuadrados; gl, grados de libertad; CM, cuadrados medios; p(α0.05), valor de probabilidad. ……………………………….. 57 Tabla 11. Resultados de densidad media larval (larvas•10 m-3) en la caleta de Xel-Há (Muestreos horizontales). G: Gasterópodos; Sg: Strombus gigas… 61 Tabla 12. Resultados de densidad media larval (larvas•10 m-3) en la caleta de Xel-Há (Muestreos verticales). ………………………………………………… 61 xii Tabla 13. Funciones Empíricas Ortogonales (FEO) empleadas en el Análisis de Discriminantes. C I PM: Componente I de Puerto Morelos, C I XH: Componente I de Xel-Há, C I SK: Componente I de Sian Ka’an, C I MH: Componente I de Mahahual, C I SP: Componente I de San Pedro. ………….. 81 Tabla 14. Valores propios calculados para el prototipo digital generado para las cinco localidades analizadas en el Sistema Arrecifal Mesoamericano (C.: Componente). ……………………………………………………………………….. 81 0 Tabla 15. Temperatura (°C), salinidad ( /00), densidad media larval (Larvas·10 m-3) y correlaciones (r) a partir de datos reportados en la literatura. ……………………………………………………………………………... 86 Tabla 16. Registros de densidad larval de S. gigas para diferentes localidades del Caribe reportados en la literatura y en este estudio. Media: Media muestral obtenido por localidad. D.E.: Desviación estándar. Var: Varianza. Mín.: Valor mínimo. Máx.: Valor máximo. …………………………….. 87 Tabla 17. Datos reportados en la bibliografía y el presente estudio, Se representan los meses con presencia de larvas de S. gigas para diferentes localidades del Caribe. Ordenamiento de acuerdo a latitud (norte a sur)……... 88 Tabla 18. Numeración empleada en el AAJ y ACP entre localidades………… 90 xiii LISTA DE FIGURAS Figura 1. Especies del género Strombus distribuidas en el Sistema Arrecifal Mesoamericano. El tamaño de los especímenes en la figura es función de la talla real que presentan en la naturaleza. A: S. gigas; B: S. costatus; C: S. pugilis; D: S. gallus; E: S. alatus; F: S. raninus…………………………………… 3 Figura 2. Caracol rosa (Strombus gigas; Linnaeus, 1758)………………….…… 4 Figura 3. Distribución geográfica de la especie S. gigas (Ávila Poveda, 2001)…………………………………………………………………………………… 5 Figura 4. Sistema Arrecifal Mesoamericano……………………………………… 6 Figura 5. Ciclo de vida de S. gigas. A: Huevos de 200 µm; B: Eclosión, 1 día, 300 µm; C: 5 días, 400 µm; D: 15 días, 600 µm; E: 25 días, 900 µm; F: Asentamiento, 30 días, 1 mm; G: 6 meses, 5 cm; H: 1 año, 10 cm; I: Cópula de machos y hembras, 3 años, 20 a 25 cm; I: Desove, depositación de masa ovígera. B, C, D y E: Estadios larvales. F, G y H: Juveniles. I: Adultos. Fondo azul: Vida planctónica. Fondo rosa: Vida bentónica……………………………… 12 Figura 6. Larva veliger de Strombus gigas con 3 pares de lóbulos……………. 14 Figura 7. Sitios de muestreo enero-diciembre 2008. El área de estudio para la presente investigación comprende cinco sitios del Sistema Arrecifal Mesoamericano, cuatro ubicados en Quintana Roo, México (Puerto Morelos, Xel-Há, Sian Ka’an y Mahahual) y uno en Belice (San Pedro)…………………. 25 Figura 8. Sitios de muestreo en la caleta de Xel-Há para el año 2010………... 25 Figura 9. Red de arrastre tipo cónica empleada en el muestreo de larvas para el SAM. A: Red cónica (1.5 m de largo); B: Copo (abertura de malla de 300 µm); C: Boca de la red (diámetro de 30 cm)…………………………………. 26 Figura 10. Muestreos horizontales (arrastres) realizados en la caleta de XelHá de mayo a diciembre de 2010………………………………………………….. 26 Figura 11. Muestreos verticales (bombeos) realizados en la caleta de Xel-Há de julio a diciembre de 2010………………………………………………………… 27 Figura 12. Proceso de filtrado de muestra y separación de gasterópodos en laboratorio……………………………………………………………………………… 28 Figura 13. Estadios de crecimiento de larvas de tres especies del género Strombus: S. gigas, S. costatus y S. raninus (Davis et al., 1993)………………. 29 Figura 14. Mediciones realizadas a conchas de S. gigas: a) Ancho de concha; b) Longitud sifonal………………………………………………………….. 29 0 Figura 15. Salinidad media mensual ( /00) registrada durante el año 2008 en las localidades pertenencientes al Sistema Arrecifal Mesoamericano: San Pedro (Belice), Mahahual, Sian Ka’an, Xel-Há y Puerto Morelos……………….. 38 Figura 16. Temperatura media (°C) registrada durante el año 2008 en las 38 xiv localidades pertenencientes al Sistema Arrecifal Mesoamericano: San Pedro (Belice), Mahahual, Sian Ka’an, Xel-Há y Puerto Morelos………………………. Figura 17. Valores medios de Oxígeno disuelto (mg·L-1) registrada durante el año 2008 en las localidades pertenencientes al Sistema Arrecifal Mesoamericano: San Pedro (Belice), Mahahual, Sian Ka’an, Xel-Há y Puerto Morelos………………………………………………………………………………… 0 39 Figura 18. Salinidad mensual ( /00) registrada en las localidades de estudio…. 40 Figura 19. Temperaturas mensuales (°C) registradas en las localidades de estudio. ………………………………………………………………………………………… 41 -1 Figura 20. Valores mensuales de Oxígeno disuelto (mg·L ) en las localidades de estudio. …………………………………………………………………………… 42 Figura 21. Densidad de larvas de gasterópodos (larvas•10 m-3).en las cinco localidades de estudio del Sistema Arrecifal Mesoamericano. …………………. 44 Figura 22. Densidad media mensual de larvas de gasterópodos (larvas•10 m3 ) en las cinco localidades de estudio del Sistema Arrecifal Mesoamericano…. 45 -3 Figura 23. Abundancia media larval de gasterópodos (Larvas•10 m ) en las localidades de estudio. ……………………………………………………………… 46 Figura 24(a, b, c, d y e). Diversidad de gasterópodos en el Sistema Arrecifal Mesoamericano. ……………………………………………………………………… 47 Figura 25. Larvas de S. gigas encontradas en las localidades del Sistema Arrecifal Mesoamericano. …………………………………………………………… 51 Figura 26. Abundancia de larvas de S. gigas en el Sistema Arrecifal Mesoamericano. ……………………………………………………………………… 53 Figura 27. Abundancia de larvas de S. gigas en el tiempo……………………… 53 Figura 28. Densidad media larval de S. gigas (larvas•10 m-3) en el tiempo para las localidades de estudio. ……………………………………………………. 54 Figura 29. Tallas registradas en larvas de S. gigas (Longitud sifonal: µm) en el Sistema Arrecifal Mesoamericano. ……………………………………………… 58 Figura 30. Tallas registradas en larvas de S. gigas (Longitud sifonal: µm) en el tiempo. ……………………………………………………………………………… 58 Figura 31. Tallas registradas en larvas de S. gigas (Longitud sifonal: µm) en el tiempo por localidad de estudio con presencia de larvas. …………………… 59 Figura 32. Biodiversidad de larvas en la Caleta de Xel-Há. Sg: S. gigas; G: gasterópodos; C: crustáceos; P: Peces. …………………………………………... 62 Figura 33 (a, b y c). Diversidad de gasterópodos en Bocana. …………………. 63 Figura 34 (a y b). Diversidad de gasterópodos en Centro. …………………….. 65 xv Figura 35 (a y b). Diversidad de gasterópodos en Brazo Norte. ………………. 67 Figura 36 (a y b). Diversidad de gasterópodos en Cueva de los Milagros. …... 69 Figura 37. Análisis de agrupamiento para San Pedro, Belice. …………………. 72 Figura 38. Agrupamiento para Mahahual. ………………………………………... 73 Figura 39. Agrupamiento jerárquico para Sian Ka’an. …………………………... 73 Figura 40. Análisis de aglomeramiento para Xel-Há. …………………………… 74 Figura 41. Análisis de aglomeramiento para Puerto Morelos. …………………. 74 Figura 42. Agrupamiento UPGMA, análisis interlocalidades con cinco grupos. 75 Figura 43. ACP para San Pedro, Belice. …………………………………………. 77 Figura 44. ACP para Mahahual. …………………………………………………… 78 Figura 45. ACP para Sian Ka’an. ………………………………………………….. 78 Figura 46. ACP para Xel-Há. ………………………………………………………. 79 Figura 47. ACP para Puerto Morelos. …………………………………………….. 79 Figura 48. Análisis de componentes principales interlocalidades: San Pedro: agosto de 2008 (9); Sian Ka’an: agosto de 2008 (18); Puerto Morelos: abril, mayo y septiembre de 2008 (28, 29 y 33). ………………………………………... 80 Figura 49. Análisis de Discriminantes basado en un Análisis de Componentes Principales (ACP) donde los objetos están representados por las Funciones Empíricas Ortogonales (FEO) o prototipos digitales de cada localidad, los cuales fueron calculados a partir de desarrollar el polinomio del Componente I de una aproximación matemática del ACP. ………………………………………. 82 xvi I. INTRODUCCIÓN El caracol rosa (Strombus gigas) juega un importante rol ecológico, económico y social a lo largo de su distribución en el Caribe (Aldana Aranda y Brulé Desmarest, 1994; de Jesús Navarrete, 1999). En las últimas décadas su comercialización ha aumentado de manera significativa, posicionándose como la segunda pesquería después de la langosta espinosa Panulirus argus (Pérez Pérez y Aldana Aranda, 2002; Brito Manzano et al., 2006). Desde la década de los 80 y con base en diferentes estudios, se observó una disminución del 30% en la población de S. gigas en el Golfo de México y Mar Caribe, (García Santaella, 1992; de Jesús Navarrete, 1999). El decrecimiento de las poblaciones de caracol en la región del Caribe por sobrepesca, ha sido tema de preocupación y estudio para muchos países, en los cuales al ser un recurso comercial privilegiado por su alta demanda y valor, ya presenta problemas de sustentabilidad (Pérez Pérez y Aldana Aranda, 2000). Desde 1992 la especie S. gigas ha sido incluida en la lista de especies amenazadas, por lo cual, la CITES (Convención Internacional de Especies en Peligro de Extinción) regula y vigila el comercio de este recurso (de Jesús Navarrete, 2001; Brito Manzano et al., 2006). Derivado de esta problemática, se han realizado esfuerzos para la aplicación del cultivo larval de S. gigas, con la finalidad de repoblar los bancos afectados por el esfuerzo pesquero (Berg, 1976; Brownell et al., 1977). Hasta el momento los resultados no han sido satisfactorios, debido a que los costos de producción no son los adecuados, se presenta un lento crecimiento en los especímenes y se observa una elevada mortalidad de larvas y juveniles, constituyéndose así éstos entre los principales factores que limitan el desarrollo del cultivo (García Santaella, 1992). 1 Las primeras experiencias en el cultivo para S. gigas, fueron realizadas con larvas colectadas del medio natural (Robertson, 1959; D’Asaro, 1965; Berg, 1976; Brownell, 1977). Considerando las limitaciones para obtener larvas en el laboratorio, colectarlas del medio natural puede razonarse como un procedimiento para implementar acciones que permitan recuperar poblaciones sobreexplotadas, planteamiento que ha impulsado a realizar estudios destinados a identificar la distribución y abundancia larval de esta especie en el mar Caribe, especialmente en el Sistema Arrecifal Mesoamericano (Península de Yucatán). 2 II. ANTECEDENTES 1. Composición del género Strombus La familia Strombidae (Rafinesque, 1815), perteneciente al orden Mesogasteropa, alberga alrededor de 284 especies distribuidas en 20 géneros: Canarium, Conomurex, Dolomena, Doxander, Euprotomus, Gibberulus, Harpago, Labiostrombus, Laevistrombus, Lambis, Lentigo, Mirabilistrombus, Strombus, Terestrombus, Tibia, Tricornis, Tridentarius, Varicospira, Dientomochilus, Rostellaria, de los cuales, estos dos últimos están extintos. La mayor parte de las especies que integran esta familia se distribuyen en los Océanos Indico y Pacífico, encontrando en el Atlántico sólo seis especies del género Strombus, estas son S. gigas, S. costatus, S. pugilis, S. alatus, S. raninus y S. gallus (Fig. 1), de las cuales, el caracol rosa, Strombus gigas (Linnaeus, 1758), presenta la mayor importancia comercial en el Caribe (de Jesús Navarrete y Pérez Flores, 2007). Figura 1. Especies del género Strombus distribuidas en el Sistema Arrecifal Mesoamericano. El tamaño de los especímenes en la figura es función de la talla real que presentan en la naturaleza. A: S. gigas; B: S. costatus; C: S. pugilis; D: S. gallus; E: S. alatus; F: S. raninus. 3 2. Clasificación y posición taxonómica de S. gigas La clasificación taxonómica de S. gigas se presenta a continuación: Phylum: Mollusca Suborden: Hypsogastropoda Clase: Gastropoda Infraorden: Littorinimorpha Infraclase: Apogastropoda Superfamilia: Stromboidea Superorden: Caenogastropoda Familia: Strombidae Orden: Mesogastropoda Género: Strombus Especie: Strombus gigas; Linnaeus, 1758 (Fig. 2) Figura 2. Caracol rosa (Strombus gigas; Linnaeus, 1758) 4 3. Distribución geográfica de S. gigas El caracol rosado (S. gigas) se distribuye geográficamente a lo largo del Sistema Arrecifal Mesoamericano y resto del Caribe, desde el Sureste de Florida, aguas costeras del Norte de Sudamérica, aguas de Brasil, Antillas menores y Bermuda (Randall, 1964; Ávila Poveda, 2001) (Fig. 3). Se encuentra principalmente en fondos marinos arenosos y pastizales de aguas limpias, entre los 5 y 120 m de profundidad (Flores, 1964; García Santaella, 1992). Figura 3. Distribución geográfica de la especie S. gigas (Ávila Poveda, 2001). 4. Sistema Arrecifal Mesoamericano El Sistema Arrecifal Mesoamericano (SAM) es un ecosistema de aproximadamente 1,000 km de longitud que comprende los países de México, Belice, Guatemala y Honduras (Fig. 4). Este, es considerado el sistema arrecifal de barrera más grande del Mar Caribe y el segundo en tamaño del mundo, sólo después de la Gran Barrera Arrecifal Australiana (Semarnat, 2010). 5 Figura 4. Sistema Arrecifal Mesoamericano La región donde se encuentra el SAM se caracteriza por presentar arrecifes de borde, de barrera y atolones, cayos, islas, humedales costeros, lagunas arrecifales y costeras, praderas de pastos marinos y bosques de manglar. Incluye 60 Áreas Naturales Protegidas (ANP) declaradas oficialmente, que proveen hábitat para la alimentación, anidación y crianza de flora y fauna. Muchas especies que habitan las ANP son de importancia comercial, razón por la que se encuentran en la condición de especies amenazadas o en peligro de extinción (Semarnat, 2010). Este sistema arrecifal es el hábitat de más de 65 especies de corales pétreos, 350 especies de moluscos y más de 500 especies de peces. Hay numerosas especies que viven en o alrededor del SAM que están en peligro de extinción o bajo algún grado de protección, tal es el caso de las tortugas marinas verde, boba, laúd y carey, los cocodrilos Americano y de Morelet, los corales cuerno de alce y negro, el manatí de las Indias Occidentales y el Caracol reina Strombus gigas (Semarnat, 2010). 6 5. Pesquería de S. gigas en el Sistema Arrecifal Mesoamericano México. La pesquería de caracol a nivel comercial data desde los años cincuenta, así para Quintana Roo las capturas de caracol provenían inicialmente de Holbox, Puerto Morelos, Bahía de la Ascensión, Espíritu Santo, Cozumel, Punta Herrero, Xcalak y Banco Chinchorro (única vigente a la fecha). La producción reportada para 1975 fue de 350 t, disminuyendo a 150 t para 1987 (Aldana Aranday Brulé Demarest, 1994). Para 1991 se reporta una captura de 200 t, ascendiendo a 450 t en 1997 (Sagarpa, 2006), mientras que para 2009 se capturó menos de 80 t (Sagarpa, 2009). Belice. La producción de caracol entre 1990 y 2005 ha variado de 141 a 264 Tm (310.000 y 580.000 lbs.). En el 2005, se capturó aproximadamente 288 Tm (633.070 lbs.), de las cuales se exportaron aproximadamente 245 Tm (538.144 lbs.) con un valor de US$ 3,875,542.5. De 1977 a 2005, el volumen de producción de caracol en peso vivo (incluyendo la concha) se estimo entre 1,131,321 Kg y 2,923,632 Kg. En 1977, la producción fue de aproximadamente 2,737,621 Kg, sin embargo, durante los siguientes años se observó una disminución hasta principios de los 80 (Belize Fisheries Department, 2006). Guatemala. No existen registros históricos de esfuerzo y capturas. Sin embargo para 2006 se reportan 46.2 t anuales de producción (FAO, 2009). Honduras. La extracción de S. gigas se realiza desde finales de la década de 1970, como resultado de la necesidad de explotar un nuevo recurso pesquero, sin embargo existe una moratoria desde el año 2005. La producción comenzó a ser reportada a partir de 1988 (93.6 t) y alcanzó las 1,000 toneladas en 2003. Las exploraciones científicas que se realizan desde 2006 generan 210 toneladas (462 000 libras), cantidad autorizada por la CITES como cuota científica (FAO, 2009). 7 6. Biología de la especie 6.1. Adulto 6.1.1. Hábitat El caracol rosa habita en aguas someras del Caribe, a lo largo de las planicies arenosas y praderas de pastos marinos (Thalassia testudinum, Halodule wrightii y Syringodium filiforme), también se encuentran en sustratos de pedacería de coral y en sedimentos de arenas gruesas y gravas. Los juveniles prefieren zonas con densidades moderadas de pastos marinos que las zonas de arena descubierta, mientras que los adultos tienen menos especialización por el hábitat (de Jesús Navarrete, 1999). Existe una distribución de los organismos respecto a la profundidad, observándose que los juveniles se encuentran en zonas someras (< 3.0 m) mientras que los adultos pueden ubicarse a mayor profundidad (hasta 60 m). Sin embargo, la presencia del caracol está limitada a la zona fótica ya que ahí encuentra su alimento (de Jesús Navarrete, 1999). 6.1.2. Alimentación La alimentación se realiza mediante una larga probóscide, que tiene una boca terminal y con la cual el caracol ingiere pequeñas partículas alimenticias del sedimento marino. Utiliza solamente las micro algas bénticas y/o epifitas, así como algunos detritus orgánicos (Orr y Berg, 1987). S. gigas es un micro herbívoro, que se alimenta con su rádula principalmente de algas epifitas del pasto marino Thalassia testudinum, aunque en condiciones de escasez pueden consumir macrodentritus. El caracol rosa selecciona las algas 8 finas que pueda comer y digerir con facilidad. No poseen dientes con los cuales puedan cortar o mascar y por lo tanto no es capaz de consumir pedazos de algas. Los caracoles que ingieren arena en las zonas de planicies marinas, en realidad se alimentan de diatomeas y algas filamentosas que comprenden el micrófito bentos asociado al sedimento marino (Orr y Berg, 1987). En análisis de contenido estomacal, Randal (1964) encontró un alto contenido de material de origen vegetal, principalmente Thalassia testudinum, Halophila baillonis, cianobacterias (Lingbia majuscula) y microalgas (Microcoleus sp., Anacystis sp., Gracillaria verrucosa), fragmentos de Cladophora sp., Caulerpa sp., Dyctiota sp., y un pequeño porcentaje de materia animal como moluscos, pequeños crustáceos y esponjas los cuales son ingeridos de manera accidental. 6.1.3. Reproducción El adulto y el juvenil se distribuyen en sitios similares. Existen migraciones reproductivas en las que los adultos se mueven a zonas someras para realizar la copula y depositar las masas de huevos. Muchos de los caracoles son capturados por los pescadores en ese movimiento migratorio (de Jesús Navarrete, datos no publicados). Strombus gigas es un organismo dióico con fertilización interna; en general, las hembras son unos centímetros más grandes que los machos. Es fácil distinguir entre hembras y machos adultos ya que estos últimos poseen un pene, que se asemeja a un tercer pedúnculo ocular; situado sobre el pie a la altura del ojo derecho; las hembras poseen un canal ovígero que se observa como una línea muy delgada que se extiende por encima del ojo derecho bajando hacia el extremo del pie. 9 Los caracoles sexualmente maduros se caracterizan por el engrosamiento del labio en su concha y esto ocurre aproximadamente entre los 3 o 3.5 años de edad o entre 180 a 270 mm de longitud sifonal (Stoner y Lally, 1994). A esta edad el labio del caracol es de aproximadamente 4 mm de espesor; esta estimación la se basa en la presencia de los órganos sexuales y en estudios histológicos de las gónadas (Orr y Berg, 1987). Así, existe una diferencia notable entre un caracol de talla legal (20 cm) y uno sexualmente maduro, con un labio de 4 mm de espesor. Ello implica que, al menos en Chinchorro, un alto porcentaje de la población es extraído antes de que se pueda reproducir, con una clara repercusión sobre la pesquería. El período reproductivo es de 2.5 a 3 años y el promedio de vida del caracol es de 6 años. La relación de sexos es 1:1 y la reproducción ocurre durante todo el año en algunas áreas, pero en general la actividad reproductiva es más intensa en los meses cálidos (Randall, 1964). En México y Venezuela se informó de una reproducción continua (Corral y Ogawa, 1987; Cruz, 1984; Weil y Laughlin, 1984). No obstante, datos sobre reclutamiento indicaron que para la costa sur de Quintana Roo no ocurre reproducción en julio, ni se observaron masas de huevos (de Jesús Navarrete y Oliva Rivera, 1997). En Florida, Bahamas, Turk y Caicos, la reproducción está restringida al período marzo-octubre cuando la temperatura del agua es elevada (Stoner et al., 1992). Para la reproducción se requiere de aguas transparentes y sedimento arenoso con bajo contenido de materia orgánica. El primer aspecto del comportamiento reproductivo es la agregación de hembras y machos. Posteriormente viene una atracción diferencial, un macho se alinea con una hembra, hasta el punto que las conchas quedan juntas y entonces empieza la cópula. El hecho de que los machos se orienten de manera paralela a la corriente del fondo sugiere que las hembras liberan una feromona que permite a los machos identificarlas (Weil y Laughlin, 1984, Rathier, 1993). 10 Se ha observado que el inicio de la puesta de masas ovígeras, atrae a mas caracoles adultos a las zonas reproductivas (Davis, 1984). La actividad reproductiva se interrumpe en el tiempo de tormentas o nortes ya que el caracol se entierra en el sedimento. La cópula se realiza en zonas de buena circulación de agua con fondos de arena fina o con grava y aparentemente puede ocurrir a cualquier profundidad. Se ha visto que el esperma es viable por varias semanas en el receptáculo seminal; una hembra puede desovar y copular al mismo tiempo. Los desoves ocurren en sitios localizados y específicos que la hembra elige, de acuerdo con las condiciones ambientales; sin embargo, los requerimientos particulares no son bien conocidos. Aparentemente, los factores que mayor influencia tiene son la temperatura del agua y el fotoperiodo (Stoner y Sandt, 1992). Cuando desova, la hembra genera un tubo gelatinoso que es liberado por su canal ovígero frente al pie, sin desplazarse y moviendo su pie ligeramente hacia adelante y hacia atrás va construyendo la masa ovígera en forma de "S". A esta masa se van adhiriendo partículas de arena que la cubren y la disimulan en el sedimento. Las hembras pueden poner varias masas ovígeras después de una copulación. La masa ovígera mide entre 100 a 150 mm de longitud y puede contener una cantidad variable de embriones que van desde 250,000 a 750,000 (Robertson, 1959). La especie presenta una maduración sexual tardía, sin embargo la especie es iterópara, es decir tiene varias reproducciones durante su ciclo de vida. Cada hembra puede poner entre 6 y 8 masas de huevos por temporada reproductiva lo que marca una producción de hasta 106,000,000 larvas por año. Transcurridos los primeros cinco días, los huevos eclosionan y dan origen a una larva veliger que tiene una longitud promedio de 250 µm y nada libremente en la columna de agua (D’Asaro, 1965). Después de 30 días, las larvas presentan metamorfosis y se asientan en el fondo, dando origen a un caracol juvenil de aproximadamente dos mm de longitud. Al cabo de un año, los caracoles alcanzan 11 una longitud promedio de 14 cm, a los tres años, comienzan a formar el labio que indica el inicio de la madurez sexual (Fig. 5) (de Jesús Navarrete y Oliva Rivera, 2007). Figura 5. Ciclo de vida de S. gigas. A: Huevos de 200 µm; B: Eclosión, 1 día, 300 µm; C: 5 días, 400 µm; D: 15 días, 600 µm; E: 25 días, 900 µm; F: Asentamiento, 30 días, 1 mm; G: 6 meses, 5 cm; H: 1 año, 10 cm; I: Cópula de machos y hembras, 3 años, 20 a 25 cm; I: Desove, depositación de masa ovígera. B, C, D y E: Estadios larvales. F, G y H: Juveniles. I: Adultos. Fondo azul: Vida planctónica. Fondo rosa: Vida bentónica. 12 6.2. Larvas de Strombus sp. 6.2.1. Organogénesis Al eclosionar la larva mide aproximadamente 300 µm, alcanzando una longitud de 1,125 µm ± 71 µm al momento de la metamorfosis (Fig. 4) (Davis et al., 1990; Davis et al., 1993). De las tres especies descritas por Davis et al. (1993), S. gigas presenta el desarrollo larval más rápido, pero, su tamaño de concha es menor comparándola con S. raninus, el cual, alcanza la mayor longitud de concha al llegar a la fase final de su etapa larvaria (Tabla 1). Tabla 1. Desarrollo de tres especies del género Strombus sp. (Davis et al., 1993). Especie Observación S. gigas S. costatus S. raninus Crecimiento 39µm/día 28µm/día 31µm/día Competencia 21 días 32 días 40 días Al momento de la eclosión, las larvas del género Strombus presentan dos lóbulos velares empleados para la natación, respiración y alimentación, los cuales, se dividen en cuatro al quinto día, además se presenta una proyección en el pico de la concha y se hace visible la columela. Al octavo día el número de lóbulos aumenta a seis (Fig. 5) (Davis et al., 1993). Para los días nueve y diez, la larva desarrolla su segunda vuelta en la concha, alrededor del día 17 aparece la glándula del pie (ahora se conoce como larva pediveliger) y los lóbulos incrementan su tamaño (Fig. 6), para el día 28 se genera la garra del opérculo y la concha forma su tercera vuelta, los órganos ya están formados y es considerada como competente (Davis et al., 1993; de Jesús Navarrete, 1999). 13 Figura 6. Larva veliger de Strombus gigas con 3 pares de lóbulos. 6.2.2. Características de la concha Basado en el crecimiento y formación de la estructura de la concha, se han establecido cinco estadios para tres especies de Strombus, las cuales son el número de vueltas por espira, abertura del canal sifonal, ornamentaciones de la concha, etc. (D’Asaro, 1965; Davis et al., 1993) (Tabla 2 y 3). Tabla 2. Número de vueltas de espira por estadio en tres especies del género Strombus, S. gigas, S. costatus y S. raninus (Davis et al., 1993). ESPECIES Estadio S. gigas S. costatus S. raninus I 1.5 1.5 1.25 II 2 2.5 1.5 III 2.5 3 3.5 IV 3 3.5 4 V 4 4 5 14 Tabla 3. Características de las larvas de tres especies del género Strombus, S. gigas, S. costatus y S. raninus (Davis et al., 1993). ESPECIES Características S. gigas S. costatus S. raninus Transparente Color Blanquecino Semitransparente Ápice Redondeado Forma de domo Espira Redondeada Líneas de la concha Pequeño y puntiagudo Elongada y ligeramente cóncava 4 líneas paralelas Triangular Banda en forma de 1 banda cadenas de C sombreada 6.2.3. Fase planctónica Los organismos pertenecientes al género Strombus, presentan un desarrollo indirecto, es decir, se desarrollan a partir de una larva veliger, la cual, se forma parte del plancton en un período de tres a seis semanas según la especie (Davis et al., 1993). Las larvas de S. gigas pueden permanecer en la columna de agua durante un período de dos a cuatro semanas, su transporte depende en gran parte de las corrientes, aunque al igual que otros organismos del zooplancton exhiben movimientos natatorios activos que les permiten mantener una posición vertical en la columna de agua, les es imposible moverse contra corrientes fuertes, lo cual, controla la distribución horizontal, mientras la distribución vertical es influenciada por aspectos físicos, químicos y biológicos presentes en el medio (Molinet, 2009; Odum, 1971; Oliva Rivera, 2007). 6.2.4. Metamorfosis En condiciones de cultivo, la metamorfosis puede inducirse por la agregación de extractos algales (Laurencia poitei) o inductores químicos como KCL, observándose en condiciones de cultivo a 25-31°C que esta puede alcanzar tallas de 1.20±0.01 mm entre los 21 y 23 días (larvas competentes) e iniciar la 15 metamorfosis (Davis, 1994a). Mientras que D´Asaro (1965) en cultivos a 24°C señala haber alcanzado la metamorfosis entre 45 y 50 días. 7. Investigaciones de abundancia larval de S. gigas en el Sistema Arrecifal Mesoamericano (SAM) y mar Caribe. Los estudios realizados en el Sistema Arrecifal Mesoamericano (SAM) para larvas de Strombus gigas son escasos, el número mayor de investigaciones se han realizado en México, especialmente al Norte de la Península de Yucatán, entre Arrecife Alacranes, Yucatán y Cozumel, Q. Roo, Arrecife Alacranes, Banco Chinchorro, Bahía la Ascensión, Xel-Há, región Norte y Sur de Quintana Roo. En Belice sólo ha sido estudiada la abundancia larval en la región de Hol-Chán, sin embargo no existen reportes para Guatemala y Honduras. También se han realizado trabajos sobre distribución y abundancia de larvas de S. gigas en distintas partes del Caribe, comprendiendo, además de los sitios antes mencionados, las áreas de Bahamas, Florida, Venezuela y Puerto Rico. Respecto a este tópico se observan dos tendencias de muestreo, una puntual, donde específicamente se estudia un sitio y otra zonal, en la que se analiza un área determinada. En la tabla 4 se presenta en orden cronológico los estudios reportados para el género Strombus en el Caribe y el Atlántico, donde se indica la estrategia de muestreo seguida. Chaplin y Sandt (1992) realizaron varios estudios en Bahamas, determinando que la mayor parte de los organismos se distribuían durante el día en el primer metro de la columna de agua presentando distribución vertical en la noche, asimismo, reportan tallas no mayores a las 600 µm para esta zona. A su vez, Appeldoorn (1993), realizó arrastres de mayo a agosto de 1993 en Puerto Rico, reportando 16 valores máximos de abundancia para junio, de 0.681 a 0.465 larvas•10 m3 y para agosto, de 0.379 a 0.254 larvas•10 m3. En el caso de Stoner et al. (1997), de mayo a septiembre de 1992 y 1994, realizaron colectas de plancton en cayos arrecifales ubicados entre 5 y 10 km fuera de las costas de Florida, cuya finalidad fue determinar la relación del reclutamiento de larvas de las especies S. gigas y S. costatus, con la hidrografía del área. Los autores identificaron densidades para S. gigas de 0.6 a 0.09 larvas•10 m-3 en 1992 y de 1.3 larvas•10 m-3 para 1994. En este estudio se concluyó que, en base a las estructuras de tallas registradas, los organismos colectados eran provenientes de la zona. Los autores Stoner y Davis (1997a), realizaron varios muestreos en Bahamas de 1988 a 1994, encontrando una mayor abundancia en el periodo junio-agosto con densidades de 0.2 a 4 larvas•10 m-3 y tallas de 500 a >900 µm. Estos mismos autores, pero en otro estudio (Stoner y Davis, 1997b), realizaron muestreos diurnos y nocturnos en tres hábitats de Bahamas a profundidades de 1, 8 y 18 m, encontrando que la mayor abundancia se presentaba en el primer metro de profundidad, tanto de día como de noche, las mayores abundancias fueron reportadas para junio y septiembre. De 1995 a 1996, Oliva Rivera y de Jesús Navarrete (2000), realizaron muestreos verticales de plancton a 2 m de profundidad en el área comprendida entre Puerto Morelos a Cancún, Banco Chinchorro y Hol-Chán, Belice, encontrando larvas de S. gigas sólo en el mes de julio, únicamente para Banco Chinchorro, con una densidad de 20 larvas•10 m-3. En otro estudio, De Jesús Navarrete (1999 y 2001), realizó muestreos bimensuales en Banco Chinchorro de agosto de 1997 a julio de 1998, reportando densidades de 0.00093 a 7.42 larvas•10 m-3. Los mayores registros de abundancia larval se presentaron en la época de lluvias y corresponden a 467 larvas, seguida por la temporada de nortes, cuya densidad 17 fue de 283 larvas y por último la época de secas que presento un valor de 48 larvas. En cuanto a las tallas larvales, se identificó un intervalo de 150 a 950 µm, siendo las más frecuentes las comprendidas entre 150 y 320 µm. En el Archipiélago de Los Roques, Venezuela, Posada (2003), realizó muestreos en agosto de 1998 reportando densidades de 0.378 y 0.632 larvas•10 m-3. Así como, que la distribución de tallas era de 150 a 450 µm, implicando el 47.6 % del total de larvas colectadas principalmente al interior del archipiélago y de 451 a 650 µm, que correspondían al 34.5 % de este mismo total. En la zona norte de la Península de Yucatán Pérez Pérez et al. (2003), realizaron un estudio durante marzo, julio y octubre de 2001, identificando a este último como el mes con mayor abundancia, 53 larvas•10 m-3, 90 % pertenecientes a S. gigas, asimismo, reportaron valores de 0.004 a 0.45 larvas•10 m-3 para Arrecife Alacranes. Para el Arrecife Alacranes, Aldana Aranda y Pérez Pérez (2007), realizaron muestreos de noviembre de 1999 a octubre de 2000, estimando densidades de 0.31 a 5.24 larvas•10 m-3, perteneciendo el 86.42 % de los organismos a la clase I o <350 µm y el 2.35 % a larvas de 450 a 950 µm, los autores hacen énfasis en que los organismos provienen del área de estudio. En cuanto a la Bahía la Ascensión, De Jesús Navarrete y Pérez Flores (2007) realizaron un estudio de agosto de 1990 a julio de 1991 encontrando larvas de S. gigas durante el período agostonoviembre registrando los valores de densidad de 0.20936 para agosto, de 0.0016 para septiembre, de 0.0347 durante octubre y de 0.0005 larvas•10 m-3 en noviembre, de las cuales el 95.5 % de éstas pertenecen al estadio IV (Tabla 1). En Xcaret y Xel-Há, Quintana Roo, Pacheco Archundia (2007), realizó arrastres superficiales y de fondo durante el periodo noviembre de 2006 a marzo de 2007, encontrando organismos sólo en este último mes con densidades de 0.07 larvas•10 m-3 en la superficie y de 0.02 larvas•10 m-3 en el fondo, así como tallas 18 que se encontraban dentro del intervalo 1,000 a 1,167 µm. Respecto a la abundancia larval de S. gigas en Florida, Delgado et al. (2008), la estudiaron durante el periodo mayo-agosto de 1996 a 2002, reportando que las larvas registradas se encontraban en dos estadios de desarrollo. El primero o estadio medio presentó una densidad de 0 a 5.09 larvas•10 m-3, y el segundo o estadio tardío, cuya densidad fue de 0 a 12.69 larvas•10 m-3. Por último, Bravo Castro (2009), analizó la abundancia larval de S. gigas en 12 sitios de la zona norte de Quintana Roo durante el ciclo enero-diciembre de 2005, encontrando un total de 417 larvas, señalando que los mayores registros de abundancia se presentaron de agosto a septiembre. Las tallas observadas en dicha investigación fueron de 200 a 320 µm, las cuales pertenecen al estadio larval II y III (Tabla 1), que corresponden a aproximadamente una longevidad de 5 días después de la eclosión. 19 Tabla 4. Relación cronológica de los estudios realizados en áreas con presencia de larvas de Strombus sp. en el Caribe y Atlántico, indicando la estrategia de muestreo aplicada, puntual o zonal. Autor Año Localidad Latitud N Longitud W Estrategia 23°46’ 76°06’ Puntual 17°58’11” 67°02’50” Puntual Chaplin y Sandt 1992 Bahamas Appeldoorn 1993 Puerto Rico Stoner y Davis 1997a Bahamas 23°46' 76°06' Puntual Stoner y Davis 1997b Bahamas 24°30' 76°34.5' Puntual Stoner et al. 1997 Florida 24°32.5’ 81°24.1’ Puntual de Jesús Navarrete 1999 Banco Chinchorro 18°23‘-18°47’ 87°14‘-87°27’ Zonal de Jesús Navarrete 2001 Banco Chinchorro 18°23‘-18°47’ 87°14‘-87°27’ Zonal 18°23‘-18°47’ 87°14‘-87°27’ Zonal 18°23‘-18°47’ 87°14‘-87°27’ Zonal Oliva Rivera y de Jesús Navarrete de Jesús Navarrete y Aldana Aranda Pérez Pérez et al. Posada de Jesús Navarrete y Sur de Quintana Roo, 2000 Banco Chinchorro y HolChán, Belice 2000 2003 2003 Banco Chinchorro Norte de la Península de Yucatán Archipiélago de Los Roques, Venezuela 18°21'-21°40' y 21°30'-23°42' 87°22'-86°30' y 87°00'- Zonal 90°00' 12°00'-11°40' 67°05'-66°25' Zonal 2007 Bahía de la Ascensión 19°30'-19°47' 87°29'-87°45' Zonal 2007 Arrecife Alacranes 22°21'-22°35' 89°38'-89°39' Zonal Pacheco Archundia 2007 Xel-Há 17°22' 87°16' Puntual Delgado et al. 2008 Florida 24°27’-25°00’ 80°22‘-81°52’ Zonal Bravo Castro 2009 Norte de Quintana Roo 20°49´-21°10´ 86°43´-86°55' Zonal Pérez Flores Aldana Aranda y Pérez Pérez 20 III. HIPÓTESIS 1. La distribución y abundancia espacio-temporal de larvas de Strombus gigas es la misma en el Sistema Arrecifal Mesoamericano. 2. La distribución y abundancia larval de S. gigas es la misma en un ciclo anual. 3. La larva de S. gigas se distribuye homogéneamente en la columna de agua. IV. OBJETIVOS 4.1. General Determinar la distribución y variación de la abundancia larval de Strombus gigas durante un ciclo anual para cinco sitios del Sistema Arrecifal Mesoamericano: México: Puerto Morelos, Sian Ka’an, Mahahual, Xel-Há; Belice: San Pedro. 4.2. Específicos Observar la variación de los parámetros fisicoquímicos en el Sistema Arrecifal Mesoamericano. Analizar la abundancia espacio-temporal de moluscos gasterópodos en el Sistema Arrecifal Mesoamericano. Analizar la riqueza especifica de moluscos gasterópodos en el Sistema Arrecifal Mesoamericano. Analizar la abundancia espacio-temporal de larvas de S. gigas en el Sistema Arrecifal Mesoamericano. 21 Analizar la estructura de tallas en larvas de S. gigas del Sistema Arrecifal Mesoamericano. Observar la asociación de los parámetros fisicoquímicos con la abundancia larval de S. gigas del Sistema Arrecifal Mesoamericano. Analizar el patrón de abundancia temporal de S. gigas en el Sistema Arrecifal Mesoamericano. Comparar técnicas de muestreo de plancton vertical y horizontal en la Caleta de Xel-Há. Analizar la distribución larval de S. gigas, gasterópodos, peces y crustáceos en la Caleta de Xel-Há. 22 V. MATERIALES Y MÉTODOS 5.1. Área de Estudio El área de estudio para el período enero-diciembre de 2008 en la presente investigación comprende cinco sitios del Sistema Arrecifal Mesoamericano, cuatro ubicados en Quintana Roo, México y uno en Belice. El primero de los sitios es Puerto Morelos, cuya ubicación geográfica es 20°49’21”-20°51’21”N y 86°51’50”86°52’45”W; el segundo es Xel-Há, localizado en las coordenadas 20°18’51”20°19’00”N y 87°21’20”-87°21’25”W; el tercer sitio es Sian Ka’an, localizado geográficamente entre los 19°44’28”-20°00’58”N y 87°27’10”-87°28’10”W; el cuarto es Mahahual ubicado entre los 18°42’15”-18°42’57”N y 87°42’10”-87°42’30”W; la última localidad es San Pedro, Belice, la cual se ubica a los 17°50’44”-18°06’41”N y 87°50’09”-88°01’14”W (Fig. 7). Para el período mayo-diciembre de 2010, el sitio de estudio fue la caleta de XelHá, situada en el estado de Quintana Roo entre los 20°18’50”-20°19’17”N y 87°21’02.5”-87°21’45.5” (Fig. 8). La caleta recibe aportes subterráneos de agua dulce, factor que genera un fenómeno de haloclina, característica considerada para la selección del sitio, además de su accesibilidad para realizar monitoreos y la población considerable de juveniles y adultos que esta presenta. 5.2. Colecta de plancton y registro de parámetros fisicoquímicos Se realizaron de uno a tres arrastres superficiales en cada sitio de muestreo, empleando una embarcación con motor fuera de borda a una velocidad constante de 5 m/min. La duración del arrastre fue de 5 minutos a una profundidad de 1 m, empleando una red cónica de 30 cm de diámetro de boca, 1.5 m de largo y una abertura de malla de 300 µm (Fig. 9). Los muestreos fueron realizados entre la línea costera y la barrera arrecifal de cada sitio con excepción de Xel-Há. A la par 23 que se efectuaron los arrastres, mensualmente se realizaron registros puntuales de temperatura (°C), salinidad (0/00) y de oxígeno disuelto (mg·L-1), empleando un medidor de parámetros YSI-55. Se realizaron arrastres superficiales de mayo a diciembre de 2010 (Fig. 10), en cuatro puntos de la caleta de Xel-Há para los sitios Bocana, Centro, Brazo Norte y Cueva de los Milagros. La toma de muestras se realizó desde una embarcación con motor fuera de borda a una velocidad de 1 m/s durante 5 minutos, utilizando una red cónica de 60 cm de diámetro, 1.5 m de largo y una abertura de malla de 300 µm. Con objeto de examinar variaciones en el método de colecta, conocer la distribución de larvas de S. gigas en la fracción vertical de la columna de agua y comprender el patrón que esta guarda, así como que factores están implícitos en su movilidad, se realizaron muestreos verticales en zona superficial (aprox. 1 m) y profunda (aprox. 2.5 m) de los cuatro puntos, empleando una bomba sumergible de flujo constante de 20 L·min (Fig. 11), los muestreo en profundidad fueron realizados en zonas con salinidad entre 25 y 30 0/00, valores medidos con medidor de parámetros YSI-85. Las muestras obtenidas en arrastres y bombeos, fueron fijadas en formol salino al 4 %, neutralizado con Borato de Sodio (Na3BO3) y transportadas al laboratorio para su posterior análisis. 24 Figura 7. Sitios de muestreo enero-diciembre 2008. El área de estudio para la presente investigación comprende cinco sitios del Sistema Arrecifal Mesoamericano, cuatro ubicados en Quintana Roo, México (Puerto Morelos, Xel-Há, Sian Ka’an y Mahahual) y uno en Belice (San Pedro). Figura 8. Sitios de muestreo en la caleta de Xel-Há para el año 2010. 25 Figura 9. Red de arrastre tipo cónica empleada en el muestreo de larvas para el SAM. A: Red cónica (1.5 m de largo); B: Copo (abertura de malla de 300 µm); C: Boca de la red (diámetro de 30 cm). Figura 10. Muestreos horizontales (arrastres) realizados en la caleta de Xel-Há (mayo-diciembre de 2010). 26 Figura 11. Muestreos verticales (bombeos) realizados en la caleta de Xel-Há de julio a diciembre de 2010. 5.3. Identificación de larvas de S. gigas El análisis de muestras de plancton se realizó en el Laboratorio de Biología y Cultivo de Moluscos del CINVESTAV-IPN, Unidad Mérida. Esta fase del estudio comprendió cuatro pasos. El primero consistió en la preparación de la muestra, la cual fue filtrada en un tamiz de 80 µm. El segundo paso fue realizar la separación de los gasterópodos, colocando parte de la muestra filtrada en un separador de cristal para su observación a través de un microscopio estereoscópico Leica Zoom 2000 las larvas fueron separadas del resto del plancton, colocándolas en viales de cristal con una solución de alcohol al 70 % (Fig. 12). 27 Figura 12. Proceso de filtrado de muestra y separación de gasterópodos en laboratorio. El tercer paso consistió en identificar y separar las larvas de Strombus sp. Se observaron las larvas de los gasterópodos al estereoscopio y empleando guías de identificación de larvas del género Strombus se separaron los estrómbidos, colocándolos en viales con alcohol al 70 %. El cuarto paso fue obtener las larvas de S. gigas, lo cual se logró al identificarlas empleando la metodología planteada por Davis et al. (1993) (Fig. 13). Con el objetivo de determinar la estructura de tallas, se midió la amplitud de concha y longitud sifonal (µm), a las larvas encontradas en la muestra (Fig. 14). Para efectuar esta medición se utilizó un micrómetro previamente instalado en el objetivo 10X de un microscopio óptico Zeiss. Una vez separadas las larvas de 28 gasterópodos, fueron tomadas imágenes mediante Microscopía Electrónica en el Laboratorio de Microscopía Electrónica del Cinvestav-IPN, Mérida. Figura 13. Estadios de crecimiento de larvas de tres especies del género Strombus: S. gigas, S. costatus y S. raninus (Davis et al., 1993). Figura 14. Mediciones realizadas a conchas de S. gigas: a) Ancho de concha; b) Longitud sifonal. 29 5.4. Análisis Estadístico Para estimar la densidad larval en los sitios muestreados se estandarizaron los resultados obteniendo un volumen de larvas·10 m-3, dicho resultado se obtuvo empleando la siguiente fórmula: Biomasa (larvas·10m-3): [N° Organismos / Volumen (m-3)]*10 Se empleó el programa InfoStat Profesional/Versión 1.1 para realizar los siguientes análisis: 5.4.1. Medidas de tendencia central Se calcularon medias, desviación estándar, valores mínimos, y máximos para parámetros fisicoquímicos y la abundancia larval de gasterópodos registradas en cada sitio durante el período de muestreo. Asimismo, se aplicaron estos parámetros estadísticos para examinar la abundancia y tallas de S. gigas (longitud sifonal: µm) entre zonas y meses. 5.4.2. Análisis de varianza Se aplicó análisis de varianza a la abundancia larval de gasterópodos, S. gigas, tallas obtenidos en espacio y tiempo para el Sistema Arrecifal Mesoamericano, y para Xel-Há en los dos períodos de estudio (enero-diciembre de 2008 y mayodiciembre de 2010). Asimismo se empleo este estadístico a los parámetros fisicoquímicos para observar las diferencias existentes entre sitios. 30 5.4.3. Análisis de correlación Se realizaron análisis de correlación de Spearman para observar la asociación de la abundancia larval de S. gigas con los parámetros fisicoquímicos temperatura (°C), salinidad (0/00) y oxígeno disuelto (mg·L-1). 5.4.4. Estadística multivariada El objetivo de emplear estadística multivariada en el presente estudio fue evaluar la influencia que ejercen descriptores de distinta naturaleza en la variación espacio temporal de la abundancia larval de Strombus gigas en cinco sitios del Sistema Arrecifal Mesoamericano. La mayoría de los estudios generan dos o más variables que influencian el análisis, por lo cual, al evaluar de manera conjunta a estos predictores o variables responsables, el empleo de estadística multivariada es más adecuado. De esta forma, esta aproximación en el análisis numérico de los datos no puede realizarse empleando métodos de estadística univariada, ya que estos describen el efecto de una sola variable sobre otra. Estructuración de las matrices de datos Con la finalidad de detectar el patrón que presenta la distribución y variación de la abundancia larval de S. gigas en el tiempo para cinco sitios del Sistema Arrecifal Mesoamericano, se realizaron matrices multidimensionales de datos (ij) en modo Q, en el que se busca generar la matriz de asociación entre los objetos, en donde los objetos (meses) se representaron por los renglones (i) y los descriptores (temperatura, oxígeno disuelto, salinidad, densidad de gasterópodos y densidad de S. gigas) por las columnas (j) (Legendre y Legendre, 1983). La secuencia numérica usada en los análisis son presentadas en anexos (Tabla 18) 31 De esta forma se construyeron cinco matrices para realizar el análisis intralocalidades, una por cada una de ellas, en esta aproximación aquello que se pretende es examinar la variabilidad de la información tanto física como biológica colectada en cada localidad. Asimismo, se construyó una matriz de datos para el análisis interlocalidades, ésta se integró por las cinco matrices realizadas para el anterior análisis, respetando el orden de los descriptores y objetos, en una secuencia que responde al procesamiento en el laboratorio de las muestras de cada localidad. Una vez estructuradas la matrices en el programa EXCELL 2007 (Microsoft Corporation, 2006), los archivos conteniendo una matriz a la vez, fueron convertidos a texto separado por tabulaciones, una vez concluida esta etapa estos fueron exportados al programa S PLUS 6.2 (Stadistical Sciences, 2003) y convertidos en objetos de este mismo. Análisis de agrupamiento Para calcular las matrices de distancia, a partir de las matrices de datos, se empleó el coeficiente métrico “Distancia euclideana”, empleando el programa S PLUS 6.2 (Stadistical Sciences, 2003). Las matrices de distancia obtenidas, tanto intra como interlocalidades, fueron sometidas a un Análisis de Agrupamiento Aglomerativo Jerárquico, en el que, para la formación de los grupos, se empleó el Método de Unión por Promedios (UPGMA) (Sneath y Sokal, 1973). El UPGMA identifica la distancia entre dos grupos como la distancia promedio entre todos los pares de elementos que les integran, provocando que los elementos presenten cohesión interna y se encuentren externamente aislados (Legendre y Legendre, 1983; Johnson y Wichnern, 1991). La distancia de corte utilizada en la presente investigación para distinguir a los grupos formados fue (D) ≤ 0.5. El cálculo y los dendogramas derivados del Análisis Aglomerativo Jerárquico fueron realizados mediante el programa S PLUS 6.2 (Stadistical Sciences, 2003). 32 Análisis de ordenamiento Completado el análisis de agrupamiento, a las mismas matrices de distancia se les sometió a un análisis de ordenamiento en espacio reducido, utilizando el Análisis de Componentes Principales (ACP). Este análisis reduce la multidimensionalidad de los datos multivariados generando un número menor de variables clave, lo cual, permite encontrar un número de combinaciones lineares equivalente al número de descriptores presentes en las matrices multidimensionales de datos. La descomposición en componentes principales no es invariante a la escala, por lo que al efectuar el cálculo, se especificó el empleo de la matriz de correlación (Legendre y Legendre, 1983). El cálculo y los diagramas en espacio reducido resultantes del ACP fueron generados mediante el programa S-PLUS 6.2 (Stadistical Sciences, 2003). Con objeto de identificar el peso específico de cada variable dentro de la combinación linear segregada por cada Componente Principal (CP), en la rutina de cálculo se específico obtener los “Loadings”. Estos son el coeficiente de transformación de los CP, los cuales proveen un resumen apropiado sobre la influencia de las variables originales en el análisis de ordenamiento, facilitando de esta manera la interpretación. Un gran coeficiente, en valor absoluto, denota alto peso o significancia en el modelo linear y un coeficiente cercano a cero tiene una significancia baja. Debido a que el propósito de los ACP es reducir la complejidad de los datos multivariados transformándolos dentro del espacio del CP, es fundamental identificar el número de componentes estadísticamente significativos y por ende, que deben ser considerados en el análisis. Con este objetivo, se utilizaron tres criterios empleando el programa S-PLUS 6.2 (Stadistical Sciences, 2003). El primero se conoce como “screeplot” o criterio de Cattell, en éste se grafican los valores propios (λj) contra los descriptores (j) generándose un gráfico en el que se 33 observa una tendencia en la pendiente, el Componente en donde se rompe esta tendencia, es el último en ser considerado en el análisis. El segundo, consiste en incluir únicamente a los CP que explican, en su conjunto, hasta el 90% de la varianza total del problema abordado con el ACP. El tercero se le conoce como de Kaiser y consiste en excluir a los CP con valores propios <1, considerando que el cálculo del ACP se realizó a partir de una matriz de correlación. Análisis de discriminantes Con objeto de lograr discernir de forma concluyente la relación entre las localidades en cuanto a la tendencia observada en las técnicas de agrupamiento y de ordenamiento empleadas en el análisis intra e interlocalidades, se aplicó un análisis de discriminantes basado en el ACP. En éste se emplearon funciones empíricas ortogonales (FEO) para representar el prototipo digital de cada una de las localidades muestreadas y, de esta manera, observar los patrones de variación en la abundancia larval de S. gigas en estas. Las FEO fueron construidas a partir de la aproximación matemática del ACP y corresponden al polinomio que describe al componente I de cada localidad. Para obtener los componentes I, se calcularon los vectores propios a partir de la matriz de correlación de cada una de las localidades y estos fueron multiplicados por el valor promedio calculado para cada uno de los descriptores que integraban las matrices de datos originales, tal y como se indica en la siguiente ecuación. PCI = b1a * A + b1b * B + b1c * C + b1d * D + … + b1j * j En esta ecuación polinomial, el conjunto b1 constituye el vector propio 1 y j corresponde a los descriptores, así al desarrollarla se obtuvó un número equivalente al número inicial de variables en el análisis. De esta forma se obtuvieron cinco vectores, los cuales integran la mejor combinación linear de las 34 matrices que representan a las cinco localidades estudiadas. Esta matriz de las FEO fue sometida a un Análisis de Discriminantes basado en el ACP y con la finalidad de obtener el máximo contraste entre las localidades, se le aplicó una rotación VARIMAX, obteniendo un diagrama en espacio reducido compuesto por los Componentes I y II. Para excluir el número de componentes estadísticamente significativos se emplearon los criterios de exclusión utilizados en la sección del análisis de ordenamiento y la rutina de cálculo descrita fue realizada en el programa S-PLUS 6.2 (Stadistical Sciences, 2003). 35 VI. RESULTADOS 6.1. Parámetros fisicoquímicos Salinidad En la figura 15 se presenta la salinidad media mensual (0/00) en el Sistema Arrecifal Mesoamericano. El valor medio fue 32.80±4.99 0/00, en junio y septiembre se presentaron las máximas salinidades (34.52±1.19 y 34.50±0.87 0 /00, respectivamente) y en diciembre la menor (31.2.4±8.41 0/00). La salinidad mensual (0/00) por localidad se presenta en la figura 18. Esta fue constante en San Pedro, Mahahual, Sian Ka’an y Puerto Morelos (35.00 0/00); mientras que Xel-Há presentó variación anual, 32.40 0/00 en junio y 16.20 0/00 en diciembre. El análisis de varianza no mostró variación en el tiempo (p(α0.05; g.l. 11:44): 0.4865), pero si entre localidades (p(α0.05; g.l. 4:44): <0.0001), siendo diferente Xel-Há (Tukey: ≤0.05). Temperatura En la Fig. 16 se presenta la temperatura media mensual (°C) en el Sistema Arrecifal Mesoamericano. La temperatura media fue de 27.02±1.43°C, los mayores valores se observaron de abril (27.20±1.65°C) a julio (29.52±1.42°C), y los menores de diciembre a marzo (25.58±0.91°C y 25.86±0.82°C, respectivamente). Las temperaturas mensuales (°C) por localidad se muestran en la Fig. 19. San Pedro, Mahahual, Sian Ka’an y Puerto Morelos hubo un incremento en julio (29.40°C, 31.20°C, 30.10°C y 29.60°C, respectivamente), mientras que en Xel-Há se observaron dos picos: junio (29.10°C) y septiembre (30.20°C). 36 Menores registros se observan en diciembre (24.10°C) para San Pedro, en enero (25.20°C) para Puerto Morelos, enero y febrero (25.80°C) para Mahahual, en febrero (25.80°C y 25.30°C) para Sian Ka’an y de noviembre a marzo (26.50°C) para Xel-Há. El análisis de varianza de una vía mostró diferencias significativas en la temperatura media entre localidades (p(α0.05; 11:44): g.l. 4:44): 0.0214) y tiempo (p(α0.05; g.l. <0.0001). Oxígeno disuelto Los valores medios de oxígeno disuelto (mg·L-1) en el Sistema Arrecifal Mesoamericano se presentan en la figura 17. La concentración media fue de 5.64±1.98 mg·L-1, con mayores registros de marzo a abril (7.82±0.33 y 7.68±0.38 mg·L-1, respectivamente) y menores en octubre (3.68±0.52 mg·L-1). La figura 20 muestra los valores mensuales de oxígeno disuelto (mg·L-1) por localidad. Los mayores registros se obtuvieron en marzo (8.10 mg·L-1) para Mahahual, en abril para Sian Ka’an y Xel-Há (8.10 y 7.70 mg·L-1, respectivamente), abril y mayo para Puerto Morelos (8.00 mg·L-1), así como en marzo y mayo (8.00 mg·L-1) para San Pedro. Octubre (de 2.80 a 4.10 mg·L-1) presentó menores registros en las cinco localidades. El análisis de varianza entre localidades (p(α0.05; g.l. 4:44): <0.0001) y tiempo (p(α0.05; g.l. 11:44): <0.0001) mostró diferencias significativas. 37 40.00 Salinidad (0/00) 33.75 27.50 21.25 15.00 Ene Feb Mar Abr May Jun Jul Ago Sep Oct Nov Dic Figura 15. Salinidad media mensual (0/00) registrada durante el año 2008 entre las localidades pertenencientes al Sistema Arrecifal Mesoamericano: San Pedro (Belice), Mahahual, Sian Ka’an, Xel-Há y Puerto Morelos. 32.00 Temperatura (°C) 29.50 27.00 24.50 22.00 Ene Feb Mar Abr May Jun Jul Ago Sep Oct Nov Dic Figura 16. Temperatura media mensual (°C) registrada durante el año 2008 en las localidades pertenencientes al Sistema Arrecifal Mesoamericano:.San Pedro (Belice), Mahahual, Sian Ka’an, Xel-Há y Puerto Morelos 38 10.00 Oxígeno disuelto (mg.L-1) 7.50 5.00 2.50 0.00 Ene Feb Mar Abr May Jun Jul Ago Sep Oct Nov Dic Figura 17. Valores medios de Oxígeno disuelto (mg·L-1) registrada durante el año 2008 en las localidades pertenencientes al Sistema Arrecifal Mesoamericano: San Pedro (Belice), Mahahual, Sian Ka’an, Xel-Há y Puerto Morelos. 39 Figura 18. Salinidad mensual (0/00) registrada en las localidades de estudio. 40 Figura 19. Temperaturas mensuales (°C) registradas en las localidades de estudio. 41 Figura 20. Valores mensuales de Oxígeno disuelto (mg·L-1) en las localidades de estudio. 42 6.2. Abundancia espacial y temporal de gasterópodos La figura 21 y tabla 5 muestran la densidad media (larvas·10 m-3) de gasterópodos para las cinco localidades del Sistema Arrecifal Mesoamericano. Puerto Morelos tuvo los mayores registros (41.26±63.23 larvas·10 m-3), seguido por Mahahual (14.78±28.21 larvas·10 m-3) y San Pedro (13.90±17.53 larvas·10 m-3), Sian Ka’an y Xel-Há presentaron las menores densidades (9.16±16.73 y 3.35±4.33 larvas·10 m3 , respectivamente). Por lo que respecta a la abundancia temporal, mayo y agosto presentaron los mayores registros (33.66±67.39 y 31.78±25.92 larvas·10 m-3, respectivamente), mientras que marzo y diciembre los menores (1.70±1.88 y 3.18±5.27 larvas·10 m-3, respectivamente) (Fig. 22). El análisis de varianza identificó diferencias estadísticamente significativas en la densidad media espacial (p (α0.05; g.l. 4;167): <0.0001) y temporal (p (α0.05; g.l. 11;160): 0.0275). La figura 23 muestra la densidad media (larvas·10 m-3) de gasterópodos mensual por localidad. Las mayores densidades se presentaron de junio a septiembre. En San Pedro de julio a agosto (de 40.76±16.33 a 45.65±18.21 larvas·10 m-3). En Mahahual los mayores registros se observaron en junio y agosto (61.78±83.48 y 47.65±5.17 larvas·10 m-3). Para Sian Ka’an las densidades fueron de 59.60±4.62 y 13.59±11.77 larvas·10 m-3, en agosto y septiembre, respectivamente. En Xel-Há en julio y septiembre (8.87±5.96 y 12.98±2.45 larvas·10 m-3) y para Puerto Morelos en abril y mayo (129.35±41.83 y 150.90±76.31 larvas·10 m-3). Las menores densidades se presentaron de noviembre a marzo. El análisis de varianza mostró diferencias significativas para cuatro localidades con excepción de Mahahual donde se obtuvo un valor de p (α0.05; g.l. 11;24): 0.0850 (Tabla 5). 43 Tabla 5. Densidad larval de gasterópodos (larvas•10 m3) en las localidades muestreadas dentro del Sistema Arrecifal Mesoamericano. n: número de muestras procesadas por muestreo; Media: valor medio por localidad; D.E.: Desviación estándar. Var: Varianza; Mín.: Valor mínimo; Máx.: Valor máximo; p: Valor de probabilidad obtenido del análisis de varianza de una vía por localidad. Localidad San Pedro Mahahual Sian Ka'an Xel-Há Puerto Morelos n 29 36 36 36 35 Media 13.9 14.78 9.16 3.35 41.26 D.E. 17.53 28.21 16.73 4.33 63.23 Var 307.36 796.01 279.88 18.76 3998.24 Mín. 0.54 0 0 0 0 Máx. 64.13 157.61 63.04 15.76 208.7 p 0.0001 0.0850 <0.0001 <0.0001 0.0018 220.00 Densidad de gasterópodos (larvas.10 m-3) 165.00 110.00 55.00 0.00 San Pedro Mahahual Sian Ka'an Xel-Há Pto. Morelos -3 Figura 21. Densidad de larvas de gasterópodos (larvas•10 m ).en las cinco localidades de estudio del Sistema Arrecifal Mesoamericano. 44 220.00 Densidad de gasterópodos (larvas.10 m-3) 165.00 110.00 55.00 0.00 Ene'08 Feb'08 Mar'08 Abr'08 May'08 Jun'08 Jul'08 Ago'08 Sep'08 Oct'08 Nov'08 Dic'08 -3 Figura 22. Densidad media mensual de larvas de gasterópodos (larvas•10 m ) en las cinco localidades de estudio del Sistema Arrecifal Mesoamericano. 45 -3 Figura 23. Abundancia media larval de gasterópodos (Larvas•10 m ) en las localidades de estudio. 46 6.3. Diversidad de gasterópodos en el Sistema Arrecifal Mesoamericano A continuación se muestran imágenes tomadas mediante microscopía electrónica de los gasterópodos observados en las localidades del Sistema Arrecifal Mesoamericano: Figura 24a. Diversidad de gasterópodos en el Sistema Arrecifal Mesoamericano. 47 Figura 24b. Diversidad de gasterópodos en el Sistema Arrecifal Mesoamericano. 48 Figura 24c. Diversidad de gasterópodos en el Sistema Arrecifal Mesoamericano. 49 Figura 24d. Diversidad de gasterópodos en el Sistema Arrecifal Mesoamericano. 50 Figura 24e. Diversidad de gasterópodos en el Sistema Arrecifal Mesoamericano. Figura 25. Larvas de S. gigas encontradas en las localidades del Sistema Arrecifal Mesoamericano: a) Mahahual; b) Sian Ka’an; c) y d) Puerto Morelos. 51 6.4. Abundancia espacio-temporal de S. gigas La abundancia larval de S. gigas se muestra en la figura 26 y la densidad media en la tabla 6. La mayor abundancia se presentó en Puerto Morelos (30 Ind.; 0.47 ± 1.21 larvas·10 m-3), seguido de San Pedro (12 Ind.; 0.22±0.64 larvas·10 m-3) y Sian Ka’an (10 Ind.; 0.15±0.42 larvas·10 m-3). En Mahahual se encontraron 3 larvas (0.05 ± 0.20 larvas·10 m-3), mientras que en Xel-Há no hubo presencia. El análisis de varianza presentó diferencias significativas (p(α0.05; g.l.4;167): 0.0242), siendo estadísticamente diferentes Xel-Há y Puerto Morelos (Tukey: p≤0.05). La abundancia larval de S. gigas en los meses de estudio se muestra en la figura 27. Se observaron larvas de abril a octubre, registrándose dos picos: abril (12 larvas) y agosto-septiembre (18-14 larvas, respectivamente). El ANOVA mostró diferencia significativa (p(α0.05; g.l.11;23): 0.0218). La densidad media larval para las diferentes localidades en el tiempo es mostrada en la figura 28. Puerto Morelos presentó larvas en cuatro meses, mientras las otras localidades sólo en dos. La mayor densidad larval se presentó en Puerto Morelos (0.47±1.21 larvas·10 m-3). Se observaron diferencias significativas en la densidad media larval entre meses para San Pedro y Sian Ka’an (p(α0.05; g.l.11;17): 0.0018 y p(α0.05; g.l.11;24): <0.0001, respectivamente). 52 35.00 Abundancia de S. gigas 26.25 17.50 8.75 0.00 San Pedro Mahahual Sian Ka'an Xel-Há Puerto Morelos Figura 26. Abundancia de larvas de S. gigas (larvas·10 m-3) en el Sistema Arrecifal Mesoamericano. 35.00 Abundancia de S. gigas 26.25 17.50 8.75 0.00 Ene'08 Mar'08 Feb'08 May'08 Abr'08 Jul'08 Jun'08 Sep'08 Ago'08 Nov'08 Oct'08 Dic'08 Figura 27. Abundancia de larvas de S. gigas (Larvas•10 m-3) en el tiempo. 53 Tabla 6. Densidad media larval de S. gigas (Larvas•10m-3). n: número de muestras procesadas; Media: media muestral obtenido por localidad; D.E.: Desviación estándar; Var.: Varianza obtenida por localidad; Mín.: Valor mínimo; Máx.: Valor máximo; p: Valor de probabilidad resultante del análisis de varianza de una vía. Localidad San Pedro Mahahual Sian Ka'an Puerto Morelos n Media D.E. Var. Mín. Máx. p 29 36 36 35 0.22 0.05 0.15 0.47 0.64 0.2 0.42 1.21 0.41 0.04 0.18 1.46 0 0 0 0 2.72 1.09 1.63 5.43 0.0018 0.5313 <0.0001 0.2178 -3 Figura 28. Densidad media larval de S. gigas (larvas•10 m ) en el tiempo para las localidades de estudio 54 6.5. Asociación entre parámetro fisicoquímicos y abundancia de S. gigas La tabla 7 muestra medias anuales (n: 64) y valores de p para salinidad (0/00), temperatura (°C), oxígeno disuelto (O.D. mg·L-1), y densidad larval de S. gigas (larvas·10 m-3). La salinidad presentó variación significativa (Media: 5.6±1.34 0 /00, p: <0.0001) entre localidades. La salinidad tuvo 63% (r: 0.6307; p: 0.0000016) de asociación con la densidad larval, mientras que temperatura y oxígeno se asociaron en 38% y 22%, respectivamente. 0 Tabla 7. Medias y valor de probabilidad para salinidad ( /00), temperatura (°C), oxígeno disuelto (O. D. mg·l-1) y densidad larval (Larvas·10 m -3); n, número de datos analizados; p(α0.05), valor de probabilidad del anova entre parámetro y localidades; r, coeficiente de correlación de Spearman. P, valor de significancia entre parámetro fisicoquímico y densidad larval. Parámetro 0 /00 °C O. D. mg·L-1 Larvas·10 m-3 Localidades Puerto XelSian Mahahual Morelos Há Ka'an 35.01 23.76 35.00 34.96 ±0.05 ±5.27 ±0.00 ±0.13 26.43 27.48 26.51 27.18 ±1.59 ±1.31 ±1.53 ±1.94 5.47 5.71 5.34 5.84 ±1.48 ±1.06 ±1.43 ±1.40 0.47 0.00 0.15 0.05 ±1.21 ±0.00 ±0.42 ±0.20 San Pedro 35.00 ±0.00 26.48 ±1.69 6.02 ±1.42 0.22 ±0.64 Media (n: 64) p(α0.05) r P 5.60 <0.0001 0.6307 0.0000016 ±1.34 26.85 0.3499 0.3840 0.0035 ±1.60 32.70 0.7557 0.2197 0.0900 ±5.00 0.17 0.0244 1.0000 1.0000 ±0.66 55 6.6. Tallas de S. gigas (espacio-temporal) La talla media de larvas de S. gigas por localidad se presenta en la figura 29 y tabla 8, con tallas entre 285.00±58.55 µm (Sian Ka’an) y 396.67±46.19 µm (Mahahual). El 98.28% de las larvas observadas corresponden al estadio I (150.00-450.00 µm LS) propuesto por Davis et al. (1993). El análisis de varianza mostró diferencias significativas entre localidades (p(α0.05; g.l.4,190): 0.0098). En la tabla 9 se presenta la prueba de Duncan, observando que Sian Ka’an es diferente de los otros sitios de estudio. En la figura 30 se presenta la talla media en el tiempo, observándose tallas medias entre 316.94±75.72 µm (agosto) y 377.50±75.09 µm (abril). No se presentó variación significativa entre meses (p(α0.05; g.l.6,48): 0.3176) (tabla 10). En la figura 31 se muestran las tallas medias por localidad en el tiempo. Los mayores registros se obtuvieron en julio para San Pedro (370±98.99 µm), septiembre para Mahahual y Sian Ka’an (410 ± 56.57 y 325 ± 21.21 µm, respectivamente) y en abril para Puerto Morelos (377.5 ± 75.09 µm). 56 Tabla 8. Tallas registradas en larvas de S. gigas (Longitud sifonal µm). Media: valor promedio muestral obtenido por localidad. D.E.: Desviación estándar. Var: Varianza muestral obtenida por localidad. Mín: Valor mínimo obtenido por localidad. Máx: Valor máximo obtenido por localidad. Localidad n Media D.E. Var Mín Máx San Pedro Mahahual Sian Ka'an Puerto Morelos 12 3 10 30 353.75 396.67 285 351.33 71.45 46.19 58.55 56.8 5105.11 2133.33 3427.78 3225.75 240 370 200 300 450 450 400 600 Tabla 9. Prueba de Duncan entre talla media y localidades; n2, número de larvas; —, sin dato; A y B, diferencias significativas (p≤ 0.05). Localidad Puerto Morelos San Pedro Sian Ka'an Mahahual Media (µm) n: Grupos 351.33±56.80 353.75±71.45 285.00±58.55 396.67±46.19 30 12 10 3 A A — — — Xel-Há B A — Tabla 10. Análisis de varianza entre tallas (Longitud sifonal en µm) y meses. FV, Factor de variación; SC, suma de cuadrados; gl, grados de libertad; CM, cuadrados medios; p(α0.05), valor de probabilidad. FV Modelo Mes Error Total SC gl CM F p(α0.05) 30287.54 30287.54 200253.37 230540.91 6 6 48 54 5047.92 5047.92 4171.95 1.21 1.21 0.3176 0.3176 57 750.00 Longitud Sifonal (Micras) 562.50 375.00 187.50 0.00 San Pedro Mahahual Sian Ka'an Pto. Morelos Figura 29. Tallas registradas en larvas de S. gigas (Longitud sifonal: µm) en el Sistema Arrecifal Mesoamericano. 750.00 Longitud Sifonal (Micras) 562.50 375.00 187.50 0.00 Ene'08 Feb'08 Mar'08 Abr'08 May'08 Jun'08 Jul'08 Ago'08 Sep'08 Oct'08 Nov'08 Dic'08 Figura 30. Tallas registradas en larvas de S. gigas (Longitud sifonal: µm) en el tiempo. 58 Figura 31. Tallas registradas en larvas de S. gigas (Longitud sifonal: µm) en el tiempo por localidad de estudio con presencia de larvas. 59 6.7. Distribución horizontal y vertical de larvas en la caleta de Xel-Há (mayodiciembre de 2010) Muestreos horizontales La densidad media larval (larvas·10 m-3) de gasterópodos (G) y S. gigas (Sg) obtenidos en arrastres es mostrada en la tabla 11. La mayor densidad de gasterópodos se registró en Centro (6.55±13.87 larvas·10 m-3), seguido por Bocana (5.52±6.05 larvas·10 m-3). No se encontraron larvas de S. gigas durante el periodo de estudio. Muestreos verticales La tabla 12 presenta la densidad media larval para gasterópodos y S. gigas (larvas·10 m-3) procedentes de bombeos superficiales (aprox. 1 m) y de fondo (aprox. 2.5 m). La mayor densidad larval de gasterópodos en superficie se detectó en Bocana (4.85±10.70 larvas·10 m-3) mientras que en Cueva no hubo presencia. Bocana (16.62±36.45 larvas·10 m-3) presentó la mayor densidad en muestreos de fondo, mientras que en Cueva se obtuvó la menor (0.04±0.09 larvas·10 m-3). Larvas de S. gigas fueron encontradas sólo en julio provenientes de la Bocana (0.30±0.14 larvas·10 m-3). La abundancia larval de S. gigas no presentó variación significativa entre zonas (p(α 0.05; g.l. 3;38): 0.4537) y tiempo (p(α 0.05; g.l. 4;37): 0.3415). 60 Tabla 11. Resultados de densidad media larval (larvas•10 m-3) en la caleta de Xel-Há (Muestreos horizontales). G: Gasterópodos; Sg: Strombus gigas. Bocana Mes Centro Brazo Norte Cueva G Sg G Sg G Sg G Sg Mayo 4.71±1.25 0.00 0.72±0.32 0.00 5.25±1.67 0.00 8.51±3.32 0.00 Junio Julio Octubre 2.54±1.25 6.34±1.57 9.78±11.80 2.17±0.94 5.80±1.66 0.00 33.34±23.84 0.00 0.00 0.00 0.72±0.32 0.00 1.27±0.83 0.00 7.61±6.12 0.00 0.00 0.00 0.00 0.00 5.07±3.27 17.03±2.27 3.08±2.19 0.36±0.31 4.17±0.83 0.00 0.00 0.00 0.00 0.00 0.00 31.16±15.38 0.00 1.63±1.63 0.00 0.00 0.00 0.00 0.00 0.00 Noviembre 11.78±11.15 0.00 2.17±1.63 0.00 0.36±0.31 0.00 0.00 0.00 Diciembre 1.09±0.55 0.00 0.00 0.00 0.00±0.00 0.00 0.00 0.00 Media 5.52±6.05 0.00 6.55±13.87 0.00 4.42±5.49 0.00 5.90±12.06 0.00 Agosto Septiembre Centro Brazo Norte Bocana Tabla 12. Resultados de densidad media larval (larvas•10 m-3) en la caleta de Xel-Há (Muestreos verticales). Gasterópodos Strombus gigas Sitio Mes Superficie Fondo Superficie Fondo 0.30±0.14 Julio 24.10±10.18 82.95±30.90 0.00 Agosto 0.15±0.15 0.06±0.00 0.00 0.00 Septiembre 0.00 0.06±0.08 0.00 0.00 Octubre Noviembre 0.01±0.01 0.00 0.01±0.01 0.00 0.00 0.00 0.00 0.00 Diciembre 0.00 0.00 0.00 0.00 Media 4.85±10.70 16.62±36.45 0.00 0.06±0.13 Julio Agosto Septiembre Octubre Noviembre 1.15±0.49 0.00 0.00 0.00 0.00 2.15±0.07 0.01±0.00 0.00 0.02±0.02 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 Media 0.26±0.54 0.48±0.95 0.00 0.00 Julio Septiembre Noviembre 0.70±0.71 0.00 0.00 0.30±0.42 0.01±0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.28±0.52 0.12±0.27 0.00 0.00 Septiembre Octubre Noviembre 0.00 0.00 0.00 0.00 0.17±0.00 0.00 0.00 0.00 0.00 0.00 0.00 0.00 Diciembre 0.00 0.00 0.00 0.00 Media 0.00 0.04±0.09 0.00 0.00 Diciembre Diciembre Cueva Media 61 6.8. Biodiversidad y distribución de especies en la Caleta de Xel-Há La distribución de larvas de S. gigas (Sg), gasterópodos (G), crustáceos (C) y peces (P) procedentes de arrastres y bombeos en la Caleta de Xel-Há es presentada en la figura 32. Se observó la presencia de crustáceos y gasterópodos en la mayoría de los meses para los cuatro puntos de muestreo, larvas de peces de junio a septiembre en Brazo Norte y de S. gigas en julio para la Bocana. Brazo Norte y Bocana presentaron mayor diversidad de especies, Cueva fue el sitio con menor riqueza de organismos. Figura 32. Biodiversidad de larvas en la Caleta de Xel-Há. Sg: S. gigas; G: gasterópodos; C: crustáceos; P: Peces. A continuación se presentan imágenes de microscopia electrónica, la cuales muestran la diversidad larval de gasterópodos por zona de estudio en la Caleta de Xel-Há: 62 Figura 33a. Diversidad de gasterópodos en Bocana. 63 Figura 33b. Diversidad de gasterópodos en Bocana. 64 Figura 33c. Diversidad de gasterópodos en Bocana. Figura 34a. Diversidad de gasterópodos en Centro. 65 Figura 34b. Diversidad de gasterópodos en Centro. 66 Figura 35a. Diversidad de gasterópodos en Brazo Norte. 67 Figura 35b. Diversidad de gasterópodos en Brazo Norte. 68 Figura 36a. Diversidad de gasterópodos en Cueva de los Milagros. 69 Figura 36b. Diversidad de gasterópodos en Cueva de los Milagros. 70 6.9. Patrón de abundancia larval de S. gigas en el SAM 6.9.1 Análisis aglomerativo jerárquico (AAJ) Análisis intralocalidades En la Fig. 37 se presenta el dendograma para la localidad de San Pedro, donde se muestran cuatro grupos bien estructurados a una distancia de corte < 0.5. El grupo I se conforma por los objetos que representan a enero, febrero y mayo. Los grupos II y III se integraron por los objetos que representan a junio y abril, respectivamente. Por último, el grupo IV se encuentra integrado por los objetos que representan a julio y agosto. En la Fig. 38, generada para la localidad de Mahahual se detectó la presencia de cinco grupos. El grupo I integró el mayor número de objetos (febrero, marzo, abril, noviembre y diciembre), seguido por el grupo III (enero, mayo y julio), el grupo II sólo describe a octubre, el grupo IV a septiembre, mientras que el grupo V corresponde a junio y agosto. Sian Ka’an, Quintana Roo presentó menor variabilidad (Fig. 39), condición que se observa en la presencia de tres grupos detectados, agregándose el mayor número de objetos en el grupo I (ocho objetos), seguido por el grupo II (abril y noviembre) y en última instancia el grupo III (enero y septiembre), el objeto que representa a agosto (9) no fue clasificado como grupo, ya que se formó fuera de la distancia de corte determinada (D: <0.5). Xel-Há mostró mayor heterogeneidad (Fig. 40) al generarse 5 grupos (I: enero, junio y septiembre; II: febrero, mayo y agosto; III: marzo; IV: abril y octubre; V: julio y noviembre) influenciados por la variabilidad de los parámetros fisicoquímicos registrados en este sitio. El objeto que representa a diciembre (12) no fue tomado en cuenta en el análisis. 71 En el dendograma generado para Puerto Morelos (Fig. 41) se observan cinco agrupamientos. El grupo I se encuentra el objeto correspondiente a julio, el grupo II (con mayor cohesión) agrupa a los objetos procedentes de febrero, marzo, agosto, octubre, noviembre y diciembre, el grupo III representa a enero y junio, mientras que los grupos IV y V muestran a los objetos septiembre y, abril y mayo, respectivamente. Figura 37. Análisis de agrupamiento para San Pedro, Belice. 72 Figura 38. Agrupamiento para Mahahual. Figura 39. Agrupamiento jerárquico para Sian Ka’an. 73 Figura 40. Análisis de aglomeramiento para Xel-Há. Figura 41. Análisis de aglomeramiento para Puerto Morelos. 74 Análisis interlocalidades El análisis aglomerativo a nivel interlocalidades muestra la formación de cinco grupos en el dendograma obtenido (Fig. 42). Los grupos I y II se integran por objetos donde no se observó la presencia de larvas de S. gigas, en el grupo III se concentraron los objetos que en menor proporción se observó a esta especie, y en los grupos IV y V se encuentran segregados los objetos que cuentan con los mayores registros de abundancia larval de S gigas (Puerto Morelos: Septiembre, abril y mayo; 33, 28 y 29, respectivamente). Figura 42. Agrupamiento UPGMA, análisis interlocalidades con cinco grupos. 75 Análisis de componentes principales (ACP) Análisis intralocalidades En la Fig. 43 se presenta un diagrama en espacio generado para San Pedro. Se observó la presencia de cuatro grupos, dos de ellos integrados por un objeto y los restantes por dos o más objetos caracterizados por estar. El grupo I se integró por el objeto correspondiente a mayo (6), los otros dos grupos se segregan de manera positiva uno en la componente 2 (3: febrero) y el último en la componente 1 (8 y 9: julio y agosto, respectivamente). En Mahahual se observó la presencia de tres grupos (Fig. 44). El grupo I representa a marzo (4), siendo el objeto más segregado del análisis. El segundo grupo lo conformaron de forma dispersa los objetos abril, mayo, junio, julio y agosto (5, 6, 7, 8 y 9), mientras que el resto de los objetos formaron el grupo III observándose estos objetos más apretados con respecto a los anteriores. Para Sian Ka’an se observa la formación de tres grupos (Fig. 45). El grupo I contiene a febrero, marzo, abril y mayo, el grupo II es integrado por la mayoría de los objetos (enero, junio, julio, septiembre, octubre, noviembre, diciembre) y el grupo III es representado por agosto, el cual fue influenciado por la presencia de larvas de S. gigas. Para Xel-Há se observó la formación de cuatro grupos (Fig. 46). El grupo I está representado por enero (1), el grupo II se integra por los objetos correspondientes a junio y septiembre (6 y 9). El tercer grupo integró al mayor número de objetos, los cuales se distribuyeron de manera dispersa (febrero, marzo, abril, mayo, julio, agosto, octubre y noviembre), y el grupo IV fue representado por diciembre (12). 76 Para Puerto Morelos se mostró la formación de tres grupos (Fig. 47). El grupo I se integró por el objeto que describe a diciembre, el grupo II por la mayoría de los objetos (enero, febrero, marzo, junio, julio, agosto, septiembre, octubre y noviembre) los cuales mostraron un patrón de apretamiento, y, por último, el grupo III presentó a los objetos correspondientes a abril y mayo, meses donde se observó la mayor abundancia larval de S. gigas. Figura 43. ACP para San Pedro, Belice. 77 Figura 44. ACP para Mahahual. Figura 45. ACP para Sian Ka’an. 78 Figura 46. ACP para Xel-Há. Figura 47. ACP para Puerto Morelos. 79 Análisis interlocalidades El gráfico generado para el conjunto de las localidades de estudio mostró la formación de dos grupos (Fig. 48). El grupo I integró en un patrón de apretamiento a los objetos que describen a los meses con valores mínimos o ausencia de larvas de S. gigas. El grupo II, con objetos dispersos, se formó con los objetos donde se registraron las mayores abundancias para esta especie (San Pedro: agosto, 9; Sian Ka’an: agosto, 18; Puerto Morelos: abril, mayo y septiembre, 28, 29 y 33, respectivamente). Figura 48. Análisis de componentes principales interlocalidades: San Pedro: agosto de 2008 (9); Sian Ka’an: agosto de 2008 (18); Puerto Morelos: abril, mayo y septiembre de 2008 (28, 29 y 33). 80 6.9.3. Análisis de discriminantes 6.9.3.1. Funciones Empíricas Ortogonales (FEO) La tabla (13) muestra las Funciones empíricas ortogonales (FEO) empleadas para representar el prototipo digital de cada una de las localidades muestreadas. Tabla 13. Funciones Empíricas Ortogonales (FEO) empleadas en el Análisis de Discriminantes. C I PM: Componente I de Puerto Morelos, C I XH: Componente I de Xel-Há, C I SK: Componente I de Sian Ka’an, C I MH: Componente I de Mahahual, C I SP: Componente I de San Pedro. C I PM C I XH FEO C I SK -7.4031 -3.4790 -13.9859 -3.0298 -8.9675 2.1671 3.5164 3.6254 10.7432 -1.8890 0.0000 -16.2349 0.0000 -16.5903 0.0000 -90.6414 6.4261 -25.3300 -7.5923 27.8146 -0.9345 0.0000 -0.4020 -0.0544 0.4233 C I MH C I SP Al calcular los valores propios se determinó que el patrón observado en el Sistema Arrecifal Mesoamericano para la distribución y abundancia larval de S. gigas fue explicado en mayor proporción por la componente 1, sin embargo, aunque en menor medida, la componente 2 mostró significancia estadística en el análisis de discriminantes (tabla 14). Tabla 14. Valores propios calculados para el prototipo digital generado para las cinco localidades analizadas en el Sistema Arrecifal Mesoamericano (C.: Componente). C. 1 2.5242 C. 2 1.1860 C. 3 0.9585 C. 4 0.3313 C. 5 0.0000 Al tomar como referencia la componente 1 para realizar el Análisis de Discriminantes se observó la formación de tres grupos (Fig. 49). El grupo I fue integrado sólo por Puerto Morelos, el II por Xel-Há, Sian Ka’an y Mahahual; mientras que el grupo fue integrado por San Pedro, localidad que se observó más distante de las anteriores. 81 En el eje de la componente dos se observaron dos tendencias de distribución. El primer grupo se integró por Puerto Morelos, Sian Ka’an y San Pedro, sitios con mayor abundancia larval de S. gigas, y en segunda instancia Mahahual y Xel-Há, donde la abundancia larval para esta especie fue menor o nula. Figura 49. Análisis de Discriminantes basado en un Análisis de Componentes Principales (ACP) donde los objetos están representados por las Funciones Empíricas Ortogonales (FEO) o prototipos digitales de cada localidad, los cuales fueron calculados a partir de desarrollar el polinomio del Componente I de una aproximación matemática del ACP. 82 VII. DISCUSIÓN Stoner et al. (1992) y Barile et al. (1994) señalan que la abundancia larval de Strombus gigas está asociada a la temperatura y al fotoperiodo. Contrariamente, de Jesús Navarrete (1999) no encontró relación entre la abundancia y la temperatura, salinidad y oxígeno disuelto. En la tabla 15 se presentan datos de temperatura, salinidad y densidad mostrados en las zonas de estudio, observando que en la mayoría de los casos, temperatura, salinidad y densidad se relacionaron con más del 50%. En el presente estudio la prueba de Spearman mostró 63% de asociación entre abundancia larval y salinidad, mientras que la temperatura no presentó asociación. Se han realizado estudios de abundancia larval de S. gigas en Florida, Bahamas, Puerto Rico, Península de Yucatán y Los Roques Venezuela (Appeldoorn, 1993; Stoner et al., 1997; Stoner y Davis, 1997 a y b; Pérez Pérez et al., 2003; Posada, 2003). La Península de Yucatán ha sido la más estudiada (de Jesús Navarrete, 1999; de Jesús Navarrete y Aldana Aranda, 2000; de Jesús Navarrete, 2001; Pérez Pérez et al., 2003; Aldana Aranda y Pérez Pérez, 2007; de Jesús Navarrete y Pérez Flores, 2007; Bravo Castro, 2009), seguido por Bahamas (Stoner y Davis, 1997a y b; Pérez Pérez et al., 2003). La mayor abundancia larval reportada ha sido para el Arrecife Alacranes (Tabla 16) con 3.40±6.73 larvas·10·m-3 (Aldana Aranda y Pérez Pérez, 2007) y Bahamas con 1.44±1.80 larvas·10·m-3 (Stoner y Davis, 1997b). Los registros más bajos están reportados para la Bahía de la Ascensión con 0.02±0.07 larvas·10·m-3 (de Jesús Navarrete y Pérez Flores, 2007). Pérez Pérez et al. (2003) han sido los únicos en estudiar la abundancia y distribución de larvas de S. gigas con un enfoque regional. En el presente trabajo se siguió este enfoque para el Sistema Arrecifal Mesoamericano. Se observó que la abundancia larval de S. gigas presentó variaciones en el tiempo y entre 83 localidades. Se presentó una abundancia larval media de 0.17±0.66 larvas·10·m-3 (n: 172), dos veces menor a lo reportado por Pérez Pérez et al. (2003) para la Península de Yucatán. Puerto Morelos fue la localidad con mayor abundancia, presentando valores similares a lo reportado por Bravo Castro (2009), pero mayor a lo reportado por Pérez Pérez et al. (2003) para el norte de Cozumel (0.02±0.03 larvas·10·m-3), mostrando de esta manera que la abundancia larval de esta especie, se ha mantenido constante en el área. En la tabla 15 se presenta un resumen de los registros de abundancia larval de S. gigas reportados en la literatura y en el presente estudio. Los estudios de abundancia larval temporal reportados en la literatura abarcan desde muestreos puntuales (días) a un ciclo anual. Investigaciones que cubre un ciclo anual representan el 55 % del total de artículos publicados (de Jesús Navarrete, 1999; de Jesús Navarrete y Aldana Aranda, 2000; de Jesús Navarrete, 2001; Pérez Pérez et al., 2003; Aldana Aranda y Pérez Pérez, 2007; de Jesús Navarrete y Pérez Flores, 2007; Bravo Castro, 2009). El 33 % de ellos se realizaron en el período reproductivo (Appeldoorn, 1993; Stoner et al., 1997; Stoner y Davis, 1997a y b) y de manera puntual el trabajo de Posada (2003). Los autores que trabajan un ciclo anual reportan larvas durante todo el año, con mayor incidencia de junio a agosto (4.70±7.03-17.80±24.77 larvas·10·m-3) (Appeldoorn, 1993; Stoner et al., 1997; Stoner y Davis, 1997 a y b; Aldana Aranda y Pérez Pérez, 2007; de Jesús Navarrete y Pérez Flores, 2007). En febrero y diciembre se reportan las más bajas densidades (0.70±0.38 y 0.81±0.31 larvas·10·m-3) (Aldana Aranda y Pérez Pérez, 2007). En este estudio se observaron larvas de abril a octubre, con la mayor densidad en abril (0.43±1.09 larvas·10·m-3). 84 La región de Florida y Bahamas, se caracteriza por presentar un período que comprende los meses de mayo a septiembre En Arrecife Alacranes y Banco Chinchorro el periodo de desove para S. gigas fue mayor que en las demás áreas estudiadas, reportándose la presencia de larvas de esta especie para todos los meses de colecta. De acuerdo a los estudios realizados por Bravo Castro (2009) y los resultados del presente trabajo, en la región norte de Quintana Roo se observa la presencia de dos ciclos con presencia de larvas: abril a mayo y el segundo entre agosto y septiembre (Tabla 17). Los estudios reproductivos realizados por Aldana Aranda y Pérez Pérez (2007) reportan para esta zona un solo pico de actividad reproductiva para el período junio a septiembre. En estudios realizados por de Jesús Navarrete (1999), y, Aldana Aranda y Pérez Pérez (2007), se observa que los mayores registros de abundancia larval para S. gigas se presentaron en zonas cerradas como Banco Chinchorro y Arrecife Alacranes, lo cual contrasta con lo registrado en la Caleta de Xel-Há, donde sólo se encontraron larvas en julio de 2010 (muestreos verticales). Pacheco Archundia (2008) realizó arrastres en las caletas de Xel-Há y Xcaret, reportando la presencia de larvas de S. gigas en la Cueva de los Milagros para el mes de marzo, con una abundancia de 0.07 larvas·10 m-3 en superficie y 0.02 larvas•10 m-3 en fondo (1 m de profundidad). En este estudio se encontró una abundancia de 0.3 ± 0.14 larvas•10 m-3, mayor a la reportada por Pacheco Archundia (2008), lo cual implica que la distribución de las veliger de S. gigas en la caleta de Xel-Há ésta restringida principalmente por la haloclina existente. Las tallas de larvas registradas en el presente estudio oscilaron entre 285.00±58.55 y 396.67±46.19 µm, donde el 98.82% de las larvas corresponde al estadio I (Davis et al., 1993). Resultado similar reportan de Jesús Navarrete y 85 Aldana Aranda (2000) para Banco Chinchorro (89.10%), Aldana Aranda y Pérez Pérez (2007) para Arrecife Alacranes (86.42%) y Bravo Castro (2009), para el norte de Quintana Roo (96.16%). De acuerdo a la clasificación de Stoner (1997), las localidades del presente trabajo son sitios fuente, con larvas provenientes de actividad reproductiva local por lo que las localidades estudiadas son sitios suministradores de larvas de S. gigas. Tabla 15. Datos de temperatura (°C), salinidad (0/00), densidad media larval (Larvas·10 m-3) y correlaciones (r) calculados a partir de datos reportados en la literatura para la Península de Yucatán. Temperatura Larvas·10 m-3 °C n r 24 25 26 27 28 29 30 1 3 8 5 6 8 8 0.61±0.00 0.26±0.14 0.33±0.17 0.12±0.13 0.49±0.10 1.56±0.14 2.00±2.06 Salinidad 0 /00 n Densidad media r 22 36 37 1 19 19 0.09±0.00 1.15±1.16 0.74±1.17 sd 0.51 0.51 sd 0.50 0.56 0.75 0.56 0.58 0.52 86 Tabla 16. Registros de densidad larval de S. gigas para diferentes localidades del Caribe reportados en la literatura y en este estudio. Media: Media muestral obtenido por localidad. D.E.: Desviación estándar. Var: Varianza. Mín.: Valor mínimo. Máx.: Valor máximo. -3 Densidad (Larvas•10 m ) larval de Strombus gigas por localidad Autor Stoner y Davis (1997a; 1997b) Stoner, Davis y Glazer (1997) Aldana Aranda y Pérez Pérez (2007) Pérez Pérez et al. (2003) Localidad n Media D.E. Var Mín. Máx. Bahamas 128 0.56 1.25 1.56 0.01 7.44 Florida 9 1.13 0.96 0.92 0.14 3.1 A. Alacranes 31 3.4 6.73 45.33 0.11 35.31 P. de Yucatán 30 0.35 0.89 0.79 0.04 4.98 Bravo Castro (2009) De Jesús Navarrete y Pérez Flores (2007) Pacheco-Archundía (2008) De Jesús Navarrete (1999; 2001) de Jesús Navarrete y Aldana Aranda (2000) Apeeldorn (1993) Quintana Roo 4 1.03 1.16 1.34 0.18 2.7 B. Ascensión 4 0.06 0.1 0.01 1.00E-03 0.21 Xel-Há 2 0.05 0.04 1.30E-03 0.02 0.07 B. Chinchorro 18 0.65 0.67 0.45 0.06 1.69 Puerto Rico Posada (2003) Los Roques 31 15 0.8 0.25 1.63 0.23 2.65 0.05 0 0.06 6.81 0.79 San Pedro 29 0.22 0.64 0.41 0 2.72 Mahahual 42 0.04 0.19 0.03 0 1.09 Sian Ka'an 43 0.13 0.39 0.15 0 1.63 Xel-Há 40 0 0 0 0 0 Puerto Morelos 41 0.4 1.13 1.27 0 5.43 En este estudio 87 Tabla 17. Datos reportados en la bibliografía y el presente estudio, Se representan los meses con presencia de larvas de S. gigas para diferentes localidades del Caribe. Ordenamiento de acuerdo a latitud (norte a sur). Mes Autor Localidad E F M A M J J A S O N D Stoner y Davis (1997a) Stoner y Davis (1997b) Stoner et al., (1997) Aldana Aranda y Pérez Pérez (2007) Bravo Castro (2009) En este estudio Bahamas Bahamas Florida Arrecife Alacranes Norte de Q. Roo Puerto Morelos X X X X X X X X X X X X X X X X Pérez Pérez et al. (2003) Pacheco Archundía (2007) En este estudio de Jesús Navarrete y Pérez Flores (2007) En este estudio En este estudio Península de Yucatán Xel-Há Xel-Há de Jesús Navarrete (1999) de Jesús Navarrete y Aldana Aranda (2000) de Jesús Navarrete (2001) De Jesús Navarrete y Oliva Rivera (2000) En este estudio Appeldoorn (1993) Posada (2003) Banco Chinchorro X X X X X X Banco Chinchorro X X X X X X Banco Chinchorro X X X X X X X X X X X X X X X X X X X X X X X X X X X X X Bahía de la Ascensión X X X X Sian Ka'an Mahahual X X X X Banco Chinchorro San Pedro Puerto Rico Los Roques X X X X X X X X 88 VIII. CONCLUSIÓN Se detectaron cuatro sitios con presencia de larvas de Strombus gigas. Se observó mayor incidencia de larvas entre julio y septiembre. Existen dos temporadas con presencia de larvas al norte del Sistema Arrecifal Mesoamericano. La salinidad influencia la distribución de S. gigas en la fracción vertical de la columna de agua. Se considera que el SAM (México y Belice) suministra larvas a las poblaciones de S. gigas de la zona norte del Caribe. 89 IX. ANEXOS Tabla 18. Numeración empleada en el AAJ y ACP entre localidades Mes San Pedro Mahahual Sian Ka’an Xel-Há Puerto Morelos Dic-07 1 38 10 Ene-08 2 39 11 52 25 Feb-08 3 40 12 53 26 Mar-08 4 41 13 54 27 Abr-08 5 42 14 55 28 May-08 6 43 15 56 29 Jun-08 7 44 16 57 30 Jul-08 8 45 17 58 31 Ago-08 9 46 18 59 32 Sep-08 47 19 60 33 Oct-08 48 20 61 34 Nov-08 49 21 62 35 Dic-08 50 22 63 36 Ene-09 51 23 64 37 24 90 X. BIBLIOGRAFÍA Aldana Aranda, D. y M. Pérez Pérez. 2007. Abundance and distribution of queen conch (Strombus gigas, Linné 1758) veligers of Alacranes Reef, Yucatan, Mexico. Journal of Shellfish Research, Ed. 26 Vol. 1 pp. 59-63. Aldana Aranda, D. y T. Brulé Demarest. 1994. Estado actual de la pesquería, el cultivo y programa de investigación del caracol Strombus gigas en México. En: Appeldoorn, R. S. y B. Rodríguez. (eds). 1994. Biología, Pesquería, Cultivo y Manejo del Caracol Strombus gigas. Fundación Científica Los Roques, Venezuela. pp. 358. Aldana Aranda, D. y V. Patiño Suárez. 1998. Overview of diets used in larviculture of three Caribbean Conchs: Queen Conch Strombus gigas, Milk Conch Strombus costatus and Fighting Conch Strombus pugilis. Aquaculture 167 (1998): pp 163178. Appeldoorn, R. S. 1993. Reproduction, spawning potential radio and larval abundance of queen conch off La Parguera, Puerto Rico. Ms. Rept. To Caribbean Fishery Management Council. Puerto Rico. pp 25. Barile, P.J., A.W. Stoner y C.M. Young. 1994. Phototaxis and vertical migration of the queen conch (Strombus gigas, Linné) veliger larvae. J. Exper. Mar. Biol. Ecol. 183: pp. 147-162. Belize Fisheries Department. 2006. Informe nacional sobre la pesquería del caracol rosa (Strombus gigas) en Belize. Belize Fisheries Department, Ministry of Agriculture and Fisheries. Belize City, Belize. Dic. 1, 2006. pp. 15. Bravo Castro, M.H. 2009. Abundancia de larvas de Caracol rosa Strombus gigas en Quintana Roo. México. Tesis de Licenciatura, ITC, Yucatán. pp. 47. 91 Chaplin, J. y V.J. Sandt. 1992. Vertical migration and distribution of queen conch veligers, a progress report. Proceedings Gulf and Caribbean Fisheries Institute. Ed. 42 pp. 158-160. CITES. 2003. Decimonovena reunión del Comité de Fauna Ginebra (Suiza). CONVENCIÓN SOBRE EL COMERCIO INTERNACIONAL DE ESPECIES AMENAZADAS DE FAUNA Y FLORA SILVESTRES. Ac. 19. Doc. 8.3. pp. 83. D’Asaro, C.N. 1965. Organogenesis, development, and metamorphosis in queen conch Strombus gigas, with notes on breeding habitats. Bull. Mar. Sci., 15(2): 359-416. Davis, M., C.A. Bolton y A.W. Stoner. 1993. A comparison of larval development, growth, and shell morphology in three Caribbean Strombus species. Veliger, Ed. 36 Vol. 3. pp. 8: 236-244. De Jesús Navarrete, A. 1999. Distribución y abundancia de larvas velígeras de Strombus gigas en Banco Chinchorro Quintana Roo, México. Tesis doctoral, Centro de Investigación y de Estudios Avanzados del Instituto Politécnico Nacional. pp. 223. De Jesús Navarrete, A. 2001. Distribución y abundancia de larvas velígeras de Strombus gigas en Banco Chinchorro Quintana Roo, México. Proceedings Gulf and Caribbean Fisheries Institute Ed. 52 pp. 174-183. De Jesús Navarrete, A. 2002. Distribution and abundance of Strombus costatus (Gmelin, 1791) larvae and adults at the biosphere reserve: Banco Chinchorro, Quintana Roo, Mexico. J. Shellfish Res. Ed. 21 Vol. 1 pp. 227-231. De Jesús Navarrete, A. y D. Aldana Aranda. 2000. Distribution and abundance of Strombus gigas veligers at six fishing sites on Banco Chinchorro, Quintana Roo, Mexico. J. Shellfish Res Ed. 19 Vol. 2 pp. 891-895. 92 De Jesús Navarrete, A. y M. Pérez Flores. 2007. Distribution and abundance of strombid larvae in the Bahia de la Ascension, Quintana Roo, Mexico. 2007. Proceedings Gulf and Caribbean Fisheries Institute, Ed. 58 pp. 411-416. De Jesús Navarrete, A., R.A. Glazer y G.A Delgado. 2003. Distribución y abundancia de larvas del caracol ala de halcón (Strombus raninus, Gmelin, 1791) en Los Cayos de Florida. En: Aldana Aranda, D. (Ed.), El caracol Strombus gigas: conocimiento integral para su manejo sustentable en el Caribe. pp. 65-71. CYTED. Programa Iberoamericano de Ciencia y Tecnología para el Desarrollo. Yucatán, Mexico. pp. 65-71. De Jesús Navarrete, A., R.A. Glazer y G.A Delgado. 2004. Distribución y abundancia de larvas del caracol ala de halcón (Strombus raninus, Gmelin, 1791) en Los Cayos de Florida. Special session at the 55th annual meeting Gulf and Caribbean Fisheries Institute, Mexico. pp. 981-982. Delgado, G.A., R.A. Glazer, D. Hawtof, D. Aldana Aranda, L.A. Rodríguez Gil y A. de Jesús Navarrete. 2008. Do queen conch (Strombus gigas) lavae recruiting tothe Florida Keys originate from upstream sources? Evidence from plankton and drifter studies. In R. Grober-Dunsmore and B. D. Keller, eds. Carribean connectivity: Implications for marine protected area management. Proceedings of a Special Symposium, 9-11 November 2006, 59th Annual Meeting of the Gulf and Caribbean Fisheries Institute, Belize City, Belize. Marine Sanctuaries Conservation Series ONMS-0807. US. Department of commerce, National Oceanic and Atmospheric Administration, Office of National Marine Sanctuaries, Silver Spring, MD. pp 29-4. FAO. 2009. Factores de conversión para el Caracol Reina procesado a peso nominal. Apéndice: Informes de los países de la FAO FISHCODE-STF OSPESCA taller FAO FISHCODE STF -OSPESCA sobre la mejora de la información acerca de la situación y tendencias de la pesca de captura del caracol en la región de América Central y el Caribe, Panamá, 1-2 de febrero de 2007 Food and Agriculture Organization of the United Nations, Rome. pp. 97. 93 Flores, C. 1964. Contribución al conocimiento del género Strombus Linnaeus, 1758, (Mollusca: Mesogastrópoda), en las aguas costaneras de Venezuela (*). Instituto Oceanográfico, Universidad de Oriente, Cumaná. Mem. Soc. Cien. Nat. La Salle. Ed. 24 Vol. 69 pp. 261–276. Legendre, L. y P. Legendre. 1983. Numerical ecology. Developments in environmental modelling, Vol. 3. Elsevier Scient. Publ. Co., Amsterdam. XVI + pp 419. Mehta, N. y A.W. Stoner. 1994. Concentrations of queen conch larvae at Looe Key Reef, within the Looe Key National Marine Sanctuary - 1994. Technical Report, Caribbean Marine Research Center, Vero Beach, Florida. pp. 11. Oliva-Rivera, J.J. y A. de Jesús Navarrete. 2000. Composición, distribución y abundancia de larvas de moluscos gastrópodos en el sur de Quintana Roo, México y norte de Belice. Rev. Biol Trop. 2000 Dec. Ed. 48 Vol. 4. pp. 77-83. Oliva-Rivera, J.J y A. de Jesús Navarrete. 2007. Larvas de moluscos gasterópodos del sur de Quintana Roo, México. Hidrobiológica 2007, Ed. 17 Vol. 2 pp. 151-158. Pacheco Archundía, V. 2007. Abundancia de larvas de Caracol rosa Strombus gigas en el área de Xcaret y Xel-Há, Quintana Roo, México. Tesis de Licenciatura, Técnico de Estudios Superiores de Huixquilucán. pp. 88. Pérez Pérez, M., D. Aldana Aranda, y V. Patiño-Suarez. 2003. Abundancia de larvas de Strombus en la costa norte de la Península de Yucatán, México. In: Aldana Aranda, D. (Ed.), El caracol Strombus gigas: conocimiento integral para su manejo sustentable en el Caribe, p. 81-87. CYTED. Programa Iberoamericano de Ciencia y Tecnología para el Desarrollo. Yucatán, México. pp. 81-87. Posada, J.M. 2003. Potencial para el transporte y retención de larvas de Strombus gigas Linnaeus, 1758 (Gastropoda: Caenogastropoda: Strombidae) en el Parque Nacional Archipiélago de los Roques, Venezuela. En: Aldana Aranda, D. (Ed.), El caracol Strombus gigas: conocimiento integral para su manejo sustentable en el 94 Caribe, p. 89-97. CYTED. Programa Iberoamericano de Ciencia y Tecnología para el Desarrollo. Yucatán, México. pp. 89-97. Randall, J.E. 1964. Contributions to the biology of the queen conch, Strombus gigas. Bull. Mar. Sci. Gulf and Caribbean Fisheries, 14(2): 246-295. Sagarpa. 2006. Caracoles: Indicadores de la pesquería. Diario Oficial, Segunda Sección. Secretaria de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación. pp. 128 Sagarpa. 2009. Indicadores de la pesquería. Diario Oficial. Secretaria de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación. pp. 155 Semarnat. 2010. Sistema Arrecifal Mesoamericano (SAM). Secretaría de Medio Ambiente y Recursos Naturales. (http://portal.semarnat.gob.mx/sitioantiguo/ presenciainternacional/fronterasur/Paginas/SistemaArrecifalMesoamericano.aspx). Sneath, P.H.A. y R.R. Sokal. 1973. Numerical taxonomy: the principles and practice of numerical clasification. San Francisco, CA: Freeman. pp. 573. Stoner, A.W. 1997. The status of queen conch Strombus gigas research in the Caribbean. Marine Fisheries Review. pp 14-22. Stoner, A.W. y M. Davis. 1997a. Abundance and distribution of queen conch veligers (Strombus gigas Linne) in the central Bahamas. I. Horizontal patterns in relation to reproductive and nursery grounds. J. Shellfish Res. Ed. 16 Vol. 1 pp. 7-18. Stoner, A.W. y M. Davis. 1997b. Abundance and distribution of queen conch veligers (Strombus gigas Linne) in the central Bahamas. II. Vertical patterns in nearshore and deep-water habitats. J. Shellfish Res. Ed. 16 Vol. 1 pp. 19-29. 95 Stoner, A.W., N. Mehta y T.N. Lee. 1997. Recruitment of Strombus veligers to the Florida keys reef tract: Relation to hydrographic events. Journal of Shellfish Research, Vol. 16, N° 1 pp. 1-6. Stoner, A.W. y N.P. Smith. 1998. Across-shelf transport of gastropod larvae in the central Bahamas: rapid responses to local wind conditions. J. Plankton Res. Ed. 20 Vol. 1 pp. 1-16. Stoner, A.W., V.J. Sandt y I F. Boidron Metairon. 1992. Seasonality in reproductive activity and larval abundance of queen conch, Strombus gigas. Fishery Bulletin U.S.90: pp. 161 - 170. 96