descargar documento
Anuncio

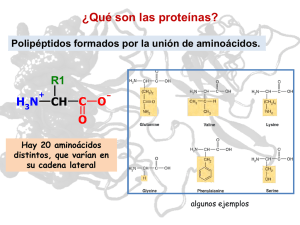
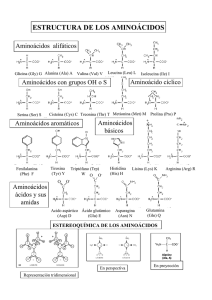
PÉPTIDOS Formación del enlace peptídico por condensación de dos aminoácidos. Amida Ejemplo de un pentapéptido Extremo amino-terminal Extremo carboxiterminal Ser–Gly–Tyr–Ala–Leu Ejemplo de un tetrapéptido • Los péptidos son polímeros de aminoácidos de PM menor a 6000 daltons ( <50 aa) • Dipéptido: 2 aa Extremo N-terminal: comienzo de la • Tripéptido: 3 aa cadena Extremo C-terminal: fin de la cadena • Tetrapéptido: 4 aa • Pentapéptido: 5 aa 1 dalton equivale a la masa de un átomo de hidrógeno NOMENCLATURA • Se nombran desde el extremo N-terminal al C-terminal, usando la terminación il, excepto para el último aminoácido. • Ej: ser-asp-tyr-lys-ala-cys seril-aspartil-tirosil-lisil-alanil-cysteína Secuencia aminoacídica de la insulina bovina. La insulina es una hormona formada por dos cadena polipeptídicas unidas entre sí a través de dos puentes disulfuro. Edulcorantes artificial de naturaleza peptídica Éster metílico de L-aspartil-L-fenilalanina (aspartame o NutraSweet®) PROTEÍNAS Las proteínas son biopolímeros de aminoácidos de más de 6000 daltons, indispensables para los procesos vitales de los seres vivos. Están formadas por C, H, O, N y S CLASIFICACIÓN DE LAS PROTEINAS Por su naturaleza química •SIMPLES •CONJUGADAS Por la forma que adopta •FIBROSAS •GLOBULARES Por su función biológica •ENZIMAS •PROTEÍNAS DE TRANSPORTE •CONTRÁCTILES Y MÓTILES •DE DEFENSA •REGULADORAS •NUTRIENTES •HORMONAS ESTRUCTURA TRIDIMENSIONAL DE LAS PROTEÍNAS • Las proteínas tienen 4 niveles de organización: • ESTRUCTURA PRIMARIA • ESTRUCTURA SECUNDARIA • ESTRUCTURA TERCIARIA • ESTRUCTURA CUATERNARIA ESTRUCTURA PRIMARIA Así como el orden de las letras dan identidad a una palabra, el orden de los aminoácidos dan identidad a un péptido. Ejemplo: ESPONJA – JAPONES MONJA – JAMON – MOJAN AMOR – ROMA – OMAR – RAMO – ARMO - •Hace referencia a: MORA •La identidad de aminoácidos. •La secuencia de aminoácidos. •La cantidad de aminoácidos. •La variación en un sólo aa hace que cambie su función biológica. •Los aa se unen por UNIONES PEPTÍDICAS. ESTRUCTURA SECUNDARIA • Interacciones entre aa que se encuentran próximos en la cadena. • La cadena no es lineal, adopta formas en el espacio. • Los aa interaccionan por puentes de hidrógeno. • Tipos de estructuras secundarias: • HÉLICE ALFA • HOJA PLEGADA BETA • AL AZAR. Una estructura tridimensional específica supone que cada uno de los miles de átomos de una molécula de proteína ocupa una posición concreta en el espacio y bien definida dentro de la molécula. HELICE ALFA • Los grupos R de los aa se orientan hacia el exterior. • Se forman puentes de hidrógeno entre el C=O de un aa y el NH- de otro que se encuentra a 4 lugares. • Hay 3,6 aa por vuelta. • Ej: queratina. Hélice de a-queratina Dos cadenas helicoidales enrolladas Protofilamento Protofibrilla Células Filamento intermedio Protofibrilla Protofilamento Dos cadenas helicoidales enrolladas Hélice a Sección transversal de un pelo El rizado u ondulación permanente del cabello se explica por las uniones disulfuro entre las fibras de queratina. reducción ondulación oxidación Estructura del colágeno Tres hélices a con una secuencia repetida de Gly–X–Pro o Gly–X–4-Hyp Se envuelven una con otras con un giro hacia la derecha. Sección de la molécula de colágeno HOJA PLEGADA BETA • Los grupos R se orientan hacia arriba y abajo alternativamente. • Se establecen puentes hidrógenos entre C=O y NH- de aa que se encuentran en segmentos diferentes de la cadena. • Ej. Fibroína (seda) Sentido antiparalelo de las cadenas Vista desde arriba Vista lateral HOJA PLEGADA BETA Estructura de la seda y de la telaraña La fibroína consiste en capas de hojas b antiparalelas ricas en residuos de Ala y Gly. ESTRUCTURA TERCIARIA • Una cadena con estructura secundaria adquiere una determinada disposición en el espacio por interacciones entre aa que se encuentran en sitios alejados de la cadena. • Proteínas globulares: se pliegan como un ovillo. • Proteínas fibrosas: tiene aspecto alargado. Estructura terciaria de la mioglobina de esperma de ballena Grupo Hemo ESTRUCTURA TERCIARIA Tipos de enlaces que intervienen en la estabilización de la estructura terciaria ESTRUCTURA CUATERNARIA • Surge de la asociación de varias cadenas con estructuras terciarias. • Intervienen las mismas interacciones que en la estructura terciaria. Estructura cuaternaria de la desoxihemoglobina Está formada por cuatro cadenas polipeptídicas con cuatro grupos hemo MIOGLOBINA • Es una proteína conjugada (hemoproteína) formada por: • Fracción proteica: globina • Fracción no proteica (grupo prostético) – Porción orgánica: grupo HEM – Porción inorgánica: átomo de Fe+2. • Función: transporte de O2 en el músculo HEMOGLOBINA • Es una proteína conjugada al igual que la mioglobina. • Está formada por 4 subunidades (estructura 4º) – 2 cadenas a y 2 cadenas b (adulto) – 2 cadenas a y 2 cadenas g (feto) • Formas: – Oxihemoglobina – Carboxihemoglobina – Metahemoglobina: Fe+3 PROTEINAS DEL PLASMA • ALBUMINA: transporta ácidos grasos. • FIBRINÓGENO: proteína que interviene en la coagulación. • GLOBULINAS: a1, a2, b1, b2 y g • IMNUNOGLOBULINAS: IgA, IgM, IgE, IgG, IgD. Desnaturalización de proteínas Proceso generalmente irreversible mediante el cual la proteína pierde su estructura 2º, 3º y 4º, careciendo de importancia biológica • Causas: Agentes Físicos: Calor Radiaciones Grandes presiones Agentes Químicos: solventes orgánicos solución de urea sales Celiaquía La Enfermedad Celíaca (EC) es un proceso frecuente de naturaleza autoinmune y con afectación sistémica. Es la única enfermedad producida por una intolerancia permanente al gluten, que aparece en individuos genéticamente susceptibles. Es inducido por la ingesta de gluten, un conjunto de proteínas contenidas en la harina de diversos cereales, fundamentalmente el trigo, pero también la avena, el centeno y la cebada. http://www.celiaco.org.ar/ Bibliografía - QUÍMICA ORGÁNICA. J. Mc Murry. 6ta edición 2004. Thompson. - QUIMICA ORGANICA. F Carey. 6ta edicion 2006. Mc Graw Hill. - PRINCIPIOS DE BIOQUIMICA. Albert L. Lehninger. 4ta edición. 2005 Omega. - BIOQUIMICA. Mathews, Van Holde, Ahern. 3ra. edición 2002. Pearson-Addison Wesley. - APRENDIENDO QUÍMICA ORGÁNICA. A. Fernandez Cirelli, M. Deluca, C. Du Mortier. 2da edición, 2008. Eudeba.