J - Práctica sobre termodinámica
Anuncio

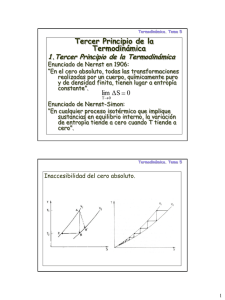
Física General ­ Taller de Enseñanza de la Física, curso 2011 en su XXVII aniversario Actividades sobre Termodinámica Ya vimos que hay fenómenos físicos que requieren modelos con nuevas variables de estado (Temperatura y Entropía) y nuevas interacciones con el entorno (Calor). Así como el estudio de las causas del movimiento nos llevaron a las tres leyes de Newton, veremos que los fenómenos térmicos nos llevan a introducir dos nuevas leyes (las “leyes de la termodinámica”). A continuación iniciamos la discusión sobre la primera de ellas. Actividad 1 Objetivo: discutir el primer principio de la termodinámica. Cierta persona es propietaria de un pequeño estanque (de pequeña superficie superior y profundidad desconocida), alimentado por un canal y desaguado por otro. El estanque recibe también agua de las lluvias ocasionales y la pierde por evaporación y filtrado. Supongamos que el propietario quiere determinar qué cantidad de agua fue entregada por los canales, por un lado, y qué cantidad por las lluvias, evaporación y filtración, por el otro. (a) Diseñá dispositivos que permitan determinar qué cantidad de agua fue entregada por los canales y cuánta por las lluvias, evaporación y filtración ¿Qué marco de referencia y sistema de coordenadas elegiste? (b) ¿Cuál es el objeto de estudio que elegiste? ¿Qué fronteras consideraste? ¿Cómo modelizaste la situación? ¿Podés caracterizar un estado del sistema? ¿Qué parámetros elegiste para hacerlo? (c) ¿Importa conocer la profundidad del estanque? ¿Por qué? (d) ¿Podés identificar algún proceso? Nombralo/s. Problema 1 (para hacer luego de los teóricos sobre primera ley de la termodinámica y sobre diagrama P­V) Objetivo: Afianzar el uso de la primera ley y los conceptos de función de estado y procesos termodinámicos. En la figura se muestran cuatro estados sucesivos de un gas, conectados por el proceso cuasiestático ilustrado. Es decir: el gas pasa del estado 1 al 2, del 2 al 3, del 3 al 4 y del 4 nuevamente al 1. Supongamos que sabemos que la energía interna en el estado 2 (U2) es 492 J, y la del estado 4 (U4) es 377 J. Desconocemos las energías U1 y U3. Queremos, a partir de datos sobre calores y trabajos que el entorno hace sobre el gas, razonar sobre los cambios de estado del último. (a) Identifiquen el objeto de estudio y cómo lo modelarían. (b) Identifiquen las interacciones del objeto de estudio al ir del estado i al j y planteen la primera ley de la Termodinámica en esa situación. (c) Si para pasar del estado 2 al 3 el entorno hace sobre el gas un trabajo de ­190 J y un calor de ­30 J, ¿Cuánto vale U3? (d) Si para pasar del estado 1 al 2 el entorno hace sobre el gas un trabajo de 12 J y un calor de 315 J, ¿Cuánto vale U1? (e) Si para pasar del estado 2 al 4 el entorno hace un trabajo de ­197 J, ¿Qué calor hace el entorno en el mismo proceso? (f) Si el trabajo que hace el entorno a lo largo de todo el ciclo es de ­115 J, ¿Qué calor hace el entorno en el mismo proceso? (g) Si pasáramos, digamos, del estado 1 al 3 por otro proceso, ¿Serían necesariamente los mismos los valores de los calores y los trabajos? ¿Por qué? Serían necesariamente iguales los cambios de U? ¿Por qué? Problema 2 (para hacer luego del teórico sobre modelo de gas ideal) Objetivo: Familiarizarse con el modelo de gas ideal. Ya conocemos un modelo simple para un gas: si las variables de estado (de equilibrio) son su presión (P) y su volumen (V), introducimos la función de estado “temperatura absoluta” T(P,V) = PV/nR. Éste es el modelo de Gas Ideal. Veamos cómo se usa. (a) En un tanque de 10 litros hay seis moles de oxígeno a 3 atmósferas. ¿A qué temperatura está el gas? Ubiquen el estado del gas en un diagrama P­V. (b) El tanque tiene un émbolo que puede moverse lentamente. Supongamos que vamos aumentando (cuasiestáticamente) el volumen del gas de modo que su presión se mantenga constante, hasta que ocupe 40 litros. ¿Cómo deberá evolucionar la temperatura del gas para llevar adelante ese proceso? Grafíquenlo en el diagrama P­V. (c) Supongamos que ahora queremos hacer una expansión desde el estado del ítem a hasta que ocupe 40 litros, pero manteniendo la temperatura constante. ¿Cómo deberá evolucionar la presión para llevar adelante ese proceso? Grafíquenlo en el diagrama P­V. Datos útiles: T[K] = t[ºC] + 273,16 1 atm = 101325 Pa (recuerden que 1 Pa = 1 Nm­2 = 1 Kg m­1 s­2) 1 litro = 1000 cm3 (recuerden las botellas de birra o gaseosa) R = 8.314472 J K−1 mol−1 (recuerden que 1 J = 1 N m = ...) Problema 3 (Para hacer después del teórico sobre trabajo termodinámico y calor) Consideremos otra vez el tanque con émbolo del problema anterior. Adentro ponemos una cantidad de aire (que no conocemos) ocupando V0 = 10 litros y a P0 = 4 atmósferas. El tanque es metálico. A continuación haremos desde el entorno lo que tengamos que hacer para que el gas recorra el ciclo que se muestra en la figura (V1 = 50 litros y P1 = 0.6 atmósferas). Queremos saber el trabajo termodinámico y el calor que el entorno hace sobre el aire. (a) ¿Cuál es el objeto de estudio? ¿Cómo lo modelarían? Cuál es el entorno? ¿Cómo son las fronteras? (b) Encuentren una expresión para la presión durante la expansión isotérmica. ¿Pueden calcular por definición el trabajo que el entorno hace sobre el gas? En ese caso, calcúlenlo. (c) ¿Pueden calcular por definición el calor que el entorno hace sobre el sistema? ¿Por qué? (d) Sabiendo que durante una expansión adiabática un gas se enfría (¡Acuérdense del inflador!) (e) ¿Qué pueden decir sobre el calor del entorno durante la expansión isotérmica? (f) ¿Cuál es el trabajo que el entorno hace sobre el gas en los procesos isocóricos? (g) ¿Cuál es el trabajo del entorno sobre el gas durante la compresión isobárica? (h) ¿Cuál es el trabajo total del entorno sobre el gas en el ciclo completo? ¿Pueden decir algo sobre el trabajo total en el mismo ciclo? Problema 4 El cilindro mostrado en la figura contiene una pequeña cantidad de agua líquida en el fondo. Sobre ella y por debajo del pistón, hay vapor de agua. El pistón se puede bajar o subir a voluntad. Dentro del cilindro no hay aire y la fase gaseosa contiene solamente vapor de agua. El cilindro y las paredes del pistón son diatérmicos. Las pérdidas de vapor entre el cilindro y el pistón se consideran despreciables. Queremos estudiar los procesos que puedan ocurrirle al agua encerrada (líquido o vapor). (a) Elijan el objeto de estudio. ¿Cómo lo modelarían? (Ayudita: recordar los diagramas p–V vistos hasta acá). (b) ¿Cuál es el entorno que acciona sobre el objeto de estudio? ¿Cómo son las fronteras? (c) ¿Cómo es la temperatura de la fase gaseosa respecto de la del medio ambiente si se modifica la posición del pistón? (d) ¿Y la de la fase líquida? ¿Cómo se dan cuenta? (e) El pistón se eleva de forma tal que su volumen aumenta de V i a Vf. Mostrar la sucesión de estados en un diagrama P­V (f) ¿Qué procesos ocurren? Indicá el signo de los mismos y hacé los diagramas correspondientes. Problema 5 (Para hacer después del teórico sobre calor específico) Objetivo: Familiarizarse con cálculos de calor y cambios de entropía. El calor específico del agua líquida es de 4,2 J g­1 K­1; el del hielo es de 2 g­1 K­1. El calor latente de fusión del agua es de 334 J g­1. Deseamos calcular el cambio en la entropía de un cuarto litro de agua metido en el congelador al pasar de T = 298 K (25 ºC) a T = 268 K (­5 ºC). Para eso: (a) Identifiquen el objeto de estudio. ¿Cómo lo modelizarían? (b) Identifiquen el entorno y modelicen las paredes. (c) ¿Qué procesos tienen lugar durante el enfriamiento del agua? ¿Pueden calcularlos? (d) Con todo eso, calculen la entropía. Problema 6 Objetivo: Calcular cambios de entropía en gases, preparar el camino hacia procesos adiabáticos en gases. El ácido pitufhídrico es un gas azul y maloliente. Su calor específico a volumen constante es de 1,4 R, donde R es la constante de Raoult. En cambio, su calor específico a presión constante es de 2,4 R. Se desea conocer el cambio de entropía que experimentará el gas al pasar del estado (P 0,V0) al estado (P,V). Para eso: (a) Identifiquen el objeto de estudio. ¿Cómo lo modelarían? (b) Usando el modelo elegido y los datos del enunciado, calculen el cambio de entropía del gas al pasar del estado inicial (P0,V0) al estado (P0,V) a presión constante. (c) Hagan lo mismo para ir de (P0,V) a (P,V) a V constante. (d) ¿Cuál es el cambio de entropía? ¿Cómo sería el cambio de entropía si se fuera de (P0,V0) a (P,V) por otro camino? ¿Por qué? (e) Supongan ahora que la presión y el volumen varían manteniendo la entropía constante. ¿Qué puede decirse del calor en esos procesos? Problema 7 (Para hacer después del teórico sobre segunda ley de la termodinámica) Objetivo: Afianzar la comprensión de la segunda Ley de la termodinámica. En el problema 5 han calculado el cambio de entropía de un poco de agua enfriada en un congelador. Revisen los cálculos. Si todo salió bien debieron llegar a una cantidad negativa. ¿Se contradice eso con la segunda ley de la Termodinámica? ¿Por qué? Problema 8 Objetivo: Afianzar la comprensión de la segunda Ley de la termodinámica. La figura representa un recipiente conteniendo un gas en tres situaciones sucesivas, que ilustran lo que suele llamarse “Expansión libre de un gas”. Primero (A) el gas está completamente contenido a la izquierda de un tabique; a la derecha hay un perfecto vacío. En (B) se muestra la situación inmediatamente después de haber retirado el tabique, mientras el gas sigue estando en la mitad izquierda. En (C) se muestra la situación del gas un rato después de retirado el tabique, cuando el gas llena completamente el recipiente. Suponemos que el recipiente es adiabático e indeformable. Queremos estudiar el cambio de estado del gas y los procesos que el entorno hace sobre él durante la expansión libre. (a) Teniendo en cuenta la naturaleza de las paredes, determinen los procesos que el entorno hace sobre el objeto (y, en consecuencia, los que el objeto hace sobre el entorno) entre las situaciones (B) y (C). (b) Teniendo en cuenta lo anterior: ¿Cuál es el cambio de la energía interna del gas durante la expansión? ¿Cuánto cambia la entropía del entorno debido a la acción del gas? (c) En la situación (B), ¿Se encuentra el sistema en equilibrio térmico? ¿Se encuentra en equilibrio termodinámico? ¿Puede considerarse la expansión libre como cuasiestática? (d) Pensemos ahora en el cambio de entropía del gas; para hacerlo, consideremos un camino cuasiestático que lleve al gas de (A) a (C) (¿Por qué podemos hacer eso?). Pensemos que en primer lugar movemos cuasiestáticamente el émbolo. ¿Qué signo tendría el trabajo del entorno en ese caso? ¿Qué signo tendría el calor? ¿Qué signo tendría el cambio de la energía interna? ¿Qué signo tiene el cambio de entropía? (e) En el punto (b) debieron llegar a que el cambio en la energía interna durante la expansión libre fue cero (de no ser así, revisen lo hecho); para completar la transformación cuasiestática hasta (C) el entorno debería hacer calor a V constante. ¿Qué signo tendrá entonces el cambio de entropía del gas? (f) Recapitulando: El cambio de entropía del entorno fue determinado en (b); el signo del cambio de entropía del gas fue determinado en (e). ¿Qué signo tiene el cambio de entropía del Universo? Usen la segunda ley de la Termodinámica para concluír que los procesos de expansión libre son irreversibles. (g) Un gas que se expandió del modo que sea puede volver a comprimirse, y ponerse a la misma temperatura que tenía antes de la expansión. ¿Qué significa entonces que las expansiones libres son “irreversibles”? Problema 9 (Para hacer después del teórico sobre potenciales termodinámicos) Objetivo: Afianzar el uso de la entalpía en problemas. Consideren un poco de agua en una cubetera, en el congelador. Es sabido que el agua fría ocupa menos lugar que el agua caliente, y que el hielo ocupa más lugar que el agua líquida. Vamos a estudiar lo que le ocurre a su estado al enfriarse y congelarse. (a) Elijan el objeto de estudio. ¿Cómo van a modelizarlo? (b) Describan el entorno, la frontera y los procesos que ocurren mientras el agua se enfría y se congela. (c) Con los datos disponibles (tengan en cuenta los datos sobre el agua dados en el ejercicio 5) ¿Pueden calcular el cambio en la energía interna del objeto? ¿Qué información falta? (d) Con los datos ¿Pueden calcular el cambio de entalpía del objeto? Justifiquen. Problema 10 Objetivos: Usar la entalpía, ejercitar el uso de las herramientas termodinámicas. Es sabido que en verano puede acudirse a los cubitos de hielo para enfriar la bebida. Supongan que tienen un vaso de cuarto litro de agua a 32 ºC y le echan dos cubitos de hielo de 10 gramos cada uno. Queremos hacer una estimación de a qué temperatura se enfriará el agua. (a) Elijan el objeto de estudio y una modelización para ellos. (b) Modelicen la frontera y la interacción con el entorno. En virtud de eso elijan una función de estado adecuada para atacar el problema. (c) Al momento de echar los cubitos al agua ¿Está el objeto de estudio en equilibrio termodinámico? La evolución del sistema ¿Será reversible? (d) En virtud de las hipótesis planteadas calculen la temperatura final del sistema. ¿Cómo creen que es ese resultado respecto de la temperatura que realmente se alcanzará? (e) Den un argumento para mostrar que efectivamente aumenta la entropía del Universo mientras se derrite el hielo. Problema 11 Objetivo: Afianzar el uso de las herramientas termodinámicas. Siguiendo los razonamientos en el problema 8, calculen el cambio de entropía durante la expansión libre del gas, suponiendo que este es ácido pitufhídrico (cuyas propiedades se enuncian en el problema 6), que el volumen inicial es de 5 litros, la presión inicial es de 3 atmósferas y la temperatura inicial absoluta es de 300 ºK. El recipiente tiene en total 10 litros. Aprovechen el repaso de los razonamientos efectuados para resolver el problema 5 para evaluar su comprensión de las herramientas teóricas. Problema 12 Objetivo: Afianzar el uso de las herramientas termodinámicas. Adentro de un vaso de telgopor se coloca un vaso (que calza justo) de 200 gramos de cobre a 90 ºC. Adentro se echa un cuarto litro de agua a 25 ºC. El cobre tiene un calor específico (a presión atmosférica) de 0,086 + 0,00023T cal g­1 K­1. ¿A qué temperatura llegará el sistema? (Para responder deberán ser capaces de plantear el problema haciendo uso de las herramientas metodológicas y conceptuales del curso). ¿Comprenden los conceptos involucrados en la resolución del problema, más allá de “la fórmula”? Actividad 2 (Para después del teórico sobre termodinámica fuera del equilibrio) Objetivo: discutir procesos fuera del equilibrio con herramientas de la termodinámica del equilibrio. (a) ¿Por qué nos envolvemos la mano con un pañuelo cuando queremos retirar la pava del fuego? (b) Siendo el agua un mal conductor de energía por medio de calor: ¿por qué una olla con agua puesta sobre el fuego, eleva la temperatura en todo su volumen y no sólo la parte inferior? (c) Si sabemos que en el espacio exterior a nuestro planeta existe vacío: ¿cómo hace el sol para aumentar la temperatura de la superficie del planeta? (d) ¿Podés explicar por qué los lagos y extensiones grandes de agua moderan la temperatura? (e) ¿Por qué un abanico te hace sentir más “fresco” en un día “caluroso”? (f) ¿Por qué, al tacto, un metal parece más “frío” que la madera o el mármol? (g) ¿Por qué los termómetros más comunes son de mercurio y no de agua? (h) Analizá y discutí el efecto de las corrientes convectivas en el manto sobre el movimiento de placas litosféricas. ¿Cuáles son las suposiciones que utilizaste?