Reacciones de Ácidos y Bases
Anuncio

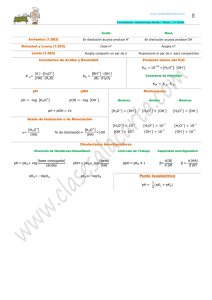
www.clasesalacarta.com 1 Tema 8.- Reacciones Ácido - Base Ácido Base En disolución acuosa produce H Arrhenius (1.883) + En disolución acuosa produce OH- HCl + H2O Cl- (aq) + H+ (aq) NaOH + H2O Na+ (aq) + OH- (aq) Cede H+ HA Brönsted y Lowry (1.923) Ácido Lewis (1.923) + Acepta H+ B + BH Ácido conjugado Base ABase conjugada + Proporciona el par de e- para compartirlos Acepta compartir un par de e- Neutralización.- formación de enlace covalente coordinado. Ácido + Base Sal + H2O Constantes de Acidez y Basicidad HA + H2O A- + H3O+ + - K a= B + H2O BH+ + OH+ A · H3 O HA · H2 O Kb = BH · OH B · H2 O - Producto Iónico del H2O + - -14 KW = H3 O · [OH ] A 25°C KW = 10 + - pOH = - log [OH ] pH = - log H3 O pH + OH = 14 Disoluciones Neutras Ácidas Básicas [H3O+] = [OH-] [H3O+] > [OH-] [H3O+] < [OH-] [H3O+] = 10-7 = [OH-] [H3O+] > 10-7; [OH-] < 10-7 [H3O+] < 10-7; [OH-] > 10-7 Constante de Hidrólisis K h= Kw Ka K h= Kw Kb En disoluciones Acuosas Diluidas [H2 O] = cte = 55’6 M - K a = K · H2 O = + A · H3 O HA K b = K · H2 O = “Fortaleza” <1 + · OH B - Mayor Kb Base Más Fuerte Mayor Ka Ácido Más Fuerte =1 K << 1 BH Fuerte Débil á á 2 Química _ 2º Bachillerato Grado de Ionización o de Disociación + Grado de disociación α= + H3 O HA % de Ionización= H3 O HA ×100 Propiedades ácido-Base de las Sales (Hidrólisis) Sales de Bases Fuertes y Ácidos Fuertes: Disolución Neutra Sales de Bases Fuertes y Ácidos Débiles: Disolución Básica Sales de Bases Débiles y Ácidos Fuertes: Disolución Ácida Sales de Bases Débiles y Ácidos Débiles Kh (catión) > Kh (anión): Disolución Ácida Kh (catión) = Kh (anión): Disolución Neutra Kh (catión) < Kh (anión): Disolución Básica Disoluciones Amortiguadoras Ácido Débil y Sal de su Base Conjugada: CH3COOH / CH3COO- Base Débil y Sal de su Ácido Conjugado: NH3 / NH4+ Ecuación de Henderson-Hasselbach pH = pKa + log base conjugada ácido pOH = pKb + log base sal pKb = - log Kb pKa = - log Ka Propiedades pH: depende de Ka y de la relación de las concentraciones. El intervalo de trabajo: intervalo de pH donde la disolución es amortiguadora ∆pH = pKa ± 1 Capacidad Amortiguadora () depende de la concentración β= d B d pH β =- Punto Isoeléctrico pH = 1 pK1 + pK2 2 d HA d pH









![[B] = 1 d](http://s2.studylib.es/store/data/008471630_1-67bea5e6645a8af6f053a6191073e185-300x300.png)
