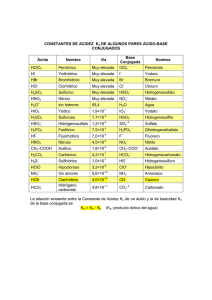
NH CO HCO NH + → + HCO HSO H CO SO + → +
Anuncio

1 Define y pon un ejemplo que ilustre la definición: a) b) c) d) e) Base de Arrhenius. Base de Brönsted Lowry. Anfótero. Base conjugada. Ácido fuerte. Solución .......................................................................................... 2 Las siguientes reacciones, verificadas en disolución acuosa, se encuentran casi totalmente desplazadas hacia la derecha: NH4+ + CO32 − → HCO3− + NH3 HCO3− + HSO4− → H2 CO3 + SO42 − SO42 − + H3O + → HSO4− + H2 O H2 SO4 + H2 O → HSO4− + H3O + H2 CO3 + NH3 → HCO3− + NH4+ a) b) c) d) Nombra todas las especies químicas que aparecen en ellas. Indica qué especie química actúa como ácido en cada una de las reacciones. Ordena dichos ácidos según su fuerza creciente. Escribe las fórmulas de sus bases conjugadas. Solución .......................................................................................... 3 Razonando la respuesta y escribiendo las correspondientes reacciones de hidrólisis, indica si será ácido, neutro o básico el pH de cada una de las siguientes disoluciones: a) NaCN (0,1 M) b) NH 4 CN (0,1 M) Datos: Ka (HCN) = 4,9 @10 -10; Kb (NH 4 OH) = 1,8 @10 -5 Solución .......................................................................................... 4 Se dispone de una disolución de ácido acético diluido de concentración 3,57 @ 10 -3 M y otra de ácido acético concentrado de concentración 1,32 M. a) Calcula el pH de la primera. b) Calcula cuántas gotas de la segunda hay que añadir a 10 mL de la primera para que el pH disminuya en una unidad. Datos: Ka (HAc) = 1,8 @10 -5 Volumen de una gota = 0,05 ml Solución 5 Calcula el pH de una disolución saturada de hidróxido cálcico. Datos: Solubilidad [Ca(OH) 2 ]= 1,48 g/L. M (Ca)=40 g/mol; M(O)=16 g/mol; M(H)=1 g/mol Nota: El hidróxido cálcico es un electrolito fuerte y por tanto se encuentra completamente disociado. Solución