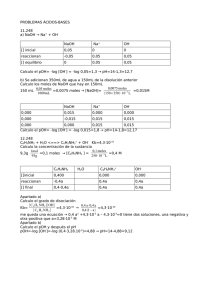
HAc OH Ac Ka = 10.8,1 x2,0 x HAc OH Ac Ka = − = =
Anuncio

Cl- + H3O+ HCl + H2O Na+ + OH- NaOH HAc + H2O Ac- + H3O+ NH3 + H2O NH4+ + OH- [Ac ][H O ] Ka = − + 3 [HAc] [NH ][OH ] Kb = + − 4 [NH 3 ] pH = -log H3 O+ 1- Calcula el pH de una disolución de ácido clorhídrico 0,2 M. Cl- + H3O+ HCl + H2O 0,2M 0,2M 0,2M pH = -log H3 O+ = -log 0,2 = 0,7 2- Calcula el pH de una disolución de ácido acético 0,2 M cuya constante de ionización es 1,8.10-5 y su grado de ionización. Ac- + H3O+ HAc + H2O 0,2M x x x 0,2-x x x [Ac ][H O ] = Ka = − + 3 [HAc] x2 = 1,8.10 − 5 0,2 − x x= 1,9.10-3 pH = -log 1,9.10-3 = 2,7 3- Calcula el pH de una disolución de hidróxido de sodio 0,2 M. NaOH 0,2M Na+ + OH0,2M 0,2M pOH = -log OH- = -log 0,2 = 0,7 pH = 14 – 0,7 = 13,3 4- Calcula el pH de una disolución de amoniaco 0,2 M y el grado de ionización, siendo la constante de la base 1,8.10-5. NH4+ + OH- NH3 + H2O 0,2M x x x 0,2-x x x Kb = [NH ][OH ] + 4 [NH 3 ] − x2 = 1,8.10 − 5 0,2 − x -3 x= 1,9.10 pOH = -log 1,9.10-3 = 2,7 pH = 14 – 2,7 = 11,3





![[B] = 1 d](http://s2.studylib.es/store/data/008471630_1-67bea5e6645a8af6f053a6191073e185-300x300.png)