Tema 8.- Reacciones de Transferencia de Protones
Anuncio

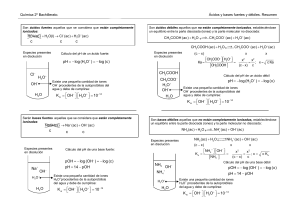
www.clasesalacarta.com 1 Formulario.- Reacciones Ácido – Base _ 2º Bach. Ácido Base Arrhenius (1.883) En disolución acuosa produce H+ En disolución acuosa produce OH- Brönsted y Lowry (1.923) Cede H+ Acepta H+ Lewis (1.923) Acepta compartir un par de e- Proporciona el par de e- para compartirlos Constantes de Acidez y Basicidad Producto Iónico del H2O KW = 10 + - K a= + A · H3 O HA · H2 O BH · OH B · H2 O Kb = -14 + - Constante de Hidrólisis KW = K a· K pH pOH + b Disoluciones - pH = - log H3 O - = H3 O · [OH ] pOH = - log [OH ] pH + pOH = 14 Neutras Ácidas Básicas [H3O+] = [OH-] [H3O+] > [OH-] [H3O+] < [OH-] [H3O+] = 10-7 [H3O+] > 10-7 [H3O+] < 10-7 [OH-] = 10-7 [OH-] < 10-7 [OH-] > 10-7 Grado de Ionización o de Disociación + α= + H3 O HA % de Ionización= H3 O HA ×100 Disoluciones Amortiguadoras Ecuación de Henderson-Hasselbach pH = pKa + log base conjugada ácido pKa = - log Ka pOH = pKb + log Intervalo de Trabajo base sal pKb = - log Kb ∆pH = pKa ± 1 Capacidad amortiguadora β= d B d pH Punto Isoeléctrico pH = 1 pK1 + pK2 2 β =- d HA d pH