descargar documento
Anuncio

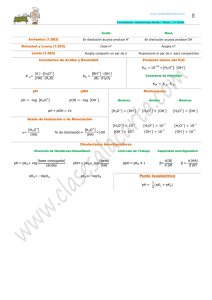
Química Analítica Lic. en Nutrición CONCEPTO DE pH Como es muy común en la práctica tratar valores muy pequeños de [H3O+] y de [OH-] resulta más conveniente el tratamiento de esos valores en términos logarítmicos. En 1909, Sörensen propuso la notación pH. Se denomina pH al logaritmo negativo de la concentración de ión hidronio o lo que es igual al logaritmo de la inversa de la concentración de ión hidronio. pH = -log [H3O+] pH = log 1/[H3O+] ; La misma notación puede ser usada para otras cantidades, de modo que la aplicación del logaritmo negativo se ha extendido a valores de [OH-], Kw, Ka, Kb, etc. Así, la [OH-] se suele expresar como pOH pOH = - log [OH-] ; pOH = log 1/[OH-] En el caso del agua pura a 25 °C, la [H3O+] = [OH-] = 1.1-7 M, por lo tanto: pH = log 1/1.10-7 = log 1.107 = 7 pOH = log 1/1.10-7 = log 1.107 = 7 pH = pOH = 7 En las soluciones ácidas, el pH tiene un valor menor de 7, en un rango que comúnmente va de 7 hasta 0 (este último valor corresponde a una [H3O+] 1M ó 100). En las soluciones alcalinas, los valores son superiores a 7, de 7 a 14, este último valor corresponde a una [H3O+] de 1.10-14 M. Normalmente se considera que la escala de pH va desde 0 a 14, pero es importante hacer notar que algunas soluciones pueden tomar valores de pH menores que 0 o mayores que 14 (por ejemplo -1 ó 15) si los valores de la [H3O+] son mayores que 1M o menores que 10-14 M, respectivamente ( por ejemplo 10 M ó 1.10-15M). Las soluciones básicas tienen valores de pOH menores de 7. Aunque ambos términos, pH y pOH, son útiles, en la práctica se usa más la notación pH, para indicar la acidez o la alcalinidad de una solución acuosa. 1 Tema 3 Química Analítica Lic. en Nutrición Correspondencia entre los valores de [H3O+] y de pH [H3O+] M 100 10-1 10-2 10-3 10-4 10-5 10-6 10-7 10-8 10-910-10 10-11 10-12 10-13 10-14 pH │ │ │ │ │ │ │ │ │ │ │ │ │ │ │ 0 2 3 4 6 7 8 9 11 12 13 14 1 5 Acidez creciente Neutro 10 Alcalinidad Creciente Debe notarse que como pH = log 1/[H3O+], el pH disminuye cuando la [H3O+] aumenta y viceversa. Además, como las escalas de pH y de pOH son logarítmicas (no aritméticas), todo aumento o disminución en una unidad, tanto de pH como de pOH, indica un cambio de diez veces la [H3O+] a la [OH-]. Teniendo en cuenta que el producto iónico del agua: Kw = [H3O+] . [OH-] Aplicando logaritmo a ambos miembros: log Kw = log ([H3O+] . [OH-]) ; log Kw = log [H3O+] + log [OH-] Multiplicando por -1 en ambos miembros: -log Kw = -log [H3O+] – log [OH-] ; -log Kw = pH + pOH designado p Kw a –log Kw pKw = pH + pOH pKw = 14 Ejercicio de aplicación La concentración de ión hidrógeno en una muestra de café es de 1·10-5 M. Calcule el pH y pOH. ¿Esa muestra de café es ácida o alcalina? [H3O+] = 1.10-5 M por definición, pH = -log [H3O+], esto es: -log 1·10-5 , por lo tanto el pH = 5 como pKw = pH + pOH 14 = 5 + pOH entonces pOH = 9 El café tiene un pH = 5, por lo tanto es ácido. 2 Tema 3 Química Analítica Lic. en Nutrición EL FENOMENO ACIDO-BASE EN SOLUCIONES ACUOSAS Para el estudio y desarrollo del problema del cálculo de pH, se utilizará la teoría de ácidos y bases de Bronsted – Lowry. Autoionización del agua : El agua presenta un comportamiento anfiprótico, es decir, se trata de una sustancia anfótera, ya que puede comportarse como ácido y como base. El agua, incluso cuando es pura, contiene una concentración muy baja de iones que pueden detectarse en medidas de conductividad eléctrica muy precisas. Este hecho se justifica teniendo en cuenta que algunas moléculas actúan como dadoras y otras como aceptores de protones, de acuerdo con la siguiente reacción ácido-base que se denomina como autoprotólisis o autoionización del agua. H2O ↔ OH- + H+ H+ + H2O ↔ H3O+ H2O + H2O ↔ OH- + H3O+ ácido1 + base2 ↔ base1 + ácido2 En esta reacción intervienen dos sistemas protolíticos diferentes: H2O/OH- y H3O+/H2O. La constante de equilibrio correspondiente a esta reacción será la siguiente: KW = [H 3 ][ O + HO − ] [H O] 2 2 Teniendo en cuenta que la actividad (concentración) de una sustancia pura (el disolvente) es igual a la unidad. [ ][ K W = H 3 O + HO − ] Esta constante se conoce como constante de autoprotólisis o autoionización del agua o producto iónico del agua. Para una temperatura de 25ºC, el valor de esta constante es 10-14. Cuando sobre el agua pura se adiciona un ácido o una base, la concentración original de iones hidrógeno se verá modificada. Por efecto del citado carácter anfiprótico del solvente, frente a los ácidos aceptará protones (comportándose como base) en tanto que frente a las bases, cederá protones (comportándose como ácido). El agua, no es por lo tanto, un simple medio de soporte que permite a los ácidos y a las bases desplegar sus propiedades características, sino que interviene activamente en el proceso de protólisis. 3 Tema 3 Química Analítica Lic. en Nutrición En agua pura, que es considerada neutra, las concentraciones de los iones hidronio e hidroxilo son iguales [H 3 ][ ] O + = HO − = K w = 10 −7 Las concentraciones de los iones hidronio e hidroxilo se utilizan para medir la acidez o basicidad de una disolución: medio neutro [H3O+] = [OH-] = 10-7 M medio ácido [H3O+] > 10-7 M , [OH-] < 10-7 M medio básico [H3O+] < 10-7 M , [OH-] > 10-7 M Las concentraciones de estos iones en disolución son generalmente cantidades pequeñas, normalmente menores de 1 M y, a menudo, mucho menores. Con objeto de simplificar la escritura del valor numérico de estas concentraciones, en 1909 el bioquímico danés Soren Sorensen introdujo el concepto de pH para indicar el potencial del ion hidrógeno. En función de [H3O+] el concepto de pH se puede definir como: pH = - log [H3O+] De modo análogo se puede definir la magnitud pOH. pOH = - log [OH-] Se puede obtener otra expresión útil tomando el logaritmo cambiado de signo de la constante Kw, que se ha indicado para 25ºC e introduciendo el símbolo pKw. Kw = [H3O+] [OH-] = 10-14 - log Kw = - log ([H3O+] [OH-]) = - log (10-14) pKw = - (log [H3O+] + log [OH-]) = - (- 14) pKw = - (log [H3O+] - log [OH-]) = 14 pKw = pH + pOH = 14 4 Tema 3 Química Analítica Lic. en Nutrición Teoría de ácidos y bases de Bronsted y Lowry Fue propuesta en 1923 por J.N. Bronsted en Dinamarca y T.M. Lowry en Gran Bretaña de forma independiente, y considera a los ácidos como sustancias que en disolución ceden protones y a las bases como sustancias que en disolución aceptan protones. Un ácido y la base que se forma cuando cede un protón (base conjugada) constituyen un sistema conjugado. Un ácido y su base conjugada forman una pareja ácido-base. Tanto los ácidos como las bases pueden ser moléculas neutras, cationes o aniones. NH4+ ↔ NH3 + H+ CH3COOH ↔ CH3COO- + H+ H2CO3 ↔ HCO3- + H+ - HCO3 ↔ CO32- + H+ Algunas sustancias, como el ion bicarbonato, pueden actuar como ácido y como base. Estas sustancias se las conoce como anfóteras, y su comportamiento se dice que es anfiprótico. Los equilibrios anteriormente indicados no pueden tener lugar de manera aislada, ya que un protón tan solo puede existir libre en disolución acuosa 10-14 segundos debido a su pequeño radio iónico y a su carga positiva (densidad de carga positiva alta). De este modo, el protón se une inmediatamente a otra molécula o ion, normalmente una molécula de disolvente. Así, las reacciones indicadas sólo tienen lugar si dos parejas ácido-base o sistemas protolíticos se encuentran presentes simultáneamente en la disolución. sistema 1 ácido1 ↔ base1 + H+ sistema 2 H+ + base2 ↔ ácido1 ácido1 + base2 ↔ base1 + ácido2 De este modo, una reacción ácido-base es el resultado de una transferencia de protones entre el ácido y la base de dos sistemas protolíticos. Esta transferencia de protones se conoce como protólisis. 5 Tema 3 Química Analítica Lic. en Nutrición El comportamiento como ácido o base de un determinado compuesto viene determinado en gran parte por las propiedades del disolvente en el que está disuelto. En este curso tan solo se tratan los equilibrios en disolución acuosa, pero hay que saber que el comportamiento de las especies ácidas o básicas puede ser diferente en otros disolventes. Cuando el disolvente es agua, ésta puede actuar como ácido o base en función de las características del soluto. Disolución de ácido acético en agua CH3COOH ↔ CH3COO- + H+ H+ + H2O ↔ H3O+ CH3COOH + H2O ↔ CH3COO- + H3O+ ácido1 + base2 ↔ base1 + ácido2 El catión H3O+ representa el ácido conjugado de la base H2O y se denomina ion hidronio. Disolución de amoniaco en agua NH3 + H+ ↔ NH4+ H2O ↔ HO- + H+ NH3 + H2O ↔ NH4+ + HObase1 + ácido2 ↔ ácido1 + base2 - El anión OH es la base conjugada del ácido H2O y se denomina ion hidroxilo. Así, la acidez o basicidad de una disolución se puede expresar utilizando estas magnitudes: medio neutro pH = pOH = 7 medio ácido pH < 7, pOH > 7 medio básico pH > 7, pOH < 7 Por lo expuesto en el agua no puede existir un ácido más fuerte que el ion hidrónio, como tampoco una base más enérgica que el ion hidroxilo. 6 Tema 3 Química Analítica Lic. en Nutrición LABORATORIO Nº 2 Carácter Ácido, Básico o Neutro de Sustancias Usadas en la Vida Diaria Objetivos Extraer el colorante del repollo morado y utilizarlo como indicador ácido-base. Utilizar como indicador ácido-base el extracto alcohólico de colorante presente en repollo. Reactivos : Material de laboratorio: 1. 2. 3. 4. 5. 6. 7. 8. 9. 1- Tubos de Ensayos 2- Gradilla 3- Pipeta Extracto de Antocianinas Leche Vinagre CH3COOH Bicarbonato de Sodio NaHCO3 Jugo de Limón H3C6H5O7 Ácido Clorhídrico HCl Antiácido Mg(OH)2 Hidróxido de Sodio NaOH Cloruro de Sodio NaCl Introducción Cuando se combina una disolución acuosa de un ácido con otra de una base, tiene lugar una reacción de neutralización. Esta reacción es en la que generalmente se forma agua y sal. Las propiedades de los ácidos y de las bases nos permiten reconocerlos, es decir, si tenemos una disolución cuya naturaleza es desconocida, podemos comprobar experimentalmente si se trata de una disolución ácida o básica. ¿Cómo podemos darnos cuenta de que una sustancia es un ácido o una base? Mediante la observación es posible detectar las propiedades que caracterizan a cada tipo de sustancia. Se puede definir un ácido como aquella sustancia que cuando está disuelta en agua: • Es ácida al gusto, como por ejemplo el limón, • Vira el papel tornasol al rojo, • Reacciona con ciertos metales, como el cinc, liberando gas hidrógeno. 7 Tema 3 Química Analítica Lic. en Nutrición Por su parte, una solución alcalina, o de carácter básico: • Es amarga al gusto, • Vira el papel tornasol al azul, • Se siente untuosa o resbaladiza al tacto. La forma más sencilla y segura de determinar si una sustancia es un ácido o una base consiste en disolver en agua esa sustancia y luego, poner la solución en contacto con papel tornasol. Éste es un indicador ácido-base que proviene de una mezcla de compuestos extraídos de ciertas plantas que se encuentran principalmente en Holanda. En esta mezcla de compuestos hay un colorante que se denomina eritrolitmina, que se torna rojo frente a los ácidos y azul frente a las bases. Los indicadores ácido-base son sustancias que modifican su estructura química en presencia de ácidos y bases. Este cambio de estructura produce un cambio en el color de la sustancia. Las flores, como muchos productos naturales, contienen indicadores ácido-base. Si representamos la forma molecular del indicador como HIn (forma ácida) y la forma ionizada como In- (forma básica) la ecuación que da cuenta de la reacción ácido - base es: In- + H+ HIn De acuerdo al desplazamiento de este equilibrio, se explica que pasa cuando se adiciona al indicador unas gotas de ácido o de base. Si nos encontramos en un medio ácido, los iones In- se combinan con los iones H+ para dar moléculas de HIn y el equilibrio iónico anterior se desplaza hacia la izquierda. Por el contrario, si el medio es básico los iones OH- se combinan con los iones H+ para dar agua e iones In- y el equilibrio iónico anterior se desplaza hacia la derecha. El cambio neto de color del indicador se denomina viraje, y el intervalo de pH en el que se produce el cambio de color se denomina intervalo de viraje y con lo cual nos podemos dar cuenta del desplazamiento del equilibrio. 8 Tema 3 Química Analítica Lic. en Nutrición Antocianinas Las antocianinas son un grupo de pigmentos hidrosolubles ampliamente distribuidos en el reino vegetal, cuyo color puede variar del rojo al azul, pasando por una amplia gama de tonalidades. Pertenecen al grupo de los bioflavonoides y estos a una amplia familia de fotoquímicos que se conocen como flavonoides. Las antocianinas se mostraron como los más potentes antioxidantes de entre 150 flavonoides diferentes. Son los colorantes naturales (pigmentos hidrosolubles) de algunas plantas que se pueden encontrar en; hojas, flores, frutos y semillas. Comprenden principalmente los colores rojos, violetas y azules y las protegen de la luz ultravioleta. Se encuentran en; arándano, maíz azul, frambuesa, cereza, col lombarda, ciruelas, uva madura y en otros vegetales con colores que van desde rojo al azul pasando por el naranja. En un reciente estudio comparativo entre el maíz azul y el arándano azul, se descubrió que el maíz tenía un contenido cuatro veces superior en antocianinas que el arándano azul, siendo la cianidina la más abundante en el maíz azul y la que posee más actividad antioxidante. 9 Tema 3 Química Analítica Lic. en Nutrición El color de las antocianinas varía en función del pH y de su estructura. En general, dichas sustancias adquieren un color rojo en medio ácido y cambian de color a azul oscuro cuando el pH se hace básico, pasando por el color violeta. Col lombarda rojo color intenso pH 2 rojo violeta 4 violeta azul violeta azul verde azulado verde 6 7 9 10 12 amarillo 13 El repollo morado tiene como nombre científico Brassica oleracea, variedad capitata, su color se debe a la presencia de un pigmento llamado antocianina. La fuerza de este color puede depender en gran medida de la acidez (pH) del suelo, las hojas crecen más rojas en suelos de carácter ácido mientras que en los alcalinos son más azules. Este pigmento resulta ser un electrolito de carácter débil con características ácido-base, la cual permite que actúe como indicador de la acidez o basicidad de una solución acuosa. Además se produce un cambio de color entre la forma neutra y la ionizada, lo que lo convierte en un indicador ácido-base similar a la fenolftaleina, naranja de metilo u otros. La función del extracto de repollo es que al mezclar este con las soluciones estas pueden cambiar de color y así se pueda reconocer un ácido o una base. Procedimiento En el presente experimento se realizan reacciones químicas que ocurren en disoluciones acuosas, con el fin de aprender a identificar si una sustancia domestica es ácida, básica o neutra, para ello utilizaremos los indicadores ácido-base, los cuales son por lo general un ácido orgánico o una base orgánica débil que tiene colores claramente diferentes en sus formas ionizadas y no ionizadas. Cortar el repollo lo más fino posible, colocar en vaso de precipitado, adicionar solución de alcohol (50%) hasta cubrir, agitar. Una vez que se observe coloración proceder a filtrar. Usar el filtrado separado en los tubos de ensayo para comprobar la acidez de las diferentes sustancias a ensayar. Observar las coloraciones. 10 Tema 3 Química Analítica Lic. en Nutrición I. Ensayo para leche 1. En un tubo limpio agregar 1 mL de disolución de colorante de repollo (indicador) y luego añadir unas gotas de leche. 2. Registrar en su cuaderno de anotaciones color, valor de pH estimado y conclusiones respecto del carácter ácido-base de cada sustancia ensayada. 3. Lavar y enjuagar con agua destilada todo el material de laboratorio, en especial los tubos de ensayo y pipetas, después de cada experiencia. II. Ensayo para jugo de limón 1. En un tubo limpio agregar 1 mL de disolución de colorante de repollo (indicador) y luego añadir unas gotas de jugo de limón. 2. Registrar en su cuaderno de anotaciones color, valor de pH estimado y conclusiones respecto del carácter ácido-base de cada sustancia ensayada. 3. Lavar y enjuagar con agua destilada todo el material de laboratorio, en especial los tubos de ensayo y pipetas, después de cada experiencia. III. Ensayo para vinagre 1. En un tubo limpio agregar 1 mL de disolución de colorante de repollo (indicador) luego añada unas gotas de Vinagre (ácido acético CH3COOH). 2. Registrar en su cuaderno de anotaciones color, valor de pH estimado y conclusiones respecto del carácter ácido-base de cada sustancia ensayada. 3. Lavar y enjuagar con agua destilada todo el material de laboratorio, en especial los tubos de ensayo y pipetas, después de cada experiencia. IV. Ensayo para antiácidos 1. En un tubo limpio agregar 1 mL de disolución de colorante de repollo (indicador) luego añada unas gotas de de antiácido [Mg (OH)2] . 11 Tema 3 Química Analítica Lic. en Nutrición 2. Registrar en su cuaderno de anotaciones color, valor de pH estimado y conclusiones respecto del carácter ácido-base de cada sustancia ensayada. 3. Lavar y enjuagar con agua destilada todo el material de laboratorio, en especial los tubos de ensayo y pipetas, después de cada experiencia. V. Ensayo para reactivos químicos usados en el laboratorio 1. En tres tubos de ensayo limpios agregar 1 mL de disolución de colorante de repollo (indicador) en cada uno, marcar cada tubo para diferenciar, y luego adicionar: a) gotas de bicarbonato de sodio [NaHCO3] b) gotas de carbonato de sodio [Na2CO3] c) gotas de hidróxido de sodio [NaHO] 2. Registrar en su cuaderno de anotaciones color, valor de pH estimado y conclusiones respecto del carácter ácido-base de cada sustancia ensayada. 3. Lavar y enjuagar con agua destilada todo el material de laboratorio, en especial los tubos de ensayo y pipetas, después de cada experiencia. 12 Tema 3