Isótopos y masa atómica relativa
Anuncio

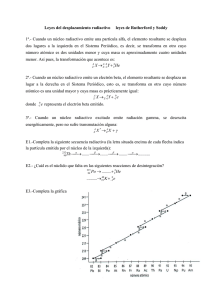
Isótopos y masa atómica relativa ¿Tenía razón Dalton cuando afirmaba que todos los átomos de un mismo elemento son exactamente iguales entre sí? ¿Se pueden considerar elementos diferentes los átomos que tienen el mismo número atómico, pero diferente número másico? ¿Qué nombre reciben estos átomos? Un isótopo del oxígeno se representa por 208O. ¿Qué fila de la tabla contiene el número correcto de partículas en un átomo de este isótopo? N.° de electrones N.° de protones N.° de neutrones A 8 8 20 B 8 8 12 C 12 8 8 D 8 12 8 ¿Qué inconvenientes crees que tiene medir la masa de los átomos en kilogramos o gramos? Averigua la masa atómica relativa de un elemento formado por una mezcla de dos isótopos: un 90 % de un isótopo de masa atómica 100 y un 10 % de un isótopo de masa atómica 102. Suponiendo que el hidrógeno natural esté formado por un 98 % de protio, un 1 % de deuterio y un 0,1 % de tritio, calcula la masa atómica relativa del hidrógeno. Física y Química 3.º ESO MATERIAL FOTOCOPIABLE / © Oxford University Press España, S. A. Isótopos y masa atómica relativa Solucionario No tenía razón porque no había previsto la existencia de isótopos. No son elementos diferentes; son isótopos del mismo elemento. Reciben el nombre de isótopos. La fila B. Ambas son unidades muy grandes y habría que utilizar muchas cifras decimales. La masa atómica relativa es 100,2. La masa atómica relativa es 1,003. © Oxford University Press España, S. A. Física y Química 3.º ESO