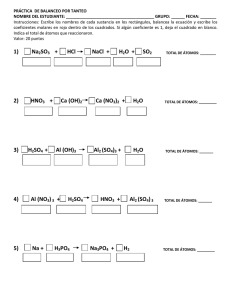
Docente: Lorelys Vega EJERCICIOS DE ESTEQUIOMETRIA 1. Un elemento consta de dos isótopos. La abundancia de un isótopo es de 95,72% y su masa atómica 114,9041 uma, la masa atómica del segundo isótopo es 112,9043 uma. a) ¿Cuál es la masa atómica promedio del elemento? b) ¿Qué elemento es? 2. Para una reacción química se requiere contar con 0,25 mol de sodio Na: a) ¿Qué masa de Na habría que pesar? b) ¿Cuántos átomos de sodio están contenidos en la masa obtenida? 3. Calcule la masa atómica promedio del silicio considerando que se encuentra en la naturaleza formado por tres isótopos que tienen las siguientes masas atómicas y porcentaje de abundancia: 28Si 27,997 uma y 92,23%; 29Si 28,977 uma y 4,67%; 30 Si 29,974 uma y 3,10%. 4. ¿Cuántos moles están contenidos en cada una de las siguientes cantidades? a) 350 g de F b) 5,25 x 1020 átomos de Al c) 1,25 x 1015 moléculas de H2SO4 5. La fórmula molecular del óxido de hierro (III), es Fe2O3. Determine la composición porcentual del compuesto. 6. Supongamos que tenemos 250 g de FeSO4, ¿Cuántos átomos de hierro están contenidos en dicha masa? 7. A cuantos moles equivalen 15x1020 moléculas de H20 8. Balancee por oxido- reducción la siguiente reacción: KMnO4 + FeSO4 + H2SO4 MnSO4 + Fe2(SO4)3 + K2SO4 + H2O Indique: a) Sustancia oxidada y reducida b) Agente oxidante y agente reductor Docente: Lorelys Vega 9. Balancear por tanteo las siguientes reacciones: a) Zn + HCl -→ ZnCl2 + H2 b) Fe + H2O → Fe2O4 + H2 c) NaOH + H2SO4 → Na2SO4 + H2O 10. Para la siguiente reacción indique si es espontanea o no espontanea Mg(NO3)2 + Cu → Cu(NO3)2 + Mg 11. ¿Será correcto almacenar una solución de Cu(NO3)2 en un recipiente de Al? Justifique su respuesta.