ORDINARIO B, ESTRUCTURA DE LA MATERIA. NOMBRE Para las
Anuncio
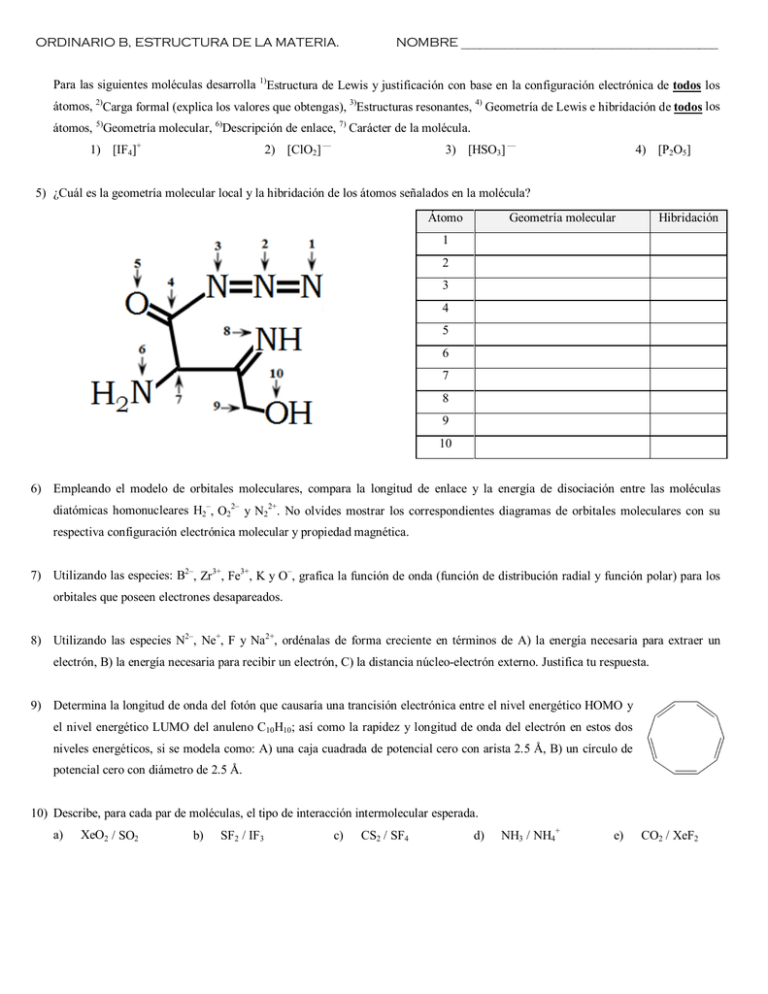
ORDINARIO B, ESTRUCTURA DE LA MATERIA. NOMBRE _________________________________________ Para las siguientes moléculas desarrolla 1)Estructura de Lewis y justificación con base en la configuración electrónica de todos los átomos, 2)Carga formal (explica los valores que obtengas), 3)Estructuras resonantes, 4) Geometría de Lewis e hibridación de todos los átomos, 5)Geometría molecular, 6)Descripción de enlace, 7) Carácter de la molécula. 1) [IF4]+ 2) [ClO2] –– 3) [HSO3] –– 4) [P2O5] 5) ¿Cuál es la geometría molecular local y la hibridación de los átomos señalados en la molécula? Átomo Geometría molecular Hibridación 1 2 3 4 5 6 7 8 9 10 6) Empleando el modelo de orbitales moleculares, compara la longitud de enlace y la energía de disociación entre las moléculas diatómicas homonucleares H2–, O22– y N22+. No olvides mostrar los correspondientes diagramas de orbitales moleculares con su respectiva configuración electrónica molecular y propiedad magnética. 7) Utilizando las especies: B2–, Zr3+, Fe3+, K y O–, grafica la función de onda (función de distribución radial y función polar) para los orbitales que poseen electrones desapareados. 8) Utilizando las especies N2–, Ne+, F y Na2+, ordénalas de forma creciente en términos de A) la energía necesaria para extraer un electrón, B) la energía necesaria para recibir un electrón, C) la distancia núcleo-electrón externo. Justifica tu respuesta. 9) Determina la longitud de onda del fotón que causaría una trancisión electrónica entre el nivel energético HOMO y el nivel energético LUMO del anuleno C10H10; así como la rapidez y longitud de onda del electrón en estos dos niveles energéticos, si se modela como: A) una caja cuadrada de potencial cero con arista 2.5 Å, B) un círculo de potencial cero con diámetro de 2.5 Å. 10) Describe, para cada par de moléculas, el tipo de interacción intermolecular esperada. a) XeO2 / SO2 b) SF2 / IF3 c) CS2 / SF4 d) NH3 / NH4+ e) CO2 / XeF2