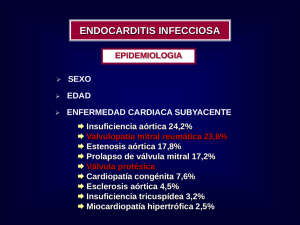
INTRODUCCIÓN - Bases de la Medicina Clínica
Anuncio

INTRODUCCIÓN Endocarditis infecciosa (EI) es una grave afección clínica, causada por microorganismos que afectan al endocardio y/o endoarterio (endarteritis), cuyo desenlace sin tratamiento antibiótico es fatal en prácticamente todos los casos. Descrita hace 3 siglos, la mejor y más acabada exposición sobre esta la efectuó William Osler, refiriéndose a “Endocarditis Maligna” en la Gulstonian Lectures de 1885. En la Revista Médica de Chile se escribe sobre ella en 1886 y a comienzos del siglo XX, en era preantibiótica. Con el advenimiento de los antibióticos, el perfeccionamiento de las técnicas bacteriológicas (hemocultivos), las técnicas cardioquirúrgicas y más recientemente, el decisivo aporte de la ecocardiografía en el diagnóstico de la vegetación, complicaciones y determinación de factores pronósticos, tanto para válvulas nativas como en válvulas protésicas, se ha progresado en la sistematización de su diagnóstico y manejo médico-quirúrgico. Sin embargo persiste una elevada mortalidad que puede oscilar entre 4% y 50% a pesar del tratamiento médico-quirúrgico actual, mortalidad tan elevada esta última al asociarse endocarditis protésica e infección estafilocócica, la más temida combinación junto a la endocarditis fúngica. En nuestro medio, comunicaciones de estudios prospectivos recientes, dan cifras de mortalidad entre 16,3% y 25,2% en el área metropolitana. En el estudio Cooperativo Nacional de Endocarditis Infecciosa (ECNEI.: 1998-2002) comprobamos una mortalidad de 29% en 321 pacientes, estudiados prospectivamente (1998-2002) la que disminuye a 26.1% mortalidad intrahospitalaria al completar el estudio de esta cohorte de pacientes, ahora con 506 sujetos estudiados hasta el 2008, (ECNEI 1998-2008) fecha en que se puso término a este estudio nacional. DEFINICIÓN Y CLASIFICACIÓN El perfil clínico y epidemiológico de la EI ha variado en las últimas décadas en forma importante, lo que debe considerarse al momento de tomar decisiones en relación al diagnóstico, tratamiento y, posiblemente, en la profilaxis. De ser una afección predominante en pacientes con alteraciones anatómicas valvulares, principalmente secuelas de enfermedades reumáticas y bacteremias por gérmenes clásicamente extrahospitalarios (60-80% de los gérmenes aislados correspondían a especies de estreptococos), sus características epidemiológicas han variado sustancialmente en los últimos 20 años. El envejecimiento poblacional, el mayor uso de métodos diagnósticos y terapéuticos de tipo invasivo, la mayor difusión de implantes de dispositivos intracardíacos y las mayores tasas de bacteremias nosocomiales, son algunas de las razones que explican que actualmente la EI se presente en pacientes sin valvulopatías o con una etiología diferente a la reumática y que el germen más frecuentemente aislado en las series comunicadas en el último tiempo sea el estafilococo aureus, incluido el estudio prospectivo nacional ya mencionado. • Endocarditis Infecciosa (EI) es una enfermedad causada por agentes infecciosos, que afecta el endocardio y estructuras cardíacas y/o el endoarteria de grandes vasos intratorácicos y que puede afectar también a dispositivos o prótesis endovasculares. 2 Su lesión característica es la vegetación, la que habitualmente se produce en una válvula cardíaca. Esta “lesión característica” o vegetación, es temprana en el desarrollo de la enfermedad, de tamaño variables (2 mm a varios cms), pudiendo ser causa de absedación, rotura, perforación o ulceración de las estructuras en las que se asiente o en áreas cercanas a ella (complicaciones intracardíacas), o causando a través de émbolos sépticos o asépticos, complicaciones a distancia (complicaciones extracardíacas). • La EI puede adoptar la forma subaguda de expresión clínica, de acuerdo a la violencia o intensidad del cuadro clínico (EISA), la que se mantiene por semanas o meses y generalmente es causada por gérmenes de poca virulencia (S. Viridans). • Por el contrario, la forma aguda de la enfermedad (EIA), se desarrolla en pocos días o en una a dos semanas, con severo compromiso del estado general y complicaciones intracardíacas o a distancia de rápido desarrollo; habitualmente este cuadro es causado por el S. Aureus. • La endocarditis que se injerta en una válvula previamente dañada por una enfermedad adquirida o congénita, o en válvula sana, corresponde a EI en válvula nativa (EIVN). En una válvula artificial, constituye la EI valvular protésica (EIVP). • La EIVP puede ser precoz (aparición de ella en los primeros 2 meses de instalada la prótesis; tardía, luego de 2 meses. Entre 2 meses y 1 año corresponde a la forma intermedia, para otros en cambio, cualquier infección en el primer año corresponde a la forma precoz. • La EI puede afectar sólo al corazón derecho (EID), al corazón izquierdo (EII) o puede ser mixta. • La EID habitualmente la observamos en cardiopatía congénitas, en portadores de marcapasos, y, más raramente en Chile, en narcoadictos por vía endovenosa y en portadores de desfibriladores implantables, patología que posiblemente va en aumento en el mundo. • En la serie nacional citada, de 351 pacientes estudiados el 11, 58% correspondió a EI derecha. De estos 41 pacientes el 20% tenía endocarditis de marcapasos (8 casos). • La presencia de vegetaciones estériles constituye la EI trombótica no bacteria, lo que incluye desde lesiones microscópicas que son agregados fibrino-plaquetarios, hasta vegetaciones de mayor tamaño como las que se aprecian en endocarditis marántica, las que se observan en enfermedades neoplásicas o en enfermedades crónicas (ca digestivos, TBC). • Idealmente debe designársele identificando el sitio afectado y el germen causal, lo que se traduce en implicaciones clínico-diagnósticas y pronósticas, ya que, por ejemplo, una EI valvular aórtica por s. viridans, tiene un pronóstico mejor que una EI valvular protésica por Candida Albicans. 3 ASPECTOS HISTÓRICOS Y EPIDEMIOLOGÍA • Las primeras descripciones de EI fueron realizadas por Riviére en 1646, Lancisi en 1706 y Morgagni en 1761, en pacientes fallecidos por EI. Boullaud introdujo el término de endocarditis entre 1824 y 1835. Virchow en 1846 describe vegetaciones en necropsias y la etiología bacteriana de la enfermedad fue reconocida por Virchow, Winge y Heiberg entre 1869 y 1872 en forma separada, como se aprecia en la comunicación citada en Revista Médica de Chile en 1886. • El cuadro clínico de la EI ha evolucionado y cambiado, a lo que diagnosticamos en la actualidad. En la era preantibiótica, esta enfermedad tenía 100% de mortalidad y quedó magistralmente descrita por William Osler, siendo punto de referencia obligado en los textos médicos, como ya se ha mencionado. • Desde 1961, muchos autores describen la “moderna endocarditis” y sus aspectos cambiantes. • La tendencia actual puede resumirse como sigue: a) Incidencia. Existiría un aumento del número de casos en algunos países como Dinamarca con 1,74/100.000 personas por año entre 1984-89 y 3,65/100.000 personas por año entre 1989-93, o, en algunas regiones, como lo observado en USA en áreas con mayor prevalencia de drogadicción, concentrados en zonas urbanas. En Francia, Delahaye y cols, dan un 2,4 por 100.000 personas por año de incidencia (1991) valor similar al observado en Dinamarca en la década de 1980 en otra serie. Estas incidencias son inferiores a las del área de Filadelfia con 11,6/100.000 habitantes ya citada y a la encontrada en Suecia de 5,9/100.000 en igual período. En Chile en el área central de Santiago, observamos una incidencia de 2/100.000 personas por año en la primera mitad de la década de los 90 en el Siglo XX. b) Edad: Aumento de la edad promedio de los pacientes. En la era preantibiótica el promedio de edad oscilaba entre 30-40 años. En las últimas décadas, el promedio de edad es aproximado a los 50 años. c) Otros factores asociados al huésped, agente causal y nuevos tratamientos. - Mayor proporción hombres/mujeres - Aumento del número de casos de EI aguda. - Infecciones por estreptococos en disminución y aumento en el número de casos por estafilococos. - Aumento de la incidencia de otros gérmenes como bacilos gram negativos, hongos y gérmenes misceláneos poco usuales. - Aumento de casos por narcoadicción por vía intravenosa (esto último poco frecuente en Chile). 4 - Aumento del número de EI en portadores de válvulas protésicas, marcapasos y desfibriladores implantables. - Aumento de casos de infección por HIV y EI, especialmente en presencia de drogadicción intravenosa. - Aumento de número de casos en adultos mayores, en diabéticos y sujetos sometidos a hemodiálisis. - Disminución del número de pacientes valvulopatas reumáticos En la experiencia nacional, también hemos observado una tendencia a la disminución de la enfermedad reumática como cardiopatía de base y una tendencia al alza de lesiones cardíacas degenerativas predisponentes, en el adulto mayor, en pacientes diabéticos y en hemodiálisis, lo que es concordante con series prospectivas recientes comunicadas en el extranjero. En la tabla 1, podemos resumir estos aspectos, obtenidos del Estudio Cooperativo Nacional en EI, ya citado, del grupo de estudios multicéntricos de la Sociedad Chilena de Cardiología. Como puede apreciarse en esta Tabla, la edad promedio de estos pacientes bordea los 50 años, persiste la etiología reumática como la cardiopatía subyacente más frecuente aún pero en disminución, con un aumento de las prótesis valvulares, cardiopatía congénitas y lesiones degenerativas como sustrato lesional. Tabla 1. Características generales en 321 pacientes con EI (demográficas, cardiopatía predisponente, otros antecedentes mórbidos y tipo de gérmenes) Característica Demografía Cardiopatía predisponente (*) Otros antecedentes mórbidos (*) n Edad, media ± DE (años) Sexo (varones) EI definida (Duke) Días de latencia (días) Etiología reumática Sin cardiopatía Prótesis valvulares Cardiopatías congénitas Degenerativas Catéter intravenoso Mixomatosis Marcapasos cardíaco EI previa Cirugía cardíaca previa Hemodiálisis Drogadicción IV Virus inmunodeficiencia humana (+) Diabetes Mellitus 49,1±16,5 210 274/307 35,5± 41 79/312 61/312 47/316 41/312 26/312 16/310 14/312 13/313 8/312 4/312 65/319 1/312 0 35/311 % (65,4) (89) (25,3) (19,6) (14,9) (13,1) (8,3) (5,1) (4,5) (4,1) (2,5) (1,3) (20,4) (0,003) (0) (11,2) 5 Tipo de germen (*) Inmunosupresión Estafilococo coagulasa positivo Estreptococo viridans Otros estreptococos Estafilococo coagulasa negativo Enterococo Bacilos gram negativos Hongos HACEK (#) Hemocultivos negativos 10/312 62/204 49/204 39/204 21/204 13/204 11/204 6/204 3/204 110/314 (3,2) (30,4) (24) (19,2) (10,3) (6,4) (5,4) (2,9) (1,5) (35) (*) Porcentajes calculados sobre el total de casos en que la variable fue consignada. (#) Haemophilus aphorophilus, Haemophilus parainfluenzae, Actinobacilus actinomycetemcomitans, Cardiobacterium hominis, Eikeinella corrodens o Kingella Kingae. EI = Endocarditis infecciosa. La hemodiálisis y la diabetes son comorbilidades decisivas en estos sujetos, 20,4% y 11,2% respectivamente, siendo muy infrecuente la infección por HIV y drogadicción intravenosa asociada a endocarditis en Chile. Los gérmenes predominantes: el estafilococo aureus seguido por el estreptococo viridans, con un alto porcentaje de hemocultivo negativo en el país, especialmente en regiones. Esta misma evidencia podemos observarla en USA., como lo han comprobado Cabell et al y pueden tener implicancias pronosticas de mortalidad. Recientemente se ha evidenciado el riesgo de las hemodiálisis y su asociación con estafilococo aureus. LESIÓN CARDÍACA Y RIESGO DE EI En la tabla 2, se aprecia el riesgo relativo estimado para endocarditis infecciosa, de acuerdo a la cardiopatía subyacente o lesión cardíaca predisponerte, adaptado de Durack. La profilaxis de EI será entonces más recomendada y, el clínico, debe estar en una actitud más vigilante frente a lesiones de “alto riesgo y riesgo intermedio” (Tabla 2). Sin embargo, a la luz de las evidencias actuales, también en presencia de marcapasos y desfibriladores implantables en opinión de los autores, podría efectuarse profilaxis de EI. Dada la severidad y alta mortalidad de esta enfermedad, ella debe ser prevenida cuando sea posible y la determinación de una adecuada profilaxis, implica establecer el riesgo del paciente y de los procedimientos que pueden producir bacteriemia. 6 Tabla 2. Tipos de lesión cardiovascular y riesgo de endocarditis* Alto riesgo Endocarditis infecciosa previa Válvulas protésicas Enfermedad valvular aórtica Insuficiencia mitral Enfermedad Mitral Ductus arterioso persistente Comunicación interventricular Coartación aórtica Síndrome de Marfan Cardiopatía congénita cianótica Riesgo intermedio Prolapso valvular mitral Con regurgitación Estenosis mitral pura Enfermedad tricuspídea Enfermedad valvular pulmonar Hipertrofia septal asimétrica Calcificación degenerativa aórtica Valvulopatías degenerativa en adultos mayores Catéteres en corazón derecho: Implante protésicos intracardíacos no valvulares Bajo riesgo Prolapso válvula mitral sin regurgitación Insuficiencia tricuspídea trivial Comunicación interauricular ostium secundum Placas arterioescleróticas Enfermedad coronaria Aortitis luética Marcapasos cardíacos Cardiopatías previas corregidas Quirúrgicamente (sin material protésico) 6 meses después de la operación *(Modificado de Hurst). Como se apreciará más adelante nuevos criterios de profilaxis se han propuesto en esta materia, que está en plena discusión. En resumen la clasificación y características clínico epidemiológicas más aceptada en la actualidad incluiría: EI Nosocomial Esta forma de EI puede injertarse tanto en válvulas nativas (con daño o sin lesiones previas) como en válvulas protésicas en pacientes hospitalizados. En la serie de Pelletier y Petersdort el 28% de los casos corresponderían a esta variedad. La Medicina Intensiva puede predisponer de muchas maneras a su aparición, como con cirugía, catéteres para registro de presiones, alimentación parenteral, válvulas ventrículo-atriales (drenaje de líquido cefalorraquideo), agujas de biopsia, marcapasos endocavitarios, desfibriladores implantables, catéteres arteriales, urinarios y en la vía aérea. Las bacteriemias en pacientes muy comprometidos desde estas vías de entrada infectadas, son frecuentes, incluidas aquellas con hemodiálisis. En pacientes quemados, diabéticos, portadores de prótesis valvulares cardíacas, trasplantados medulares y cardíacos (inmunocomprometidos), están en riesgo de EI nosocomial. El germen aislado más frecuente es el estafilococo, enterococo, cándida y gérmenes gram negativos. 7 El estafilococo aureus, se asocia con mayor frecuencia a infecciones de heridas operatorias, celulitis y cánulas. El estafilococo epidermidis con shunts ventriculoatriales y c. albicans, con alimentación parenteral. El pronóstico de esta enfermedad es peor que el de otras formas de EI en válvula nativa, posiblemente por lo difícil de su diagnóstico en pacientes previamente muy dañados y con cuadros complejos por patologías superpuestas. Una nueva variedad de EI, ha sido recientemente propuesta, por el grupo de investigadores del ICE (Estudio Internacional Colaborativo de Endocarditis Infecciosa), la EI infecciosa valvular nativa asociado a cuidados de la salud (ambulatorios). Se refiere a la EI adquirida en la comunidad, pero en pacientes provenientes de centros de atención de salud ambulatorios (diálisis, casas de reposo, terapias controladas), con agentes etiológicos y una morbimortalidad parecida a la EI nosocomial; Benito et al, comunica una mayor incidencia de estafilococo aureus, bacteremia persistente y de mortalidad en este grupo de pacientes comparado con aquellos con EI adquirida en la comunidad. En resumen, cuatro son los tipos de endocarditis de acuerdo a sus características clínicoepidemiológicas: EI valvular nativa – EI valvular protésica – EI por narcoadicción intravenosa – EI nosocomial. PATOGENIA a- Consideraciones anatómicas y funcionales: Como ya se señaló, la lesión característica de esta enfermedad de etiología infecciosa, se produce habitualmente en una válvula cardíaca, característicamente en la superficie auricular de las válvulas aurículo ventriculares (mitral y tricúspide) y en la cara ventricular de los velos sigmoideos aorticos y pulmonares. Rodbard, demostró elegantemente que esta disposición guarda relación con una disminución de la presión lateral (con menor perfusión de la intima a ese nivel), en la zona distal al flujo de regurgitación. Las lesiones que se acompañan de mucha turbulencia (pequeños defectos interventriculares, flujos sanguíneos de alta velocidad en válvulas estenóticas y/o insuficientes), generan estas zonas con traumatismos endoteliales donde se facilita la colonización bacteriana. Lo contrario tiende a ocurrir cuando los defectos son grandes (menor velocidad del chorro sanguíneo) o con bajo flujo (CIA tipo ostium secundum) o en casos de turbulencias atenuadas por bajo débito (insuficiencia cardíaca congestiva, arritmia completa por fibrilación auricular) tienen menor incidencia de la enfermedad. En presencia de endarteritis (Ductus Arterioso Persistente) o en fístulas infectadas, el cierre de ellos conduce a la mejoría (además del tratamiento antimicrobiano), evidenciando lo esencial del factor hemodinámico en la producción de esta enfermedad. 8 Dónde se produce la lesión, en qué válvulas, tiene también directa relación con el grado de carga mecánica que soporta cada una de ellas. En 1024 autopsias, Lepchkin encontró una incidencia de 86% en válvula mitral, 55% en válvula aórtica, 19.6% en tricuspide y 1.1% en la pulmonar, cuya distribución guardaría directa relación como ya se ha dicho, con la presión en reposo sobre la válvula cerrada: 116 mmHg, 72 mmHg, 24 mmHg y 5 mmHg. En décadas anteriores, se observaba que ¾ partes de los casos los pacientes con EI tenían una cardiopatía subyacente. En la actualidad, esta cifra va en disminución considerando la mayor frecuencia de EI a estafilococos, en pacientes hospitalizados sometidos a medicina intensiva, en pacientes drogadictos o en inmunodeprimidos, cambios demográficos que inciden directamente en la etiología de esta enfermedad, tanto a nivel extranjero como en Chile. La valvulopatía aórtica ha sido la lesión predisponerte en cerca de un tercio de los casos. Se explica porque el gradiente máximo sistólica transvalvular está asociado a un mayor riesgo de EI. Aquellos sujetos con insuficiencia aórtica tiene la mitad de probabilidad de tener EI, a diferencia de pacientes con estenosis aórtica. La valvulopatía mitral ha aumentado su incidencia, ya que el prolapso mitral subyacente se ha encontrado hasta en un 29% de algunas series. Algunos han insistido en que esta patología conlleva un riesgo sustancialmente más alto de desarrollo de ella que en pacientes control, como lo señala Clemens et al. En décadas pasadas las etiología reumática era la lesión subyacente sobre 2/3 de los casos y la válvula mitral sola o asociada se encontraba en el 85% de los pacientes infectados. La tricúspide hasta en 6% y la pulmonar no llegaba al 1%. En nuestro medio se ha observado una tendencia decreciente de la lesión reumática como cardiopatía subyacente, comprobándose en el Estudio Cooperativo Nacional de Endocarditis Infecciosa (1998 – 2008) una incidencia de 21.6%. La cardiopatía congénita es la lesión subyacente en 10 a 20% de los casos, siendo el ductos arterioso persistente, válvula aórtica bicúspide, comunicación interventricular, tetralogía de Fallot, y la coartación aórtica, las que mayor predisposición tienden a desarrollar esta complicación infecciosa. En la miocardiopatía hipertrófica obstructiva, la incidencia puede llegar al 3.8%o personas año y de 4,3 %o a 10 años. La valvulopatía degenerativa (calcificación anular mitral) fibroesclerosis y calcificación valvular aórtica), se asocian frecuentemente en pacientes sin otra valvulopatía subyacente demostrable. En pacientes ancianos, su incidencia es mayor llegando a ser sobre un 50% en los mayores de 60 años que desarrollaron EI. En el estudio nacional ya citado su incidencia entre las cardiopatías subyacentes 8,3%. b- Fisiopatología: El endotelio (endocardio) que recubre el corazón y sus válvulas es resistente a las infecciones por bacterias y hongos. Observaciones experimentales en animales demuestran que la superficie valvular debe estar lesionada previamente para permitir un lugar adecuado para la fijación y localización de bacterias. Los cambios en la superficie endotelial pueden producirse por agentes físicos (sobre carga local o sistémica) generando turbulencias sanguíneas. Estas turbulencias generan un traumatismo en esta superficie, permitiendo el depósito de plaquetas y fibrina, produciéndose una vegetación o acumulo fibrino-plaquetario, estéril, lesiones que son propias de la endocarditis trombótica no bacteriana (ETNB). Las bacterias llegan a este sitio y deben adherirse a esta vegetación y producir la colonización. El origen de estas bacteriemias puede encontrarse en mucosas traumatizadas y previamente colonizadas, como es el caso de la mucosa oral, o en procedimientos urogenitales, gastrointestinales y respiratorios. Ciertas cepas bacterianas tienen especial selectividad para adherirse a estas superficies previamente dañadas y que ya han constituido una ETNB, lo que es determinante para el desarrollo de una endocarditis infecciosa. Gould et al, demostraron que los 9 gérmenes que habitualmente causan EI (estreptococos viridans, estafilococos aureus y epidermidis, pseudomonas aeruginosa) se adhieren con mayor avidez, en modelos experimentales en perros, a velos aórticos caninos normales in Vitro, que aquellos gérmenes que se aislan con mayor frecuencia en EI (klebsiella pneumoniae, E. coli). En modelos con conejos también S. aurius y E. viridans, produjeron EI con mayor facilidad que E. coli. La adherencia microbiana está mediada por la cantidad de dextrano en la pared celular del microorganismo, la capacidad de unión del gérmen a la fibronectina, la presencia de moléculas de adherencias superficiales como la FIMA y otras sustancias que modulan esta adherencia bacteriana como: Integrinas, fibrinogeno, laminina y colágeno tipo 4. Estos gérmenes con mayor capacidad de adherencia, poseen en su superficie sustancias denominadas “adhesinas”, decisivas en la unión entre el germen y la vegetación (tablas 3 y 4). Tabla 3. Adhesinas de Stapilococos aureus en la patogénesis de Endocarditis Infecciosa Sustrato adherible MSCRAMMS Rol en EI experimental Fibrinógeno/Fibrina Clumping factor A Clumping factor B Coagulasa Proteína A ligante de fibrinógeno Proteínas A y B adherentes a fibronectina Proteína ligante de colágeno Análogo clase Ii MHC Si No No No Si Fibronectina Colágeno ECM de Amplio espectro No No MSCRAMMS: “microbiol surface component reacting with adhesive matrix molecules” *Modificado de Moreillon P. et al. Tabla 4 Adhesinas estrepcocicas en patogénesis de Endocarditis Infecciosa Sustrato adherible MSCRAMMS Rol en EI Trombo fibrino-plaquetario Glicanos de superficie (S saguis, S mutans) Tn917 inactivado FBP 130 activado (S mutans) Moléculas de adhesión (S gordonii) fimA (S parasanguis) heterólogos en otros estreptococos (ssaB, scaA, psaA, efaA) Si Fibronectina Películas de saliva y Moléculas ECM Si No No Si No 10 Antígenos fase I y II (S sanguis) pbIA y pbIB (S mitis) pblT (S mitis) MSCRAMMS: “microbiol surface component reacting with adhesive matrix molecules” *Modificado de Moreillon P. et al. Plaquetas Si No Estas bacterias ya adheridas atraen y activan monocitos sanguíneos que producen citokinas y factor tisular; citokinas y factores procoagulantes contribuyen al crecimiento del trombo fibrinoplaquetario infectado, constituyendo una vegetación en la EI, con una proliferación bacteriana activa (elementos procoagulantes y proinflamatorios) y no pudiendo los monocitos así erradicar la infección. En infecciones estafilococicas, incluso éstos pueden atacar las válvulas sanas, como puede observarse con mayor frecuencia en sujetos drogadictos por vía intravenosa, quienes tienen corazón previamente sin lesiones. Después de la colonización, bajo la cubierta fibronoplaquetaria, se favorece la proliferación bacteriana y el crecimiento de la vegetación como ya se señaló, con más acúmulo de plaquetas y fibrina originando la excrecencia macroscópica o vegetación. En su interior hay un acúmulo de eritrocitos, plaquetas, gérmenes, fibrina y leucocitos. En la profundidad de la vegetación hay un mayor número de histiocitos, monocitos, bacterias y células gigantes que pueden contener bacterias fagocitadas. Las bacterias pueden estar en concentraciones extraordinariamente altas (109– 1011 bacterias por gramo de tejido). Después del tratamiento antibiótico y en la fase de curación, aparecen capilares y fibroblastos. En ausencia de tratamiento e inicialmente en la infección, son estructuras avasculares. A consecuencia de lo anterior, podemos observar complicaciones intracardíacas como 1) Falla de coaptación de los velos por efecto mecánico de la vegetación (insuficiencia valvulares), lo que gatilla o empeora la regurgitación valvular y la ICC. 2) Perforación de la válvula, que puede dar origen a insuficiencia cardíaca aguda; rotura de cuerda de válvulas mitral y/o tricúspide 3) Extensión de la infección (abscesos) hacia el anillo valvular, miocardio adyacente, sistema de conducción, o a la interfibrosa mitroaórtica y cavitación de abscesos periaorticos en la pared adyacente de la aorta con forma de aneurismas micoticos. 4) Perforación de aneurismas (senos de valsalva, pared aortica), con formación de fístulas aortoauriculares o aortopericardicas 5) Grandes vegetaciones, particularmente en la válvula mitral, pueden resultar en estenosis valvular funcional y con deterioro hemodinámico consecuente. En general las complicaciones intracardiacas producidas por la lesión de válvula aórtica son de más rápida evolución que aquellas asociadas a lesión mitral, aunque es impredecible en cada individuo. Complicaciones extracardíacas: 1) Embolización de fragmentos sépticos de la vegetación (parcial o total) resultando el infarto y/o en infección del territorio comprometido. Bacteremia continua y siembra hematogena a tejidos remotos de la economía. El embolismo es clínicamente evidente entre el 11 y 43% de los pacientes, siendo en nuestra serie nacional de un 28%. En autopsias la embolia se detecta entre el 45 - 65%, ocurriendo 11 embolias pulmonares a menudo sépticas hasta en un 75% de los sujetos narcoadictos intravenosos con endocarditis tricuspidea, generalmente por estafilococos aureus, estreptococos betahemoliticos y otros agentes pingenicos. 2) Respuesta inmunitaria humoral: La EI provoca una respuesta inmunitaria tanto humoral como celular, que se manifiesta en hipergamaglobulinemia, esplenomegalia y macrofagos en sangre periférica. El factor reumatoídeo (FR) constituido por la unión de anticuerpos IgM contra IgG, se encuentra en alrededor del 50% de los pacientes con EI que tienen al menos 6 semanas de evolución de la enfermedad. También pueden observarse anticuerpos antinucleares que contribuyen al dolor pleurítico, manifestaciones musculoesqueléticas y febrícula. Se ha descrito presencia de anticuerpos opsonizantes (IgG), aglutinantes (IgG, IgM) y fijadores de complemento (IgG, IgM), crioglobulinas (IgG, IgM, IgA, C3, fibrinógeno), anticuerpos contra proteínas bacterianas y macroglobulinas. Se han detectado complejos inmunes circulantes en prácticamente todos los pacientes con EI, capaces de producir glomerulonefritis. Según el sitio del depósito de los complejos, su tamaño y cantidad, la localización de estos complejos puede ser subendotelial, mesangial o subepitelial. La localización, el patrón de enfermedad glomerular que aparecerá y el que se relaciona con el síndrome clínico que el médico observará se aprecia más adelante en complicaciones de endocarditis. Algunas manifestaciones periféricas de la EI como los nódulos de Osler, pueden ocurrir por depósito de complejos inmunes, lesiones que recuerdan la reacción de Arthus aguda; sin embargo, también existe concomitantemente la microembolia séptica en estos nódulos. En resumen, la respuesta de anticuerpos a la infección microbiana acarrea el consecuente daño orgánico tisular causado por el depósito de complejos inmunes o unión de anticuerpo-complemento que interactúan con antígenos localizados en los tejidos. Ante el estímulo antigénico microbiano persistente originado en los microorganismos protegidos en la vegetación, hay una respuesta inmune persistente, pero que resulta ineficiente. Se estimula la respuesta humoral, dependiente de los linfocilitos B, con aparición de hipergamaglobulinemia, múltiples Ac (anticuerpos), e incluso aparición de autoAc. Las crioglobulinas, factores reumatoideos y complejos inmunes son por ellos frecuentes en la EI como se detalla a continuación: Hipergamaglobulinemia 20 - 30%, factores reumatoideos 50%, complejos inmunes circulantes 65-100%, crioglobulinas mixtas tipo III 64 – 95%, disminución del complemento 5 – 15%, Ac antinucleares 20-30%, Ac anticitoplasma de neutrófilos (excepcional) y Ac antifosfolípido 5 – 15%, también se estimula la respuesta inmune celular dependientes de los linfocitos T, cuya participación y cooperación es indispensable para que se reproduzca una respuesta de los linfocitos B frente a estímulos antigénicos proteicos. Se van así generando múltiples alteraciones inmunológicas, las que pueden o no tener una expresión clínica. Es así como diversas manifestaciones clínicas que se observan en esta enfermedad, resultan tanto del proceso infeccioso como de la respuesta inmune misma. c- Agentes infecciosos etiológico y tipos de endocarditis: El espectro de especies microbianas causantes de EI es extraordinariamente extenso, si bien son unas pocas especies las responsables de la gran mayoría de los casos, de acuerdo con el estudio ICE ya señalado, en 2.781 pacientes estudiados (provenientes de todos los continentes), en esta cohorte estudiada prospectivamente con endocarditis definida, se observó en lo que agentes etiológico se 12 refiere, una incidencia de s. aureus de 31%, estafilococo coagulasa negativa 11%, estreptococo grupo viridans 17%, estreptococo bovis 6%, otros estreptococo 6%, enterococos 10%, HACEK 2%, cultivos polimicrobianos 1%, hemocultivos negativos 10%, otros agentes microbianos 4%. Los gérmenes gram positivos predominaron en 81.5%). Cuando se trata de válvulas nativas, los estreptococos y los estafilococos sumados, representan más del 80% de las infecciones. En la tabla 1 se señalan los gérmenes aislados en Chile en los primeros 321 casos estudiados (1998 – 2002). En cambio son muy pocos frecuentes las endocarditis valvulares nativas por s. epidermidis, bacilos entéricos y hongos. En la endocarditis sobre válvulas protésicas y en EI en narcoadictos intravenosos, la incidencia por estos gérmenes es mayor. En la tabla 5, se aprecia la frecuencia de agentes etiológicos sobre válvulas nativas, en adictos a drogas IV y sobre válvulas protésicas, según datos representativos recogidos de la bibliografía. Tabla 5 Frecuencia de los diferentes gérmenes causantes de endocarditis en 2.781 pacientes con E.I. definida Microorganismo Estafilococos Coagulasa positivos Coagulasa negativos Estreptococos Viridans Strepcococcus bovis Enterococcus especies Otros estreptococos HACEK Hongos Infección polimicrobiana Bacterias misceláneas Hemocultivo negativo EVN,% Adictos a drogas IV % EVP % EV otros dispositivos 28 9 68 3 23 17 35 26 21 7 11 7 2 1 1 4 9 10 1 5 2 0 1 3 3 5 12 5 12 5 2 4 0.8 7 12 8 3 6 4 0.5 1 0 6 11 Modificado de Murdoch et al. CUADRO CLÍNICO, CRITERIOS DIAGNÓSTICOS Y COMPLICACIONES El diagnóstico de EI comienza con una cuidadosa historia y examen físico. El antecedente de endocarditis previa, valvulopatías previas (lesiones cardíacas congénitas o adquiridas), manipulaciones dentales, genitourinarias, broncoscopias, drogadicción endovenosa o tatuajes en la piel, deben orientar a la puerta de entrada y bacteremia consecutiva. El diagnóstico puede basarse en la presencia de manifestaciones cardíacas o sistémicas. La presencia de un soplo cardíaco, reciente o que haya variado, asociado a fiebre, debe hacer sospechar el diagnóstico, especialmente si existe una válvula protésica. Los criterios diagnósticos de Duke han sido un aporte para el diagnóstico de esta 13 afección y para un manejo más oportuno y precoz de ella. Las complicaciones en la EI pueden afectar a cualquier órgano. Las complicaciones cardíacas son frecuentes y la insuficiencia cardíaca puede acarrear la muerte. La formación de abscesos intracardíacos con alteraciones en la conducción, pueden afectar el miocardio y pericardio, siendo necesaria la resolución quirúrgica. Las complicaciones extracardíacas, neurológicas, vasculares, renales y sépticas son comunes y habitualmente producidas por embolización de vegetaciones o complejos inmunes. A pesar de los avances en la detección y tratamiento de estas complicaciones, el manejo de este cuadro y su diagnóstico diferencial persiste difícil y es de alta letalidad. Al llegar al diagnóstico de Endocarditis Infecciosa (EI) puede ser extremadamente difícil y un verdadero desafío para el clínico, dado que esta afección puede presentarse con manifestaciones no específicas como fiebre, escalofríos, pérdida de peso, anorexia y sudoración nocturna. El diagnóstico en nuestros días, se basa en la combinación de hallazgos del cuadro clínico, el laboratorio (especialmente hemocultivos) y el ecocardiograma. MANIFESTACIONES CLÍNICAS Pueden agruparse en aquellas derivadas de: a) b) c) La infección sistémica Las lesiones intravasculares La evidencia de respuestas inmunes a la infección Estas alteraciones se verán reflejadas en la historia y examen físico. Historia clínica: Los síntomas de endocarditis infecciosa subaguda (EISA), se desarrollan en el tiempo y son muy polimorfos, con fiebre, escalofríos, sudoración nocturna que orientan a infección sistémica. El malestar general, astenia y adinamia, es bastante frecuente. Las pérdidas de peso, artralgias, mialgias y lumbago, son también frecuentes, a veces el paciente se refiere a estas molestias como a un “estado gripal”. El compromiso intravascular es el responsable de síntomas propios de insuficiencia cardíaca izquierda o derecha, manifestaciones embólicas en territorio del sistema nervioso central (SNC), abdomen, coronario, renal o de una extremidad, síntomas que se acentúan hasta 1 o 2 meses previos al diagnóstico. En la EI aguda (EIA), el curso es muy rápido, con mayor severidad de síntomas y signos, con temperaturas altas, escalofríos y severo compromiso del estado general en pocos días. Los síntomas de insuficiencia cardíaca congestiva (ICC) pueden desarrollarse gradualmente o agravarse repentinamente, dependiendo si la EI es subaguda o toma un curso agudo, debido a complicaciones mecánicas, como rotura de velos o cuerdas, músculo papilar, perforación de velos, rotura de seno de Valsalva, o al desarrollo de una estenosis valvular (funcional), por obstrucción del flujo sanguíneo por vegetaciones. La ICC se puede desarrollar también insidiosamente, o agravarse la ya preexistente, por daño valvular progresivo, o por miocarditis por complejos inmunes o séptica, o por embolismo coronario (forma de cardiopatía isquémica). 14 Examen físico: Por ser esta una enfermedad multisistémica, puede afectar varios órganos y parénquimas. El paciente puede presentarse con la clásica triada de fiebre, soplo y esplenomegalia (manifestación embólica), además de palidez de piel y mucosas, elementos que aclaran el diagnóstico. La fiebre y su expresión clínica al examen físico es la más frecuente manifestación de EI en alrededor del 90% de los casos, dado su carácter infeccioso, sin embargo, puede estar ausente o minimizada en casos de severa ICC, caquexia, insuficiencia hepática o renal; drogas antimicrobianas previas o gérmenes poco virulentos como causa de la enfermedad. La anemia y las manifestaciones de uremia, se observan en pacientes con esta grave afección. Fenómenos vasculares bastante comunes como petequias, la mayoría debida a microembolizaciones, o a coagulación intravascular diseminada en caso de sepsis muy severas (EIA). Hemorragias subungueales en astilla, que no llegan al borde externo ungueal, se pueden encontrar en 20% de los casos y producidas por microembolización, pero son inespecíficas, dado que pueden observarse en 5-8% de pacientes sin EI. Los nódulos de Osler son formaciones nodulares, eritematosas en la piel de extremidades y habitualmente en pulpejos de los dedos. No llegan a encontrarse más allá del 20% de los casos y su génesis tendrían un doble origen: capilaritis por microembolización infecciosa o por reacciones inmunes (especialmente en EISA). Las lesiones de Janeway (menores de 5 mm), planas, indoloras, eritematosas e irregulares, se encuentran en plantas y palmas. A diferencia de las petequias, no son hemorrágicas y empalidecen con la compresión. Lesiones oculares: petequias subconjuntinales en párpados, son graves pero inespecíficas, dado que pueden encontrarse luego de cirugía extracorpórea o en sepsis. Hemorragías retinianas, algunas con una zona pálida al centro, las llamadas “manchas de Roth”, que representan cuerpos citoides producidos por microinfartos de la retina. La pérdida de la visión puede producirse por oftalmitis, neuritis óptica o por embolización a la arteria retinal o al cerebro. La endoftalmitis puede verse en EI por cándidas. Hipocratismo digital: antiguamente, en la era preantibiótica, era muy común (EISA), actualmente, sólo se da en el 5% de los casos dado la mayor precocidad diagnóstica. En nuestra experiencia, su hallazgo es mayor, en 34.1% de los casos como se aprecia en la Tabla 6. Su patogenia no está aclarada y desaparece luego del control de la infección. Signos de embolización: signos neurológicos localizados o accidente vascular encefálico (AVE), pulsos periféricos en extremidades disminuidos o abolidos, pueden traducir embolias por fragmentos de vegetación. Infartos del brazo, riñón, intestino, se manifiestan con dolor abdominal y en ocasiones simulan un abdomen agudo por obstrucción intestinal o peritonitis, ICC, infarto agudo miocárdico o disrritmias que puede obedecer a oclusión de arterias coronarias. Esplenomegalia. Se observa en cerca del 25% de los casos de EIA y en la mitad de los portadores de EISA. En nuestra experiencia, esta cifra es mayor (48,4%), pero hemos incluido casos con ecotomografía abdominal positiva para esplenomegalia. Cuando su palpación es dolorosa, debe sospecharse infarto esplénico o absceso. Examen cardiovascular, puede haber taquisfigmia como resultado de la fiebre y/o ICC. Alteraciones en la conducción, pueden determinar irregularidad del pulso, por abscesos perivalvulares o AC X FA (arritmia completa por fibrilación auricular) según lesión cardíaca subyacente. En presencia de insuficiencia aórtica severa, se apreciarán los signos derivados de una mayor diferencia de presión de pulso (signos de Corrigan, Quincke, Duroziez, etc.), o disminución de estos pulsos por bajo débito o 15 por embolias (asimetría). Uno o más soplos se presentan en algún momento de la enfermedad en forma constante. Hasta 15% de los pacientes puede no tener soplo al ingreso, lo que debe hacer sospechar endocarditis derecha o EIA. Los soplos que se auscultan pueden ser por el daño cardíaco, o por el cuadro séptico o por ambos. Lo habitual, es detectar soplos de regurgitación valvular: Mitral, aórtica y/o tricuspídea. La presencia de EI y estenosis mitral no supera el 5%. En una enfermedad febril, la aparición de un soplo de insuficiencia aórtica, debe hacer sospechar la enfermedad. La aparición de nuevos soplos es muy importante en el curso de EISA y de EIA. Soplos cambiantes pueden encontrarse en esta última. Las artralgias son comunes, secundarias a inflamación gatillada por depósito de complejos inmunes. En la tabla 6, se resumen los signos y síntomas más frecuentes encontrados en un grupo de pacientes estudiados en forma prospectiva en el área central de Santiago. Tabla 6 Manifestaciones clínicas Endocarditis Infecciosa* Síntomas Fatigabilidad Disnea Anorexia, baja de peso Sudoración Edema Cefalea Mialgias Tos Dolor torácico Artrialgias Lumbago Delirio % 85,6 81,7 78,1 74,0 58,3 56,8 53,5 51,8 46,4 27,4 20,9 10,05 Signos físicos Soplos Fiebre (sobre 37,5°C) Esplenomegalia (clínica/Eco) Alteraciones mucocutáneas Embolismo (sistémico/pulmonar) Hipocratismo digital Accidente vascular encefálico Coma Aneurisma micótico % 97,9 93,1 48,4 47,5 45,9 34,1 15,0 11,7 11,6 *(Hospital Clínico San Borja-Arriarán: 1980-1995) DIAGNÓSTICO Las claves diagnósticas planteadas por Osler en 1908: fiebre remitente, con valvulopatía y fenómenos embólicos, lesiones cutáneas y alteraciones cardíacas progresivas, tienen plena vigencia. En esa época, el diagnóstico se confirmaba en la necropsia, pues casi todos los pacientes fallecían. Con el uso de modernas técnicas de hemocultivos en la actualidad, el diagnóstico se confirma reconociendo el agente causal. Werner et al en 1967, demostró que la mayoría de los pacientes sin antibióticos previos en EI, tenían hemocultivos psositivos en las primeras 48 horas de estudio. De ahí que es suficiente con 3 hemocultivos para aislar al germen responsable. Se ha demostrado que para pacientes con bacteremía, 2 sets de hemocultivos, permiten asilar el germen en el 99% de los casos y con 3, sobre el 99% (habiendo bacteremia). Este no es aplicable si hubo antibióticos previos, en EI por hongos, por Coxiella o Bartonellas. El hemocultivo es el test de laboratorio, por tanto, más 16 importante en pacientes en los que se sospecha la EI, pudiendo tener una positividad del 95%. La bacteremia es constante y, por tanto, explica el alto porcentaje de positividad en ausencia de antibióticos previos, lo que se analizará más adelante en exámenes de laboratorio. Criterios Diagnósticos En 1981, Von Reyn et al, publicaron “criterios estrictos” para el diagnóstico de EI, en los que hemocultivos positivos o la histología entre los criterios claves diagnósticos. Criterios mayores para EI probable eran la bacteremia persistente, con un soplo de regurgitación reciente, valvulopatía con vasculitis o hemocultivos negativos con fiebre, o soplos de regurgitación recientes y vasculitis. Posteriormente, la aparición de la ecocardiografía permitió un diagnóstico morfológico, funcional y de las complicaciones intracardíacas, de extraordinario valor clínico en cuanto a diagnóstico y tratamiento, como se trata en el capítulo correspondiente. Basado en lo anterior en 1994, Durack et al (Universidad de Duke), agregaron como criterio mayor el hallazgo ecocardiográfico y propusieron nuevos criterios diagnósticos para esta afección, un ecocardiograma que evidencia una vegetación, abscesos o dehiscencia valvular protésica, asociado a hemocultivos positivos, es suficiente para el diagnóstico. Como ya se ha mencionado, estos “criterios de Duke” integran factores predisponentes, bacteremías persistentes y hemocultivos y hallazgos ecocardiográficos, con otros elementos clínicos y de laboratorio (criterios mayores y menores). La utilidad de los criterios de Duke en la evaluación de pacientes con sospecha clínica de EI, han sido debidamente validados. La especificidad es alta, 0,99 con IC 95% de 0,97-1,0 y el valor predictivo negativo estuvo sobre el 92%. Las mayores discrepancias se producen cuando se rechazan casos de EI posible. Una versión modificada de los criterios de Duke, se han propuesto y se incluyen en la Tabla 7. Tabla 7 CRITERIOS DE DUKE PARA EL DIAGNÓSTICO DE ENDOCARDITIS INFECCIOSA Y MODIFICACIONES PROPUESTAS Criterios de Duke Criterios anatomopatológicos • Gérmenes encontrados por cultivo o examen histológico • Endocarditis activa demostrada por examen histológico Criterios mayores (criterios clínicos) • Hemocultivos positivos • Microorganismos típicos de EI En dos muestras separadas de hemocultivos • Microorganismos propios de EI con Hemocultivos persistentemente positivos Evidencia de compromiso endocárdico Ecocardiografía: masa o estructuras oscilantes Formación de absdesos, dehiscencia parcial de Válvulas protésicas. Nueva regurgitación valvular Criterios menores • Modificaciones sugeridas Agregar: Serología positiva para Coxiella Burnetti, Chlamydia pisittaci y Bartonellas - Bacteremia por S aureus - Examen molecular positivo para genes de microorganismos o reacción de polimerasa en cadena (PCR). 17 • • • • • • Lesión cardíaca predisponente o drogadicción iv Fiebre > 38°C Fenómenos vasculares* Fenómenos inmunológicos* Evidencia microbiológico (no siendo signo mayor) Sospecha ecocardiográfica (no siendo signo mayor) Categorías Definida: • Criterio anatomopatológico positivo o • Criterios clínicos: 2 criterios mayores positivos o 1 mayor y 3 menores positivos o 5 criterios menores positivos Posible: Todos los casos que no clasifican Como definidas o rechazadas Rechazados: Diagnóstico alternativo Término del cuadro con antibióticos en < 4 días Sin evidencia histológica Eliminar: Sospecha ecocardiográfica Agregar: Proteína C reactiva; VHS elevada Hematuria, esplenomegalia, Hipocratismo digital, petequia, Púrpura, hemorragias en astilla Gérmenes de EI aislados en lesiones metastásicas. 1 criterio mayor y 1 criterio menor 3 criterios menores presentes EI: Endocarditis Infecciosa. VHS: Velocidad Hemosedimentación. PCR: reacción de cadena de polimerasa. Iv: intravenosa. *Fenómenos vasculares: émbolos arteriales, infartos sépticos pulmonares, hemorragia intracraneana, hemorragia conjuntival, lesiones de Janeway. Fenómenos Inmunológicos; glomerulonefritis, nódulos de Osler, manchas de Roth, Factor reumatoideo. Con técnicas histológicas e inmunológicas, puede demostrarse la presencia de cambios inflamatorios en endocardio valvular, tejidos y/o en vegetaciones, característicamente en la base de la vegetación. Este estudio con tinciones adecuadas puede también identificar el germen causal de la EI, con técnicas inmunohistológicas, pudiendo así diferenciar aquellos casos en que la ecocardiografía es de difícil diagnóstico frente a mixomas, fibroelastomas y nódulos reumatoides. Los criterios histológicos para EI propuestos, se anotan en la Tabla 8. A ello puede asociarse tinciones especializadas como se dijo con anterioridad, con técnicas enzimáticas de inmunoabsorción (ELISA) e inmunofluorescente (ELIFA), inmunofluorescencia directa con fluoresceína conjugada y anticuerpos monoclonales, e inmunoperoxidasa, están disponibles ahora para una mejor identificación de gérmenes de difícil cultivo y causantes de EI con hemocultivo negativo, como C Burnetti y Bartonellas las que con mayor facilidad se detectan con serología (ELISA), y legionella a partir de productos de degradación de este microorganismo en orina estudiados con ELISA. Estas técnicas y su real aporte en el diagnóstico, deben ser validadas a futuro. 18 Tabla 8. Criterios histológicos propuestos para el diagnóstico de EI EI: Endocarditis Infecciosa EXÁMENES DE LABORATORIO Ya se ha mencionado la importancia del hemocultivo y de la ecocardiografía para el diagnóstico y manejo terapéutico de esta enfermedad, exámenes y técnicas que serán descritas a continuación. Alteraciones hematológicas, inmunológicas y urinarias, son comunes, por lo que la información obtenida a través de los exámenes “de rutina”, es variada, pero inespecífica. a) Hemocultivo, el cultivo de la sangre es la prueba más importante para el diagnóstico etiológico de la enfermedad (o aislando el germen del material embolico o de vegetaciones en situaciones más excepcionales) y para su tratamiento antibiótico posterior. La bacteriemia suele ser continua y de grado bajo (en el 80% de los casos se encuentran menos de 100 UFC/ml de sangre). En cerca de 2/3 de los casos, el resultado del hemocultivo es positivo, pero cuanto existe bacteriemia, los dos primeros cultivos de sangre dan el diagnóstico de germen causal en más del 90% de los casos. Los sistemas de cultivo de sangre automatizados tienen mayor sensibilidad que los métodos de hemocultivos tradicionales. La muestra de sangre se obtiene de punción venosa dada la condición de bacteriemia continua en la enfermedad, por lo que no tiene ventajas extraer muestras de punción arterial o esperar “peak” febriles. En pacientes que no hayan recibido tratamiento antibiótico previo, su positividad puede llegar al 95%. El uso de antibióticos previos es la mayor causa de hemocultivos negativos como se ha dicho. Suspendido el tratamiento antibiótico, la toma de nuevos hemocultivos 19 está directamente relacionada con la duración que tuvo el tratamiento antimicrobiano para la reversión del hemocultivo, así como por la sensibilidad del germen. Pueden necesitarse desde sólo pocos días hasta semanas para su positividad. Tres muestras separadas de hemocultivos, cada una de una punción venosa distinta, en 24 horas, es lo recomendable en EI. Cada set o muestra, debe incluir una botella para medios aeróbicos y otra para el cultivo de gérmenes anaeróbicos, con 10 ml al menos de la muestra de sangre en cada botella. En el aislamiento de bacteriemias, deben considerarse si son transitorias o sostenidas y típicas de EI (de acuerdo al tipo de germen y número de hemocultivos positivos). Naturalmente que la presencia de otras alternativas como fuentes u origen de la infección, son útiles en su evaluación. Los hemocultivos pueden ser negativos entre el 3-23% de los casos en algunas series; en nuestro estudio nacional de EI su negatividad llega lamentablemente, al 34.6% en 506 pacientes estudiados prospectivamente en su fase final (1998 – 2008). La EI con cultivo negativo se encuentra asociada habitualmente al uso de antibióticos en las dos semanas anteriores a la toma de las muestras. En algunos casos el agente causal puede identificarse en presencia de hemocultivos negativos, por estudios histológicos y examen microbiológico del material embolizado el que puede ser diagnóstico para endocarditis fúngica o por gérmenes del grupo HACEK. Los cultivos de médula pueden dar positivo para infecciones por Brucella, mycobacterias u hongos. El diagnóstico de EI por Coxiella Burnetti (fiebre Q) o chlamydias, generalmente requiere estudios serológicos. También la serología, aglutinación, fluorescencia indirecta, ELISA, fijación de complemento, la reacción de cadenas de polimerasa (PCR) amplificada para detección del RNA ribosomal del gene 16 S, genes específicos para bacterias. PCR es muy útil para identificar ADN bacteriano en muestras de tejido, incluyendo válvulas y émbolos periféricos. Este proceso es de alta importancia en la identificación de Tropheryma Whipplei, bacteria prácticamente no cultivable. La PCR es útil aun después de finalizado el tratamiento. En la experiencia de Grijalva et al, la sensibilidad fue de 93% con la técnica de PCR para la capacidad de detección de ácidos nucleicos de gérmenes específicos y en material quirúrgico (válvulas) de pacientes operados por EI con hemocultivos negativos. Recientemente se han comunicado experiencias con técnicas de autoinmunohistoquímica, con alto rendimiento para estos casos. La procalcitonina proporcionaría un mejor marcador diagnóstico que la proteína C reactiva, en pacientes con sospecha de EI. b) Ecocardiografía. A partir de 1973, se diagnostica por primera vez con este método (modo M) imágenes compatibles con vegetaciones, lo que posteriormente se ha perfeccionado a través de las décadas y se ha constituido en una prueba fundamental para el diagnóstico y seguimiento clínico de esta enfermedad, incluída su repercusiones anatómicas y funcionales en el corazón, durante el período intrahospitalario y en el seguimiento posterior. Detecta vegetaciones, las que corresponden a masas ecogénicas adheridas a la válvula adyacente, pero con un movimiento independiente al de la propia válvula. La ecocardiografía no solo identifica vegetaciones en caso de sospecha clínica de EI, o en presencia de bacteriemias, sino que también proporciona información sobre la función ventricular, el grado de regurgitación valvular o la real extensión de la enfermedad en pacientes congénitos o con cardiopatía adquirida. La ecocardiografía transtorácica (ETT) se puede y debe utilizar en todo paciente bajo sospecha de EI. La ETT y la ecocardiografía transesofágica (ETE) tienen una sensibilidad y especificidad variables para la detección de vegetaciones, roturas y accesos, de acuerdo a Jacob et al, con ETT el porcentaje de sensibilidad para vegetaciones varía de 28 a 63% y la especificidad al 91 – 100%. Para roturas valvulares 45 y 98% respectivamente. Para la detección de abscesos 28 – 36%. 20 Con la técnica ETE, la sensibilidad para vegetaciones oscila entre 86 y 100% y la especificidad entre el 91 y 100%. Para roturas valvulares la sensibilidad es del 95% y la especificidad llega al 98% y la detección de abscesos varía entre 80 y 87%; el valor predictivo negativo es mayor al 96%, con lo que se reafirma la mayor sensibilidad del ETE. Los pacientes en los cuales se identifica una vegetación mediante esta técnica, experimentan un riesgo aumentado de embolias sistémicas, ICC, necesidad de cirugía, especialmente cuando está afectada la válvula aórtica, lo que conlleva mayor mortalidad. Estos hallazgos sumados a la situación clínica del sujeto condicionan la conducta quirúrgica en cada caso. La flecha a la izquierda en la imagen obtenida a través de la técnica trans-esofágica, muestra una perforación del velo mitral posterior; la flecha a la derecha una gran vegetación de aspecto triangular en este velo. (Gentileza Dr. Mario Alfaro Díaz, Hospital Clínico San Borja-Arriarán) La ETE ha cambiado significativamente la estrategia diagnóstica para paciente con sospecha de EI, dada su mayor sensibilidad y especificidad que la técnica transtorácica, especialmente para válvulas protésicas y dispositivos intracardíacos, como marcapasos. La ETE puede identificar vegetaciones en electrodos del marcapaso (MP) y en vías intravenosas, especialmente en vegetaciones pequeñas (sobre 2 mm). La ETE es la técnica de elección para la detección de abscesos perivalvulares. En las tablas 10 y 11, de la AHA para ecocardiografía se anotan las proposiciones para uso de esta técnica en el diagnóstico y tratamiento de EI y aquellos hallazgos ecocardiográficos que sugieren la potencial necesidad de intervención quirúrgica respectivamente, criterios propuestos en la guías de la ACC/AHA-2008, centradas en EI. 21 Tabla 9 Uso de Ecocardiografía durante el diagnóstico y tratamiento de Endocarditis (EI) Precoz: Ecocardiografía lo más pronto posible (< 12 hs. luego de evaluación inicial) ETE preferida; obtener imágenes de ETT de cualquier anormalidad para comparación posterior ETT si ETE no esta disponible inmediatamente ETT puede ser suficiente en niños pequeños Repetir Ecocardiograma: ETE luego de un ETT positivo lo antes posible en pacientes con alto riesgo de complicaciones ETE 7 – 10 días después de ETE inicial si persiste sospecha sin diagnóstico de EI o hay curso clínico Desfavorable durante el tratamiento precoz de EI Intraoperatorio: Pre-bomba: Identificación de vegetaciones, mecanismos de regurgitación, abscesos, fístulas, y pseudoaneurismas. Post-bomba: Confirmación de reparación exitosa u hallazgos anormales Verificación de disfunción valvular residual: Post carga elevada si es necesario evitar subestimación de insuficiencia valvular o presencia de flujo anormal residual. Al completar terapia: Establecer nueva línea de base para función y morfología valvular, y tamaño y función ventricular. ETT suele ser suficiente ETE: ecocardiograma tranesofágico ATT: Ecocardiograma transtorácico Tabla 10: Hallazgos ecocardiográficos que sugieren potencial necesidad de intervención quirúrgica Vegetación: Vegetación persistente posterior a embolización sistémica Vegetación de velo mitral anterior, particularmente con tamaño > 10 mm. (por riesgo de embolización) ≥ 1 eventos embólicos durante las primeras 2 semanas de tratamiento antimicrobiano (por riesgo de embolización) Aumento en el tamaño de la vegetación a pesar de tratamiento antimicrobiano efectivo cirugía por falla de la terapia médica) Disfunción valvular Insuficiencia mitral u aórtica aguda con signos de falla ventricular Insuficiencia cardíaca refractaria a terapia médica Perforación o ruptura valvular Extensión perivalvular: Dehiscencia, ruptura, o fístula Abscesos grandes, o extensión de absceso a pesar de tratamiento antimicrobiano apropiado 22 c) Otras técnicas: La resonancia nuclear magnética (RNM) y la tomografía computarizada (TC), han identificado extensiones perivalvulares de la infección, aneurismas de raíz aórticas y fístulas, pero la experiencia clínica es todavía limitada. Cintigrafía: Se han intentado identificar vegetaciones y abscesos intracardíacos en pacientes con EI y en modelos animales, empleándose para estos fines galio-67 citratado, granulocitos marcados con indio 111 y plaquetas. Estos esfuerzos no han sido lo suficientemente exitosos como para obtener una buena sensibilidad y capacidad para la detección anatómica en el contexto clínico, a diferencia de lo prometedor que ella ha sido en el área experimental. Cateterismo cardíaco: Se sigue discutiendo su papel en esta enfermedad, se sostiene que las vegetaciones intracardíacas no deben ser alcanzadas por los catéteres; la técnica puede aplicarse para evaluar anomalías de flujo si no se pueden detectar con certeza con la evaluación clínica y la ETE. La angiografía coronaria se recomienda previa a la cirugía cardíaca en presencia de riesgo de arteriopatía coronaria. Idealmente y en los más jóvenes bastaría la reparación quirúrgica o la sustitución valvular solo con técnicas de evaluación no invasivas (ET) anteriores al acto quirúrgico. d) Exámenes bioquímicos: En el hemograma, la anemia es frecuente, encontrándose, entre el 50%-80% de los casos, de tipo normocítica, normocrómica (propio de una enfermedad crónica). En la forma subaguda, el número de leucocitos es habitualmente normal, pero puede haber desviación a izquierda. La anemia puede deberse también a hemólisis como en EI aguda. La anemia hemólita crónica leve, se asocia a prótesis mecánicas valvulares por lo que, en endocarditis de prótesis, su interpretación en estos casos es difícil. Leucocitosis con gran desviación a izquierda, orienta a infección a estafilococos o neumococos. La trombocitopenia es inusual, pero puede verse en casos de esplenomegalia o con coagulación intravascular diseminada. La presencia de histiocitos en sangre periférica en la punción del lóbulo de la oreja en 1/3 de los sujetos, refleja la fuerte estimulación reticuloendotelial asociada a EI, pero no es patognomónica. La VHS está elevada en 90% de los casos y en promedio es de 65 mm/h, pero puede estar normal (10%), especialmente al comienzo de la enfermedad (primeros días) o si hay insuficiencia cardíaca congestiva. Puede persistir aumentada hasta 6 meses de tratada la enfermedad. La proteína C reactiva está habitualmente elevada, pero es un hallazgo inespecífico y vuelve a lo normal rápidamente con el éxito del tratamiento, antes que la VHS. La procalcitonina proporcionaría un mejor marcador diagnóstico que en la proteína C reactiva en paciente con sospecha de EI. El examen de orina a menudo es normal en pacientes con EI; hematuria microscópica y proteinuria se ven habitualmente en 50% de los casos; cilindros hemáticos y proteinuria significativa orientan a glomerulonefritis por complejos inmunes, a menudo asociado a disminución del complemento sérico total. Hematuria importante sugiere infarto renal. Puede haber bacteriuria en caso de abscesos sépticos renales (EI a estafilococos). Creatininemia y nitrógeno ureico elevados, reflejan insuficiencia renal. Si hay una elevación desproporcionada de la uremia, implica una azotemia prerrenal propia de la Insuficiencia Cardíaca. Anticuerpos IgM dirigidos contras las IgG (factor reumatoideo), está elevado en alrededor de 50% de los casos, indicando una enfermedad de, al menos, 6 semanas. Complejos inmunes circulantes, especialmente en la forma subaguda, se observan en la mayoría de los pacientes y van asociados a artritis y glomerulonefritis. 23 También pueden originar daño miocárdico. inmunes, desaparecen al mejorar el cuadro. Tanto el factor reumatoideo como los complejos e) El electrocardiograma debe registrarse al ingreso y repetirlo según el curso de la enfermedad. La presencia de un trastorno de conducción (bloqueo AV o de rama), debe orientar a infección miocárdica (miocarditis focal o un absceso en el tejido de excito-conducción o perivalvulares). Un p-r prolongado, puede implicar un reemplazo valvular y un peor pronóstico. Infartos silentes por embolización de vegetaciones a arterias coronarias, pueden ser identificados en este examen. f) La radiografía de tórax evidencia la presencia de ICC y/o de émbolos sépticos pulmonares en endocarditis derecha, pudiendo formarse abscesos pulmonares. COMPLICACIONES La ICC y los eventos neurológicos tienen un importante papel en el pronóstico de la EI, al igual que la complicación infecciosa séptica. a) Insuficiencia cardíaca: la causa habitual de ICC es el daño estructural valvular (roturas de cuerdas, músculos papilares, velos, perforación de éstos, aneurismas, estenosis funcionales por la vegetación). Ocasionalmente émbolos coronarios (vegetaciones y sus fragmentos) pueden producir infarto miocárdico, complejos inmunes con daño miocárdico tóxico directo, o la presencia de abscesos, que explicarían las alteraciones en la contractilidad, independientemente del daño valvular o de aumentos secundarios en la pre y post carga ventricular. La infección valvular aórtica se asocia con mayor frecuencia a ICC. La extensión de la infección más allá de la región anular, conlleva mayor mortalidad y cirugía (abscesos perivalvulares), compromiso del septum, bloqueos AV y de rama, como ya se dijo más arriba. La rotura de un aneurisma del seno de Valsalsa, puede producir pericarditis, hemopericardio, taponamiento cardíaco o fístulas al ventrículo derecho izquierdo. El bloqueo AV simple puede observarse hasta en 45% en algunas series. Bloqueo completo 20%; de segundo grado en 15% y bloqueo de rama aislado 15%. La ICC puede desarrollarse con compromiso de la válvula aórtica o de la válvula mitral. Cuando una válvula previamente normal se infecta y desarrolla insuficiencia, hay menor tiempo para su compensación hemodinámica. Aquellos que desarrollan ICC de la EI aórtica, tienen mayor mortalidad que los afectados por EI sólo valvular mitral. Esta complicación debe ser tratada con oxigenoterapia, diuréticos, inótropos y vasodilatadores; pacientes con ICC leve a moderada, pueden ser tratados sólo con tratamiento médico antibiótico, dejando la cirugía para luego de finalizado éste. Si hay descompensación hemodinámica, debe intervenirse de inmediato, aun cuando esté en clase IV de la HYHA y con un cuadro infeccioso activo. El empleo de la cardiocirugía ha disminuido la mortalidad por ICC en EI de casi 100% a cifras promedio de 18,5% con un tratamiento antibiótico y quirúrgico asociado. En nuestra experiencia (Estudio Nacional Prospectivo en EI), la ICC se registró en el 58,9% de los casos, cifra acorde con la experiencia internacional. 24 b) Embolismo: se encuentra presente en el 12-40% de los casos de EIA y 40-60% en la EISA. Afecta, en orden decreciente, con mayor frecuencia el sistema nervioso, pulmón, arterias coronarias, bazo, extremidades, abdomen y ojos. En nuestra serie citada el embolismo se registró en 28,9% de los casos (en SNC 46,5%; bazo 10,5%; extremidades 9,3%; pulmón 9,3%; poliembolismo 8,1%; piel 4,6%; oculares 1,2% y renal 1,2%). Los abscesos esplénicos pueden producir fiebre prolongada, irritación diafragmática con dolor pleurítico o de hombro izquierdo. Dolor abdominal y la esplenomegalia pueden faltar. El scanner abdominal y la resonancia nuclear magnética son los mejores exámenes de exploración y pueden mostrar lesiones con una sensibilidad y especificidad de 90% y 95%, respectivamente. c) Complicaciones neurológicas: el compromiso del sistema nervioso (SN) en la EI es frecuente. Anormalidades clínicas se detectan hasta en 50% de los casos, siendo la primera manifestación de la enfermedad hasta en el 15% de ellos. Se expresa clínicamente a través de diferentes síndromes: cuadros tóxicos, confusionales, síndromes neurosiquiátricos, accidentes vasculares encefálicos, meningoencefalitis, compromiso de pares craneanos y/o de nervios periféricos. Los infartos suelen deberse, a menudo, a embolismo de las arterias cerebrales. La hemorragia es una complicación o del accidente embólico o de aneurismas micóticos. d) Aneurismas micóticos: se presentan en 3%-15% de los pacientes con EI, con severas consecuencias por expansión o rotura del vaso, especialmente a nivel cerebral, los lugares más afectados son aorta proximal incluyendo senos de Valsalva (25%), arterias viscerales (24%), cerebrales (15%), algunos de éstos múltiples. La génesis del aneurisma micótico está en la microembolización séptica de los vasa vasorum o por un gran émbolo en el lumen. La posibilidad de ruptura de un aneurisma micótico estéril, se desconoce; por esta razón, el descubrir su presencia en un órgano finalizado el tratamiento, no significa necesariamente la cirugía. Sin embargo, se debe tener presente que estos aneurismas pueden crecer por el efecto expansivo físico de la presión arterial, en ausencia ya de infección activa. e) Estado febril prolongado: la fiebre en la EI se resuelve a menudo en 48-72 horas luego de comenzar un tratamiento antibiótico apropiado. La defervescencia ocurre en el 90% de los casos al final de la segunda semana de tratamiento. La causa más común de fiebre persistente luego del 14º día, es la extensión de la infección más allá de la válvula (abscesos perivalvulares, miocárdicos, infección metastásica focal, tromboembolismo pulmonar, hipersensibilidad a drogas o por infección nosocomial). f) Insuficiencia renal: La encontramos en el 31,6% de los casos en nuestra serie el embolismo renal y el infarto consecutivo es la lesión más común en la EI, pudiendo expresarse por dolor en el flanco o en abdomen, pero es asintomático en 50% de los casos. Puede existir daño tubular, glomerular (séptico, complejos inmunes) o intersticial (antibióticos). En relación a factores pronósticos de mortalidad, derivados de esta enfermedad infecciosa y sus múltiples complicaciones intra o extracardíacas, algunos autores basados en sus propias experiencias, 25 han individualizado factores predictores de mortalidad. Chu et al, identifican como factores independientes de muerte en portadores de EI durante su hospitalización, al estafilococo aureus como agente causal, el score APACHE II y eventos embólicos. Los hallazgos ecocardiográficos tempranos de acuerdo con los criterios de Duke, no tuvieron estadísticamente valor predictivo de mortalidad. Respecto a factores pronósticos de “embolización mayor”, en pacientes hospitalizados con EI, Mangoni et al, en un estudio prospectivo que incluyó 94 pacientes, determinaron que pacientes jóvenes, con vegetaciones grandes en ecocardiografía y niveles elevados de proteína C reactiva, eran variables independientes asociadas a una mayor incidencia de eventos embólicos, en el análisis de regresión logística multivariado. En el estudio cooperativo nacional de Endocarditis Infecciosa, al analizar en los 321 pacientes estudiados los factores pronósticos de mortalidad, el estudio multivariado de ellos fue significativo para 4 variables (complicaciones intra y extracardíacas): a) presencia de insuficiencia renal; b) sepsis; c) Compromiso mitroaórtico asociado a cirugía de ambas válvulas; y d) fracaso del tratamiento antibiótico (sin cirugía asociada). DIAGNÓSTICO DIFERENCIAL Considerar la multiplicidad de manifestaciones clínicas de la EI, su inespecificidad y variabilidad evolutiva, el diagnóstico diferencial es amplio y, a veces, difícil. a) En la EI aguda, es difícil diferenciarla de otros cuadros agudos sépticos a gérmenes invasivos patógenos como estafilococo aureus, neisseria, pneumococo y bacilos gram negativos. Clínicamente pueden incluir neumonía, pleuresía, meningitis, abscesos cerebrales, AVE, malaria, pericarditis aguda, vasculitis y coagulación intravascular diseminada. b) En la EI subaguda, puede adoptar la forma de fiebre de origen desconocido; debe descartarse fiebre reumática, osteomielitis, TBC, meningitis, infecciones intraabdominales, salmonellosis, brucelosis, glomerulonefritis, infarto miocárdico, AVE, trombo endocavitario, mixomas, conectivopatías, vasculitis, neoplasias ocultas (linfomas), ICC, pericarditis, cuadros neuropsiquiátricos. TRATAMIENTO Para lograr un tratamiento efectivo en EI, dos son los objetivos principales que deben alcanzarse: 1. El agente infeccioso (etiológico) debe ser erradicado de la vegetación. El fracaso en este intento resultará en una recaída. Así mismo las complicaciones intracardíacas resultantes del proceso invasivo y destructivo por los microorganismos, así como el daño focal extracardíaco (embolismo pulmonar y/o sistémico) de la infección, deben ser solucionados para evitar mayor morbimortalidad. 2. El segundo objetivo corresponde a la necesidad de intervenir quirúrgicamente el corazón, vasos y otros órganos comprometidos como se verá más adelante: 26 a) Terapia antimicrobiana Para conseguir el primer objetivo de erradicación del germen, una vez establecido el diagnóstico a través de métodos clínicos, microbiológicos y ecocardiográficos, se deben administrar antibióticos en dosis que alcancen concentraciones séricas, bactericidas, sostenidas durante todo o gran parte del intervalo entre las dosis. Es necesario un curso prolongado de terapia para erradicar los gérmenes que crecen en las vegetaciones valvulares. Deben elegirse antibióticos, bactericidas en lugar de bacteriostáticos, para disminuir la posibilidad del fracaso del tratamiento y de recidiva. En la mayoría de los casos se prefieren los antibióticos por vías paraenteral, para obtener actividad antibacteriana permanente. Las combinaciones antibióticas favorecen un efecto bactericida más rápida, en combinaciones sinérgicas como penicilinas y un aminoglucósido efectivo como en las infecciones por s. vividans y enterococos. Aquellos pacientes que han respondido exitosamente a la terapia inicial y están afebriles, sin complicaciones significativas intra o extracardíacas, que pongan en peligro su vida, con un entorno familiar y hogareño adecuados, pueden luego de la segunda semana de tratamiento, continuar en su casa el resto del tratamiento médico. Deben estar hemodinámicamente estable, cumplir una monitorización regular, cuidadosa y contar con controles médicos y de enfermería permanentes frente a cualquier complicación. En nuestro Hospital San Borja-Arriarán aplicamos los esquemas de tratamiento que han elaborado en el grupo Infectológico Local (tabla 11, 12 y 13). Recomendaciones terapéuticas de endocarditis infecciosa. Hospital San Borja Arriarán 2009 AGENTE ANTIBIOTICO Streptococcus grupo viridans, anginosus, bovis y otros Streptococcus spp Sensible o con sensibilidad intermedia a penicilina (PNC) PNC sódica 5 millones cada 6 h ev por 4 semanas + Gentamicina 1 mg/kg cada 8 horas por 2 semanas. (puede ser también en dosis única diaria y es optativo, no usar en >60 años y/o en disfunción renal) En endocarditis se puede usar hasta 24 millones de UI diarias (PNC). Alternativa Ceftriaxona 2 g/día por 4 semanas ó Vancomicina 15 mg/kg c/12 hrs por 4 semanas (alergia grave y confirmada a PNC) En válvula protésica PNC sódica 5 millones c/6 horas ev por 6 –8 semanas + Gentamicina 1mg/kg c/ 8 horas ev por al menos 2 semanas Enterococcus spp PNC 5 millones c/6 horas ev por 6 semanas ó Ampicilina 3 g c/6 horas por 6 semanas + Gentamicina 1mg/kg c/8 horas minimo 2 semanas. Luego reevaluar su continuación si hay oto/nefrotoxicidad. Alternativa para Enterococcus (en caso de resistencia a ampicilina) Vancomicina 15 mg/kg c/12 horas o Imipenem 1 g c/6 horas ev o Linezolid 600 mg c/12 horas por 6 semanas + Gentamicina 1 mg/kg c/8 horas por 4-6 semanas (la mayor duración posible en ausencia de oto o nefrotoxicidad). Grupo HACEK Ampicilina 3 g c/ 6 horas ev por 4 semanas + Gentamicina 1 mg/kg c/8 horas ev por 2 semanas Alternativa Ceftriaxona 2 gr/día ev por 4 semanas o Ampicilina+ Sulbactam 2 (ampicilina) gr c/6 hrs. 27 Recomendaciones terapéuticas de endocarditis infecciosa. Hospital San Borja Arriarán 2009 AGENTE ANTIBIOTICO S.aureus sensible (SAMS) y resistente (SAMR) a cloxacilina SAMS Cloxacilina 12 g/día ev (3 gr c/6 horas) o Cefazolina 2 grs c/ 8 hrs por 4-6 semanas + Rifampicina 600 mg/día (opcional, no rutinario) por 4-6 semanas o Gentamicina 1 mg/kg c/8 horas ev (opcional por 3-5 días) SAMR Vancomicina 15 mg/kg c/12 horas ev por 4-6 semanas +Rifampicina 600 mg/día (opcional) po 4-6 semanas SAMS Vancomicina 15 mg/kg c/12 horas ev por 4-6 semanas + Rifampicina (opcional, no rutinario)600 mg/día por 4-6 semanas o Gentamicina 1 mg/kg cada 8 horas ev por 2 semanas Si alergia no severa ni inmediata a penicilina: cefazolina 6 g/d más opcional rifampìcina por duración total o gentamician por 3-5 días SAMS Cloxacilina 12 g/día ev (3 gr c/6 horas) por 6 semanas + Rifampicina 600-900 mg/día por 6 semanas más gentamicina por 2 semanas. SAMR Vancomicina 15 mg/kg cada 12 horas ev o Linezolid 600 mg cada 12 hrs ev por 6 semanas o más + Rifampicina 600-900 mg/día por 6 semanas o más + Gentamicina 1 mg/kg cada 8 horas ev por 2 semanas Válvula nativa Alternativa en alergia a betalactámicos Válvula protésica Bacilos gram negativos Cefalosporinas 3 gen ó Ciprofloxacino (dosis máximas) ev + Aminoglicósido por 4-6 semanas (máxima duración posible en ausencia de toxicidad). Pueden combinarse betalactámicos con quinolonas o otros antimicrobianos si hay susceptibilidad del agente y evitarse aminoglucósidos). 28 Recomendaciones terapéuticas de endocarditis infecciosa. Hospital San Borja Arriarán 2009 AGENTE ANTIBIOTICO Endocarditis germen desconocido (Hemocultivos negativos) válvula nativa Curso sub agudo Ampicilina 3 g c/6 horas ev ó PNC 5 millones cada 6 horas ev por 6 semanas + Gentamicina 1 mg/kg c/8 horas ev, máximo por 2 semanas Curso Agudo PNC 5 millones c/6 horas ev + Cloxacilina 12 gr/día ev (3 gr cada 6 hrs) por 4-6 semanas + Gentamicina 1 mg/kg c/8 horas ev, máximo 2 semanas Se puede reemplazar cloxacilina por cefazolina 6 g/d Endocarditis germen desconocido (Hemocultivos negativos) válvula protésica Precoz (< 1año) Vancomicina 15mg/kg c/12 horas por 6 semanas + Cefepime 2 gr c/ 12 horas (sulperazona 3 gr c/12 horas ev) por 6 semanas + Gentamicina 1mg/kg c/8 hrs ev máximo 2 semanas + Rifampicina 600 mg al día por 2 semanas si no hay contraindicación. Este regimen, sin cefepime es el recomendado para infección por Staphylococcus coagulasa negativo Tardío (> 1 año) Similar a válvula nativa. Uso de vancomicina será analizado por especialista según paciente individual por la persistente predisposición a infección por S coagulasa negativo La AHA actualizó las normas de tratamiento específico basado en el agente etiológico, microbiológico específico, lo que puede revisarse en la bibliografía anexa. b) Tratamiento quirúrgico El rol de la cardiocirugía ha ido en aumento en las últimas décadas en el manejo de la EI, con un aumento de casos de intervención en la fase activa de la enfermedad. Básicamente se indica en aquellos sujetos que no responden al tratamiento antibiótico y/o a las complicaciones intracardíacas derivadas de la EI (roturas de cuerdas, perforaciones de velos, fístulas intracardíacas, pericarditis purulentas, abscesos perivalvulares y aneurismas micóticos). La combinación del manejo médico antibiótico y la cirugía han demostrado disminuir la mortalidad. En la tabla 14 se anotan las indicaciones de cirugía cardíacas propuestas por la AHA. El tratamiento antibiótico en endocarditis valvular nativa, debe mantenerse hasta completar 4 a 6 semanas, según el tipo de germen, si la cirugía se lleva a cabo durante éste. Idealmente, con 2 semanas de tratamiento antibiótico coincidiendo con el período post operatorio. Si la cirugía es por EIVP, se debe realizar tratamiento antibiótico completo por 4 a 6 semanas en el post operatorio, según el agente causal y el estudio de sensibilidad si se aisló el germen. En la EI del corazón derecho, mayormente en narcoadictos intravenosos, la persistencia de la infección es su gran indicación. La valvulectomía tricuspidea o la vegetectomía con valvuloplastia, son ahora los procedimientos de elección para la EI derecha refractaria. El tratamiento antibiótico combinado se debe mantener 4 a 6 29 semanas en el post operatorio. Si la insuficiencia cardíaca derecha es progresiva, se recomienda luego la sustitución tricuspidea. Las indicaciones de cirugía cardíaca de acuerdo a los criterios propuestos por la AHA, se detallan en la tabla 14. Tabla 14 Cirugía Cardíaca en pacientes con Endocarditis Infecciosa Cirugía Cardíaca en pacientes con Endocarditis Infecciosa Indicaciones: Absolutas Falla cardíaca congestiva moderada a severa causada por disfunción valvular • • • Prótesis inestable, o con orifício protésico obstruído. • Infección no controlada a pesar de tratamiento antimicrobiano óptimo. • Ausencia de terapia antimicrobiana efectiva: endocarditis causada por hongos, Brucellae, Pseudomona aeruginosa (válvulas aórtica o mitral). • Endocarditis en válvula protésica por Staphilococcus aureus con complicación intracardíaca. • Recaída de endocarditis en válvula protésica a pesar de tratamiento antimicrobiano óptimo. Fístula al saco pericárdico. Relativas • Extensión perivalvular de la infección, fístula intracardíaca, absceso miocárdico con fiebre persistente. • Endocarditis en válvula nativa a S. aureus con respuesta pobre a tratamiento. • Recaída de endocarditis en válvula nativa a pesar de tratamiento antimicrobiano óptimo. • Endocarditis con cultivo negativo (válvula nativa o protésica) con fiebre persistente (> a 10 días) • Vegetaciones hipermóviles grandes (> 10 mm de diámetro) • Endocarditis causada por enterococo con alta resistencia a antibióticos Cirugía y complicaciones neurológicas: Frente a un AVE (accidente vascular encefálico) en EI, si existen síntomas neurológicos debe efectuarse TAC con contraste o RNM del cerebro, para identificar la lesión y/o presencia de hemorragia. En ausencia de infarto hemorrágico, el reemplazo valvular (cardíaco) se puede realizar al menos 72 horas después de ocurrido un ictus. Si el paciente está 30 estable, se puede planificar la operación cardíaca para 2 semanas después. Aquellos que tienen hemorragia, se deben operar de 2 a 4 semanas luego del evento neurológico. c) Tratamiento de complicaciones extracardíacas: Absceso esplénico: Se puede encontrar en el 3 a 5% de los casos de EI., se puede diagnosticar por ecografía o por tomografía computada (TC), pero no puede diferenciarse adecuadamente del infarto embólico. Si la fiebre persiste, se puede efectuar punción del órgano. El tratamiento puede ser por drenaje percutáneo o esplenectomía, idealmente, previo a la cardiocirugía. Aneurismas micoticos y arteritis séptica: Entre el 2 al 10% de los pacientes desarrollan aneurismas micoticos; en la mitad de ellos se comprometen vasos cerebrales, sea por embolo séptico que ocluye el vaso (s. aureus) o por llegadas de gérmenes a través de los vassa vasorum (s. viridans). Con la ruptura, se produce hemorragia cerebral; pueden existir déficits focales (motores y sensitivos) por eventos embólicos, cefalea persistente, deterioro neurológico general y eritrocitos con líquido espinal xantocromico son premonitorios. La angiografía cerebral permite evaluar el aneurisma pequeño a lo hemorragia. RNM o TC angiográficas, tienen un 95% de sensibilidad para aneurismas mayores de 5 ml. en casos de síntomas y signos premonitorios, previos a la realización de la anticoagulación y/o cardiocirugía. La hemorragia y ruptura pueden ocurrir en cualquier momento durante el inicio de la terapia antibiótica y su mortalidad puede llegar al 80% de los casos. El aneurisma micotico no complicado puede seguirse durante el tratamiento y la mitad de ellos se resolverá. Los aneurismas rotos o los que crecen, pueden ser intervenidos neuroquirúrgicamente; en aquellos que persisten luego de terapia antibiótica por EI, pueden si son únicos resecarse. Aneurismas extracraneanos micóticos, se manejan igual, con tratamiento antibiótico y con resección si producen hemorragia, o si se expanden o si persisten luego del término del tratamiento. De especial cuidado son aquellos ubicados en vísceras abdominales, cuyo sangramiento puede ser mortal. d) Tratamiento anticoagulante: Los pacientes con prótesis valvulares y que están con TAC oral y que desarrollan EDP, deben mantener su terapia anticoagulante con warfarina, acenocumarol o con e) heparina. En aquellos EVN, si tienen una clara indicación de TAC oral, pueden continuar su tratamiento si no hay evidencias de un riesgo mayor de hemorragia cerebral. Si se manifiesta el compromiso neurológico, el TAC oral debe suspenderse de inmediato. La aspirina puede aumentar también el riesgo de sangrado. f) Infección de dispositivos intracardíacos (marcapasos, cardiodesfibriladores): Una vez diagnosticada la infección, el tratamiento más ampliamente aceptado consiste en una estrategia mixta, conformada por antibioterapia según cultivos y remoción de todo el sistema, dispositivo y electrodo (s), aun cuando no se haya demostrado infección de estos últimos. La extracción del sistema, la mayor parte de las veces mediante cirugía, conlleva sus propios riesgos, algunos potencialmente fatales. Solo la implementación y cumplimiento de rigurosas normas de prevención podrá limitar la incidencia de esta temida complicación asociada a uso de marcapasos definitivos y 31 defibriladores internos. Tanto en el caso de infección solo del bolsillo como en el caso de EI documentada, el reimplante debe efectuarse en el lado contralateral al implante original, los pacientes con dependencia de MP deben ser manejados durante el tiempo de espera del reimplante con marcapasos transitorios transvenosos, el cual debe ser cambiado electivamente cada 5 a 7 días. El reimplante debe efectuarse no antes de 4 semanas de tratamiento antibiótico. Recaidas y recurrencias: Las recaídas en EI ocurren durante los 2 primeros meses de terminado el tratamiento antibiótico, en 2 a 4% de los casos de EVN. Para EVP en 6 a 15% de los tratados quirúrgicamente. Las recurrencias en pacientes que han tenido EVN o EVP, se presentan en 4,5% a 7% de los casos, comportándose como en los episodios anteriores. La EI en narcoadictos intravenosos, es la causa más frecuente de recurrencias. PROFILAXIS La Asociación Americana del Corazón (AHA) ha hecho el año 2007, nuevas recomendaciones para la profilaxis de esta afección, simplificadas u polémicas. El comité de la AHA luego de analizar: Los procedimientos y gérmenes que comúnmente están involucrados en la EI, los resultados de profilaxis en modelos animales, estudios poblaciones en EI y la prevalencia de valvulopatías con riesgo de EI, los análisis de estudios prospectivos y retrospectivos de profilaxis en EI, y las formas de mayor morbilidad en EI, concluyen recomendando el uso profiláctico de antibióticos en procedimientos dentales, en aquellos pacientes con cardiopatías o antecedentes de EI. Estas se resumen a continuación en tablas confeccionadas, considerando la falta de evidencia que existe en esta materia y como un consenso entre expertos de grupos interdisciplinarios (AHA – 2007/2008, tablas 15, 16 y 17). Tabla 15 Profilaxis de endocarditis para procedimientos dentales Razonable La profilaxis de EI es razonable para los pacientes con el más alto riesgo de resultados adversos que son sometidos a procedimientos dentales que involucran manipulación del tejido gingival, o la región peri apical del diente, o la perforación de la mucosa oral. No recomendado • Inyecciones anestésicas de rutina a través de tejido no infectado • Radiografías dentales • Implante o remoción de ortodoncia • Ajuste de ortodoncia • Extracción de un diente de la primera dentición (de leche) • Sangramiento por trauma de los labios o mucosa oral. 32 Tabla 16 Condiciones cardíacas asociadas al más alto riesgo de Endocarditis para los cuales la profilaxis en procedimientos dentales es razonable 123• • • • 4- Válvula protésica o material protésico usado para reparación valvular EI previa Cardiopatías congénitas: Cardiopatía cianótica no reparada Defecto congénito completamente reparado con material protésico, o dispositivospercutáneos, durante los 6 meses posteriores al procedimiento. Defecto congénito reparado: Con alteraciones residuales en, o adyacentes al sitio de reparación, con parche protésico o dispositivo protésico (que inhiba endotelización). Pacientes trasplantados cardíacos que desarrollan valvulopatías Tabla 17 Regímenes para un procedimiento dental Régimen: dosis única 60 minutos antes del procedimiento Adultos niños 2g 50 mg/kg Situación Agente oral Amoxicilina Imposibilidad de usar vía oral Ampicilina o Cefazolina o ceftriaxona 2 g IM o IV 50 mg/kg IM o IV 1 g IM o IV 50 mg/kg IM o IV Alérgico a Penicilina, oral Cefalexina o Clindamicina o Azitromicina o Claritromicina 2g 50 mg/kg 600 mg 20 mg/kg 500 mg 15 mg/kg IM o IV 50 mg/kg IM o IV 600 mg IM o IV 20 mg/kg IM o IV Alérgico a Penicilina, Imposibilidad de usar vía oral Cefazolina o ceftriaxona o Clindamicina Los antibióticos utilizados para evitar la recurrencia de la enfermedad reumática, son inadecuados para la prevención de EI, incluso para aquellos pacientes que están recibiendo penicilina y que en la cavidad oral puedan tener estreptococo viridans, ya que eventualmente pudieran haber desarrollado resistencia a penicilina/ampicilina y amoxicilina, por lo que se recomiendan esquemas alternativos, especialmente a base de macrólidos. 33 INDICACIONES DE DERIVACIÓN En pacientes con complicaciones intra o extracardíacas de la enfermedad, que se encuentren en lugares apartados o alejados de centros médicos terciarios o que no cuenten con equipos multidisciplinarios que incluyan cardiocirugía, se recomiendan los criterios de derivación enumerados en la tabla 18. Tabla 18 Indicaciones de derivación en Endocarditis Infecciosa Criterios de Derivación 1. 2. 3. 4. 5. 6. Insuficiencia cardíaca secundaria a insuficiencia valvular aguda no controlada rápidamente Insuficiencia cardíaca secundaria a disfunción de prótesis Sepsis persistente (> 7-10) a pesar de terapia antibiótica adecuada Documentación de absceso perivalvular o periprótesis o fístula intracardíaca Endocarditis por gérmenes difíciles: hongos, gram negativos, estafilococo aureus (especialmente en prótesis) siempre que no haya respuesta rápida al tratamiento antibiótico. Embolismo a repetición con persistencia de imagen de vegetaciones grandes y móviles al ecocardiograma (*) (*) (AVE luego de 10 días de ocurrido) BIBLIOGRAFIA 1. Mylonakis E., Calderwood SB.: Infective Endocarditis in the adults. N. Engl. J. Med. 2001; 345: 1318 – 30 2. Li J., Corey R., Fowler V.: Endocarditis Infecciosa. En Topol T. J. Tratado de Medicina Cardiovascular. 3° Ed. Walter Kluwer Health España S.A. Lippincott, William & Wilkins 2008., 396 – 412. 3. Karchmer A.: Infective Endocarditis. En Braunwald´s Heart Disease 8th Ed. Saunders, Elsevier. Inc. Philadelphia, USA. 4. Jacob S., Tong T.: Role of echocardiography in the diagnosis and management of imfective endocarditis. Curr. Opin. Cardiol. 2002; 17: 478 - 85. 5- Murdoch D., Corey R., Hoen B., et al: Clinical presentation, etiology and outcome of infective endocarditis in the 21st century. The International Colaboration on Endocarditis – Prospective Cohort Study. (ICE - PCS) 2009; 169 (5) 463 – 473. 34 6- Benito N., Miró J. M. De Lazarri R. et al: Health care – asóciate native valve endocarditis: Importance of non – nosocomial acquisition (ICE – PCS). Ann. Intern. Med. 2009; 150: 586 – 594. 7- Oyonarte M., Montagna R., Braun S., et al: Endocarditis Infecciosa: Morbimortalidad en Chile. Resultados del Estudio Cooperativo Nacional de Endocarditis Infecciosa (ECNEI: 1998 – 2002). Rev. Med. Chile 2003; 131: 237 – 50 8- Prendergast B. D.: The Changing face of infective endocarditis. Heart 2006; 92: 879-885 9- Baddour LM., Wilson WR., Bayer AR., et al.: Infective endocarditis, diagnosis, antimicrobial therapy and management of complications.A statement for health care professionals from the Committee on rheumatic fever, endocarditis and Kawasaki : Council on cardiovascular disease in the young, and the council on clinical cardiology, stroke and cardiovascular surgery and anesthesia; American Heart Association-executive summary. . Circulation 2005; 111: 3167 – 3184. 10- Wilson W., Taubert KA., Gewitz M. et al. Prevention of infective endocarditis: Guidelines from the American Heart Association: Rheumatic Fever, Endocarditis, Kawasaki Disease Committee Council in Cardiovascular Disease in the young and the Council on Clinical Cardiology, Council on Cardiovascular Surgery and Anesthesia an the quality of Care and Outcomes Research Interdisciplinary Working Group. Circulation 2007; 116: 1736 – 54. 11- Nishimura RA., Carabello BA., Faxon DP.: ACC/AHA 2008 Guidelines Update on Valvular Heart Disease. Focused Update on Infective Endocarditis: A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines: Endorsed by the Society of Cardiovascular Anesthesiologists, Society of Cardiovascular Angiography and Intervention and Society of Thoracic Surgeons. Circulation 2008, 118: 887 – 896. 35