Información del Documento Original
Anuncio

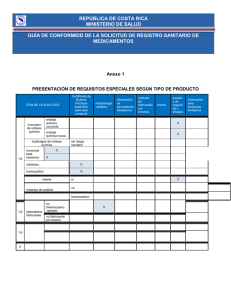
Or igin al República de Colombia Ministerio de Salud y Protección Social Instituto Nacional de Vigilancia de Medicamentos y Alimentos – INVIMA RESOLUCIÓN No. 2015049177 DE 4 de Diciembre de 2015 Por la cual se concede un Registro Sanitario La Directora de Medicamentos y Productos Biológicos del Instituto Nacional de Vigilancia de Medicamentos y Alimentos - INVIMA, en ejercicio de las facultades Legales Conferidas en el Decreto 2078 de 2012, Resolución 2012030820 del 19 de octubre de 2012, Decreto Reglamentario 677 de 1995 y Ley 1437 de 2011. oc um en to ANTECEDENTES Que mediante escrito No. 2014077623 del 27/06/2014, el señor Jhon Jairo Insuasti, actuando en calidad de apoderado de Bluepharma Industria Farmacéutica S.A con domicilio en PORTUGAL, solicitó Registro Sanitario para el producto IRBESARTAN 150 mg, en la modalidad IMPORTAR Y VENDER a favor de Bluepharma Industria Farmacéutica S.A con domicilio en PORTUGAL. Que mediante Auto No. 2015009487 del 01/09/2015, la Dirección de Medicamentos y Productos Biológicos le requirió: Formula cualicuantitatva, materias primas, información farmacológica, validaciones, estudios de estabilidad, inserto, artes de envase y empaque. Que mediante escrito No. 2015128069 del 28/09/2015, el señor Jhon Jairo Insuasti, actuando en calidad de apoderado de Bluepharma Industria Farmacéutica S.A, allegó respuesta al Auto de requerimiento. Que mediante radicado numero 2015099179 del 31/07/2015, el señor Jhon Jairo Insuasti, actuando en calidad de apoderado de Bluepharma Industria Farmacéutica S.A presento alcance al expediente a fin de allegar inserto con los ajustes solicitados al concepto emitido por la Sala Especializada de medicamentos y productos biológicos, en Acta 11 de 2015 numeral 3.13.43. lD CONSIDERACIONES DEL DESPACHO Frente a los documentos técnicos / legales allegados por el interesado con radicado No. 2014077623 del 27/06/2014, respuesta Auto No. 2015128069 del 28/09/2015 y alcance No. 2015099179 del 31/07/2015; este Despacho se permite hacer las siguientes consideraciones: de Que los artes de envase y empaque allegados mediante radicado No. 2014077623 del 27/06/2014, cumplen con los requisitos establecidos en el Artículo 72 y 74 del Decreto 677 de 1995. Sin embargo en las cajas plegadizas debe incluir la contraindicación: “Uso concomitante con aliskiren en pacientes con diabetes tipo II” . ac ión Que la información farmacológica del inserto se ajusta al producto innovador (expediente 226034) y al Acta de comisión Revisora No. 06 de 2013 numeral 3.13.18, por la cual la Sala Especializada de medicamentos y productos biológicos recomendó incluir en contraindicaciones: “Uso concomitante con aliskiren en pacientes con diabetes tipo II” . Que el inserto versión 1,1 del 07-2015 allegado en radicado de alcance No. 2015099179 del 31/07/2015, fue recomendado aprobar en Acta 24 de 2015 numeral 3.13.9, por la Sala Especializada de Medicamentos y Productos Biológicos de la Comisión Revisora, toda vez que se ajusta satisfactoriamente al requerimiento emitido en Acta No. 11 de 2015, numeral 3.13.43. Por lo tanto, este Despacho considera pertinente aprobar el inserto versión 1,1 del 07-2015, en virtud que su contenido farmacológico ha sido previamente evaluado por la Comisión Revisora y la información técnica que allí se establece, se ajusta a lo solicitado en el registro sanitario. Inf orm Que mediante certificado No. F001/S1/H/AF/001/2012, emitido por la Autoridad Nacional de Medicamentos y Productos de la Salud- Infarmed de Portugal, se avala el cumplimiento de Buenas Practicas de Manufactura a BLUEPHARMA INDUSTRIA FARMACÉUTICA S.A., ubicado en S. Martinho do Bispo, Coimbra 3045-016 Portugal, para fabricar no estériles tipo tabletas, vigente hasta el 12/12/2015. Página 1 de 3 Or igin al República de Colombia Ministerio de Salud y Protección Social Instituto Nacional de Vigilancia de Medicamentos y Alimentos – INVIMA RESOLUCIÓN No. 2015049177 DE 4 de Diciembre de 2015 Por la cual se concede un Registro Sanitario La Directora de Medicamentos y Productos Biológicos del Instituto Nacional de Vigilancia de Medicamentos y Alimentos - INVIMA, en ejercicio de las facultades Legales Conferidas en el Decreto 2078 de 2012, Resolución 2012030820 del 19 de octubre de 2012, Decreto Reglamentario 677 de 1995 y Ley 1437 de 2011. oc um en to Que con base en el Decreto 677 de 1995, Decreto 2086 de 2010, la norma farmacológica No. 7 .3.0.0.N10, Acta de comision revisora No. 24 de 2015 numeral 3.13.9 y la documentación allegada por el interesado previo estudio técnico y legal, la Dirección de Medicamentos y Productos Biológicos, RESUELVE Inf orm ac ión de lD ARTÍCULO PRIMERO.- Conceder REGISTRO SANITARIO por el término de CINCO (5) años al PRODUCTO: IRBESARTAN 150 mg REGISTRO SANITARIO No.: INVIMA 2015M-0016654 TIPO DE REGISTRO: Importar y Vender TITULAR(ES): BLUEPHARMA INDUSTRIA FARMACEUTICA S.A. con domicilio en CoimbraPortugal FABRICANTE(S): BLUEPHARMA INDUSTRIA FARMACEUTICA S.A. con domicilio en S. Martinho do Bispo, Coimbra 3045-016 Coimbra- Portugal IMPORTADOR(ES): PHARMABIZ S.A.S con domicilio en Bogotá - D.C. VENTA: Con Formula Facultativa FORMA FARMACEUTICA: Tableta Recubierta VIA ADMINISTRACIÓN: Oral PRINCIPIOS ACTIVOS: Cada TABLETA RECUBIERTA contiene 150mg de IRBESARTAN PRESENT. COMERCIAL: Caja por 28 tabletas recubiertas en 4 blister PVC-PVDC/ Alu de 7 tabletas c/u INDICACIONES: Medicamento alternativo en el tratamiento de la hipertensión arterial. Útil como coadyuvante en la protección renal en pacientes con diabetes tipo II CONTRAINDICACIONES Y ADVERTENCIAS: Contraindicado en pacientes que son hipersensibles al irbesartan o a cualquier componente de su formulación. Menores de 18 años. Embarazo y lactancia. Uso concomitante con aliskiren en pacientes con diabetes tipo 2. NOTA DE FARMACOVIGILANCIA: Los reportes e informes de Farmacovigilancia deben presentarse a la Dirección de Medicamentos y Productos Biológicos, con la periodicidad establecida en la Resolución No. 2004009455 del 28 de Mayo de 2004. OBSERVACIONES: Las contraindicaciones, advertencias, la fecha de vencimiento y número de lote, deben aparecer en las etiquetas y empaques. El titular, envasador y fabricante autorizado en el Registro sanitario adquieren la obligación de mantener las Buenas Prácticas de Manufactura, y actualizar las especificaciones de producto terminado y materias primas de acuerdo a la última versión de las farmacopeas oficiales en Colombia, durante la vigencia del Registro sanitario. Lo anterior será objeto de vigilancia por parte de este instituto. Toda información científica, promocional o publicitaria sobre los medicamentos deberá ser realizada con arreglo a las condiciones del Registro sanitario y las normas técnicas y legales previstas en el artículo 79 del Decreto 677 de 1995. VIDA UTIL: Veinticuatro (24) meses a partir de la fecha de fabricación CONDICIONES DE ALMACENAMIENTO: Almacenar a temperaturas inferiores de 30ºC en su envase y empaque original. EXPEDIENTE No.: 20078987 RADICACIÓN No.: 2014077623 Página 2 de 3 Or igin al República de Colombia Ministerio de Salud y Protección Social Instituto Nacional de Vigilancia de Medicamentos y Alimentos – INVIMA RESOLUCIÓN No. 2015049177 DE 4 de Diciembre de 2015 Por la cual se concede un Registro Sanitario La Directora de Medicamentos y Productos Biológicos del Instituto Nacional de Vigilancia de Medicamentos y Alimentos - INVIMA, en ejercicio de las facultades Legales Conferidas en el Decreto 2078 de 2012, Resolución 2012030820 del 19 de octubre de 2012, Decreto Reglamentario 677 de 1995 y Ley 1437 de 2011. oc um en to ARTÍCULO SEGUNDO.- APROBAR como único diseño para todas las presentaciones comerciales, los artes de material de envase (Blister) y empaque (Caja plegadiza) allegados bajo escrito No. 2014077623 del 27/06/2014, en los cuales debe incluir el número del Registro Sanitario y ajustar sus textos de acuerdo a lo dispuesto en la presente Resolución. ARTÍCULO TERCERO.- APROBAR el inserto versión 1.1 del 07-2015, allegado bajo radicado de alcance No. 2015099179 del 31/07/2015; acorde al concepto emitido por la Sala Especializada de Medicamentos y Productos Biológicos en Acta No. 24 de 2015 numeral 3.13.9. ARTÍCULO CUARTO.- El tiempo de vida útil asignado para el medicamento amparado en la presente Resolución, se soportó con estudios naturales realizados en 3 lotes comerciales por el término de 24 meses sometidos bajo condiciones de 30 ± 2 °C / 75 ± 5%HR, dando cumplimiento al Decreto 677 de 1995, Artículo 22, Parágrafo segundo. ARTÍCULO QUINTO.- Contra la presente Resolución procede únicamente el Recurso de Reposición, que deberá interponerse ante la DIRECTORA DE MEDICAMENTOS Y PRODUCTOS BIOLÓGICOS, del Instituto Nacional de Vigilancia de Medicamentos y Alimentos INVIMA, dentro de los DIEZ (10) días siguientes a su notificación, en los términos señalados en el Código de Procedimiento Administrativo y de lo Contencioso Administrativo. ARTÍCULO SEXTO.- La presente Resolución rige a partir de la fecha de su ejecutoria. lD COMUNÍQUESE, NOTIFÍQUESE Y CÚMPLASE ac ión de Dada en Bogotá, D.C. a los 4 de Diciembre de 2015 Este espacio, hasta la firma se considera en blanco. LUZ HELENA FRANCO CHAPARRO DIRECTORA DE MEDICAMENTOS Y PRODUCTOS BIOLÓGICOS Inf orm Proyectó: Legal: dbelalcazarj, Técnico: jmartinezma Revisó: cordina_medicamentos Página 3 de 3