Información del Documento Original
Anuncio

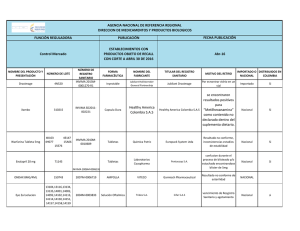
Or igin al República de Colombia Ministerio de Salud y Protección Social Instituto Nacional de Vigilancia de Medicamentos y Alimentos – INVIMA oc um en to RESOLUCIÓN No. 2015050346 DE 14 de Diciembre de 2015 Por la cual se concede un Registro Sanitario La Directora de Medicamentos y Productos Biológicos del Instituto Nacional de Vigilancia de Medicamentos y Alimentos - INVIMA, en ejercicio de las facultades Legales Conferidas en el Decreto 2078 de 2012, Decreto Reglamentario 677 de 1995 y Ley 1437 de 2011. ANTECEDENTES Que mediante escrito No. 2015123637 del 18/09/2015, la señora Edith Mary Renteria Vega, actuando en calidad de Representante Legal de la sociedad PHARMADERM S.A. con domicilio en BOGOTA - D.C., solicita concesión del Registro Sanitario para el producto TERBIDERM ®TABLETAS, en la modalidad de FABRICAR Y VENDER a favor de HARMADERM S.A. con domicilio en BOGOTA - D.C. Que revisada la documentación allegada, este Despacho solicitó mediante auto No. 2015012512, de fecha 20/11/2015, el cumplimiento del siguiente requerimiento: 1. Sírvase allegar inserto corregido, incluyendo en sus textos lo recomendado por la Sala Especializada de Medicamentos Biológicos de la Comisión Revisora en el Acta 31 del 2013 numeral 3.4.12. 2. Sírvase allegar actualizada las especificaciones de producto terminado según farmacopea vigente. 3. Estabilidad. lD Que mediante escrito Radicado No. 2015158658 de fecha 27/11/2015, la señora Edith Mary Renteria Vega, actuando en calidad de Representante Legal de la sociedad PHARMADERM S.A. con domicilio en BOGOTA D.C., presentó respuesta al referido auto. de CONSIDERACIONES DEL DESPACHO Frente a los documentos allegados por el interesado, este Despacho se permite hacer las siguientes consideraciones: ac ión Que mediante escrito No. 2015158658 de fecha 27/11/2015 la señora Edith Mary Renteria Vega, actuando en calidad de Representante Legal de la sociedad PHARMADERM S.A. con domicilio en BOGOTA - D.C., presento respuesta satisfactoria a los requerimientos del auto No. 2015012512, de fecha 20/11/2015. Que en el acta 31 del 2013 numeral 3.4.12. la sala especializada de medicamentos y productos biológicos de la comisión revisora recomendó indicaciones contraindicaciones y advertencias para este tipo de productos. Que Severiano Fernández M & Compañía Limitada con domicilio en Calle 163 No. 18 A – 57 Bogota D.C. cuenta con buenas practicas de manufactura para la fabricación de tabletas a base de principios activos comunes, según la resolución 2015021000 otorgada por el INVIMA el 01/06/2015 y que estará vigente hasta 17/07/2018. Que el inserto solo contiene la información farmacológica recomendada por Comisión Revisora en el acta 31 del 2013 numeral 3.4.12. por tanto puede ser autorizado en la presente resolución. orm Que los artes de material de empaque y envase allegados bajo radicado No. 2015123637 del 18/09/2015 cumplen con todo lo contemplado en los artículos 72 y 76 del Decreto 677 de 1995 Inf Que con base en el Decreto 677 de 1995, Decreto 2086 de 2010, la norma farmacológica No. 4.1.2.0.N10, acta de Comisión Revisora No. 31 del 2013 numeral 3.4.12. y la documentación allegada por el interesado previo estudio técnico y legal, la Dirección de Medicamentos y Productos Biológicos. Página 1 de 4 Or igin al República de Colombia Ministerio de Salud y Protección Social Instituto Nacional de Vigilancia de Medicamentos y Alimentos – INVIMA oc um en to RESOLUCIÓN No. 2015050346 DE 14 de Diciembre de 2015 Por la cual se concede un Registro Sanitario La Directora de Medicamentos y Productos Biológicos del Instituto Nacional de Vigilancia de Medicamentos y Alimentos - INVIMA, en ejercicio de las facultades Legales Conferidas en el Decreto 2078 de 2012, Decreto Reglamentario 677 de 1995 y Ley 1437 de 2011. RESUELVE Inf orm ac ión de lD ARTICULO PRIMERO.- Conceder REGISTRO SANITARIO por el término de CINCO (5) años al PRODUCTO: TERBIDERM ®TABLETAS REGISTRO SANITARIO No.: INVIMA 2015M-0016685 TIPO DE REGISTRO: FABRICAR Y VENDER. TITULAR: PHARMADERM S.A. con domicilio en BOGOTA - D.C. FABRICANTE: SEVERIANO FERNANDEZ M & CIA. LIMITADA con domicilio en Calle 163 No. 18 A – 57 Bogota D.C. VENTA: Con Formula Facultativa FORMA FARMACEUTICA: Tableta VIA ADMINISTRACIÓN: Oral PRINCIPIOS ACTIVOS: Cada TABLETAS contiene TERBINAFINA CLORHIDRATO EQUIVALENTE A TERBINAFINA BASE 250,0 mg. PRESENTACIÓN COMERCIAL: Caja Plegadiza cartulina y blister PVC / ALUMINIO por 8, 10, 14, 15, 20, 21, 28 y 30 Tabletas. MUESTRA MEDICA Caja Plegadiza cartulina y blister PVC / ALUMINIO por 14 Tabletas. INDICACIONES: Antimicótico de uso oral. NOTA DE FARMACOVIGILANCIA: Los reportes e informes de farmacovigilancia deben presentarse a la Dirección de Medicamentos y Productos Biológicos con la periodicidad establecida en la resolución No. 2004009455 del 28 de mayo de 2004. CONTRAINDICACIONES Y ADVERTENCIAS: Hipersensibilidad conocida a la terbinafina o a cualquiera de los excipientes de los comprimidos. Advertencias: Función hepática no se recomienda la administración de comprimidos a pacientes con hepatopatías crónicas o activas. Antes de prescribir los comprimidos deben efectuarse pruebas de la función hepática. Debido al riesgo de hepatotoxicidad en pacientes con o sin hepatopatías preexistentes, se recomienda un control periódico de la función hepática (después de 4 a 6 semanas de tratamiento). Ante cualquier elevación de los parámetros hepáticos, se suspenderá inmediatamente la administración del producto. En pacientes que tomaban comprimidos se han notificado casos muy inusuales de insuficiencia hepática grave (algunos mortales o que necesitaron un trasplante). La mayoría de los pacientes con insuficiencia hepática padecían afecciones sistémicas subyacentes graves y no pudo establecerse con certeza una relación causal con la ingestión de los comprimidos. Cuando se prescriban los comprimidos se pedirá al paciente que comunique de inmediato cualquier síntoma de náuseas, disminución del apetito, cansancio, vómitos, dolor en el hipocondrio derecho, ictericia, orina oscura o heces claras, de origen desconocido o persistentes. Los pacientes con estas manifestaciones deben abandonar el tratamiento con terbinafina oral y someterse de inmediato a pruebas de la función hepática. Página 2 de 4 Or igin al República de Colombia Ministerio de Salud y Protección Social Instituto Nacional de Vigilancia de Medicamentos y Alimentos – INVIMA oc um en to RESOLUCIÓN No. 2015050346 DE 14 de Diciembre de 2015 Por la cual se concede un Registro Sanitario La Directora de Medicamentos y Productos Biológicos del Instituto Nacional de Vigilancia de Medicamentos y Alimentos - INVIMA, en ejercicio de las facultades Legales Conferidas en el Decreto 2078 de 2012, Decreto Reglamentario 677 de 1995 y Ley 1437 de 2011. lD ac ión de OBSERVACIONES: Efectos dermatológicos Se han registrado casos muy esporádicos de reacciones cutáneas graves (p.ej. Síndrome de Stevens-Johnson, necrólisis epidérmica tóxica, erupción medicamentosa acompañada de eosinofilia y síntomas generales) en pacientes que tomaban comprimidos. En caso de erupción cutánea progresiva debe suspenderse el tratamiento. se requiere cautela al administrar la terbinafina a pacientes con psoriasis o lupus eritematoso preexistentes puesto que durante la farmacovigilancia se han notificado casos de precipitación y de agudización de la psoriasis y del lupus eritematoso cutáneo y sistémico. Efectos hemáticos en pacientes tratados con el producto se han notificado casos muy esporádicos de discrasia hemática (neutrocitopenia, agranulocitosis, trombocitopenia, pancitopenia). Se debe investigar la causa de toda discrasia hemática en los pacientes que toman comprimidos, y se debe considerar la posibilidad de cambiar de régimen terapéutico o incluso de suspender el tratamiento. Función renal No se ha estudiado suficientemente el uso de los comprimidos en pacientes con disfunción renal (depuración de creatinina inferior a 50 mL/min o creatinina sérica superior A 300 µMOL/L), por lo que no se recomienda su administración en estos casos. Las contraindicaciones y advertencias deben ir en las etiquetas y empaques mas la fecha de vencimiento, el numero de lote. El titular y el fabricante autorizado en el registro sanitario, adquieren la obligación de mantener las buenas practicas de manufactura y actualizar las especificaciones de materias primas y producto terminado, de acuerdo a la última versión de las farmacopeas oficiales en Colombia durante la vigencia del registro sanitario. Lo anterior será objeto de vigilancia por parte de este instituto. Toda información científica, promocional o publicitaria sobre los medicamentos deberá ser realizada con arreglo a las condiciones del registro sanitario y a las normas técnicas y legales previstas en el artículo 79 del decreto 677 de 1995. Dos (2) Años contados a partir de la fecha de fabricación. VIDA UTIL: CONDICIONES DE ALMACENAMIENTO: EXPEDIENTE No.: RADICACIÓN No.: Almacenar a temperatura inferior a 30 °C en su envase y empaque original. 20099028 2015123637 orm ARTICULO SEGUNDO: APROBAR Artes de material de empaque y envase (caja plegadiza y blister) allegados bajo radicado No. 2015123637 del 18/09/2015 como único diseño para las presentaciones muestra medica y comercial autorizadas. Inserto allegado bajo radicado 2015158658 de fecha 27/11/2015 el solo contiene la información farmacológica recomendada por Comisión Revisora en el acta 31 del 2013 numeral 3.4.12. Inf ARTICULO TERCERO: El tiempo de vida útil asignado para el medicamento amparado en la presente resolución, se soportó con estudios (naturales) con la siguiente frecuencia de tiempos 0, 3, 6, 12, 18, 24 meses y bajo condiciones de humedad y Temperatura de (30 °C) (65 %HR). Página 3 de 4 Or igin al República de Colombia Ministerio de Salud y Protección Social Instituto Nacional de Vigilancia de Medicamentos y Alimentos – INVIMA oc um en to RESOLUCIÓN No. 2015050346 DE 14 de Diciembre de 2015 Por la cual se concede un Registro Sanitario La Directora de Medicamentos y Productos Biológicos del Instituto Nacional de Vigilancia de Medicamentos y Alimentos - INVIMA, en ejercicio de las facultades Legales Conferidas en el Decreto 2078 de 2012, Decreto Reglamentario 677 de 1995 y Ley 1437 de 2011. ARTICULO CUARTO.- Contra la presente Resolución procede únicamente el Recurso de Reposición, que deberá interponerse ante la Directora DE Medicamentos y Productos Biológicos del Instituto Nacional de Vigilancia de Medicamentos y Alimentos INVIMA, dentro de los DIEZ (10) días siguientes a su notificación, en los términos señalados en el Código de Procedimiento Administrativo y de lo Contencioso Administrativo. ARTICULO QUINTO.- La presente Resolución rige a partir de la fecha de su ejecutoria. lD COMUNIQUESE, NOTIFIQUESE Y CUMPLASE Dada en Bogotá, D.C. a los 14 de Diciembre de 2015 Este espacio, hasta la firma se considera en blanco. Inf orm ac ión de LUZ HELENA FRANCO CHAPARRO DIRECTORA DE MEDICAMENTOS Y PRODUCTOS BIOLÓGICOS Proyectó: Legal: cgualdronp, Técnico: jmadridb Revisó: cordina_medicamentos Página 4 de 4