Malformaciones congénitas del árbol traqueo
Anuncio

Malformaciones congénitas del árbol traqueo-bronquial en
el adulto.
Poster no.:
S-1533
Congreso:
SERAM 2012
Tipo del póster: Presentación Electrónica Educativa
Autores:
R. Alcantara da Silva, I. Vollmer Torrubiano, F. Zuccarino, A.
Sanchez-Font, V. Curull, À. Gayete Cara; Barcelona/ES
Palabras clave:
Pulmón
DOI:
10.1594/seram2012/S-1533
Cualquier información contenida en este archivo PDF se genera automáticamente
a partir del material digital presentado a EPOS por parte de terceros en forma de
presentaciones científicas. Referencias a nombres, marcas, productos o servicios de
terceros o enlaces de hipertexto a sitios de terceros o información se proveen solo
como una conveniencia a usted y no constituye o implica respaldo por parte de SERAM,
patrocinio o recomendación del tercero, la información, el producto o servicio. SERAM no
se hace responsable por el contenido de estas páginas y no hace ninguna representación
con respecto al contenido o exactitud del material en este archivo. De acuerdo con las
regulaciones de derechos de autor, cualquier uso no autorizado del material o partes
del mismo, así como la reproducción o la distribución múltiple con cualquier método
de reproducción/publicación tradicional o electrónico es estrictamente prohibido. Usted
acepta defender, indemnizar y mantener indemne SERAM de y contra cualquier y todo
reclamo, daños, costos y gastos, incluyendo honorarios de abogados, que surja de o
es relacionada con su uso de estas páginas. Tenga en cuenta: Los enlaces a películas,
presentaciones ppt y cualquier otros archivos multimedia no están disponibles en la
versión en PDF de las presentaciones.
Página 1 de 41
Objetivo docente
•
Revisar los hallazgos típicos de las distintas anomalías congénitas del
árbol traqueobronquial descritas en individuos adultos, enfatizando las
características que favorecen un diagnostico correcto.
•
Hacer un breve repaso de la embriología, de la patogénesis y de los
principales diagnósticos diferenciales.
Revisión del tema
INTRODUCCIÓN
Las anomalías congénitas de las vías aéreas constituyen un grupo variado de entidades
relacionadas al desarrollo anormal del árbol traqueobronquial.
El avance en las distintas técnicas de imagen disponibles en la actualidad, a destacar
la TCMD, asociado a un mayor número de exploraciones realizadas, ha condicionado
un aumento en el reconocimiento de casos de malformaciones congénitas en individuos
adultos (1-3).
En el pasado, estas anomalías eran estudiadas principalmente mediante radiografía
convencional de tórax y broncografías (4).
El contexto más habitual es el de un paciente con una malformación conocida tratada
de manera expectante en la infancia o con antecedentes de intervención quirúrgica
incompleta (5, 6). No obstante, la mayoría de las anomalías descritas en la edad adulta
suelen ser asintomáticas o presentar un curso subclínico, siendo identificadas como un
hallazgo incidental.
En ocasiones pueden debutar como patología respiratoria aguda o simular una neoplasia
pulmonar (7), exigiendo un adecuado nivel de sospecha para una mejor aproximación
diagnóstica. Además, pueden estar asociadas con enfermedades cardiovasculares o
indicar la presencia de otras malformaciones (8).
Página 2 de 41
El reconocimiento y correcta identificación de una anomalía traqueobronquial congénita,
con su consecuente mención en el informe radiológico, presenta importantes
implicaciones en el manejo del paciente, aportando conocimientos fundamentales para
la adecuada realización de procedimientos como broncoscopia, intubación orotraqueal
o intervenciones quirúrgicas.
EMBRIOLOGÍA
El desarrollo del aparato respiratorio empieza alrededor de la 4ª a 6ª semana de vida
intrauterina, cuando surge un divertículo en la pared ventral del intestino anterior
('foregut') que se extiende en dirección caudal. Posteriormente, este divertículo será
separado del intestino anterior por la aparición del tabique traqueo-esofágico (9).
Con base en los distintos eventos que anteceden a la maturación alveolar, se divide el
proceso de formación pulmonar en 5 fases principales: Embrionaria, pseudoglandular,
canalicular, sacular y alveolar (9-11).
Página 3 de 41
Fig. 3: Desarrollo normal del aparato respiratorio. Secuencia cronológica
representando las distintas fases descritas a lo largo de los 9 meses de embarazo.
Referencias: I. Vollmer Torrubiano; Hospital del Mar, Barcelona, SPAIN
No obstante, el desarrollo normal y anormal de la tráquea y esófago es tema todavía
controvertido por cuenta de distintas opiniones con relación al papel desempeñado
por el tabique traqueo-esofágico, pero también por la escasez de embriones con las
alteraciones esperables en las distintas fases de la organogénesis (12).
La mayoría de las malformaciones tienen sus orígenes referidas en la fase embrionaria
y pseudoglandular (10).
Anomalías generadas en la fase embrionaria:
•
Relacionadas a la formación del brote pulmonar, separación traqueal y
ramificación principal.
Anomalías originadas en la fase pseudoglandular
Página 4 de 41
•
Relacionadas a la ramificación bronquial.
Página 5 de 41
Página 6 de 41
Fig. 4: Correlación entre las distintas fases del desarrollo pulmonar con las
malformaciones congénitas más probables de ocurrir en cada una de ellas.
Referencias: I. Vollmer Torrubiano; Hospital del Mar, Barcelona, SPAIN
CLASIFICACIÓN
Clasificar adecuadamente las anomalías congénitas broncopulmonares es difícil y
controvertido (7), habiendo sido organizadas de distintas maneras (13, 14), ninguna de
ellas conclusiva.
Como referido por Boyden "El desarrollo de los segmentos bronquiales e sus anomalías
asociadas es tan complejo que raramente una sola hipótesis podrá explicar todas las
variaciones" (15).
Con base en esto, en la presente revisión se ha optado por una clasificación basada
en criterios anatómicos, embriológicos y funcionales (16, 17):
Interrupción del desarrollo normal:
•
Complejo agenesia-hipoplasia
Obstrucción o compresión:
•
•
•
Estenosis traqueal
Atresia bronquial
Dilatación traqueal (Síndrome de Mounier-kuhn)
Malformaciones broncopulmonares del intestino anterior comunicantes:
•
Bronquio esofágico
Segmentaciones ectópicas o supernumerias:
•
•
•
•
Bronquio traqueal
Bronquio cardíaco accesorio
Divertículo traqueo-bronquial
Quistes broncogénicos
Malformaciones asociadas con anomalías de situs:
•
Situs Inversus
Página 7 de 41
•
Heterotaxia
INTERRUPCIÓN DEL DESARROLLO NORMAL
Complejo agenesia-hipoplasia
En la dependencia del estadio embriológico en que toman lugar, pueden resultar en:
•
Agenesia: Ausencia de bronquio, vasos y parénquima.
•
Aplasia: Ausencia de parénquima, con bronquios rudimentarios (fondo
ciego).
•
Hipoplasia: Descenso en el número de y tamaño o de las vías aéreas,
vasos y alvéolos.
En adultos lo habitual es que sean malformaciones lobares o segmentares, sin clara
predominancia en ninguno de los lados.
Agenesia y aplasia pulmonar lobar o segmentaria son más frecuentemente descritas
en el lóbulo superior derecho, y suelen ser asintomáticas cuando ocurren de manera
aislada. Los síntomas son más habituales en el pulmón derecho y en los casos en que
exista un bronquio en fondo ciego (aplásico) actuando como reservorio de infecciones
(16).
Hipoplasia es más frecuentemente secundaria (hernia congénita diafragmática, quiste
congénito, hipoperfusión pulmonar focal…) y puede venir acompañada de otras
condiciones, tales como bronquio esofágico, atresia y estenosis bronquial(18, 19).
Los hallazgos en la radiografía convencional pueden simular una segmentectomía.
OBSTRUCCIÓN O COMPRESIÓN
Estenosis traqueal
Página 8 de 41
Estenosis traqueal congénita es una rara condición caracterizada por una reducción
del diámetro luminal traqueo-bronquial, usualmente superior a los 50% (20). El
estrechamiento puede ser focal, generalizado o fusiforme, siendo condicionado por la
presencia de anillos cartilaginosos de manera aislada o asociada a alguna anomalía
vascular/quiste congénito que ocasione una compresión extrínseca (7).
En condiciones excepcionales, estos pacientes atingen la edad adulta sin haber sido
previamente diagnosticados y sin antecedentes de corrección quirúrgica (21, 22).
Algunos casos descritos revelan pacientes con antecedentes de asma desde infancia
de difícil control (21, 23). De cualquier modo, deberá ser considerada y descartada
previamente una posible etiología inflamatoria, traumática, neoplásica o iatrogénica.
Atresia bronquial [Fig. 5 on page 17, Fig. 6 on page 18, Fig. 7 on page 19]
Consiste en la obliteración focal de un bronquio segmentario, con normalidad de las
estructuras distales, sin clara causa definida.
Algunos autores la atribuyen a la ocurrencia de una interrupción vascular con
discontinuidad celular más probablemente después de la 15ª semana de gestación (16,
24, 25).
Aeración del parénquima por detrás de la impactación mucosa se debe a los canales
alveolares colaterales.
Suele acometer a los lóbulos superiores con mayor frecuencia, en particular al segmento
ápico-posterior del LSI, llegando hasta 64% en la casuística de D. kinsella (26)
Suelen ser asintomáticos, aunque en 1/3 de los casos pueden ocurrir disnea leve, tos
o infecciones de repetición (24, 25).
Los hallazgos en TC incluyen la visualización de la impactación mucosa en una
ramificación bronquial (broncocele), asociada a zona de hiperclaridad pulmonar.
La menor atenuación parenquimatosa viene condicionada por una combinación de
atrapamiento aéreo y oligohemia focal, siendo el atrapamiento aéreo mejor demostrable
en fase espiratoria (24, 27).
El diagnóstico diferencial se hace principalmente entre bronquiectasias, ABPA u
obstrucción tumoral.
Página 9 de 41
El tratamiento suele ser conservador y ocasionalmente quirúrgico en casos sintomáticos.
Dilatación traqueal (Síndrome de Mounier-kuhn) [Fig. 18 on page 30]
La traqueobroncomegalia es un síndrome descrito inicialmente por Mounier-Kuhn en
1932. Se caracteriza por una marcada debilidad o flacidez intrínseca de la pared traqueal
y bronquios principales, ocasionando dilatación traqueobronquial en la inspiración, con
formación de divertículos/herniaciones a través de los anillos traqueales y colapso en
la expiración (16, 28).
La mayoría de los casos descritos corresponden a varones de entre 20 y 50 años (28).
La etiología precisa es todavía desconocida, pero es considerada tanto la implicación
de factores congénitos como adquiridos.
Esta condición altera la depuración de las secreciones traqueo-bronquiales,
predisponiendo al desarrollo de infecciones pulmonares recurrentes, a la aparición de
bronquiectasias y de fibrosis pulmonar. Sin embargo, muchos pacientes presentan pocos
o ningún síntoma (29).
La radiografía convencional puede sugerir el diagnóstico al visualizarse la dilatación
traqueal y la presencia de divertículos.
El diagnóstico mediante TAC se basa en demostrar el aumento del diámetro traqueal
transverso por encima de 3 cm, además de un diámetro bronquial de más de 2,4 cm en
el lado derecho y 2,3 cm en el lado izquierdo, lo que corresponde a los valores normales
disponibles + 2 desviaciones estándar(29, 30).
Si bien esta entidad no tiene un tratamiento específico, un diagnóstico temprano previene
o retrasa la aparición de complicaciones.
MALFORMACIONES
COMUNICANTES
BRONCOPULMONARES
DEL
INTESTINO
ANTERIOR
Página 10 de 41
El término malformaciones broncopulmonares del intestino anterior fue descrito por
GERLE en 1968 (31) e incluía distintas anomalías dependientes del intestino anterior
como el secuestro pulmonar intra y extralobar, quistes de duplicación y divertículos,
usualmente ocurriendo de manera aislada.
Las malformaciones broncopulmonares del intestino anterior comunicantes son
anomalías poco habituales caracterizadas por la existencia de una comunicación patente
entre un segmento del tracto respiratorio con el esófago o estómago.
Una de las clasificaciones propuestas divide este grupo en 4 categorías (16):
Atresia esofágica (presente solamente en este grupo) + fístula esófago traqueal + origen
lobar o pulmonar del esófago distal
1- Atresia esofágica (presente solamente en este grupo) + fístula esófago traqueal +
origen lobar o pulmonar del esófago distal.
2- Origen esofágico de todo un pulmón (pulmón esofágico/pulmón accesorio).
3- Origen esofágico de un único lóbulo o segmento (bronquio esofágico).
4- Comunicación simple entre el sistema bronquial y el esófago, con vascularización
sistémica.
Bronquio esofágico [Fig. 8 on page 20, Fig. 9 on page 21, Fig. 10 on page
22]
De entre los anteriormente descritos, el bronquio esofágico es lo más pasible de ser
identificado en un adulto, siendo descrito en aproximadamente 75% de los casos (32)
con antecedentes de síntomas intermitentes, muchas veces poco estudiados.
Los síntomas claves son tos frecuente tras la deglución y antecedentes de Infecciones
respiratorias de repetición
La comunicación más frecuentemente se da entre el tercio medio-distal del esófago con
LID, siendo más común en mujeres (33)
Página 11 de 41
El protocolo diagnóstico suele incluir radiografía convencional y estudio baritado del
esófago, además de TAC.
RAMIFICACIONES ECTÓPICAS
TRAQUEOBRONQUIAL
Y/O
SUPRANUMERARIA
DEL
ÁRBOL
Bronquio traqueal [Fig. 11 on page 23, Fig. 12 on page 24, Fig. 13 on page
25]
El término bronquio traqueal hace referencia a un bronquio anómalo que se origina
directamente de la tráquea o en el bronquio principal, usualmente localizado desde los
6 cm por encima de la carina hasta los 2 cm por debajo (3, 34).
Estos bronquios pueden ser descritos conforme correspondan a un bronquio desplazado
o un supernumerario, siendo más habitual que sean desplazados (16, 34, 35).
Son considerados supernumerarios cuando coexisten con el resto de segmentación
normal del árbol bronquial. Por lo contrario, son considerados desplazados cuando su
existencia viene asociada a la ausencia de algún otro bronquio de la división normal para
este lóbulo.
Son encontrados con mayor frecuencia en el lado derecho y en los lóbulos superiores. La
variante más común es el bronquio traqueal desplazado que se dirige hacia el LSD (34),
siendo también apuntados como la anomalía congénita más común del árbol traqueobronquial(24).
Suelen ser asintomáticos. Los síntomas, cuando presentes, son más comunes en los BT
izquierdos y en los supernumerarios, siendo con mayor frecuencia cuadros infecciosos
de repetición o tos persistente(3, 16, 24, 34).
Han sido descritas dificultades ocasionales para la intubación orotraqueal y ventilación
mecánica (36-38).
Bronquio cardíaco accesorio (BCA) [Fig. 14 on page 26, Fig. 15 on page 27
Fig. 16 on page 28]
Página 12 de 41
Bronquio originario de la pared medial del bronquio principal derecho o, más
comúnmente, del bronquio intermedio, en el lado opuesto al origen del bronquio para el
lóbulo superior derecho (3, 16, 34). Tratase por lo tanto de un bronquio supernumerario
y no un desplazamiento.
En un modelo anatómico normal, el único bronquio que surge de la pared medial del
bronquio intermedio es el bronquio basal medial del LID.
Tiene un trayecto caudal, en dirección al pericardio, de ahí el apodo cardíaco.
Suelen terminar en fondo ciego, pero pueden presentarse con un parénquima
rudimentario asociado.
Es revestido por mucosa bronquial y tiene cartílago, lo que lo diferencia de un divertículo
o fístula adquirida, con un diámetro medio de 8,7 mm (39).
La gran mayoría son asintomáticos. Ocasionalmente los pacientes se muestran
sintomáticos, desarrollando cuadros de neumonías de repetición (BAC actuando como
reservorio), tos crónica o hemoptisis (40, 41).
Divertículo traqueo-bronquial [ Fig. 17 on page 29 ]
Considerados como remanentes de una división abortada del brote pulmonar primario
(16).
Suelen originarse en el margen lateral derecho de la tráquea, con mayor frecuencia a
unos 4-5 cm por debajo de las cuerdas vocales(42) .
Presentan una estructura histológica similar a la traqueal, siendo habitual que se
muestren al diagnóstico rellenos de aire o moco(42, 43).
Un bronquio traqueal o un bronquio cardíaco accesorio pueden tener una imagen similar
El principal diagnóstico diferencial se debe hacer con los divertículos adquiridos, que
por su vez son considerados como simples evaginaciones. Además, los divertículos de
origen congénito muestran cuello estrecho, mientras que en los adquiridos el cuello es
ancho(16).
Página 13 de 41
Los congénitos suelen ser asintomáticos, pero pueden sobre-infectar o presentar
síntomas decurrentes de su localización, como por ejemplo compresión.
Quistes broncogénicos [ Fig. 19 on page 31, Fig. 20 on page 32, Fig. 21 on
page 33 ]
Los quistes broncogénicos son remanentes del intestino anterior/brote pulmonar, siendo
descritos como resultado de ramificaciones anómalas surgidas durante el desarrollo del
árbol traqueobronquial (16, 44).
Tienen paredes finas, son revertidos por epitelio ciliado columnar y suelen contener
material seroso o mucoso. Un diagnóstico definitivo se hace cuando el epitelio
respiratorio es histológicamente presente (25).
La localización subcarinal es la más común, seguida de la región paratraqueal. Cuando
intra-pulmonares, la localización más común es en los lóbulos inferiores.
Su posición depende del periodo embrionario en que ocurrió el defecto que le origina.
Si el origen es precoz en la vida embrionaria, tiene localización pericarinal. Por lo
contrario, si el origen es más tardío, serán intra-parenquimatosos (más común en lóbulos
inferiores).
También pueden presentarse en el mediastino posterior o, más raramente, ser trans o
infra-diafragmático (45).
En general, son asintomáticos y descubiertos como hallazgo incidental, aunque es
habitual que sean descubiertos por ocurrencia de una sobreinfección. También pueden
causar sintomatología por compresión de la tráquea, bronquios o esófago
Diagnóstico diferencial:
•
Quiste de duplicación esofágica: Mediastino medio o posterior
•
Quiste neurogénico: Mediastino posterior con defectos vertebrales
asociados y, en ocasiones, evidenciando comunicación con el canal espinal
Radiografía convencional:
Página 14 de 41
Imágenes solitarias, redondeadas u ovaladas, de contornos bien definidos y densidad
uniforme, que puede presentar nivel hidroaéreo.
Tomografía computarizada
Lesiones solitarias ovoides o redondeadas, de contornos bien definidos.
El coeficiente de atenuación en el TC suele ser similar al del agua (50% de los casos),
siendo que a veces se presentan más densos por la existencia de contenido cálcico
('lechada de cal').
También pueden contener sangre cuando complicados o aire/gas, en el caso de
sobreinfección y comunicación con las vías aéreas (24, 45).
Engrosamiento mural, contenido sólido en su interior, calcificaciones groseras o
presencia de septos NO son habituales en los QB.
Resonancia magnética:
Permite relacionar el QB con estructuras vecinas y descartar la comunicación
intraespinal.
La intensidad y homogeneidad de señal en T1 es variable, sin embargo, siempre se
comportan hiperintensas y homogéneas en T2 (señal líquido).
La administración de Gadolinio permite descartar realce central (malignidad)
MALFORMACIONES ASOCIADAS CON ANOMALÍAS DE SITUS
Son anomalías relacionadas con la disposición anómala de las órganos en el interior del
tórax y/o de la cavidad abdominal.
Situs Inversus
Página 15 de 41
Ocurre cuando los grandes órganos torácicos y/o abdominales se encuentran invertidos
considerando su disposición habitual en relación a la línea media.
Tratase de una entidad muy rara, siendo encontrado en 0.00005% a 0.01% de la
población (16, 46).
Situs ambiguous (Heteroraxia)
Son descritas como alteraciones en la distribución anatómica de los grandes órganos
torácicos/abdominales.
En la historia han sido usadas distintas denominaciones sindrómicas y clasificaciones en
el intento de agrupar estas anomalías, siendo en la actualidad preferible la descripción
de manera individualizada.
Cuando presente en el árbol bronquial, los patrones de vías aéreas y de segmentación
pulmonar suelen ser idénticos en ambos pulmones, lo que se denomina isomerismo (46).
En el isomerismo derecho ambos pulmones son trilobulados con cisura menor bilateral,
asociándose con asplenia, mal posicionamiento del hígado y estómago, además de
anomalías cardíacas.
Suelen manifestarse precozmente, con elevado índice de mortalidad, llegando
asintomático a la edad adulta en muy excepcionales ocasiones (< 1%) (16).
En el isomerismo izquierdo, ambos pulmones son bilobulados, no hay cisura menor
y los bronquios principales son alongados. Suele asociarse con mal posicionamiento
hepático (línea media) y en 55 % de los casos a poliesplenia(46).
Anomalías cardíacas son menos habituales, con tasas de mortalidad inferiores al
isomerismo derecho, pudiendo con mayor frecuencia llegar asintomático a la edad
adulta, identificado como hallazgo casual.
Images for this section:
Página 16 de 41
Fig. 3: Desarrollo normal del aparato respiratorio. Secuencia cronológica representando
las distintas fases descritas a lo largo de los 9 meses de embarazo.
Página 17 de 41
Fig. 5: Puntos clave: Bronquio Traqueal.
Página 18 de 41
Fig. 6: Radiografía convencional: Opacidad tubular focalizada sobre LSD, con área de
hiperclaredad distal asociada
Página 19 de 41
Fig. 7: Atresia bronquial: El bronquio segmentario apical lobular superior derecho no es
identificable. Se observan algunas estructuras tubulares muy prominentes, densas que
corresponden a bronquios dilatados con impactaciones mucosas (flechas en B y C), con
depósito cálcico evidenciable en C (punta de flecha), lo que indica larga evolución. El
segmento apical se encuentra hiperclaro e hipovascularizado (asterisco en E).
Página 20 de 41
Fig. 8: Bronquio Esofágico: Mujer de 72 años, con clínica de infección bronquial
y antecedentes de tos y expectoración habitual. TEGD: Divertículo en tercio medio
esofágico (flecha en A), dependiente de la pared lateral derecha, que se comunica
con una imagen tubular que se adentra en pulmón derecho (punta de flecha en B) y
se comunica inmediatamente con árbol bronquial. Escasos minutos despues de haber
empezado la prueba se evidencia opacificación traqueobronquial espontánea (C).
Página 21 de 41
Fig. 9: Bronquio esofágico (mismo paciente de la imagen previa):Divertículo en tercio
medio esofágico (flecha en A), dependiente de la pared lateral derecha, que se comunica
con una imagen tubular que se adentra en pulmón derecho (punta de flecha en B) y
se comunica inmediatamente con árbol bronquial. Escasos minutos despues de haber
empezado la prueba se evidencia opacificación traqueobronquial espontánea (C).
Página 22 de 41
Fig. 10: Bronquio esofágico: Divertículo en tercio medio esofágico (flecha en A),
dependiente de la pared lateral derecha, que se comunica con una imagen tubular que
se adentra en pulmón derecho (punta de flecha en B) y se comunica inmediatamente con
árbol bronquial. Escasos minutos despues de haber empezado la prueba se evidencia
opacificación traqueobronquial espontánea (C).
Página 23 de 41
Fig. 11: Bronquio Traqueal: Distintos ejemplos de bronquio traqueal (BT). A: BT con
salida proximal a la carina, correspondiendo a desplazamiento del bronquio segmentar
apical del LSD (flecha). B y C: BT desplazado del b segmentario apical para el LSD
(Punta de flecha). D - F: Pequeña dilatación diverticular en la cara lateral derecha
traqueal, de amplia base y extremidad aguda que sugiere un bronquio traqueal terminada
en fondo ciego (flecha en D y F), interesando diferenciar de imagen de divertículo
traqueal (usualmente con base estrecha). Asterisco (*): Detalle de la imagen vista en D.
Página 24 de 41
Fig. 12: El bronquio lobar superior derecho se origina directamente de la pared lateral
de la tráquea (Círculo en A y flecha en B). En D, en un plano inferior, se objetiva la salida
del bronquio para el LM y el para el LID (punta de flecha). E: Reconstrucción MPR.
Página 25 de 41
Fig. 13: Doble bronquio traqueal: En A, se evidencia la existencia de un lóbulo de
la ácigos. En un plano inferior a (A), se observa salida del primer bronquio traqueal
(flecha en B), que corresponde al apical del LSD. El segundo bronquio, inferiormente
(flecha en C), corresponde al bronquio segmentario posterior del LSD. Dichos hallazgos
se pueden visualizar adecuadamente mediante Reconstrucción MPR (E) y volume
rendering (*).Imagen de broncoscopia virtual (F) en la que se identifica la salida de los
dos BT referidos (1 y 2).
Página 26 de 41
Fig. 14: Bronquio cardíaco accesorio: Bronquio supernumerario terminado en fondo
ciego que se origina de la pared medial del bronquio intermedio (Flecha en B). C-E:
Reconstrucciones MIP y volume rendering, con BCA terminado en fondo ciego.
Página 27 de 41
Fig. 15: A - B: Bronquio cardíaco que se origina de la pared medial del bronquio
intermediario derecho (punta de flecha), con parénquima pulmonar que depende del
mismo (asterisco) y que se separa del lóbulo inferior derecho mediante una cisura
accesoria. No se ve en la imagen, pero dicho parénquima recibe su irrigación de una
arteria bronquial por lo que correspondería a un secuestro. C- E: BCA (punta de flecha
en C), pero en este caso con parénquima rudimentario asociado (flecha en E).
Página 28 de 41
Fig. 16: Presencia de bronquio traqueal para el segmento apical (punta de flecha en A
y C) y un bronquio cardíaco accesorio (flecha en C) en un mismo paciente.
Página 29 de 41
Fig. 17: A-C: Radiografía convencional donde se objetiva zona de hipertransparencia
mediastínia. En la TCMD se evidencia que dicha zona se corresponde a un divertículo
bronquial con cuello ancho (flecha en B y C) que depende del bronquio segmentario de la
língula y que se introduce en la grasa mediastínica. En D-F se muestran otros ejemplos
de divertículos traqueales. En E y F, cabe destacar presencia de pequeño diverticulo
traqueal con cuello estrecho.
Página 30 de 41
Fig. 18: A-D: Traqueobroncomegalia en una mujer de 30 años (Síndrome de Mounier
Khun): Dilatación traqueal asociada a la presencia de diversos divertículos traqueales
(flecha en C). Se asocia alteración morfológica bronquial, más evidente en bronquio
principal derecho (punta de flecha en D) que presenta estenosis a nivel de la emergencia
del bronquio lobar superior (Flecha). Se asocian múltiples bronquiectasias de morfología
varicosa y algunas quísticas en LSD (asterisco en A) y en segmentos mediales del LID.
Página 31 de 41
Fig. 19: Quiste broncogénico. A-B: Imagen nodular solitaria mediastínica, redondeada,
de contornos bien definidos y homogénea (flecha en A y B).
Página 32 de 41
Fig. 20: A-D: Masa intrapulmonar de márgenes bien definidos, localizada en segmento
apical del lóbulo inferior derecho y que muestra una parte anterior hipodensa y un nivel
hiperdenso posterior (flecha en A y B). El diagnóstico se confirma con el desplazamiento
hacia anterior del componente cálcico del interior del quiste en posición decúbito prono
(Punta de flecha en D).
Página 33 de 41
Fig. 21: A-C: La resonancia magnética permite establecer las relaciones del QB
con estructuras vecinas y descartar la comunicación espinal. En este caso, gran
formación nodular sobre mediastino posterior, de contornos regulares, que presenta
iso/discretamente hiperintensa en T1 (A) e hiperintensa en T2 (B y C), lo que indica
naturaleza quística, siendo compatible con quiste broncogénico.
Página 34 de 41
Conclusiones
Las manifestaciones clínicas de las distintas malformaciones congénitas de las vías
aéreas en adultos pueden simular una patología respiratoria o incluso ser la causa de
esta.
El adecuado conocimiento de las manifestaciones clínicas y radiológicas de dichas
condiciones es esencial para lograr un diagnóstico preciso.
La identificación de variantes y anomalías bronquiales, con su consecuente
mención en el informe radiológico, presenta importantes implicaciones en el manejo
clínico y terapéutico del paciente, aportando conocimientos fundamentales para la
adecuada realización de procedimientos como broncoscopia, intubación orotraqueal o
intervenciones quirúrgicas. [Fig. 2 on page 39].
BIBLIOGRAFÍA:
1. Remy J, Remy-Jardin M, Artaud D, Fribourg M. Multiplanar and threedimensional reconstruction techniques in CT: Impact on chest diseases. Eur Radiol.
1998;8(3):335-51.
2. Heyer CM, Nuesslein TG, Jung D, Peters SA, Lemburg SP, Rieger CH, et
al. Tracheobronchial anomalies and stenoses: Detection with low-dose multidetector
CT with virtual tracheobronchoscopy--comparison with flexible tracheobronchoscopy.
Radiology. 2007 Feb;242(2):542-9.
3. Kang EY. Large airway diseases. J Thorac Imaging. 2011 Nov;26(4):249-62.
4. Atwell SW. Major anomalies of the tracheobronchial tree: With a list of the minor
anomalies. Dis Chest. 1967 Nov;52(5):611-5.
5. Zach MS, Eber E. Adult outcome of congenital lower respiratory tract malformations.
Thorax. 2001 Jan;56(1):65-72.
6. Shanmugam G. Adult congenital lung disease. Eur J Cardiothorac Surg. 2005
Sep;28(3):483-9.
Página 35 de 41
7. Berrocal T, Madrid C, Novo S, Gutierrez J, Arjonilla A, Gomez-Leon N. Congenital
anomalies of the tracheobronchial tree, lung, and mediastinum: Embryology, radiology,
and pathology. Radiographics. 2004 Jan-Feb;24(1):e17.
8. Evans JA. Aberrant bronchi and cardiovascular anomalies. Am J Med Genet. 1990
Jan;35(1):46-54.
9. Langman S. Aparato respiratorio - capítulo 13. In: Fundamentos Embriología Médica,
con orientación clínica. 9ª edición ed. Editora Panamericana; 2010. p. 203-10.
10. Kotecha S. Lung growth for beginners. Paediatr Respir Rev. 2000 Dec;1(4):308-13.
11. Biyyam DR, Chapman T, Ferguson MR, Deutsch G, Dighe MK. Congenital
lung abnormalities: Embryologic features, prenatal diagnosis, and postnatal radiologicpathologic correlation. Radiographics. 2010 Oct;30(6):1721-38.
12. Merei JM, Hutson JM. Embryogenesis of tracheo esophageal anomalies: A review.
Pediatr Surg Int. 2002 Sep;18(5-6):319-26.
13. Heithoff KB, Sane SM, Williams HJ, Jarvis CJ, Carter J, Kane P, et al.
Bronchopulmonary foregut malformations. A unifying etiological concept. AJR Am J
Roentgenol. 1976 Jan;126(1):46-55.
14. Barnes NA, Pilling DW. Bronchopulmonary foregut malformations: Embryology,
radiology and quandary. Eur Radiol. 2003 Dec;13(12):2659-73.
15. Freedom RM, Yoo SJ, Goo HW, Mikailian H, Anderson RH. The bronchopulmonary
foregut malformation complex. Cardiol Young. 2006 Jun;16(3):229-51.
16. Desir A, Ghaye B. Congenital abnormalities of intrathoracic airways. Radiol Clin North
Am. 2009 Mar;47(2):203-25.
17. Newman B. Congenital bronchopulmonary foregut malformations: Concepts and
controversies. Pediatr Radiol. 2006 Aug;36(8):773-91.
18. Keslar P, Newman B, Oh KS. Radiographic manifestations of anomalies of the lung.
Radiol Clin North Am. 1991 Mar;29(2):255-70.
Página 36 de 41
19. Beigelman C, Howarth NR, Chartrand-Lefebvre C, Grenier P. Congenital anomalies
of tracheobronchial branching patterns: Spiral CT aspects in adults. Eur Radiol.
1998;8(1):79-85.
20. Sandu K, Monnier P. Congenital tracheal anomalies. Otolaryngol Clin North Am. 2007
Feb;40(1):193,217, viii.
21. J. Hasse. Congenital bronchopulmonary malformations in adults. Eur Respir Mon.
2004;29:208-22.
22. Kawahara K, Tomita M. Congenital web-like tracheal stenosis cured surgically in
adult. Acta medica Nagasakiensia. 1985, 30(1-3), p.256-26. 1985;30(1-3):256-60.
23. Numasaki M, Ohrui T, Sato A, He M, Arai H. Congenital tracheal stenosis and an
anomalous origin of the right upper lobe bronchus. Lancet. 2008 May 3;371(9623):1526.
24. Rappaport DC, Herman SJ, Weisbrod GL. Congenital bronchopulmonary diseases
in adults: CT findings. AJR Am J Roentgenol. 1994 Jun;162(6):1295-9.
25. Lee EY, Boiselle PM, Cleveland RH. Multidetector CT evaluation of congenital lung
anomalies. Radiology. 2008 Jun;247(3):632-48.
26. Kinsella D, Sissons G, Williams MP. The radiological imaging of bronchial atresia. Br
J Radiol. 1992 Aug;65(776):681-5.
27. Gipson MG, Cummings KW, Hurth KM. Bronchial atresia. Radiographics. 2009 SepOct;29(5):1531-5.
28. Ghanei M, Peyman M, Aslani J, Zamel N. Mounier-kuhn syndrome: A rare cause of
severe bronchial dilatation with normal pulmonary function test: A case report. Respir
Med. 2007 Aug;101(8):1836-9.
29. Schwartz M, Rossoff L. Tracheobronchomegaly. Chest. 1994 Nov;106(5):1589-90.
30. Shin MS, Jackson RM, Ho KJ. Tracheobronchomegaly (mounier-kuhn syndrome):
CT diagnosis. AJR Am J Roentgenol. 1988 Apr;150(4):777-9.
Página 37 de 41
31. Gerle RD, Jaretzki A,3rd, Ashley CA, Berne AS. Congenital bronchopulmonaryforegut malformation. pulmonary sequestration communicating with the gastrointestinal
tract. N Engl J Med. 1968 Jun 27;278(26):1413-9.
32. BRAIMBRIDGE MV, KEITH HI. Oesophago-bronchial fistula in the adult. Thorax.
1965 May;20:226-33.
33. Verma A, Mohan S, Kathuria M, Baijal SS. Esophageal bronchus: Case report and
review of the literature. Acta Radiol. 2008 Mar;49(2):138-41.
34. Ghaye B, Szapiro D, Fanchamps JM, Dondelinger RF. Congenital bronchial
abnormalities revisited. Radiographics. 2001 Jan-Feb;21(1):105-19.
35. Wu JW, White CS, Meyer CA, Haramati LB, Mason AC. Variant bronchial anatomy:
CT appearance and classification. AJR Am J Roentgenol. 1999 Mar;172(3):741-4.
36. Peragallo RA, Swenson JD. Congenital tracheal bronchus: The inability to isolate the
right lung with a univent bronchial blocker tube. Anesth Analg. 2000 Aug;91(2):300-1.
37. Wong DT, Kumar A. Case report: Endotracheal tube malposition in a patient with a
tracheal bronchus. Can J Anaesth. 2006 Aug;53(8):810-3.
38. Carilli AD, The SH, Agress H,Jr, Shin D, Budin JA. Tracheal bronchus with regional
ventilation and perfusion abnormalities. Chest. 1980 Aug;78(2):343-6.
39. McGuinness G, Naidich DP, Garay SM, Davis AL, Boyd AD, Mizrachi HH.
Accessory cardiac bronchus: CT features and clinical significance. Radiology. 1993
Nov;189(2):563-6.
40. Bentala M, Grijm K, van der Zee JH, Kloek JJ. Cardiac bronchus: A rare cause of
hemoptysis. Eur J Cardiothorac Surg. 2002 Oct;22(4):643-5.
41. Daskalakis MK. Middle lobe syndrome due to accessory cardiac bronchus. South
Med J. 1983 Jul;76(7):941-2.
42. Soto-Hurtado EJ, Penuela-Ruiz L, Rivera-Sanchez I, Torres-Jimenez J. Tracheal
diverticulum: A review of the literature. Lung. 2006 Nov-Dec;184(6):303-7.
Página 38 de 41
43. Early EK, Bothwell MR. Congenital tracheal diverticulum. Otolaryngol Head Neck
Surg. 2002 Jul;127(1):119-21.
44. Girosi D, Bellodi S, Sabatini F, Rossi GA. The lung and the gut: Common origins,
close links. Paediatr Respir Rev. 2006;7 Suppl 1:S235-9.
45. Amendola MA, Shirazi KK, Brooks J, Agha FP, Dutz W. Transdiaphragmatic
bronchopulmonary foregut anomaly: "dumbell" bronchogenic cyst. AJR Am J
Roentgenol. 1982 Jun;138(6):1165-7.
46. Applegate KE, Goske MJ, Pierce G, Murphy D. Situs revisited: Imaging of the
heterotaxy syndrome. Radiographics. 1999 Jul-Aug;19(4):837,52; discussion 853-4.
Images for this section:
Página 39 de 41
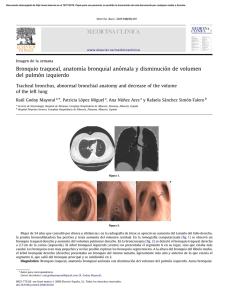
Fig. 2: Rotura traqueal en paciente con diverticulo traqueal conocido. En el contexto
de intubación orotraqueal, la paciente se presentó con importante neumomediastino y
enfisema subcutáneo.
Página 40 de 41
Página 41 de 41